文档内容
高三年级第一次考试
化学
可能用到的相对原子质量:H1 N14 O16 S32 C35.5 K39 Cr52 Fe56 Cu64
Ag108
一、选择题:本题共9小题,每小题3分,共27分.在每小题给出的四个选项中,只有一
项是符合题目要求的.
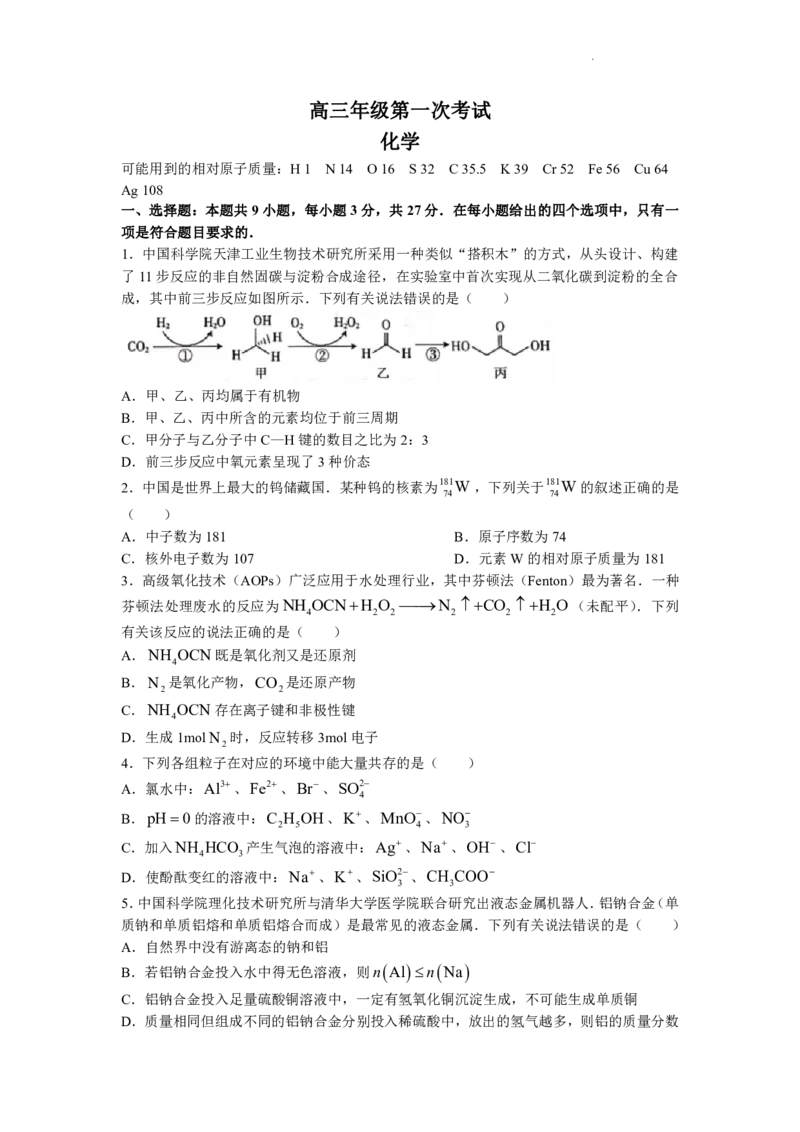
1.中国科学院天津工业生物技术研究所采用一种类似“搭积木”的方式,从头设计、构建
了11步反应的非自然固碳与淀粉合成途径,在实验室中首次实现从二氧化碳到淀粉的全合
成,其中前三步反应如图所示.下列有关说法错误的是( )
A.甲、乙、丙均属于有机物
B.甲、乙、丙中所含的元素均位于前三周期
C.甲分子与乙分子中C—H键的数目之比为2:3
D.前三步反应中氧元素呈现了3种价态
2.中国是世界上最大的钨储藏国.某种钨的核素为181W,下列关于181W的叙述正确的是
74 74
( )
A.中子数为181 B.原子序数为74
C.核外电子数为107 D.元素W的相对原子质量为181
3.高级氧化技术(AOPs)广泛应用于水处理行业,其中芬顿法(Fenton)最为著名.一种
芬顿法处理废水的反应为NH OCNH O N CO H O(未配平).下列
4 2 2 2 2 2
有关该反应的说法正确的是( )
A.NH OCN既是氧化剂又是还原剂
4
B.N 是氧化产物,CO 是还原产物
2 2
C.NH OCN存在离子键和非极性键
4
D.生成1molN 时,反应转移3mol电子
2
4.下列各组粒子在对应的环境中能大量共存的是( )
A.氯水中:Al3、Fe2、Br、SO2
4
B.pH 0的溶液中:C H OH、K、MnO、NO
2 5 4 3
C.加入NH HCO 产生气泡的溶液中:Ag、Na、OH、Cl
4 3
D.使酚酞变红的溶液中:Na、K、SiO2、CH COO
3 3
5.中国科学院理化技术研究所与清华大学医学院联合研究出液态金属机器人.铝钠合金(单
质钠和单质铝熔和单质铝熔合而成)是最常见的液态金属.下列有关说法错误的是( )
A.自然界中没有游离态的钠和铝
B.若铝钠合金投入水中得无色溶液,则n Al n Na
C.铝钠合金投入足量硫酸铜溶液中,一定有氢氧化铜沉淀生成,不可能生成单质铜
D.质量相同但组成不同的铝钠合金分别投入稀硫酸中,放出的氢气越多,则铝的质量分数
学科网(北京)股份有限公司越大
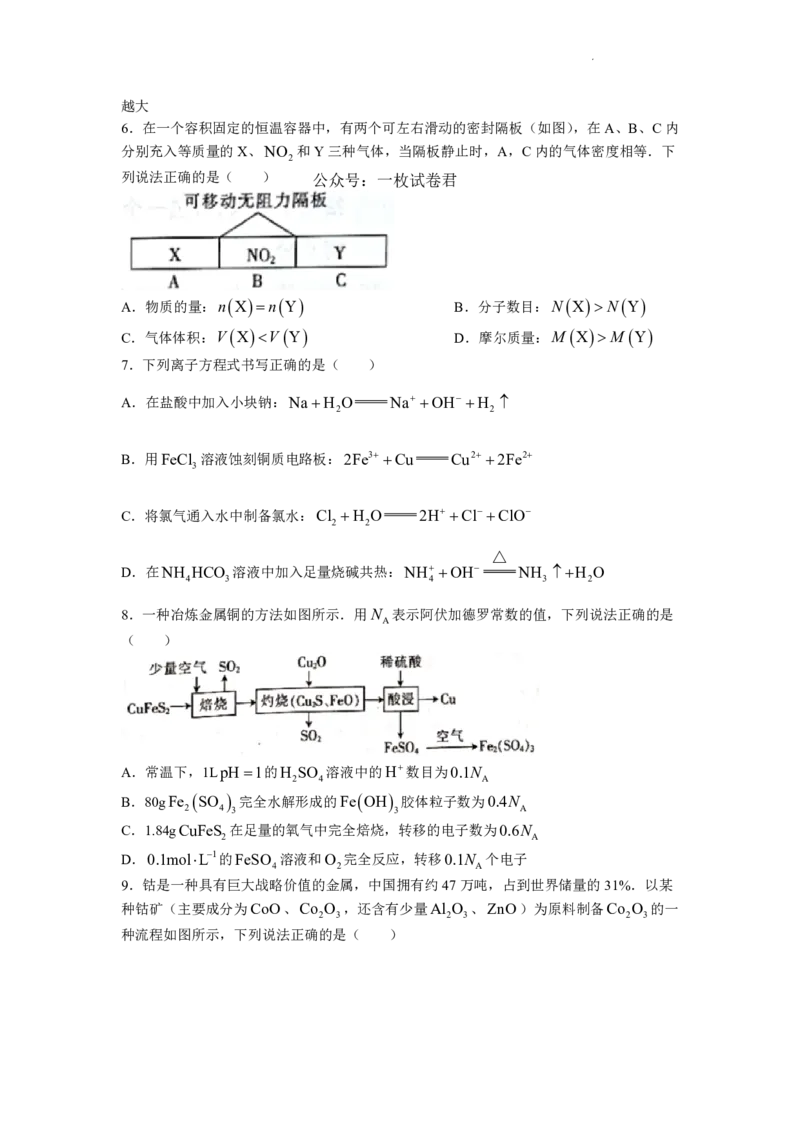
6.在一个容积固定的恒温容器中,有两个可左右滑动的密封隔板(如图),在A、B、C内
分别充入等质量的X、NO 和Y三种气体,当隔板静止时,A,C内的气体密度相等.下
2
列说法正确的是( ) 公众号:一枚试卷君
A.物质的量:n X n Y B.分子数目:N X N Y
C.气体体积:V X V Y D.摩尔质量:M X M Y
7.下列离子方程式书写正确的是( )
A.在盐酸中加入小块钠:NaH O Na OH H
2 2
B.用FeCl 溶液蚀刻铜质电路板:2Fe3 Cu Cu2 2Fe2
3
C.将氯气通入水中制备氯水:Cl H O 2H Cl ClO
2 2
△
D.在NH HCO 溶液中加入足量烧碱共热:NH OH NH H O
4 3 4 3 2
8.一种冶炼金属铜的方法如图所示.用N 表示阿伏加德罗常数的值,下列说法正确的是
A
( )
A.常温下,1LpH 1的H SO 溶液中的H数目为0.1N
2 4 A
B.80gFe SO 完全水解形成的Fe OH 胶体粒子数为0.4N
2 4 3 3 A
C.1.84gCuFeS 在足量的氧气中完全焙烧,转移的电子数为0.6N
2 A
D.0.1molL1的FeSO 溶液和O 完全反应,转移0.1N 个电子
4 2 A
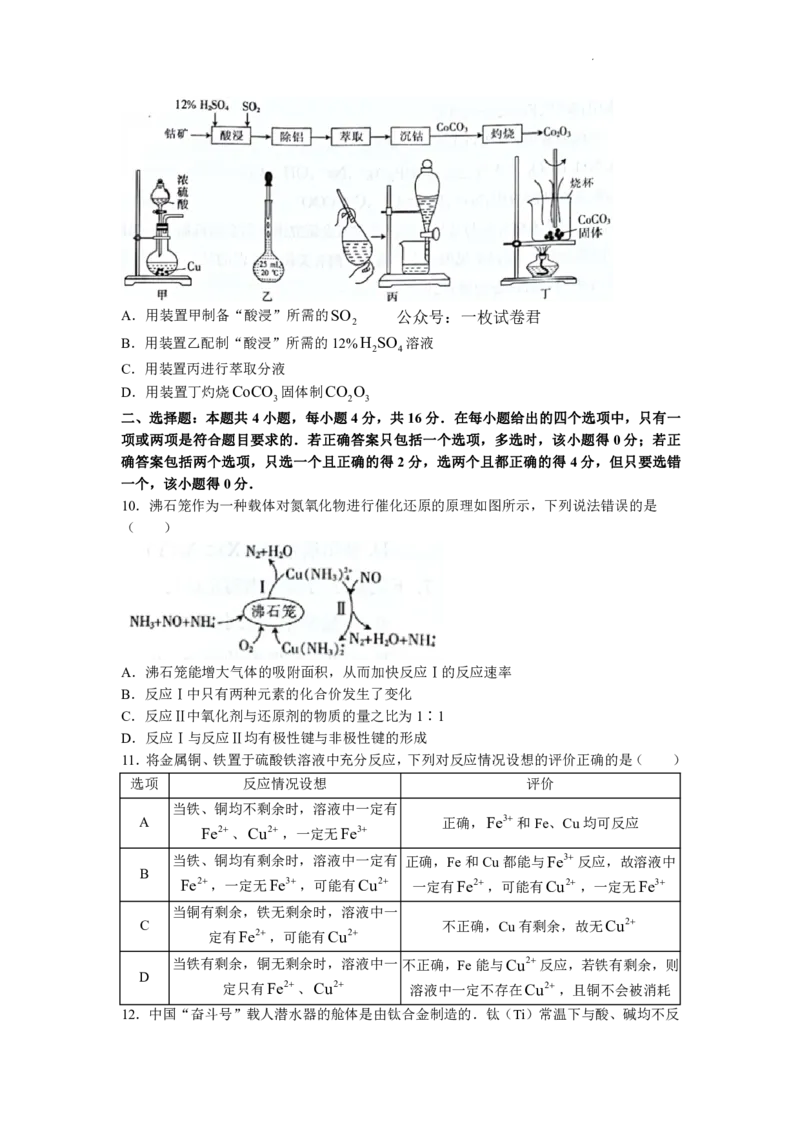
9.钴是一种具有巨大战略价值的金属,中国拥有约47万吨,占到世界储量的31%.以某
种钴矿(主要成分为CoO、Co O ,还含有少量Al O 、ZnO)为原料制备Co O 的一
2 3 2 3 2 3
种流程如图所示,下列说法正确的是( )
学科网(北京)股份有限公司A.用装置甲制备“酸浸”所需的SO 公众号:一枚试卷君
2
B.用装置乙配制“酸浸”所需的12%H SO 溶液
2 4
C.用装置丙进行萃取分液
D.用装置丁灼烧CoCO 固体制CO O
3 2 3
二、选择题:本题共4小题,每小题4分,共16分.在每小题给出的四个选项中,只有一
项或两项是符合题目要求的.若正确答案只包括一个选项,多选时,该小题得0分;若正
确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得4分,但只要选错
一个,该小题得0分.
10.沸石笼作为一种载体对氮氧化物进行催化还原的原理如图所示,下列说法错误的是
( )
A.沸石笼能增大气体的吸附面积,从而加快反应Ⅰ的反应速率
B.反应Ⅰ中只有两种元素的化合价发生了变化
C.反应Ⅱ中氧化剂与还原剂的物质的量之比为1∶1
D.反应Ⅰ与反应Ⅱ均有极性键与非极性键的形成
11.将金属铜、铁置于硫酸铁溶液中充分反应,下列对反应情况设想的评价正确的是( )
选项 反应情况设想 评价
当铁、铜均不剩余时,溶液中一定有
A 正确,Fe3和Fe、Cu均可反应
Fe2、Cu2,一定无Fe3
当铁、铜均有剩余时,溶液中一定有 正确,Fe和Cu都能与Fe3反应,故溶液中
B
Fe2,一定无Fe3,可能有Cu2 一定有Fe2,可能有Cu2,一定无Fe3
当铜有剩余,铁无剩余时,溶液中一
C 不正确,Cu有剩余,故无Cu2
定有Fe2,可能有Cu2
当铁有剩余,铜无剩余时,溶液中一 不正确,Fe能与Cu2反应,若铁有剩余,则
D
定只有Fe2、Cu2 溶液中一定不存在Cu2,且铜不会被消耗
12.中国“奋斗号”载人潜水器的舱体是由钛合金制造的.钛(Ti)常温下与酸、碱均不反
学科网(北京)股份有限公司应,但高温下能被空气氧化,由钛铁矿(主要成分是FeO和TiO )提取金属钛的工艺流程
2
如图所示.下列说法正确的是( )
A.步骤Ⅰ中,TiO 作氧化剂
2
高温
B.步骤Ⅱ发生的反应:TiO 2C2Cl TiCl 2CO
2 2 4
C.步骤Ⅲ中氩气的作用是隔绝空气,防止金属钛被还原
D.可用稀硫酸除去金属钛中的少量镁杂质
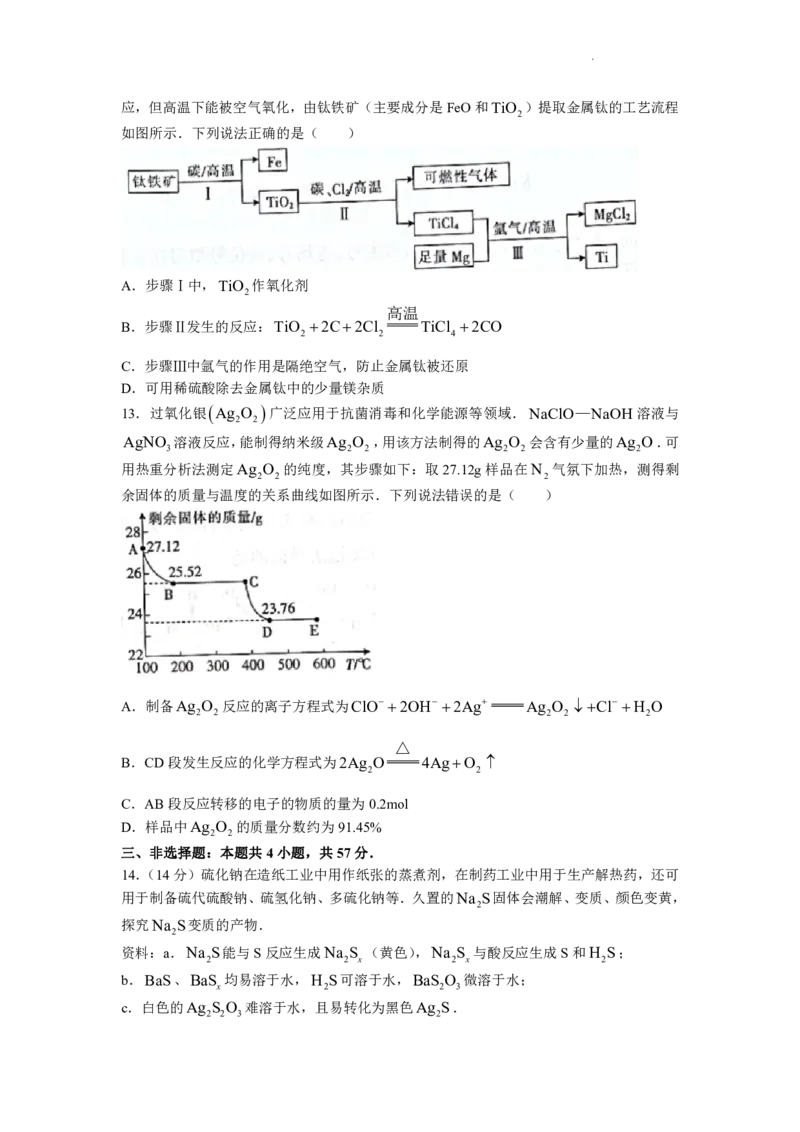
13.过氧化银 Ag O 广泛应用于抗菌消毒和化学能源等领域.NaClO—NaOH 溶液与
2 2
AgNO 溶液反应,能制得纳米级Ag O ,用该方法制得的Ag O 会含有少量的Ag O.可
3 2 2 2 2 2
用热重分析法测定Ag O 的纯度,其步骤如下:取27.12g样品在N 气氛下加热,测得剩
2 2 2
余固体的质量与温度的关系曲线如图所示.下列说法错误的是( )
A.制备Ag O 反应的离子方程式为ClO 2OH 2Ag Ag O Cl H O
2 2 2 2 2
△
B.CD段发生反应的化学方程式为2Ag O 4AgO
2 2
C.AB段反应转移的电子的物质的量为0.2mol
D.样品中Ag O 的质量分数约为91.45%
2 2
三、非选择题:本题共4小题,共57分.
14.(14分)硫化钠在造纸工业中用作纸张的蒸煮剂,在制药工业中用于生产解热药,还可
用于制备硫代硫酸钠、硫氢化钠、多硫化钠等.久置的Na S固体会潮解、变质、颜色变黄,
2
探究Na S变质的产物.
2
资料:a.Na S能与S反应生成Na S (黄色),Na S 与酸反应生成S和H S;
2 2 x 2 x 2
b.BaS、BaS 均易溶于水,H S可溶于水,BaS O 微溶于水;
x 2 2 3
c.白色的Ag S O 难溶于水,且易转化为黑色Ag S.
2 2 3 2
学科网(北京)股份有限公司将久置的Na S固体溶于水,溶液呈黄色.取黄色溶液,滴加稀硫酸,产生白色沉淀M(经
2
检验M中主要成分为S).
(1)将Na S利Na S 的混合物溶于水,溶液呈______色.
2 2 x
(2)探究白色沉淀M的产生途径,某实验小组进行如下三种假设:
途径一:白色沉淀山Na S 与稀硫酸反应产生.
2 x
途径二:Na S变质的产物中可能含有Na S O ,白色沉淀由Na S O 与稀硫酸反应产生.
2 2 2 3 2 2 3
途径三:Na S变质的产物中可能含有Na SO ,白色沉淀由……
2 2 3
①当x 2时,产物n S :n H S ______.
2
②Na S O 与稀硫酸反应的化学方程式为______.
2 2 3
③请将途径三补充完全:______.
(3)为检验Na S变质的产物中是否含有Na SO ,甲同学设计实验:取黄色溶液,滴加
2 2 3
AgNO 溶液,产生黑色沉淀.由此得出结论:Na S变质的产物中含Na SO .乙同学认
3 2 2 3
为该结论不正确,原因是______.
(4)在药物制剂中,抗氧剂与被保护的药物在发生反应时具有竞争性,抗氧性强弱主要取
决于其氧化反应的速率.Na SO 、NaHSO 和Na S O 是三种常用的抗氧剂.丙同学进
2 3 3 2 2 5
行下列实验:
实验用品 实验操作和现象
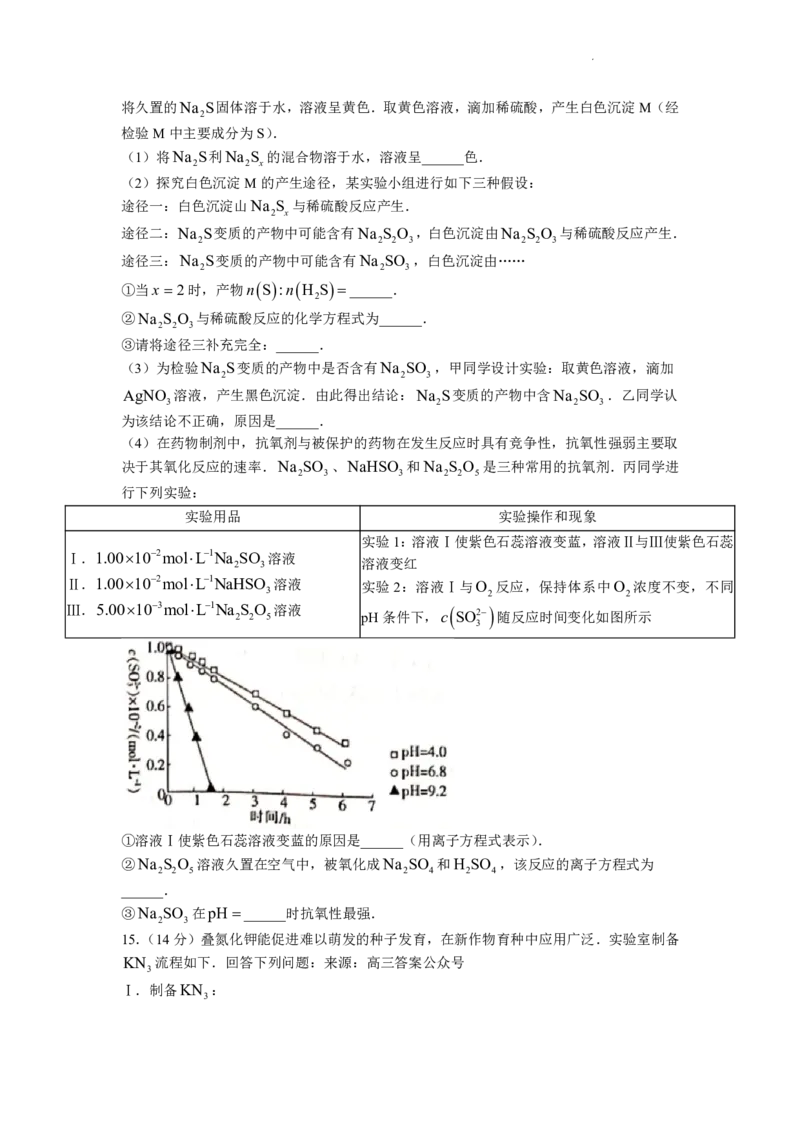
实验1:溶液Ⅰ使紫色石蕊溶液变蓝,溶液Ⅱ与Ⅲ使紫色石蕊
Ⅰ.1.00102molL1Na SO 溶液
溶液变红
2 3
Ⅱ.1.00102molL1NaHSO 溶液 实验2:溶液Ⅰ与O 反应,保持体系中O 浓度不变,不同
3 2 2
Ⅲ.5.00103molL1Na
2
S
2
O
5
溶液
pH条件下,c
SO2
随反应时间变化如图所示
3
①溶液Ⅰ使紫色石蕊溶液变蓝的原因是______(用离子方程式表示).
②Na S O 溶液久置在空气中,被氧化成Na SO 和H SO ,该反应的离子方程式为
2 2 5 2 4 2 4
______.
③Na SO 在pH ______时抗氧性最强.
2 3
15.(14分)叠氮化钾能促进难以萌发的种子发育,在新作物育种中应用广泛.实验室制备
KN 流程如下.回答下列问题:来源:高三答案公众号
3
Ⅰ.制备KN :
3
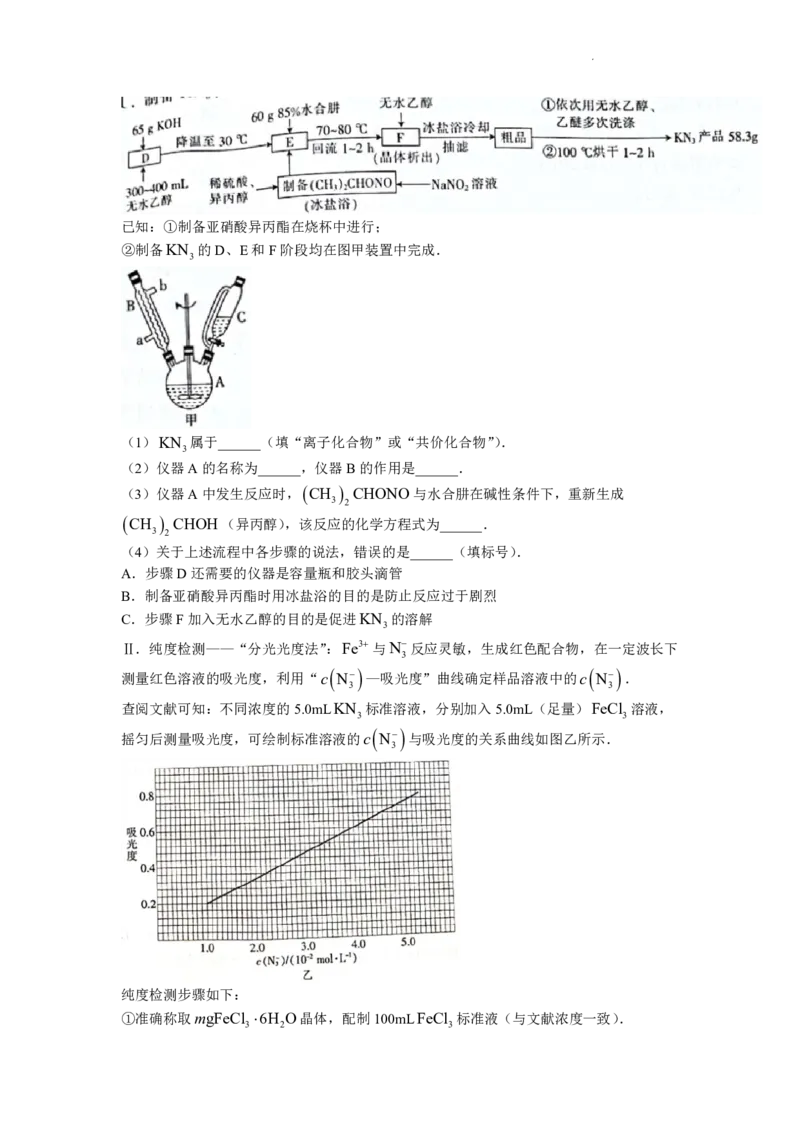
学科网(北京)股份有限公司已知:①制备亚硝酸异丙酯在烧杯中进行;
②制备KN 的D、E和F阶段均在图甲装置中完成.
3
(1)KN 属于______(填“离子化合物”或“共价化合物”).
3
(2)仪器A的名称为______,仪器B的作用是______.
(3)仪器A中发生反应时, CH CHONO与水合肼在碱性条件下,重新生成
3 2
CH CHOH(异丙醇),该反应的化学方程式为______.
3 2
(4)关于上述流程中各步骤的说法,错误的是______(填标号).
A.步骤D还需要的仪器是容量瓶和胶头滴管
B.制备亚硝酸异丙酯时用冰盐浴的目的是防止反应过于剧烈
C.步骤F加入无水乙醇的目的是促进KN 的溶解
3
Ⅱ.纯度检测——“分光光度法”:Fe3与N反应灵敏,生成红色配合物,在一定波长下
3
测量红色溶液的吸光度,利用“c
N
—吸光度”曲线确定样品溶液中的c
N
.
3 3
查阅文献可知:不同浓度的5.0mLKN 标准溶液,分别加入5.0mL(足量)FeCl 溶液,
3 3
摇匀后测量吸光度,可绘制标准溶液的c
N
与吸光度的关系曲线如图乙所示.
3
纯度检测步骤如下:
①准确称取mgFeCl 6H O晶体,配制100mLFeCl 标准液(与文献浓度一致).
3 2 3
学科网(北京)股份有限公司②准确称取0.36gKN 样品,配制成100mL溶液,取5.0mL待测溶液,向其中加入VmL
3
(足量)FeCl 标准液,摇匀后测得吸光度为0.6.
3
(5)配制100mLKN 溶液需要用到下列操作:
3
a.打开容量瓶玻璃塞,加入适量水,塞紧塞子,倒立;
b.将塞子反转180°,倒立;
c.洗涤烧杯内壁和玻璃棒2~3次;
d.冷却至室温;
e.轻轻振荡容量瓶;
f.称取0.36g试样置于烧杯中,加入适量水充分溶解;
g.将溶液转移到容量瓶中;
h.定容,摇匀.
上述给出操作的正确顺序:a→______→______→______→g→______→______→______→h
(操作可重复).
(6)步骤②中取用FeCl 标准液V=______mL,样品的质量分数为______.
3
16.(14分)碳酸镧
La
2
CO
3
3
主要用于生产镧化合物石油催化剂、PVC助剂等;碳酸
镧作为一种磷的结合剂,有降低血磷的功效.回答下列问题:
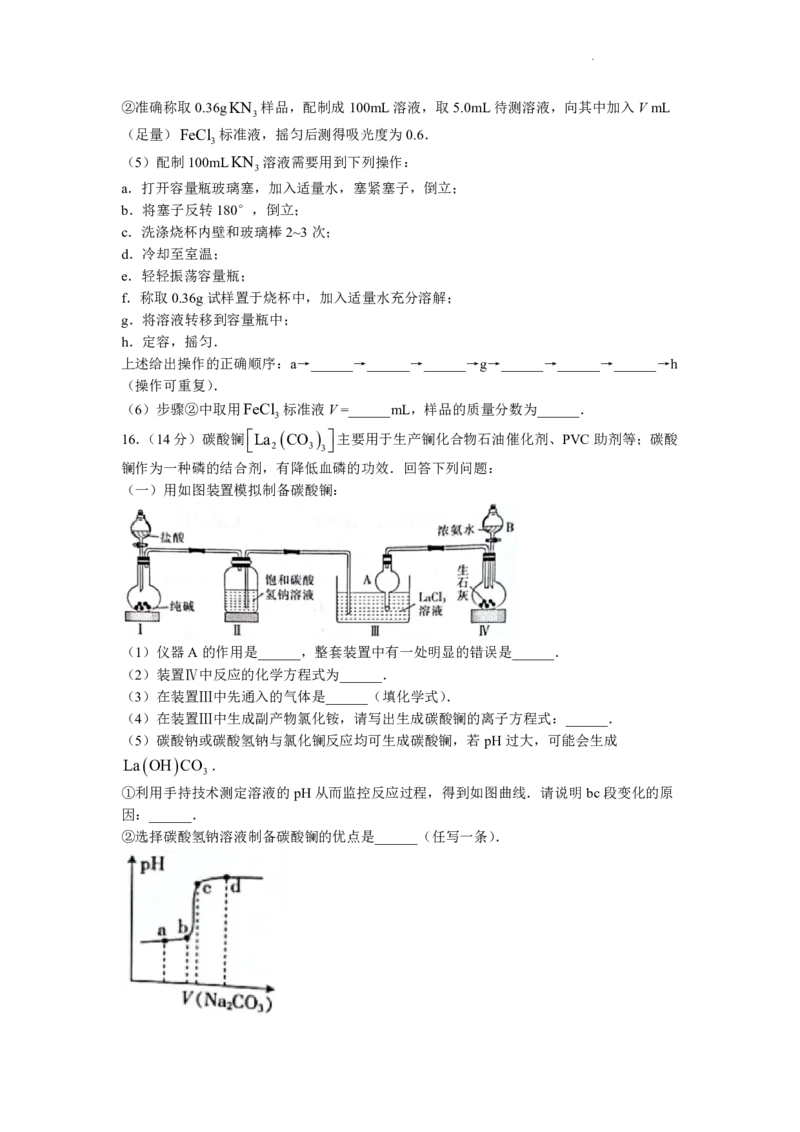
(一)用如图装置模拟制备碳酸镧:
(1)仪器A的作用是______,整套装置中有一处明显的错误是______.
(2)装置Ⅳ中反应的化学方程式为______.
(3)在装置Ⅲ中先通入的气体是______(填化学式).
(4)在装置Ⅲ中生成副产物氯化铵,请写出生成碳酸镧的离子方程式:______.
(5)碳酸钠或碳酸氢钠与氯化镧反应均可生成碳酸镧,若pH过大,可能会生成
La OH CO .
3
①利用手持技术测定溶液的pH从而监控反应过程,得到如图曲线.请说明bc段变化的原
因:______.
②选择碳酸氢钠溶液制备碳酸镧的优点是______(任写一条).
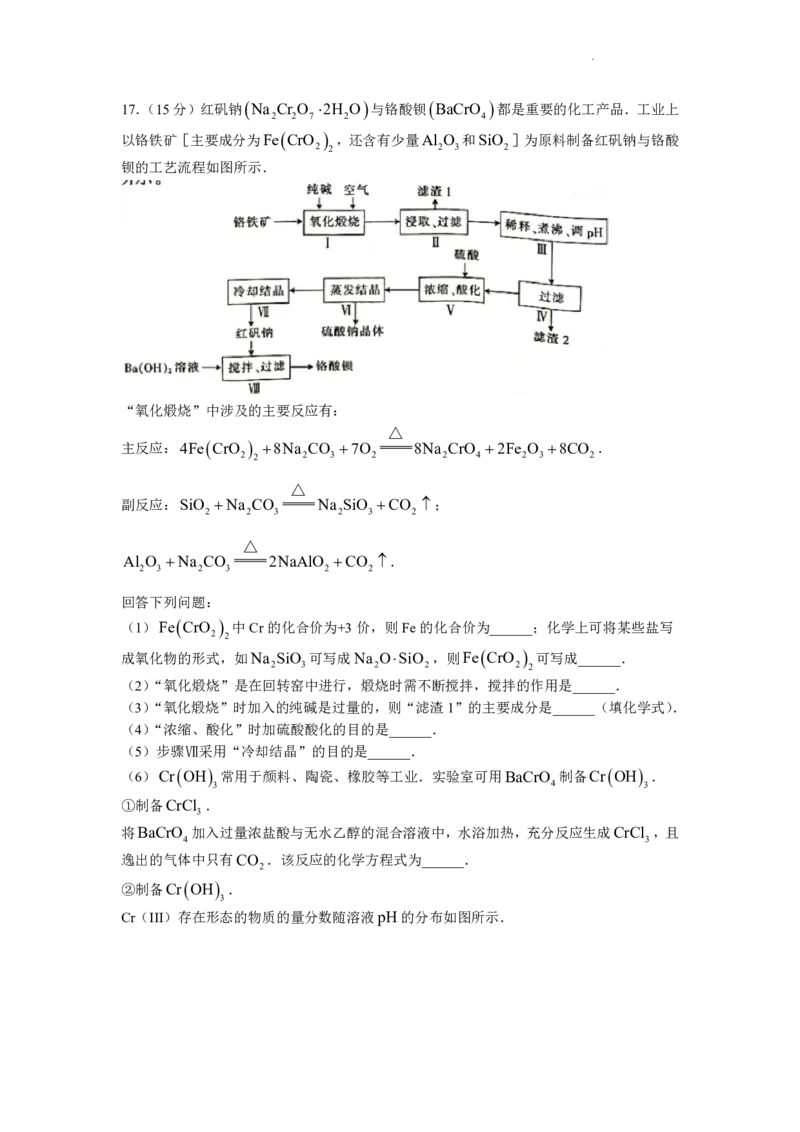
学科网(北京)股份有限公司17.(15分)红矾钠 Na Cr O 2H O 与铬酸钡 BaCrO 都是重要的化工产品.工业上
2 2 7 2 4
以铬铁矿[主要成分为Fe CrO ,还含有少量Al O 和SiO ]为原料制备红矾钠与铬酸
2 2 2 3 2
钡的工艺流程如图所示.
“氧化煅烧”中涉及的主要反应有:
△
主反应:4Fe CrO 8Na CO 7O 8Na CrO 2Fe O 8CO .
2 2 2 3 2 2 4 2 3 2
△
副反应:SiO Na CO Na SiO CO ;
2 2 3 2 3 2
△
Al O Na CO 2NaAlO CO .
2 3 2 3 2 2
回答下列问题:
(1)Fe CrO 中Cr的化合价为+3价,则Fe的化合价为______;化学上可将某些盐写
2 2
成氧化物的形式,如Na SiO 可写成Na OSiO ,则Fe CrO 可写成______.
2 3 2 2 2 2
(2)“氧化煅烧”是在回转窑中进行,煅烧时需不断搅拌,搅拌的作用是______.
(3)“氧化煅烧”时加入的纯碱是过量的,则“滤渣1”的主要成分是______(填化学式).
(4)“浓缩、酸化”时加硫酸酸化的目的是______.
(5)步骤Ⅶ采用“冷却结晶”的目的是______.
(6)Cr OH 常用于颜料、陶瓷、橡胶等工业.实验室可用BaCrO 制备Cr OH .
3 4 3
①制备CrCl .
3
将BaCrO 加入过量浓盐酸与无水乙醇的混合溶液中,水浴加热,充分反应生成CrCl ,且
4 3
逸出的气体中只有CO .该反应的化学方程式为______.
2
②制备Cr OH .
3
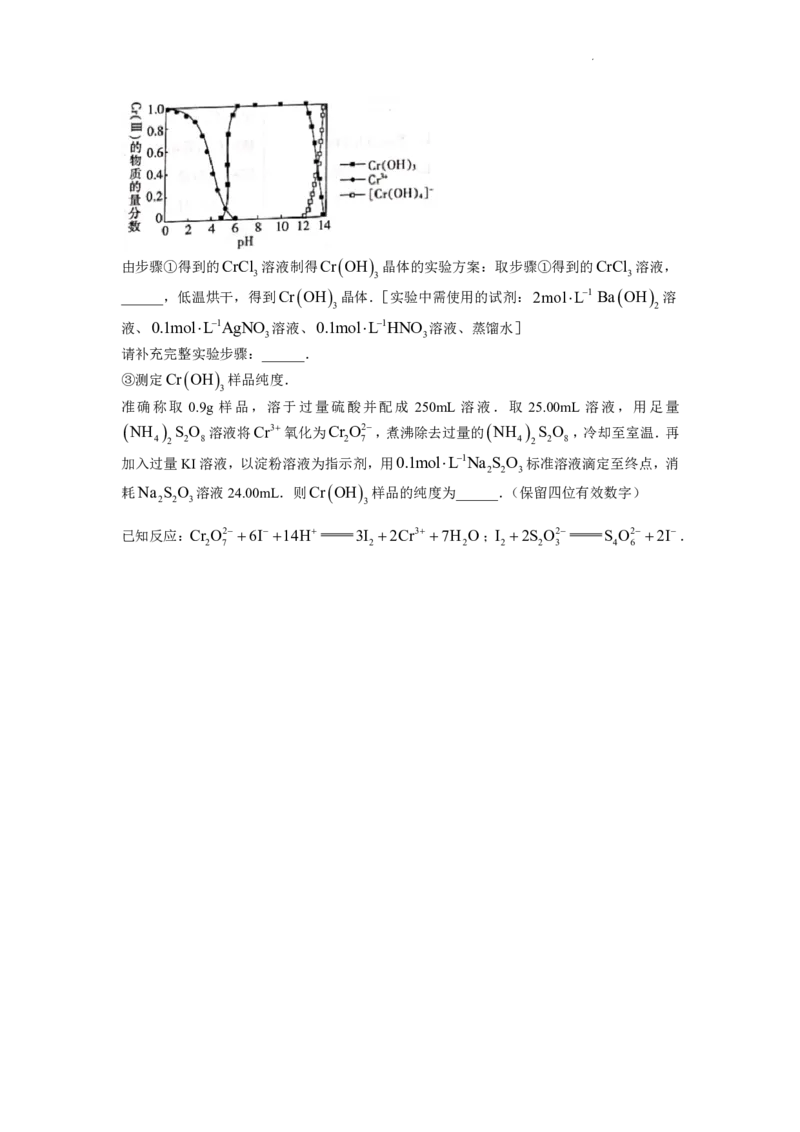
Cr(III)存在形态的物质的量分数随溶液pH的分布如图所示.
学科网(北京)股份有限公司由步骤①得到的CrCl 溶液制得Cr OH 晶体的实验方案:取步骤①得到的CrCl 溶液,
3 3 3
______,低温烘干,得到Cr OH 晶体.[实验中需使用的试剂:2molL1 Ba OH 溶
3 2
液、0.1molL1AgNO 溶液、0.1molL1HNO 溶液、蒸馏水]
3 3
请补充完整实验步骤:______.
③测定Cr OH 样品纯度.
3
准确称取 0.9g 样品,溶于过量硫酸并配成 250mL 溶液.取 25.00mL 溶液,用足量
NH S O 溶液将Cr3氧化为Cr O2,煮沸除去过量的 NH S O ,冷却至室温.再
4 2 2 8 2 7 4 2 2 8
加入过量KI溶液,以淀粉溶液为指示剂,用0.1molL1Na S O 标准溶液滴定至终点,消
2 2 3
耗Na S O 溶液24.00mL.则Cr OH 样品的纯度为______.(保留四位有效数字)
2 2 3 3
已知反应:Cr O2 6I 14H 3I 2Cr3 7H O;I 2S O2 S O2 2I.
2 7 2 2 2 2 3 4 6
学科网(北京)股份有限公司