文档内容
雅礼中学高三第二次月考化学试卷
时量:75分钟 分值:100分
命题人:朱鹏飞 审题人:孔凡亿
可能用到的相对原子质量:H:1 C:12 O:16 Na:23 Mg:24
Al:27 S:32 Cl:35.5 V:51 Cu:64
第Ⅰ卷(选择题)
一.选择题(本题共14个小题,每小题3分,共42分,每个小题只有一个正确答
案)
1.古医典富载化学知识,下述之物见其氧化性者为
A.金(Au):“虽被火亦未熟”
B.石灰(CaO):“以水沃之,即热蒸而解”
C.石硫黄(S):“能化……银、铜、铁,奇物”
D.蛎房(CaCO ):“煤饼烧蛎房成灰”
3
2.下列物质的性质与用途具有对应关系不正确的是
A.Ti—Fe合金和La—Ni合金能够吸收大量氢气,该类合金可以做储氢材料
B.HF具有酸性,可用于雕刻玻璃
C. 具有漂白、防腐和抗氧化等作用,可用作食品添加剂
D.水玻璃溶液耐高温,不易燃烧,可用于生产木材防火剂
3.下列物质的主要化学成分不正确的是
A.水晶:SiO B.不锈钢: Fe—Cr—Ni合金
2
C.石膏 :2CaSO •H O D.黄铜矿:CuFeS
4 2 2
4.我国科学家利用CO 合成淀粉的核心反应如图所示,设N 为阿伏加德罗常数的值,
2 A
下列说法正确的是
A.反应①消耗2.2g CO 时,转移电子数为0.6N
2 A
B.标准状况下22.4L H O 所含的非极性键数为N
2 2 A
C.30 g HCHO与DHA的混合物中含氧原子数为2N
A
D.16.2 g淀粉在氧气中燃烧可生成CO 分子数为0.6N
2 A
5.下列方程式或离子方程式与所给事实不相符的是
A.硫酸铜溶液中加过量的氨水:
B.在10mL0.1mol/L(NH )Fe(SO ) 溶液中滴加10mL0.1mol/L的Ba(OH) 溶液:
4 2 4 2 2
1
学科网(北京)股份有限公司2NH +SO +Ba2++2OH-═BaSO ↓+2NH+H O
4 3 2
C.侯氏制碱法的原理:NaCl+NH +H O+CO=NaHCO↓+NHCl 、
3 2 2 3 4
D.海水提溴工艺中,用纯碱溶液富集 :
6.某些化学知识用数轴表示更形象直观、简明易记。下列用数轴表示不合理的是
A 铁与稀硝酸反应
向烧碱溶液通入
B
SO 后的产物
2
Na与O 加热反
C 2
应的产物
D 分散系的分类
A.A B.B C.C D.D
7.m g铝镁合金与一定浓度的稀硝酸恰好完全反应(假定硝酸的还原产物只有 NO)向
反应后的混合溶液中滴加a mol/L NaOH溶液,当滴加到V mL时,得到沉淀质量恰好
为最大值n g,再将得到的沉淀灼烧至质量不再改变为止,得到固体p g,则下列有关
该实验的说法中正确的有 ( )
①沉淀中氢氧根的质量为(n—m)g
②恰好溶解后溶液中的NO- 的物质的量为aV mol
3
n−m
mol
17
③反应过程中转移的电子的物质的量为
22.4(n−m)
L
51
④生成NO气体的体积室温下为
n−m aV
( + )mol
51 1000
⑤与合金反应的硝酸的物质的量为
⑥用m表示P的范围: <p<
A.2项 B.3项 C.4项 D.5项
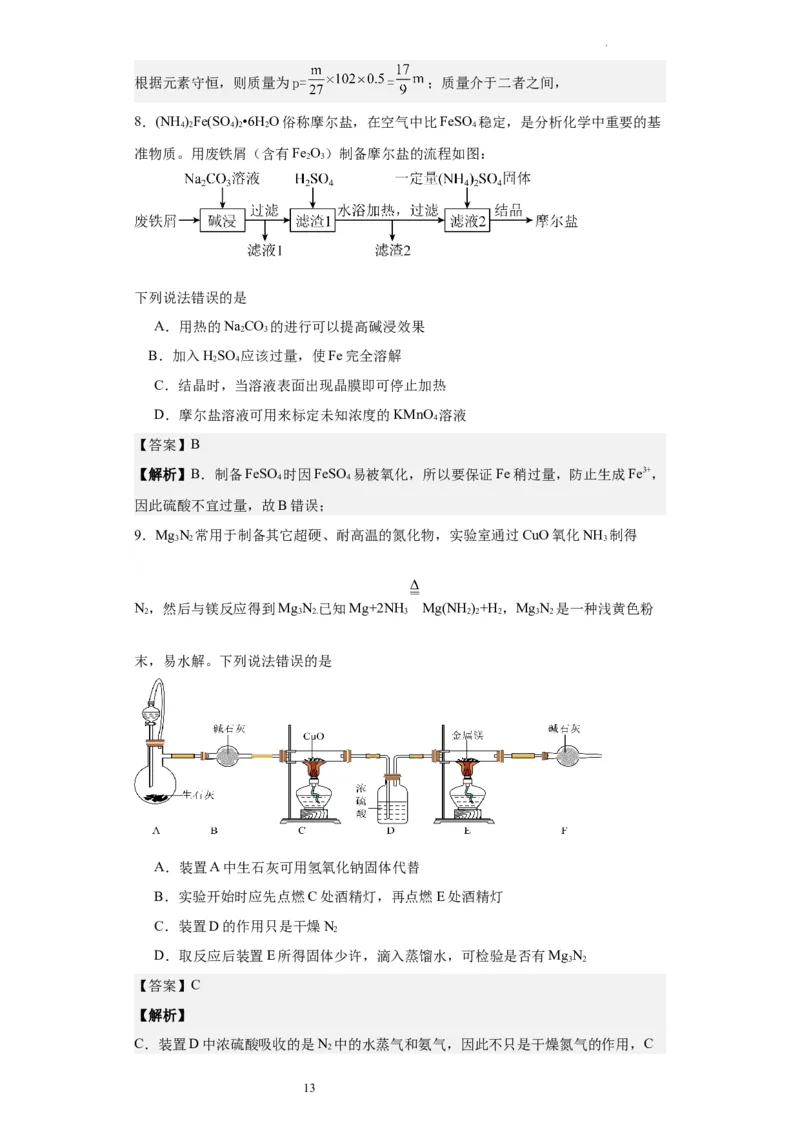
28.(NH )Fe(SO )•6H O俗称摩尔盐,在空气中比FeSO 稳定,是分析化学中重要的基
4 2 4 2 2 4
准物质。用废铁屑(含有Fe O)制备摩尔盐的流程如图:
2 3
下列说法错误的是
A.用热的NaCO 可以提高碱浸效果
2 3
B.加入HSO 应该过量,使Fe完全溶解
2 4
C.结晶时,当溶液表面出现晶膜即可停止加热
D.摩尔盐溶液可用来标定未知浓度的KMnO 溶液
4
9.MgN 常用于制备其它超硬、耐高温的氮化物,实验室通过CuO氧化NH 制得
3 2 3
N,然后与镁反应得到MgN。已知Mg+2NH Mg(NH)+H ,MgN 是一种浅黄色
2 3 2 3 2 2 2 3 2
粉末,易水解。下列说法错误的是
A.装置A中生石灰可用氢氧化钠固体代替
B.实验开始时应先点燃C处酒精灯,再点燃E处酒精灯
C.装置D的作用只是干燥N
2
D.取反应后装置E所得固体少许,滴入蒸馏水,可检验是否有MgN
3 2
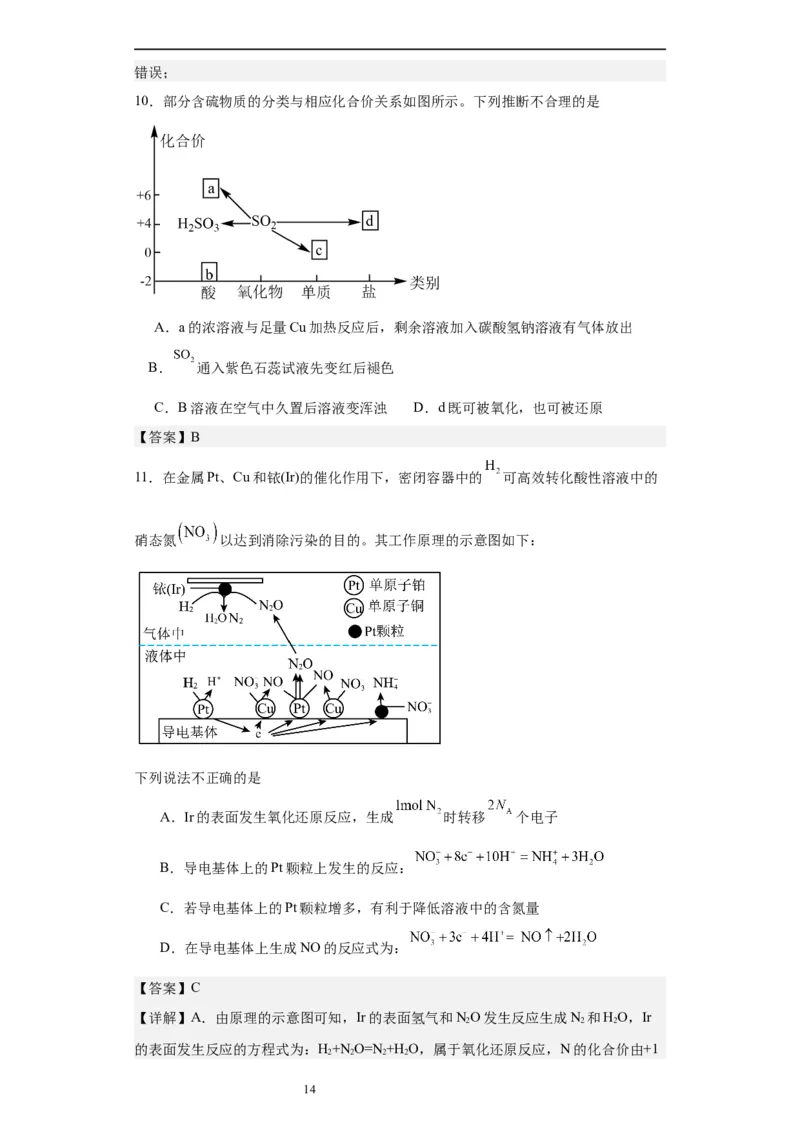
10.部分含硫物质的分类与相应化合价关系如图所示。下列推断不合理的是
3
学科网(北京)股份有限公司A.a的浓溶液与足量Cu加热反应后,剩余溶液加入碳酸氢钠溶液有气体放出
B. 通入紫色石蕊试液先变红后褪色
C.b溶液在空气中久置后溶液变浑浊 D.d既可被氧化,也可被还原
11.在金属Pt、Cu和铱(Ir)的催化作用下,密闭容器中的 可高效转化酸性溶液中的
硝态氮 以达到消除污染的目的。其工作原理的示意图如下:
下列说法不正确的是
A.Ir的表面发生氧化还原反应,生成 时转移 个电子
B.导电基体上的Pt颗粒上发生的反应:
C.若导电基体上的Pt颗粒增多,有利于降低溶液中的含氮量
D.在导电基体上生成NO的反应式为:
12.由短周期元素组成的中学常见物质A、B、C、D、E、X存在如图所示的转化关系
(部分生成物和反应条件略去)。下列推断错误的是
A.若D是白色沉淀,D与A的摩尔质量相等,则X可能是含铝离子的盐
4B.若A是金属单质,B和D的反应可能是
C.若D是 ,则A可能是 ,X同素异形体都不能导电
D.若A是氯气,X是 ,C是气体,则D和E能发生反应
13.甲~戊均为短周期元素,在元素周期表中的相对位置如图所示。戊的最高价氧化
物对应的水化物为强酸。下列说法一定正确的是
A.原子半径:乙>戊>丁
B.第一电离能:戊>丁
C.甲的氢化物遇湿润的红色石蕊试纸变蓝
D.丙的最高价氧化物对应的水化物能与强碱反应
14.工业上处理含硫矿物产生的 可以按如下流程脱除或利用。
已知: 下列说法错误的
A.燃煤中的有机硫主要呈正价 B.化合物A具有酸性
C.化合物A的沸点低于硫酸 D.工业上途径Ⅰ需要氧气参加
二.非选择题(本题共4个小题,共58分)
15.(15分)叠氮化钠( )不溶于乙醚,微溶于乙醇,易溶于水,汽车安全防护袋
的气源。
Ⅰ.实验室模拟尿素法制备水合肼( )并进一步反应制取 的流程如下:
5
学科网(北京)股份有限公司已知:① 易溶于水,具有强还原性,易被氧化成 ;
②一定条件下,碱性NaClO溶液与尿素溶液反应生成 。
回答下列问题:
(1)写出Cl 通入吸收塔中与冷的NaOH溶液反应的离子方程式 。
2
(2)写出反应器1中生成水合肼( )反应的化学方程式: 。 实际操
作中往反应器1中先加入 。(填“CO(NH)”或“吸收塔溶液”)
2 2
(3)反应器2中加入无水乙醚的作用是 。
Ⅱ.汽车安全气囊中的填充物有NaN 、SiO、KNO 等物质,NaN 遇撞击时能生成
3 2 3 3
N。
2
(4)上述列举的三种汽车安全气囊填充物中属于共价化合物的是 (填化学式),
所涉及的5种元素中,非金属元素的电负性由大到小的顺序为 。
(5)下列有关化学用语表示正确的是___________。
A.Ne和N3-的结构示意图均为 B.二氧化硅的分子式:SiO
2
C.氨气的空间填充模型: D.NH Br的电子式:
4
(6)工业也可以通过下列反应制备NaN ,
3
反应一: 反应二:
下列有关说法中正确的是__________。
A.反应一中每生成11.2L氢气(已换算至标准状况下的体积),转移电子数目为2N
A
B.反应一中NaNH 为强电解质,NH 为弱电解质
2 3
C.反应二中生成的氨气可以循环利用
D.碱金属叠氮化物的LiN 受撞击分解产生LiN和氮气,反应过程中发生了离子键和
3 3
非极性共价键的破坏与形成
16.(15分)氧化亚铜(Cu O)用于制造玻璃和陶瓷红色颜料,是一种难溶于水和乙醇
2
的砖红色固体,在酸性溶液中歧化为二价铜和铜单质。某小组制备Cu O并测定其纯度,
2
6回答下列问题:
I.制备Cu O
2
将新制NaSO 溶液和CuSO 溶液按一定量混合,加热至90°C并不断搅拌。反应结束
2 3 4
后,经过滤、洗涤、干燥得到Cu O粉末。制备装置如图所示:
2
(1)仪器a的名称是 ;反应适宜采用的加热方式为 。
(2)制备Cu O时,B装置的作用是吸收反应产生的酸性气体,防止污染环境,反应时原
2
料理论配比为n(Na SO ):n(CuSO )=3:2,该反应的化学方程式为 ;
2 3 4
(3)反应中不断滴加NaOH溶液目的是: 。
(4)Cu O的晶胞结构如图所示,图中表示Cu的是
(填“₂黑球”或“白球”),若该晶体的密度为ρg·cm ³, 晶胞参
数为apm, 则阿伏加德罗常数N = (用含⁻ ρ和a的代
A
数式表示)。
Ⅱ.测定Cu O纯度
2
称取m g样品置于烧杯中,加入足量FeCl 溶液,完全溶解后,加入4滴邻菲罗啉指示
3
剂,然后用c mol·L-1硫酸高铈[Ce(SO )]溶液进行滴定至终点,共消耗Ce(SO) 溶液
4 2 4 2
VmL。(已知:Ce4++Fe2+ =Ce3++Fe3+)
(5)加入FeCl 溶液时发生反应的离子方程式为 。
3
(6)该样品中Cu O的纯度为 %。
2
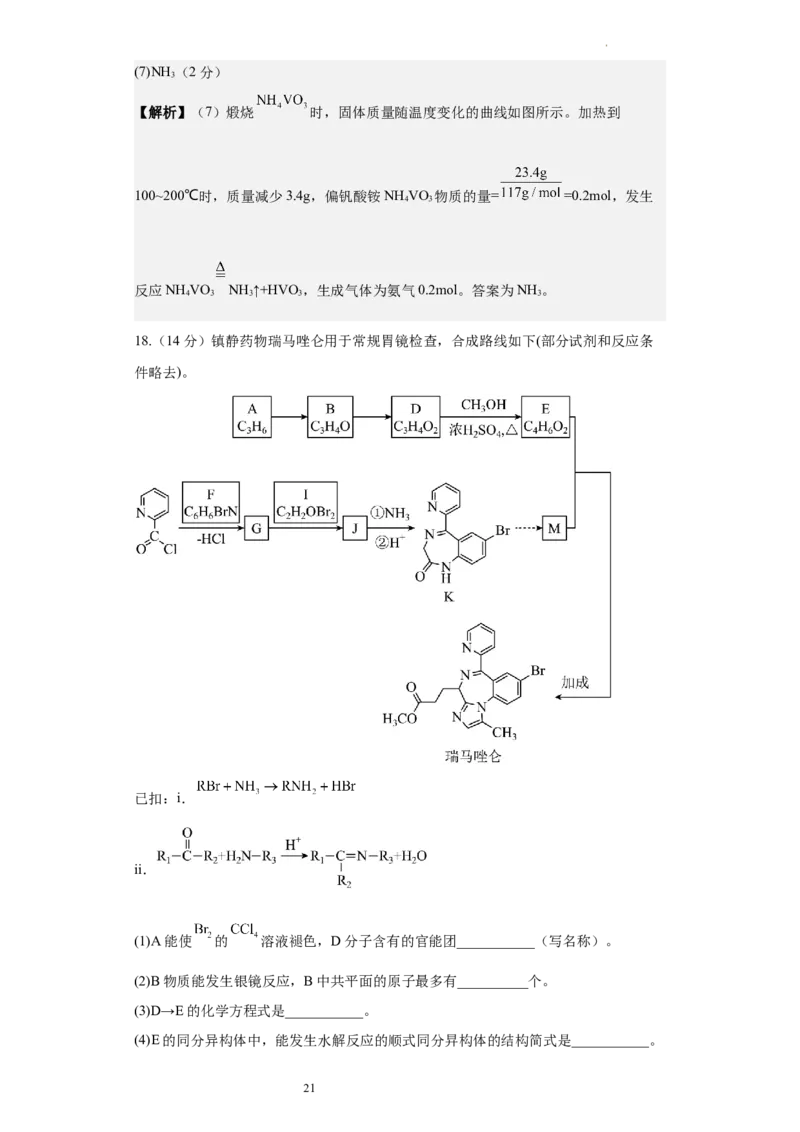
17.(14分)废催化剂(含 、 、 等成分)提取钛、钒工艺流程如下图所
示。
已知:①钛酸钠 难溶于水;
7
学科网(北京)股份有限公司②溶液的酸性较强时, 价钒主要以 的形式存在;
回答下列问题:
(1)Ti的价电子排布式
(2)上述流程中,发生的氧化还原反应有 个。
(3)“高温碱浸”中生成钛酸钠的离子方程式是 。
(4)下列金属冶炼方法与上述流程中加入 冶炼 的方法相似的是_______。
A.高炉炼铁 B.电解熔融氧化铝制铝 C.铝热反应制钒 D.氧化汞分解制汞
(5)“沉钒”过程中,一般要加入过量 ,其原因是 。
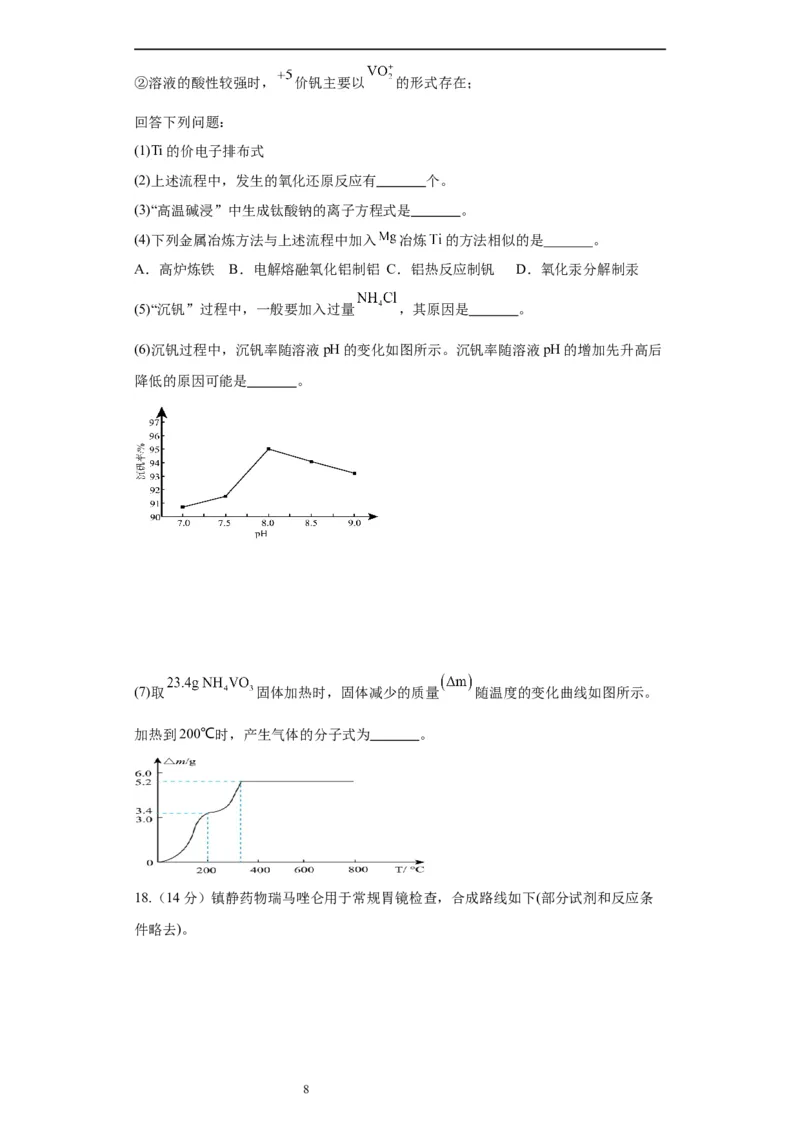
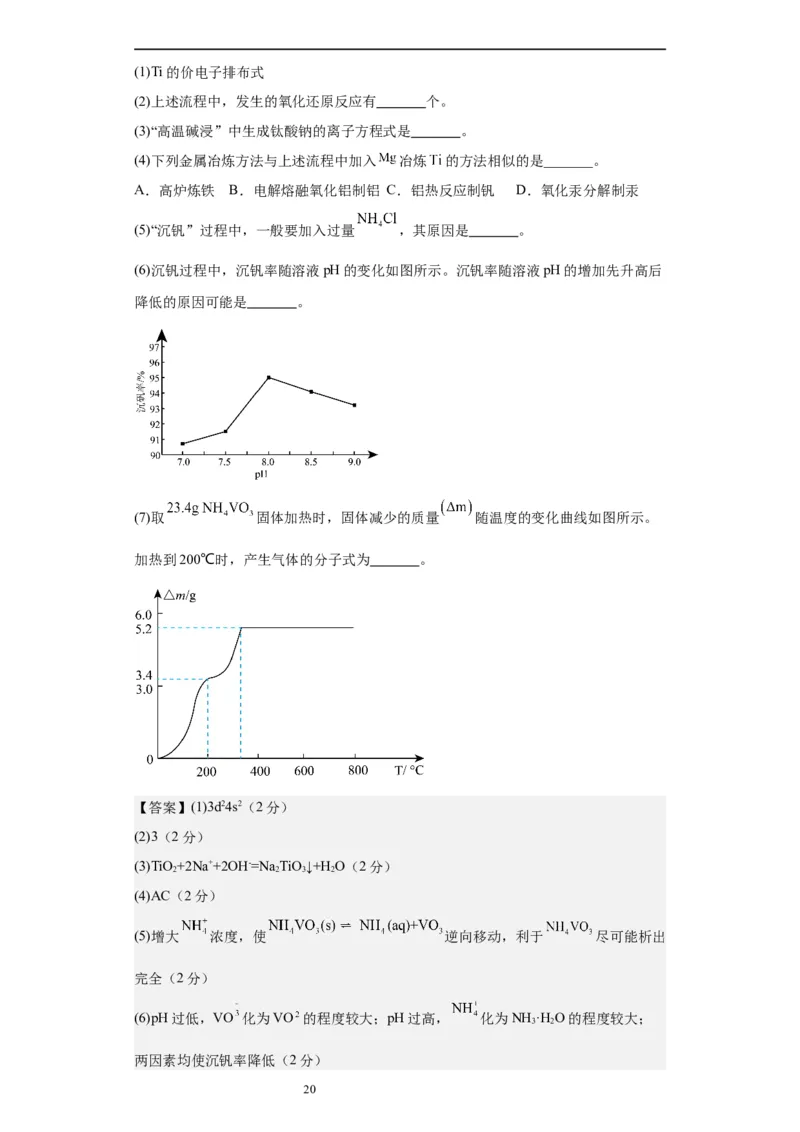
(6)沉钒过程中,沉钒率随溶液pH的变化如图所示。沉钒率随溶液pH的增加先升高后
降低的原因可能是 。
(7)取 固体加热时,固体减少的质量 随温度的变化曲线如图所示。
加热到200℃时,产生气体的分子式为 。
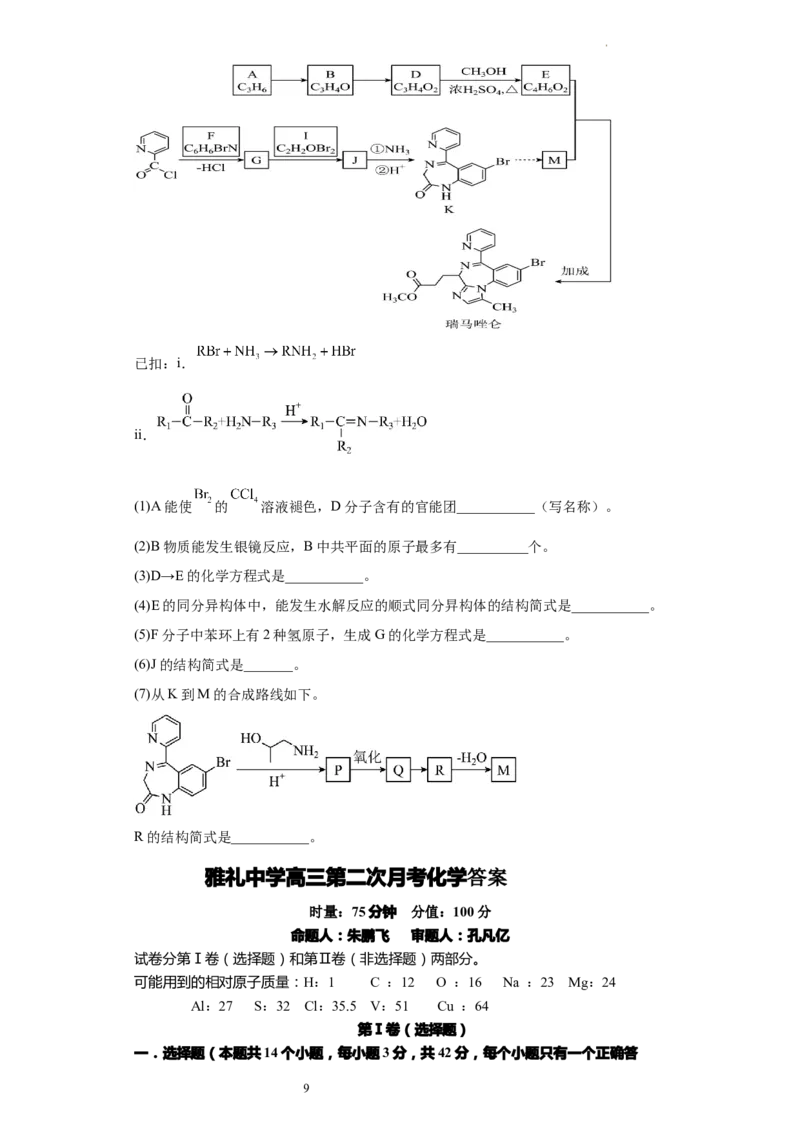
18.(14分)镇静药物瑞马唑仑用于常规胃镜检查,合成路线如下(部分试剂和反应条
件略去)。
8已扣:i.
ii.
(1)A能使 的 溶液褪色,D分子含有的官能团___________(写名称)。
(2)B物质能发生银镜反应,B中共平面的原子最多有__________个。
(3)D→E的化学方程式是___________。
(4)E的同分异构体中,能发生水解反应的顺式同分㫒构体的结构简式是___________。
(5)F分子中苯环上有2种氢原子,生成G的化学方程式是___________。
(6)J的结构简式是_______。
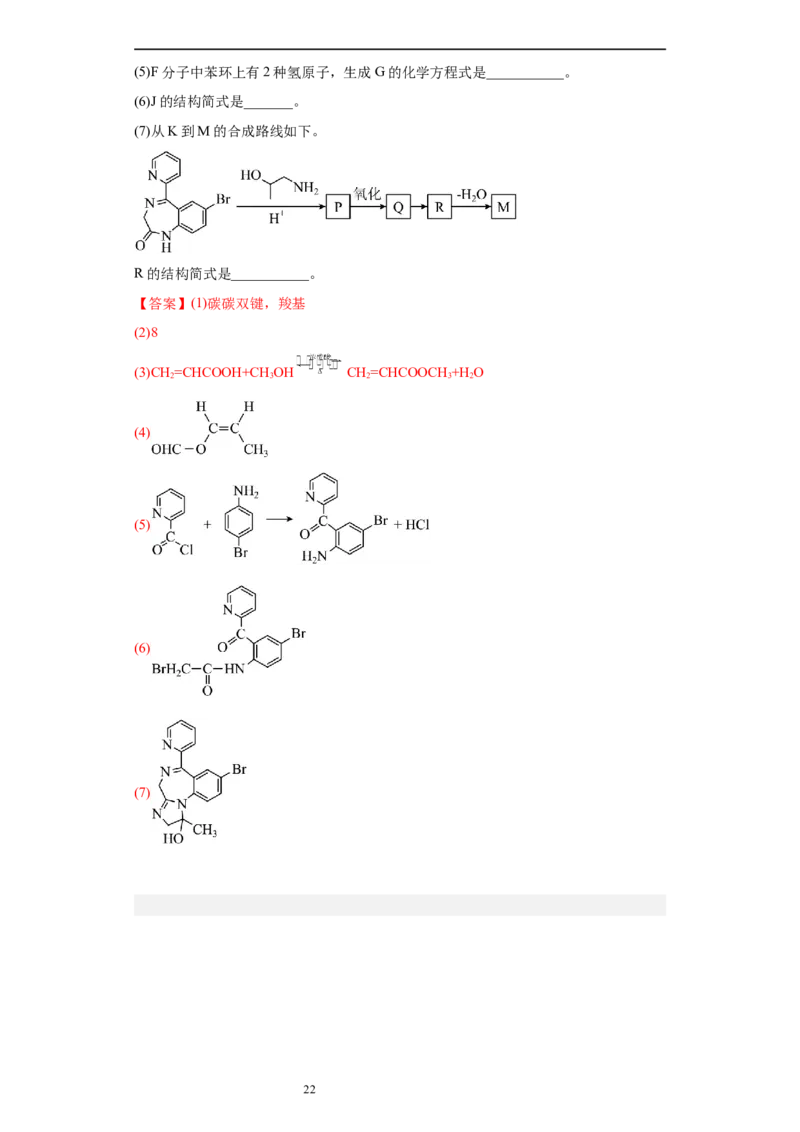
(7)从K到M的合成路线如下。
R的结构简式是___________。
雅礼中学高三第二次月考化学答案
时量:75分钟 分值:100分
命题人:朱鹏飞 审题人:孔凡亿
试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。
可能用到的相对原子质量:H:1 C :12 O :16 Na :23 Mg:24
Al:27 S:32 Cl:35.5 V:51 Cu :64
第Ⅰ卷(选择题)
一.选择题(本题共14个小题,每小题3分,共42分,每个小题只有一个正确答
9
学科网(北京)股份有限公司案)
1.古医典富载化学知识,下述之物见其氧化性者为
A.金(Au):“虽被火亦未熟”
B.石灰(CaO):“以水沃之,即热蒸而解”
C.石硫黄(S):“能化……银、铜、铁,奇物”
D.蛎房(CaCO ):“煤饼烧蛎房成灰”
3
【答案】C
【解析】 C项,语句描述的意思为S能与Ag、Cu、Fe等反应,方程式为S+2Ag
Ag S,S+2Cu Cu S,Fe+S FeS,反应中S的化合价降低,S表现为氧化性,
2 2
正确;
2.下列物质的性质与用途具有对应关系不正确的是
A.Ti—Fe合金和La—Ni合金能够吸收大量氢气,该类合金可以做储氢材料
B.HF具有酸性,可用于雕刻玻璃
C. 具有漂白、防腐和抗氧化等作用,可用作食品添加剂
D.水玻璃溶液耐高温,不易燃烧,可用于生产木材防火剂
【答案】B
【解析】B.氢氟酸能够与玻璃中二氧化硅反应,能够腐蚀玻璃,所以可以用于雕刻玻
璃,与其弱酸性无关,B不符合题意;
3.下列物质的主要化学成分不正确的是
A.石膏 :2CaSO •H O B.不锈钢: Fe—Cr—Ni合金
4 2
C.水晶:SiO D.黄铜矿:CuFeS
2 2
【答案】A 【解析】 石膏 :CaSO •2HO
4 2
4.我国科学家利用CO 合成淀粉的核心反应如图所示,设N 为阿伏加德罗常数的值,
2 A
下列说法正确的是
A.反应①消耗2.2g CO 时,转移电子数为0.6N
2 A
B.标准状况下22.4L H O 所含的非极性键数为N
2 2 A
C.30 g HCHO与DHA的混合物中含氧原子数为2N
A
D.16.2 g淀粉在氧气中燃烧可生成CO 分子数为0.6N
2 A
【答案】D
10【解析】A. 由反应机理可知,反应①发生的反应为二氧化碳与氢气反应生成甲醇和
氢气,则消耗2.2 g二氧化碳,反应转移电子数为0.3N;B.标准状况下,过氧化氢
A
为液态,;C.甲醛和DHA的最简式相同,都为CHO,则30 g甲醛与DHA的混合物中
2
含氧原子数为N,故C错误;D.16.2 g淀粉含C0.6N;故选D。
A A
5.下列方程式或离子方程式与所给事实不相符的是
A.硫酸铜溶液中加过量的氨水:
B.在10mL0.1mol/L(NH )Fe(SO ) 溶液中滴加10mL0.1mol/L的Ba(OH) 溶液:
4 2 4 2 2
2NH +SO +Ba2++2OH-═BaSO ↓+2NH+H O
4 3 2
C.侯氏制碱法的原理:NaCl+NH +H O+CO=NaHCO↓+NHCl 、
3 2 2 3 4
D.海水提溴工艺中,用纯碱溶液富集 :
【答案】B
6.某些化学知识用数轴表示更形象直观、简明易记。下列用数轴表示不合理的是
A 铁与稀硝酸反应
向烧碱溶液通入
B
SO 后的产物
2
Na与O 加热反
C 2
应的产物
D 分散系的分类
A.A B.B C.C D.D
【答案】C
【解析】C.Na与O 加热反应的产物是过氧化钠,与反应物的物质的量之比无关,该
2
数轴表示不合理,C符合题意;
7.m g铝镁合金与一定浓度的稀硝酸恰好完全反应(假定硝酸的还原产物只有 NO)向
反应后的混合溶液中滴加a mol/L NaOH溶液,当滴加到V mL时,得到沉淀质量恰好
为最大值n g,再将得到的沉淀灼烧至质量不再改变为止,得到固体p g,则下列有关
11
学科网(北京)股份有限公司该实验的说法中正确的有 ( )
①沉淀中氢氧根的质量为(n—m)g
②恰好溶解后溶液中的NO -离子的物质的量为aVmol
3
n−m
mol
17
③反应过程中转移的电子的物质的量为
22.4(n−m)
L
51
④生成NO气体的体积室温下为
n−m aV
( + )mol
51 1000
⑤与合金反应的硝酸的物质的量为
⑥用m表示P的范围: <p<
A.2项 B.3项 C.4项 D.5项
【答案】C
【解析】①正确,沉淀为 其质量为n g,而铝镁砂合金的质量
为m g,所以沉淀中氢氧根的质量为(n—m)g;②错,恰好溶解后溶液中的NO -离子
3
的物质的量与 的物质的量相等,即为 ;③正确,反应过程中转移
的电子的物质的量与 的物质的量相等,即 ;④错,,根据氧化还原反
应过程中得失电子数相等地,可得生成NO气体的体积在标准状况下为 ;
⑤正确,整个过程消耗的硝酸的物质的量为溶液中的硝酸根与生成的NO的物质的量之
和,即为 + ;
⑥氧化镁和氧化铝的质量可以按照极值方法计算,若m g全是镁,得到的氧化物为氧
化镁,根据元素守恒,则质量p= = ;若m g全是铝,得到的氧化物为氧化铝,
12根据元素守恒,则质量为p= = ;质量介于二者之间,
8.(NH )Fe(SO )•6H O俗称摩尔盐,在空气中比FeSO 稳定,是分析化学中重要的基
4 2 4 2 2 4
准物质。用废铁屑(含有Fe O)制备摩尔盐的流程如图:
2 3
下列说法错误的是
A.用热的NaCO 的进行可以提高碱浸效果
2 3
B.加入HSO 应该过量,使Fe完全溶解
2 4
C.结晶时,当溶液表面出现晶膜即可停止加热
D.摩尔盐溶液可用来标定未知浓度的KMnO 溶液
4
【答案】B
【解析】B.制备FeSO 时因FeSO 易被氧化,所以要保证Fe稍过量,防止生成Fe3+,
4 4
因此硫酸不宜过量,故B错误;
9.MgN 常用于制备其它超硬、耐高温的氮化物,实验室通过CuO氧化NH 制得
3 2 3
N,然后与镁反应得到MgN 已知Mg+2NH Mg(NH)+H ,MgN 是一种浅黄色粉
2 3 2. 3 2 2 2 3 2
末,易水解。下列说法错误的是
A.装置A中生石灰可用氢氧化钠固体代替
B.实验开始时应先点燃C处酒精灯,再点燃E处酒精灯
C.装置D的作用只是干燥N
2
D.取反应后装置E所得固体少许,滴入蒸馏水,可检验是否有MgN
3 2
【答案】C
【解析】
C.装置D中浓硫酸吸收的是N 中的水蒸气和氨气,因此不只是干燥氮气的作用,C
2
13
学科网(北京)股份有限公司错误;
10.部分含硫物质的分类与相应化合价关系如图所示。下列推断不合理的是
A.a的浓溶液与足量Cu加热反应后,剩余溶液加入碳酸氢钠溶液有气体放出
B. 通入紫色石蕊试液先变红后褪色
C.B溶液在空气中久置后溶液变浑浊 D.d既可被氧化,也可被还原
【答案】B
11.在金属Pt、Cu和铱(Ir)的催化作用下,密闭容器中的 可高效转化酸性溶液中的
硝态氮 以达到消除污染的目的。其工作原理的示意图如下:
下列说法不正确的是
A.Ir的表面发生氧化还原反应,生成 时转移 个电子
B.导电基体上的Pt颗粒上发生的反应:
C.若导电基体上的Pt颗粒增多,有利于降低溶液中的含氮量
D.在导电基体上生成NO的反应式为:
【答案】C
【详解】A.由原理的示意图可知,Ir的表面氢气和NO发生反应生成N 和HO,Ir
2 2 2
的表面发生反应的方程式为:H+N O=N+H O,属于氧化还原反应,N的化合价由+1
2 2 2 2
14变为0,故生成1molN 时转移2N 个电子,故A正确;
2 A
B.根据图示,导电基体上的Pt颗粒上,部分 得到电子变为 ,则Pt颗粒上发
生的反应: ,故B正确;
C.导电基体上的Pt颗粒上,部分 得到电子变为 , 仍在溶液中,所以若
导电基体上的Pt颗粒增多,不利于降低溶液中的含氮量,故C错误;
D.导电基体上的Cu颗粒上, 得到电子变为NO,则在导电基体上生成NO的反
应式为: +3e-+4H+═NO↑+2H O,故D正确;
2
故选:C。
12.由短周期元素组成的中学常见物质A、B、C、D、E、X存在如图所示的转化关系
(部分生成物和反应条件略去)。下列推断错误的是
A.若D是白色沉淀,D与A的摩尔质量相等,则X可能是含铝离子的盐
B.若A是金属单质,B和D的反应可能是
C.若D是 ,则A可能是 ,X同素异形体都不能导电
D.若A是氯气,X是 ,C是气体,则D和E能发生反应
【答案】C
【解析】C.过氧化钠与水反应生成氢氧化钠和氧气,而D为 CO,则B为O,X为
2
碳单质,C为CO,碳的同素异形体有金刚石、石墨、C 等,C错误;
2 60
13.(2022·广东卷)甲~戊均为短周期元素,在元素周期表中的相对位置如图所示。
戊的最高价氧化物对应的水化物为强酸。下列说法一定正确的是
A.原子半径:乙>戊>丁
B.第一电离能:戊>丁
C.甲的氢化物遇湿润的红色石蕊试纸变蓝
D.丙的最高价氧化物对应的水化物能与强碱反应
15
学科网(北京)股份有限公司【答案】D
【解析】甲~戊是短周期元素,戊中的最高价氧化物对应水化物为强酸,则可能是硫
酸或高氯酸,若是高氯酸,则戊为Cl,甲为N、乙为F、丙为P、丁为S,若是硫酸,
则戊为S,甲为C、乙为O、丙为Si、丁为P。
D选项:丙的最高价氧化物对应的水化物可能是硅酸、也可能是磷酸,都一定能与强
碱反应,正确。
14.工业上处理含硫矿物产生的 可以按如下流程脱除或利用。
已知: 下列说法错误的
A.燃煤中的有机硫主要呈正价 B.化合物A具有酸性
C.化合物A的沸点低于硫酸 D.工业上途径Ⅰ需要氧气参加
【解析】①A.硫的电负性大于碳、氢等,故燃煤中的有机硫主要呈负价,A错误;
B.根据分析可知,化合物A分子中与硫直接相连的基团中有-OH,故能电离出氢离
子,具有酸性,B正确;
C.一定压强下,化合物A分子只有1个-OH能形成氢键,而硫酸分子中有2个-OH形
成氢键,故导致A的沸点低于硫酸;
二.非选择题(本题共4个小题,共58分)
17.(15分)叠氮化钠( )不溶于乙醚,微溶于乙醇,易溶于水,汽车安全防护袋
的气源。
Ⅰ.实验室模拟尿素法制备水合肼( )并进一步反应制取 的流程如下:
16已知:① 易溶于水,具有强还原性,易被氧化成 ;
②一定条件下,碱性NaClO溶液与尿素溶液反应生成 。
回答下列问题:
(1)写出Cl 通入吸收塔中与冷的NaOH溶液反应的离子方程式 。
2
(2)写出反应器1中生成水合肼( )反应的化学方程式: 。 实际操
作中往反应器1中先加入 。(填“CO(NH)”或“吸收塔溶液”)
2 2
(3)反应器2中加入无水乙醚的作用是 。
Ⅱ.汽车安全气囊中的填充物有NaN 、SiO、KNO 等物质,NaN 遇撞击时能生成
3 2 3 3
N。
2
(4)上述列举的三种汽车安全气囊填充物中属于共价化合物的是 (填化学式),
所涉及的5种元素中,非金属元素的电负性由大到小的顺序为 。
(5)下列有关化学用语表示正确的是___________。
A.Ne和N3-的结构示意图均为 B.二氧化硅的分子式:SiO
2
C.氨气的空间填充模型: D.NH Br的电子式:
4
(6)工业也可以通过下列反应
反应一: 反应二:
制备NaN ,下列有关说法中正确的是__________。
3
A.反应一中每生成11.2L氢气(已换算至标准状况下的体积),转移电子数目为2N
A
B.反应一中NaNH 为强电解质,NH 为弱电解质
2 3
C.反应二中生成的氨气可以循环利用
D.碱金属叠氮化物的LiN 受撞击分解产生LiN和氮气,反应过程中发生了离子键和
3 3
非极性共价键的破坏与形成
【答案】(1) (2分)
(2) (2分)
17
学科网(北京)股份有限公司CO(NH)(2分)
2 2
生成具有 有强还原性,会被NaClO氧化。
(3)降低 的溶解度,有利于 结晶析出(2分)
(4) SiO (1分) O>N>Si(2分)
2
(5)D (2分) (6)CD(2分)
16.(15分)氧化亚铜(Cu O)在制造玻璃和陶瓷红色颜料。是一种难溶于水和乙醇的
2
砖红色固体,在酸性溶液中歧化为二价铜和铜单质。某小组制备Cu O并测定其纯度,
2
回答下列问题:
I.制备Cu O
2
将新制NaSO 溶液和CuSO 溶液按一定量混合,加热至90°C并不断搅拌。反应结束
2 3 4
后,经过滤、洗涤、干燥得到Cu O粉末。制备装置如图所示:
2
(1)仪器a的名称是 ;反应适宜采用的加热方式为 。
(2)制备Cu O时,B装置的作用是吸收反应产生的酸性气体,防止污染环境,反应时原
2
料理论配比为n(Na SO ):n(CuSO )=3:2,该反应的化学方程式为 ;
2 3 4
(3)反应中不断滴加NaOH溶液目的是: 。
(4)Cu O的晶胞结构如图所示,图中表示Cu的是 (填“黑球”或“白球”),
若该晶₂体的密度为ρg·cm ³, 晶胞参数为apm, 则阿伏加德罗常数N =
A
(用含ρ和a的代数式表示⁻)。
Ⅱ.测定Cu O纯度
2
18称取m g样品置于烧杯中,加入足量FeCl 溶液,完全溶解后,加入4滴邻菲罗啉指示
3
剂,然后用c mol·L-1硫酸高铈[Ce(SO )]溶液进行滴定至终点,共消耗Ce(SO) 溶液
4 2 4 2
VmL。(已知:Ce4++Fe2+ =Ce3++Fe3+)
(5)加入FeCl 溶液时发生反应的离子方程式为 。
3
(6)该样品中Cu O的纯度为 %。
2
【答案】(1) 三颈烧瓶(2分) 水浴加热(2分)
(2)3NaSO + 2CuSO = Cu O↓+ 3Na SO + 2SO ↑ (2分)
2 3 4 2 2 4 2
(3)反应产生SO ,导致溶液酸性增强,Cu O 在酸性溶液中歧化为二价铜和铜单质从而
2 2
降低Cu O含量(2分)
2
(4) 黑球 (1分) g·cm ³(2分)
⁻
(5)2Fe3+ +Cu O+2H+ = 2Fe2++ 2Cu2++ H O(2分)
2 2
(6) (2分)
【解析】
(6)由方程式可得如下转化关系:Cu O—2Fe2+—2Ce4+,滴定消耗VmLc mol·L-1硫酸
2
高铈溶液,则样品中氧化亚铜的纯度为 ×100%=
,故答案为: 。
15.(14分)废催化剂(含 、 、 等成分)提取钛、钒工艺流程如下图所
示。
已知:①钛酸钠 难溶于水;
②溶液的酸性较强时, 价钒主要以 的形式存在;
③溶液中某离子浓度 ,认为该离子沉淀完全。
回答下列问题:
19
学科网(北京)股份有限公司(1)Ti的价电子排布式
(2)上述流程中,发生的氧化还原反应有 个。
(3)“高温碱浸”中生成钛酸钠的离子方程式是 。
(4)下列金属冶炼方法与上述流程中加入 冶炼 的方法相似的是_______。
A.高炉炼铁 B.电解熔融氧化铝制铝 C.铝热反应制钒 D.氧化汞分解制汞
(5)“沉钒”过程中,一般要加入过量 ,其原因是 。
(6)沉钒过程中,沉钒率随溶液pH的变化如图所示。沉钒率随溶液pH的增加先升高后
降低的原因可能是 。
(7)取 固体加热时,固体减少的质量 随温度的变化曲线如图所示。
加热到200℃时,产生气体的分子式为 。
【答案】(1)3d24s2(2分)
(2)3(2分)
(3)TiO+2Na++2OH-=Na TiO↓+H O(2分)
2 2 3 2
(4)AC(2分)
(5)增大 浓度,使 逆向移动,利于 尽可能析出
完全(2分)
(6)pH过低,VO 化为VO 的程度较大;pH过高, 化为NH ·H O的程度较大;
3 2
两因素均使沉钒率降低(2分)
20(7)NH (2分)
3
【解析】(7)煅烧 时,固体质量随温度变化的曲线如图所示。加热到
100~200℃时,质量减少3.4g,偏钒酸铵NH VO 物质的量= =0.2mol,发生
4 3
反应NH VO NH ↑+HVO ,生成气体为氨气0.2mol。答案为NH 。
4 3 3 3 3
18.(14分)镇静药物瑞马唑仑用于常规胃镜检查,合成路线如下(部分试剂和反应条
件略去)。
已扣:i.
ii.
(1)A能使 的 溶液褪色,D分子含有的官能团___________(写名称)。
(2)B物质能发生银镜反应,B中共平面的原子最多有__________个。
(3)D→E的化学方程式是___________。
(4)E的同分异构体中,能发生水解反应的顺式同分㫒构体的结构简式是___________。
21
学科网(北京)股份有限公司(5)F分子中苯环上有2种氢原子,生成G的化学方程式是___________。
(6)J的结构简式是_______。
(7)从K到M的合成路线如下。
R的结构简式是___________。
【答案】(1)碳碳双键,羧基
(2)8
(3)CH =CHCOOH+CH OH CH=CHCOOCH +H O
2 3 2 3 2
(4)
(5)
(6)
(7)
22雅礼中学高三第二次月考化学答案
1 2 3 4 5 6 7
C B A D B C C
8 9 10 11 12 13 14
B C B C C D A
15.(15分)
【答案】(1) (2分)
(3) (2分)
CO(NH)(2分)
2 2
生成具有 有强还原性,会被NaClO氧化。
(3)降低 的溶解度,有利于 结晶析出(2分)
(4) SiO (1分) O>N>Si(2分)
2
(5)D (2分) (6)CD(2分)
16.(15分)
【答案】(1) 三颈烧瓶(2分) 水浴加热(2分)
(2)3NaSO + 2CuSO = Cu O↓+ 3Na SO + 2SO ↑ (2分)
2 3 4 2 2 4 2
(3)反应产生SO ,导致溶液酸性增强,Cu O 在酸性溶液中歧化为二价铜和铜单质从而
2 2
降低Cu O含量(2分)
2
23
学科网(北京)股份有限公司(4) 黑球 (1分) g·cm ³(2分)
⁻
(5)2Fe3+ +Cu O+2H+ = 2Fe2++ 2Cu2++ H O(2分)
2 2
(6) (2分)
17.(14分)
【答案】(1)3d24s2(2分)
(2)3(2分)
(3)TiO+2Na++2OH-=Na TiO+H O(2分)
2 2 3 2
(4)AC(2分)
(5)增大 浓度,使 逆向移动,利于 尽可能析出
完全(2分)
(6)pH过低,VO 化为VO 的程度较大;pH过高, 化为NH ·H O的程度较大;
3 2
两因素均使沉钒率降低(2分)
(7)NH (2分)
3
18.(14分)
【答案】(1)碳碳双键,羧基
(2)8
(3)CH =CHCOOH+CH OH CH=CHCOOCH +H O
2 3 2 3 2
(4)
(5)
(6)
24(7)
25
学科网(北京)股份有限公司