文档内容
2023~2024 学年高三上学期开学质量检测
化学试题
考生注意:
1.本试卷分选择题和非选择题两部分。满分 100分,考试时间 90分钟。
2.答题前,考生务必用直径 0.5毫米黑色墨水签字笔将密封线内项目填写清楚。
3.考生作答时,请将答案答在答题卡上。选择题每小题选出答案后,用 2B铅笔把答题卡上对
应题目的答案标号涂黑;非选择题请用直径 0.5毫米黑色墨水签字笔在答题卡上各题的答题区
域内作答,超出答题区域书写的答案无效,在试题卷、草稿纸上作答无效。
4.本卷命题范围:高考全范围。
5.可能用到的相对原子质量:H1 C12 O16 Si28 Cl35.5 Ca40
一、选择题(本题共 14小题,每小题 3分,共计 42分。在每小题列出的四个选项中,只有一
项是符合题目要求的)
1.化学与生产、生活、社会紧密联系,下列有关说法正确的是( )
A.CaO溶于水放出大量热,可利用该反应设计成原电池
B.氯碱工业电解饱和食盐水的电解槽中采用的是( )阴离子交换膜
C.储氢合金是一类能够大量吸收H ,并与H 结合成金属氢化物的材料
2 2
D.寻找合适的催化剂,使水分解产生氢气的同时放出热量是科学家研究的方向
2.化学用语可以表达化学过程,下列化学用语的表达正确的是( )
A.邻羟基苯甲醛中加入足量浓溴水:
B.向次氯酸钙溶液中通入SO :Ca2 2ClO SO H O CaSO 2HClO
2 2 2 3
C.用电子式表示HCl的形成过程:
D.尿素与甲醛制备线型脲醛树脂:
3.从豆科植物蚕豆中提取出来的 L-多巴用于治疗震颤麻痹症,其结构简式如图。下列说法错误的是
( )
学科网(北京)股份有限公司A.分子中所有碳原子可能共平面
B.可发生取代反应和氧化反应
C.分子中有1个手性碳原子
D.1 mol·L1多巴最多可以与4 mol H 发生加成反应
2
4.下列实验过程中的颜色变化,涉及氧化还原反应的是( )
A.用洁净的铂丝蘸食盐水在酒精灯外焰上灼烧,火焰呈黄色
B.向红墨水中加入一定量的活性炭,一段时间后颜色褪去
C.向含有淀粉的碘水中通入二氧化硫,溶液蓝色褪去
D.浓硫酸滴到蓝色五水硫酸铜晶体上,晶体变白色
5.明代《徐光启手迹》记载了制备硝酸的方法,其主要流程(部分产物已省略)如下:
下列说法错误的是( )
A.X溶于稀硫酸,加入KSCN溶液,溶液呈血红色
B.标准状况下,22.4 L SO 含有分子数约为6.021023
3
C.步骤③的反应原理是HNO 的沸点比H SO 低
3 2 4
D.实验室中硝酸应避光保存在棕色试剂瓶里
6.下列有关微粒的结构和性质的说法正确的是( )
A.H O 和C H 的空间结构均为直线形
2 2 2 2
B.NH 和BF 的VSEPR模型均为平面三角形
3 3
C.邻羟基苯甲酸沸点比对羟基苯甲酸沸点高
D.OF 和NCl 均是极性分子,且NCl 分子的键角较大
2 3 3
7.WYX 是在化工领域有着重要应用价值的离子化合物,X、W、Y、Z是原子序数依次增大的短周期主族
4
元素,X、W、Y位于不同短周期,且X、W同主族,Z的原子序数等于X、W、Y的原子序数之和,Z的氢
化物水溶液是一种常见的强酸。下列说法中正确的是( )
A.W是短周期元素中金属性最强的元素 B.离子半径:Y>Z
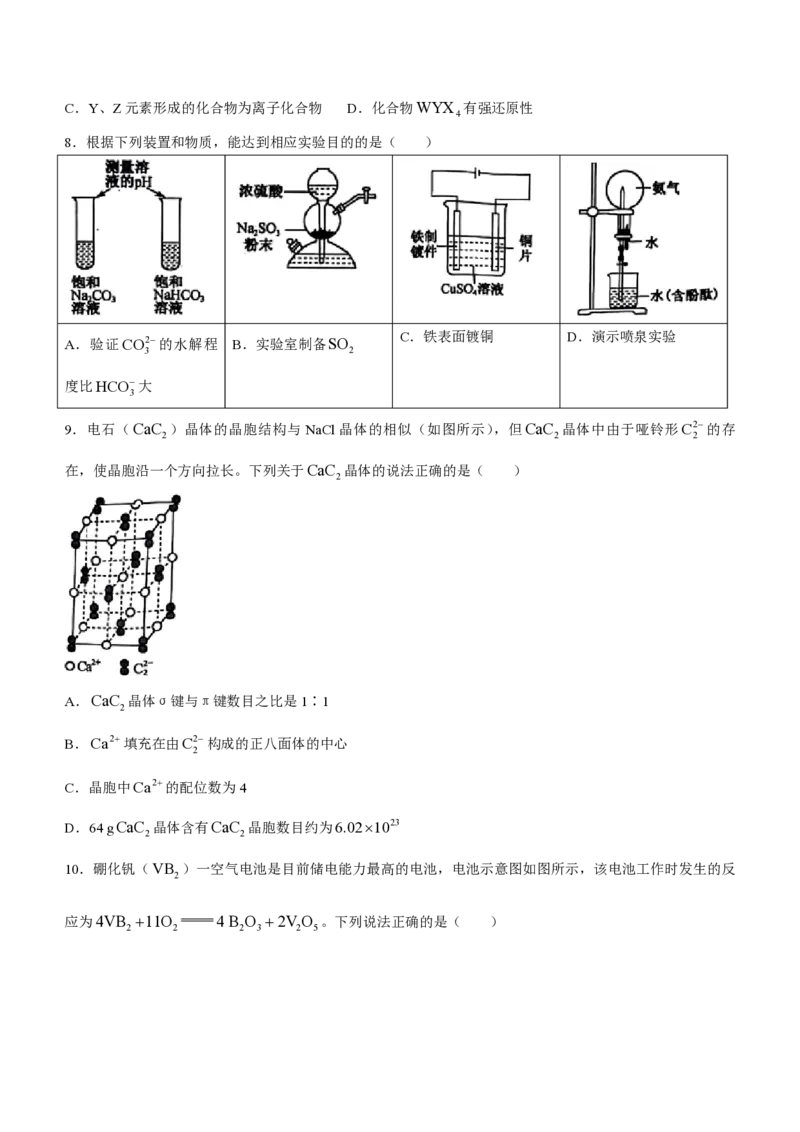
学科网(北京)股份有限公司C.Y、Z元素形成的化合物为离子化合物 D.化合物WYX 有强还原性
4
8.根据下列装置和物质,能达到相应实验目的的是( )
C.铁表面镀铜 D.演示喷泉实验
A.验证CO2的水解程 B.实验室制备SO
3 2
度比HCO大
3
9.电石(CaC )晶体的晶胞结构与 NaCl晶体的相似(如图所示),但CaC 晶体中由于哑铃形C2的存
2 2 2
在,使晶胞沿一个方向拉长。下列关于CaC 晶体的说法正确的是( )
2
A.CaC 晶体σ键与π键数目之比是1∶1
2
B.Ca2填充在由C2构成的正八面体的中心
2
C.晶胞中Ca2的配位数为4
D.64 gCaC 晶体含有CaC 晶胞数目约为6.021023
2 2
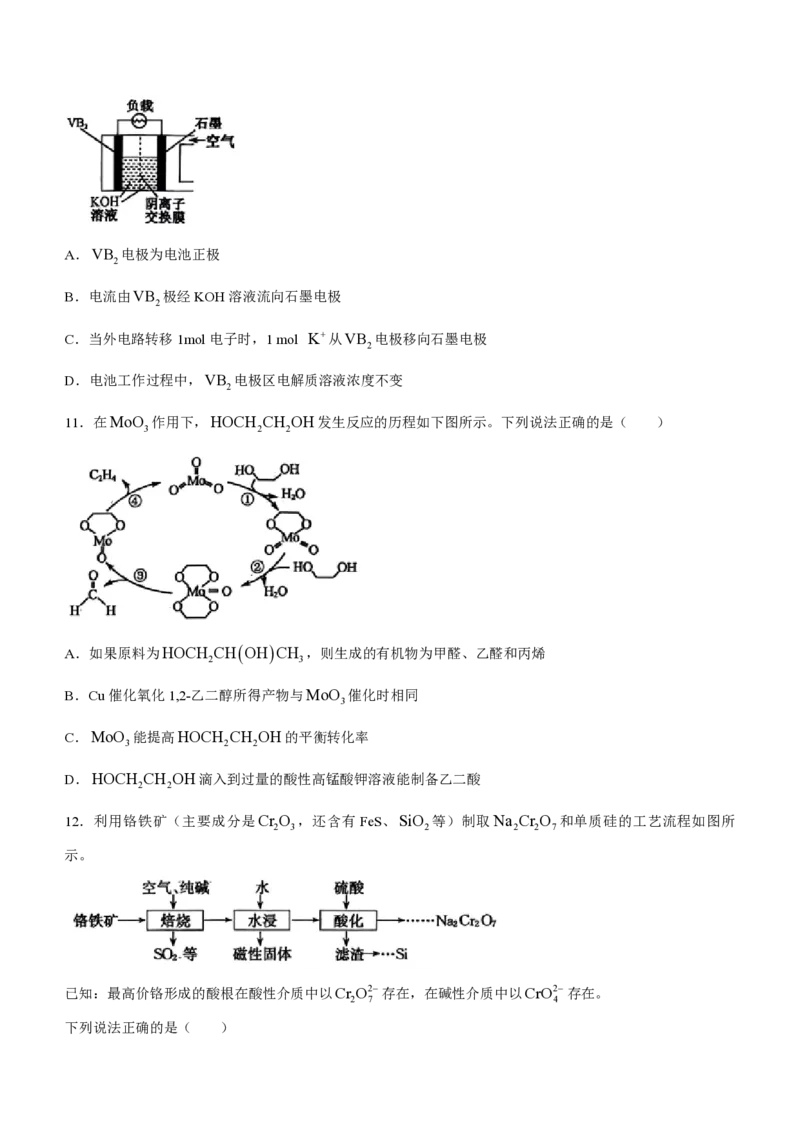
10.硼化钒(VB )一空气电池是目前储电能力最高的电池,电池示意图如图所示,该电池工作时发生的反
2
应为4VB 11O 4 B O 2V O 。下列说法正确的是( )
2 2 2 3 2 5
学科网(北京)股份有限公司A.VB 电极为电池正极
2
B.电流由VB 极经KOH溶液流向石墨电极
2
C.当外电路转移1mol电子时,1 mol K从VB 电极移向石墨电极
2
D.电池工作过程中,VB 电极区电解质溶液浓度不变
2
11.在MoO 作用下,HOCH CH OH发生反应的历程如下图所示。下列说法正确的是( )
3 2 2
A.如果原料为HOCH CHOHCH ,则生成的有机物为甲醛、乙醛和丙烯
2 3
B.Cu催化氧化1,2-乙二醇所得产物与MoO 催化时相同
3
C.MoO 能提高HOCH CH OH的平衡转化率
3 2 2
D.HOCH CH OH滴入到过量的酸性高锰酸钾溶液能制备乙二酸
2 2
12.利用铬铁矿(主要成分是Cr O ,还含有 FeS、SiO 等)制取Na Cr O 和单质硅的工艺流程如图所
2 3 2 2 2 7
示。
已知:最高价铬形成的酸根在酸性介质中以Cr O2存在,在碱性介质中以CrO2存在。
2 7 4
下列说法正确的是( )
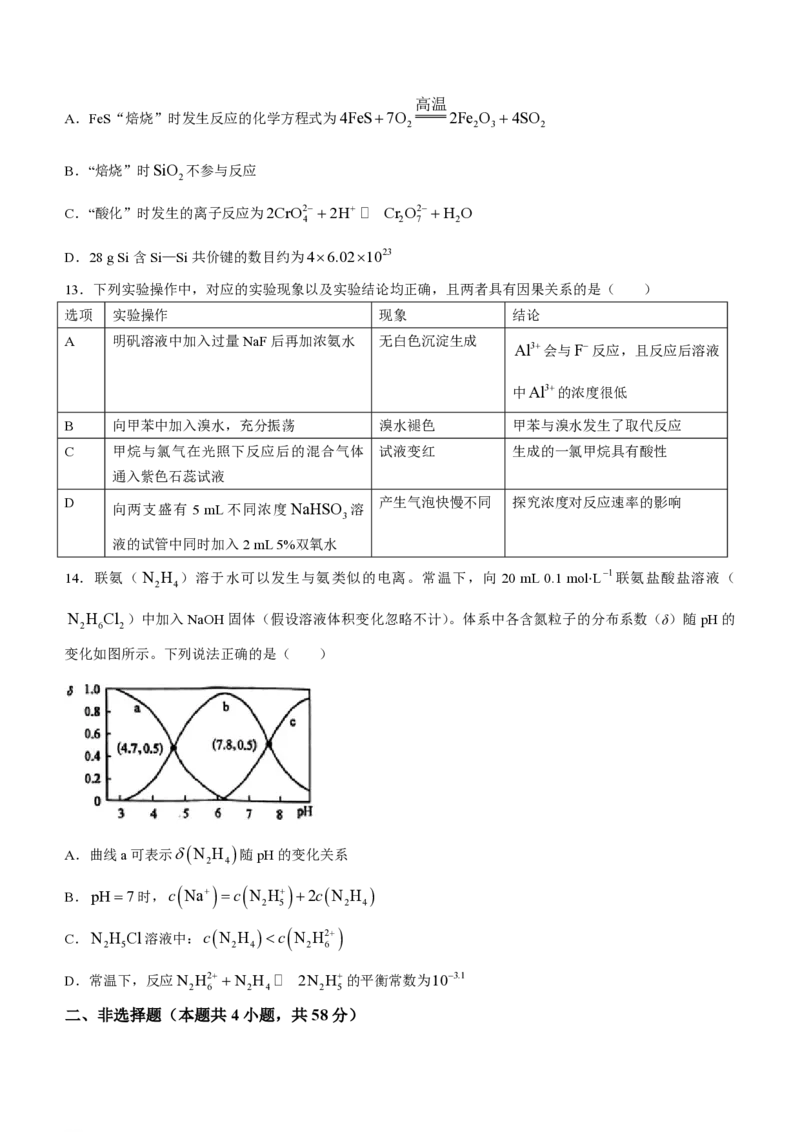
学科网(北京)股份有限公司高温
A.FeS“焙烧”时发生反应的化学方程式为4FeS7O 2Fe O 4SO
2 2 3 2
B.“焙烧”时SiO 不参与反应
2
C.“酸化”时发生的离子反应为2CrO2 2H A Cr O2 H O
4 2 7 2
D.28 g Si含Si—Si共价键的数目约为46.021023
13.下列实验操作中,对应的实验现象以及实验结论均正确,且两者具有因果关系的是( )
选项 实验操作 现象 结论
A 明矾溶液中加入过量NaF后再加浓氨水 无白色沉淀生成
Al3会与F反应,且反应后溶液
中Al3的浓度很低
B 向甲苯中加入溴水,充分振荡 溴水褪色 甲苯与溴水发生了取代反应
C 甲烷与氯气在光照下反应后的混合气体 试液变红 生成的一氯甲烷具有酸性
通入紫色石蕊试液
D 产生气泡快慢不同 探究浓度对反应速率的影响
向两支盛有 5 mL不同浓度 NaHSO 溶
3
液的试管中同时加入2 mL 5%双氧水
14.联氨(N H )溶于水可以发生与氨类似的电离。常温下,向 20 mL 0.1 mol⋅L1联氨盐酸盐溶液(
2 4
N H Cl )中加入NaOH固体(假设溶液体积变化忽略不计)。体系中各含氮粒子的分布系数(δ)随pH的
2 6 2
变化如图所示。下列说法正确的是( )
A.曲线a可表示N H 随pH的变化关系
2 4
B.pH7时,c Na c N H 2cN H
2 5 2 4
C.N H Cl溶液中:cN H c N H2
2 5 2 4 2 6
D.常温下,反应N H2 N H A 2N H的平衡常数为103.1
2 6 2 4 2 5
二、非选择题(本题共 4小题,共 58分)
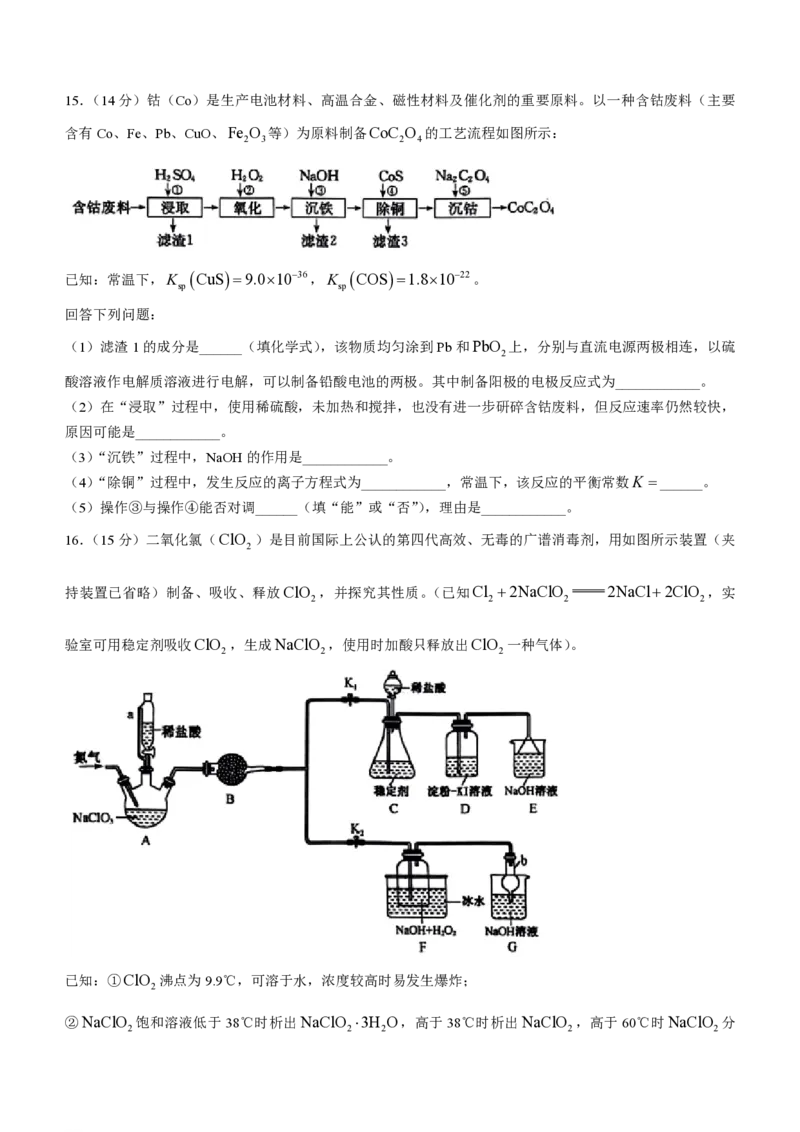
学科网(北京)股份有限公司15.(14分)钴(Co)是生产电池材料、高温合金、磁性材料及催化剂的重要原料。以一种含钴废料(主要
含有Co、Fe、Pb、CuO、Fe O 等)为原料制备CoC O 的工艺流程如图所示:
2 3 2 4
已知:常温下,K CuS9.01036,K COS1.81022。
sp sp
回答下列问题:
(1)滤渣1的成分是______(填化学式),该物质均匀涂到Pb和PbO 上,分别与直流电源两极相连,以硫
2
酸溶液作电解质溶液进行电解,可以制备铅酸电池的两极。其中制备阳极的电极反应式为____________。
(2)在“浸取”过程中,使用稀硫酸,未加热和搅拌,也没有进一步研碎含钴废料,但反应速率仍然较快,
原因可能是____________。
(3)“沉铁”过程中,NaOH的作用是____________。
(4)“除铜”过程中,发生反应的离子方程式为____________,常温下,该反应的平衡常数K ______。
(5)操作③与操作④能否对调______(填“能”或“否”),理由是____________。
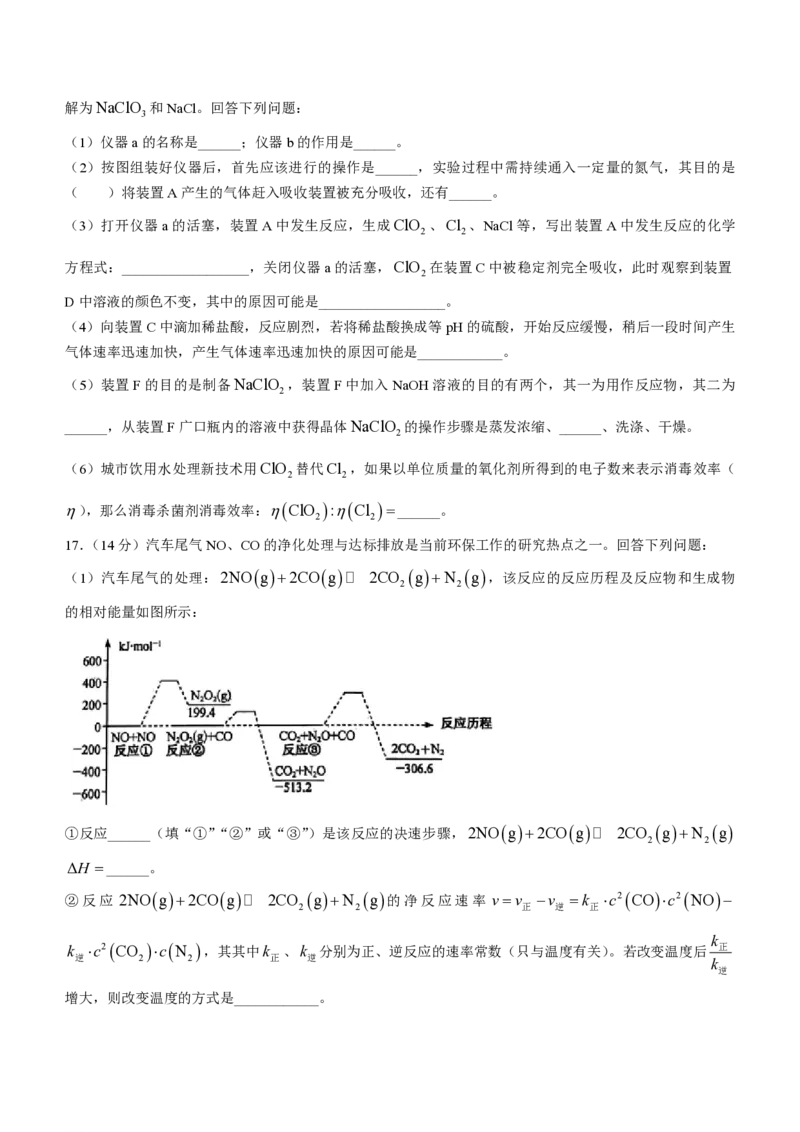
16.(15分)二氧化氯(ClO )是目前国际上公认的第四代高效、无毒的广谱消毒剂,用如图所示装置(夹
2
持装置已省略)制备、吸收、释放ClO ,并探究其性质。(已知Cl 2NaClO 2NaCl2ClO ,实
2 2 2 2
验室可用稳定剂吸收ClO ,生成NaClO ,使用时加酸只释放出ClO 一种气体)。
2 2 2
已知:①ClO 沸点为9.9℃,可溶于水,浓度较高时易发生爆炸;
2
②NaClO 饱和溶液低于38℃时析出NaClO 3H O,高于38℃时析出NaClO ,高于60℃时NaClO 分
2 2 2 2 2
学科网(北京)股份有限公司解为NaClO 和NaCl。回答下列问题:
3
(1)仪器a的名称是______;仪器b的作用是______。
(2)按图组装好仪器后,首先应该进行的操作是______,实验过程中需持续通入一定量的氮气,其目的是
( )将装置A产生的气体赶入吸收装置被充分吸收,还有______。
(3)打开仪器a的活塞,装置A中发生反应,生成ClO 、Cl 、NaCl等,写出装置A中发生反应的化学
2 2
方程式:__________________,关闭仪器a的活塞,ClO 在装置C中被稳定剂完全吸收,此时观察到装置
2
D中溶液的颜色不变,其中的原因可能是__________________。
(4)向装置C中滴加稀盐酸,反应剧烈,若将稀盐酸换成等pH的硫酸,开始反应缓慢,稍后一段时间产生
气体速率迅速加快,产生气体速率迅速加快的原因可能是____________。
(5)装置F的目的是制备NaClO ,装置F中加入NaOH溶液的目的有两个,其一为用作反应物,其二为
2
______,从装置F广口瓶内的溶液中获得晶体NaClO 的操作步骤是蒸发浓缩、______、洗涤、干燥。
2
(6)城市饮用水处理新技术用ClO 替代Cl ,如果以单位质量的氧化剂所得到的电子数来表示消毒效率(
2 2
),那么消毒杀菌剂消毒效率:ClO :Cl ______。
2 2
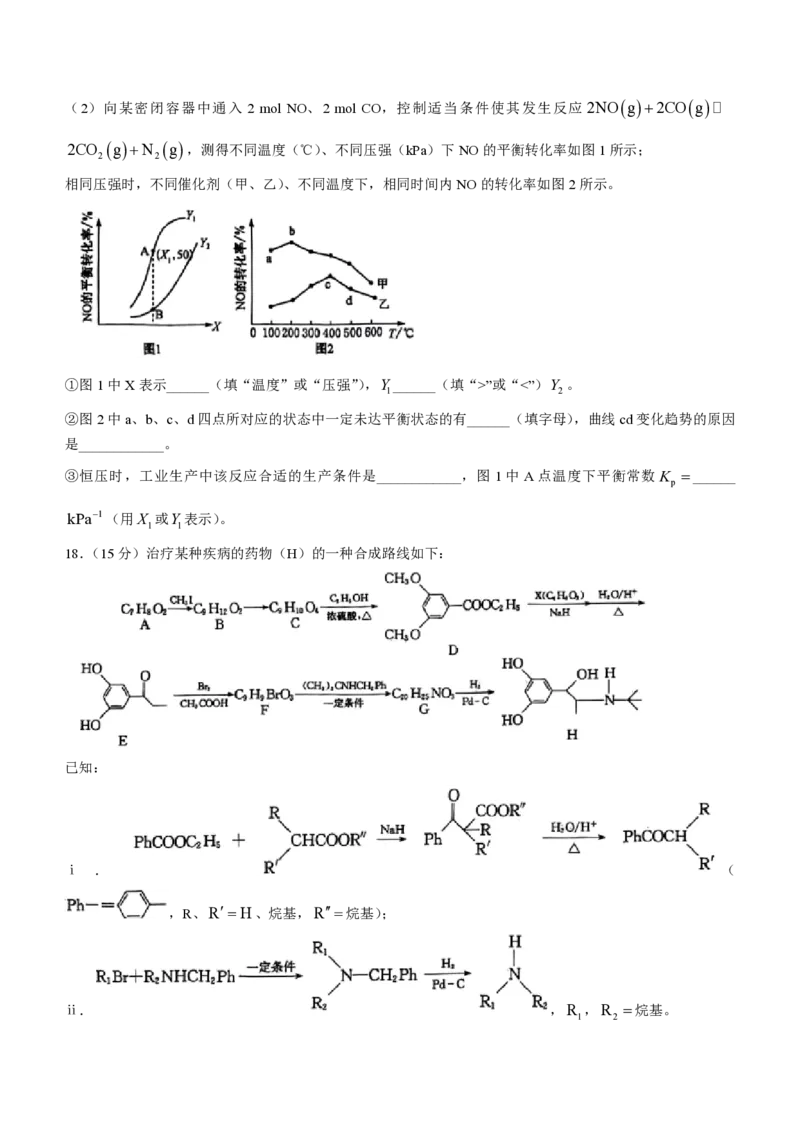
17.(14分)汽车尾气NO、CO的净化处理与达标排放是当前环保工作的研究热点之一。回答下列问题:
(1)汽车尾气的处理:2NOg2COgA 2CO gN g,该反应的反应历程及反应物和生成物
2 2
的相对能量如图所示:
①反应______(填“①”“②”或“③”)是该反应的决速步骤,2NOg2COgA 2CO gN g
2 2
ΔH ______。
②反应 2NOg2COgA 2CO gN g的净反应速率 vv v k c2COc2NO
2 2 正 逆 正
k
k c2CO cN ,其其中k 、k 分别为正、逆反应的速率常数(只与温度有关)。若改变温度后 正
逆 2 2 正 逆 k
逆
增大,则改变温度的方式是____________。
学科网(北京)股份有限公司(2)向某密闭容器中通入 2 mol NO、2 mol CO,控制适当条件使其发生反应2NOg2COgA
2CO gN g,测得不同温度(℃)、不同压强(kPa)下NO的平衡转化率如图1所示;
2 2
相同压强时,不同催化剂(甲、乙)、不同温度下,相同时间内NO的转化率如图2所示。
①图1中X表示______(填“温度”或“压强”),Y ______(填“>”或“<”)Y 。
1 2
②图2中a、b、c、d四点所对应的状态中一定未达平衡状态的有______(填字母),曲线cd变化趋势的原因
是____________。
③恒压时,工业生产中该反应合适的生产条件是____________,图 1中 A点温度下平衡常数K ______
p
kPa1(用X 或Y 表示)。
1 1
18.(15分)治疗某种疾病的药物(H)的一种合成路线如下:
已知:
ⅰ . (
,R、RH、烷基,R烷基);
ⅱ. ,R ,R 烷基。
1 2
学科网(北京)股份有限公司回答下列问题:
(1)A的化学名称是______,设计A→B反应的目的是____________。
(2)C中含氧官能团名称是______,C中碳原子的轨道杂化类型为____________。
(3)F→G的反应类型为____________。
(4)X的结构简式为____________。
(5)E→F的化学方程式为__________________。
(6)J是E的同系物且相对分子质量比E小14,符合下列条件的J的同分异构体有______种(不考虑立体异
构),其中,核磁共振氢谱有5组峰的同分异构体的结构简式为____________。
①能发生银镜反应;②水解反应;③与FeCl 溶液发生显色反应。
3
2023~2024 学年高三上学期开学质量检测·化学试题
参考答案、提示及评分细则
1.C CaO与水反应生成氢氧化钙,该反应不属于氧化还原反应,反应过程中不存在电子转移,不能设计成
原电池,A项错误;氯碱工业电解食盐水采用的是阳离子交换膜,B项错误;储氢合金是一类能够大量吸收
氢气,并与氢气结合成金属氢化物的材料,如由金属镧(La)和镍(Ni)形成的合金LaNi 就是一种良好的
5
储氢合金,C项正确;水分解产生氢气吸收热量,D项错误。
2.D 醛基能被溴单质氧化为羧基,反应生成物书写错误,A项错误;次氯酸钙有强氧化性,可以将+4价硫
氧化为+6价,B项错误;HCl为共价化合物,没有电子的得失,也没有阴阳离子,C项错误;尿素与甲醛制
备 线 型 脲 醛 树 脂 为 缩 聚 反 应 , 化 学 方 程 式 为
,D项正确。
3.D 该分子中所有碳原子可能共平面,A项正确;该有机物中含有羟基和羧基,可以发生酯化反应,酯化
反应属于取代反应,另外,酚羟基具有还原性,且该有机物可以燃烧,即可以发生氧化反应,B项正确;分
子中有1个手性碳原子,C项正确;—COOH与H 不能加成,1 mol L-多巴最多可以与3 mol H 发生加成
2 2
反应,D项错误。
4.C 焰色试验为物理变化,A项不符合题意;向红墨水中加入一定量的活性炭,一段时间后颜色褪去,这
是利用活性炭的吸附性,不涉及氧化还原反应,B项不符合题意;向含有淀粉的碘水中通入SO ,溶液蓝色
2
褪去,发生了反应SO I 2H O H SO 2HI,C:项符合题意;浓硫酸滴到蓝色五水硫酸铜晶体
2 2 2 2 4
上,五水硫酸铜晶体失去结晶水变成无水硫酸铜,晶体变白色,体现浓硫酸的吸水性,不涉及氧化还原反
应,D项不符合题意。
5.B 据图可知FeSO 分解时生成SO 、SO 和红棕色固体X,则X为Fe O ,A项正确;标准状况下,
4 2 3 2 3
学科网(北京)股份有限公司SO 是固体,B项错误;H SO 与KNO 混合后,加热过程中生成HNO ,说明HNO 的沸点比H SO 的
3 2 4 3 3 3 2 4
沸点低,C项正确;硝酸见光易分解,D项正确。
6.D H O 中氧原子为sp3杂化,空间结构不是直线形,C H 的空间结构为直线形,A项错误;NH 中
2 2 2 2 3
N原子的成键电子对数为3、孤对电子对数为1,VSEPR模型为四面体,BF₃中B原子的成键电子对数为3、
孤对电子对数为0,VSEPR模型为平面三角形,B项错误;分子内氢键使物质熔沸点降低,分子间氢键使物
质熔沸点升高,邻羟基苯甲酸存在分子内氢键,对羟基苯甲酸存在分子间氢键,则邻羟基苯甲酸沸点比对羟
基苯甲酸沸点低,C项错误;VSEPR模型相同的分子中孤对电子对数越多,对成键电子对的斥力越大,分子
的键角越小,OF 中的氧原子孤对电子对数为2,NCl 中氮原子孤对电子对数为1,则NCl 分子的键角大
2 3 3
于OF 分子的键角,D项正确。
2
7.D 由题意可知 X、W、Y、Z分别是 H、Li、Al、Cl。Na是短周期元素中金属性最强的元素,A项错
误;离子半径:Al3 Cl,B项错误;AlCl 是共价化合物,C项错误;LiAlH 中的H为-1价,故有强
3 4
还原性,D项正确。
8.D 碳酸钠和碳酸氢钠的溶解度不同,两者饱和溶液的物质的量浓度不相等,因此不能通过pH值确定水
解程度大小,A项错误;亚硫酸钠为粉末,不能用启普发生器制取,B项错误;铁表面镀铜时,铜作电镀池
的阳极,接直流电源正极,铁制镀件作阴极,接直流电源负极,C项错误;氨气极易溶于水,通过挤压胶头
滴管,可使圆底烧瓶内产生负压,从而形成喷泉,D项正确。
9.C CaC 晶体是离子晶体,σ键与π键存在于C2中,C2中两个碳原子间是碳碳三键,σ键与π键数目
2 2 2
之比是1∶2,A项错误;根据晶胞结构,Ca2位于八面体体心,但由于晶胞沿一个方向拉长,所以和Ca2
距离相同且最近的C2构成的多面体不是正八面体,B项错误;立方晶胞的形状是长方体,与每个Ca2最邻
2
近的C2为 4个而不是 6个,晶胞中Ca2的配位数为 4,C项正确;一个晶胞中含有Ca2的数目为
2
1 1 1
12 14个,含有 C2的数目为 8 6 4个,64 g CaC 晶体含有 CaC 晶胞数目约为
4 2 8 2 2 2
0.256.021023,D项错误。
10.B 硼化钒—空气燃料电池中,VB 失电子发生氧化反应,VB 电极为电池负极,A项错误;电流经外
2 2
电路由正极流向负极,再经内电路由负极流向正极,故电流由VB 极经 KOH溶液流向石墨电极,B项正
2
确;图示交换膜为阴离子交换膜,当外电路转移1 mol电子时,1 mol OH从石墨电极移向VB 电极,C项
2
错 误 ; 负 极 上 是 VB 失 电 子 发 生 氧 化 反 应 , 则 VB 极 发 生 的 电 极 反 应 为
2 2
学科网(北京)股份有限公司2VB 22OH 22e V O 2B O 11H O,消耗的OH和移动过来的OH的物质的量相等,
2 2 5 2 3 2
但有水生成,电解质溶液浓度减小,D项错误。
11.A 由图中反应③知,连接两个醇羟基的碳原子之间碳碳键断裂分别生成醛,由反应①②④知相邻的两
个醇羟基生成水分子的同时还生成碳碳双键,如果原料为HOCH CHOHCH ,则生成的有机物为甲醛、
2 3
乙醛和丙烯,A项正确;Cu催化氧化1,2-乙二醇生成物为乙二醛,而MoO 催化时生成甲醛与乙烯,B项错
3
误;催化剂不能提高反应物的平衡转化率,C项错误;乙二酸能被酸性高锰酸钾氧化成二氧化碳,D项错
误。
高温
12.C 题中信息显示,“焙烧”时发生反应生成Fe O ,反应方程式为3FeS5O Fe O 3SO ,A
3 4 2 3 4 2
项 错 误 ; “ 焙 烧 ” 时 SiO 与 纯 碱 反 应 生 成 Na SiO , B项 错 误 ; “酸 化 ”时 发 生 反 应 为
2 2 3
2CrO2 2H A Cr O2 H O,C项正确;在晶体硅中,每个 Si与其周围的 4个 Si形成共价键并形成
4 2 7 2
空间立体网状结构,平均每个Si形成2个共价键,1 mol Si含Si-Si键的数目为2N ,D项错误。
A
13.A 向盛有明矾溶液的试管中加入 NaF溶液生成AlF 3 ,AlF 3 很难电离出铝离子,则再加入氨
6 6
水,无白色沉淀生成,A项正确;甲苯与溴水不能发生取代反应,向甲苯中加入溴水,甲苯萃取溴水中的
溴,从而使液体分为两层,上层为橙红色的溴的甲苯溶液,下层为无色的水,B项错误;甲烷与氯气在光照
下发生取代反应生成一氯甲烷等和HCl,其中HCl溶于水后,溶液显酸性,使紫色石蕊试液变红,不能说明
生成的一氯甲烷具有酸性,C项错误;NaHSO 与H O 发生反应NaHSO H O NaHSO H O
3 2 2 3 2 2 4 2
,反应无明显现象,无法探究浓度对反应速率的影响,D项错误。
14.B 根据图示,随着pH增加,碱性增强,浓度降低的曲线a为 N H2 ,N H浓度先增大后减小,
2 6 2 5
故曲线b为 N H ,N H 浓度不断增大,曲线c为N H ,A项错误;pH7时,溶液呈中性,
2 5 2 4 2 4
溶液中存在电荷守恒:c
Na
c
H
c
N
H
2c
N
H2
c
Cl
c
OH
初始溶液中溶质为
2 5 2 6
N H Cl ,由此可得物料守恒:c Cl 2c N H 2c N H2 2cN H ΔH ,两式相加并结合
2 6 2 2 5 2 6 2 4
溶液呈中性时c H c OH 可得c Na c N H 2cN H ,B项正确;根据图示,曲线 a、b
2 5 2 4
的 交 点 c N H c N H2 , b、 c的 交 点 c N H cN H 故 N H 的 电 离 常 数
2 5 2 6 2 5 2 4 2 4
c
N
H
c
OH
c
N
H2
c
OH
K 2 5 c OH 106.2, K 2 6 c OH 109.3, N H Cl
b1 c N H b2 c N H 2 5
2 4 2 5
学科网(北京)股份有限公司K 1014
水 解 平 衡 常 数 K w 107.8 K 109.3, N H的 水 解 程 度 大 于 电 离 程 度 , 则
h K 106.2 b2 2 5
b1
cN H c N H2 , C项 错 误 ; N H2 N H A 2N H的 平 衡 常 数
2 4 2 6 2 6 2 4 2 5
c2
N
H
c
N
H
c
N
H
c
OH
K 106.2
K 2 5 2 5 2 5 b1 103.1,D项错误。
c N H2 cN H c N H2 c OH cN H K 109.3
2 6 2 4 2 6 2 4 b2
15.(1)PbSO (1分);PbSO 2H O2e PbO 4H SO2(2分)
4 4 2 2 4
(2)形成了原电池(2分)
(3)调节溶液pH,使Fe3沉淀(2分)
(4)CoSCu2 CuSCo2;2.01013(各2分)
(5)否(1分);在酸性条件下,CoS有较强的还原性,可以将操作②所得的Fe3还原为Fe2,不利于Fe3
水解而沉淀,降低了铁的去除率(2分)
16.(1)恒压滴液漏斗;防止倒吸(各1分)
(2)检查装置的气密性;稀释ClO ,防止浓度过高发生爆炸(各1分)
2
(3)2NaClO 4HCl 2ClO Cl 2NaCl2H O;装置 B除去了ClO 、Cl 混合气体中的
3 2 2 2 2 2
Cl (各2分)
2
(4)反应生成的Cl对反应起催化作用(2分)
(5)防止NaClO 遇酸放出ClO (1分);在38~60℃之间趁热过滤(2分)
2 2
(6)71∶27(2分)
17.(1)①(1分);-620.4 kJ·mol1(2分)②降低温度(2分)
(2)①压强;<(各1分)
②acd(2分);温度高于400℃,催化剂乙活性降低或失活,反应速率降低(1分)
7
③使用催化剂甲、温度控制在200℃左右; (各2分)
4X
1
18.(1)5-甲基-1,3苯二酚;保护酚羟基(防止酚羟基被氧化)(各1分)
(2)醚键、羧基;sp2、sp3(各2分)
(3)取代反应(1分)
学科网(北京)股份有限公司(4)CH CH COOCH (2分)
3 2 3
(5) (2分)
(6)13; (各2分)
学科网(北京)股份有限公司