文档内容
重庆南开中学高 2025 级高三七月考试
化学试题
本试卷满分 100分,考试时间 75分钟
可能用到的相对原子质量:H1 C12 N14 O16 Na23 S32 Cu64
一、选择题:本题共 14小题,每小题 3分,共 42分。在每小题给出的四个选项中,只有一
项是符合题目要求的。
1. 下列过程涉及化学变化的是
A. 金属焰色试验 B. 煤的液化 C. 氦发生核聚变反应 D. 氨的液化
2. N 表示阿伏加德罗常数的值,下列说法不正确的是
A
A. 78gNa O 中阴离子数目为1N
2 2 A
B. 0.1mol铁与0.1molCl 充分反应,产物数目为0.1N
2 A
C. 足量MnO 和80mL10mol/L浓盐酸共热,转移的电子数小于0.4N
2 A
D. 1molK FeO
在水中完全分解生成的Fe(OH)
胶体粒子数目小于1N
2 4 3 A
3. 下列溶液体系中,所述离子不可能大量共存的是
A. 滴加苯酚显紫色的溶液:NH+、K+、I−
4
B.
滴加甲基橙显黄色的溶液:CO2−、SiO2−、Na+
3 3
C. 常温下,c ( H+) =1×10−12mol/L的溶液中:Na+、Ba2+、AlO−
2
D. 常温下,水电离出的c ( H+) =1×10−12mol/L的溶液:Fe2+、SO2−、Br−
4
4. 二氧化氯(ClO )是一种安全、高效的消毒剂。工业制备ClO 的一种方法为:
2 2
ClO− +FeS +H+ →ClO ↑+Fe3+ +SO2− +H O(未配平),下列说法正确的是
3 2 2 4 2
A. ClO 净水原理与明矾相同
2
B.
ClO−的VSEPR模型为三角锥形
3
C. 该反应中氧化剂与还原剂物质的量之比为15∶1
D. 根据上述反应,氧化性:ClO− >ClO
3 2
5. 阿斯巴甜学名为天门冬酰苯丙氨酸甲酯,因其热量极低又具有较高的甜度,可添加于饮料、药制品或无
糖口香糖中作为糖替代品。下列关于阿斯巴甜说法不正确的是
第1页/共9页
学科网(北京)股份有限公司A. 阿斯巴甜是一种两性化合物
B. 阿斯巴甜分子中具有2个手性碳原子
C. 阿斯巴甜完全水解后得到两种α-氨基酸
D. 1mol阿斯巴甜最多可消耗6molH
2
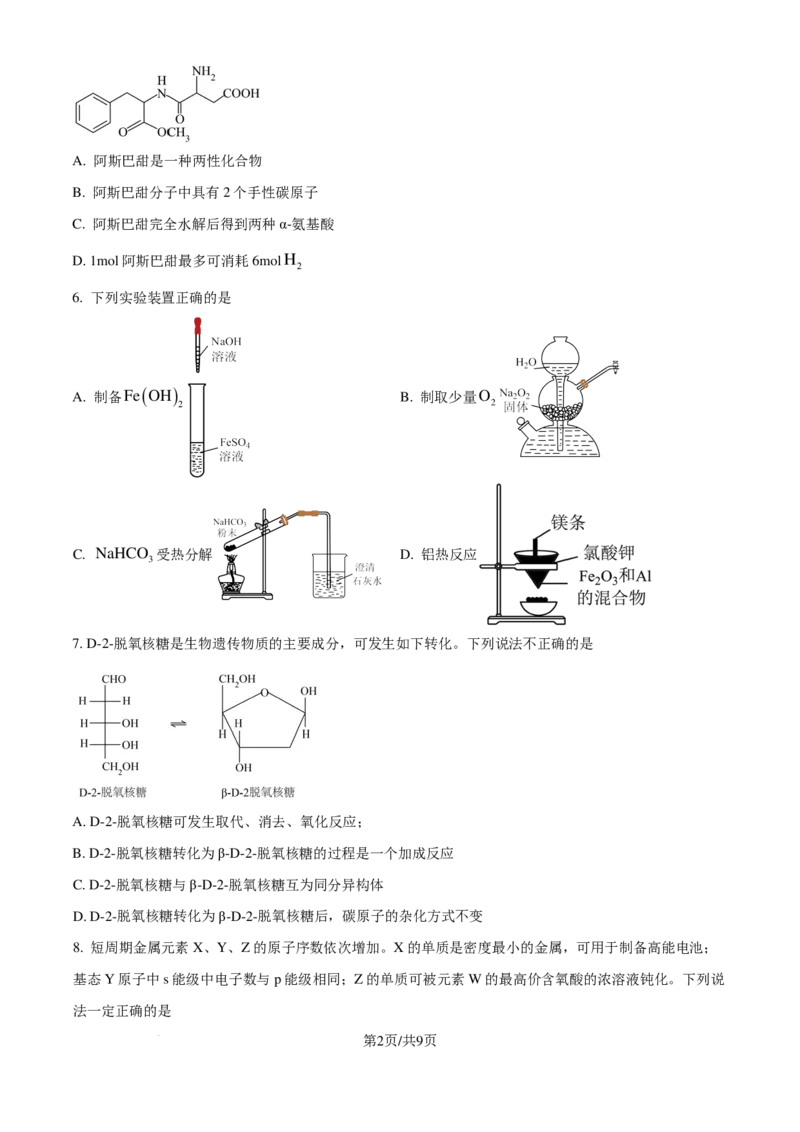
6. 下列实验装置正确的是
( )
A. 制备Fe OH B. 制取少量O
2 2
C. NaHCO 受热分解 D. 铝热反应
3
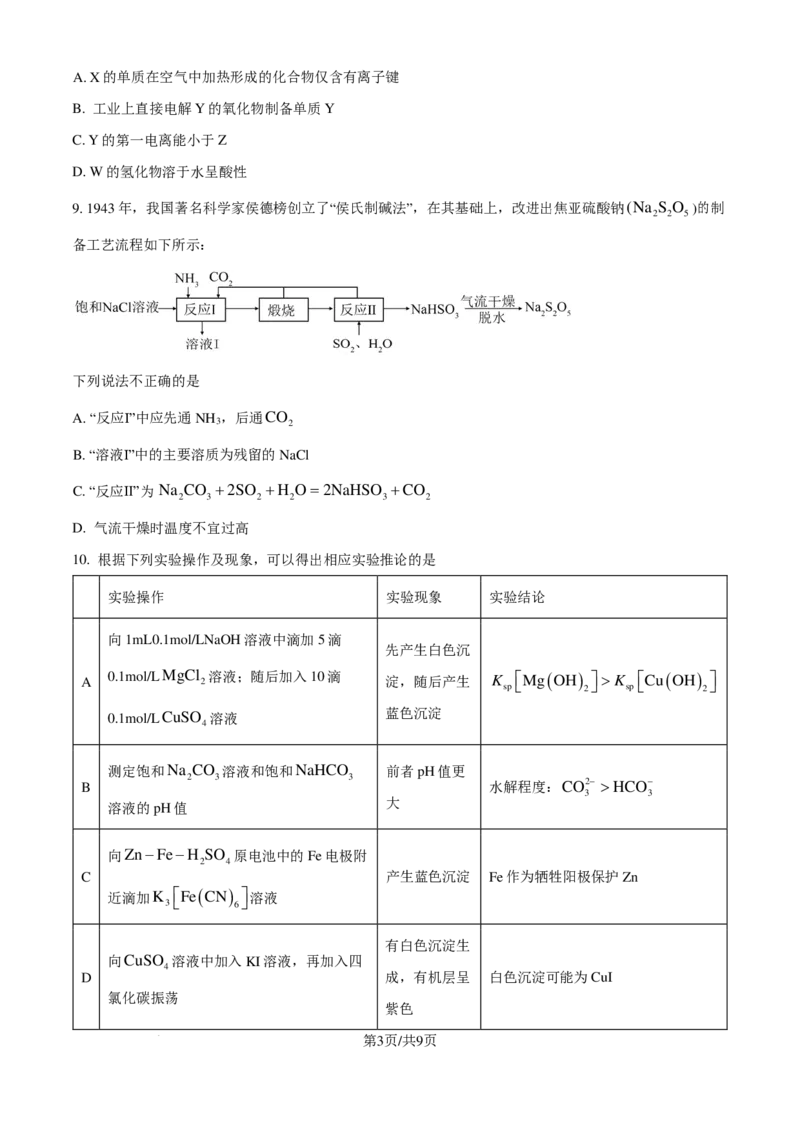
7. D-2-脱氧核糖是生物遗传物质的主要成分,可发生如下转化。下列说法不正确的是
A. D-2-脱氧核糖可发生取代、消去、氧化反应;
B. D-2-脱氧核糖转化为β-D-2-脱氧核糖的过程是一个加成反应
C. D-2-脱氧核糖与β-D-2-脱氧核糖互为同分异构体
D. D-2-脱氧核糖转化为β-D-2-脱氧核糖后,碳原子的杂化方式不变
8. 短周期金属元素X、Y、Z的原子序数依次增加。X的单质是密度最小的金属,可用于制备高能电池;
基态Y原子中s能级中电子数与p能级相同;Z的单质可被元素W的最高价含氧酸的浓溶液钝化。下列说
法一定正确的是
第2页/共9页
学科网(北京)股份有限公司A. X的单质在空气中加热形成的化合物仅含有离子键
B. 工业上直接电解Y的氧化物制备单质Y
C. Y的第一电离能小于Z
D. W的氢化物溶于水呈酸性
9. 1943年,我国著名科学家侯德榜创立了“侯氏制碱法”,在其基础上,改进出焦亚硫酸钠(Na S O )的制
2 2 5
备工艺流程如下所示:
下列说法不正确的是
A. “反应Ⅰ”中应先通NH ,后通CO
3 2
B. “溶液Ⅰ”中的主要溶质为残留的NaCl
C. “反应Ⅱ”为 Na CO +2SO +H O=2NaHSO +CO
2 3 2 2 3 2
D. 气流干燥时温度不宜过高
10. 根据下列实验操作及现象,可以得出相应实验推论的是
实验操作 实验现象 实验结论
向1mL0.1mol/LNaOH溶液中滴加5滴
先产生白色沉
A 0.1mol/LMgCl 2 溶液;随后加入10滴 淀,随后产生 K sp Mg ( OH ) 2 > K sp Cu ( OH ) 2
0.1mol/LCuSO 溶液
蓝色沉淀
4
测定饱和Na CO 溶液和饱和NaHCO 前者pH值更
2 3 3
B
水解程度:CO2− >HCO−
3 3
溶液的pH值
大
向Zn−Fe−H SO 原电池中的Fe电极附
2 4
C 产生蓝色沉淀 Fe作为牺牲阳极保护Zn
近滴加K
3
Fe ( CN )
6
溶液
有白色沉淀生
向CuSO 溶液中加入KI溶液,再加入四
4
D 成,有机层呈 白色沉淀可能为CuI
氯化碳振荡
紫色
第3页/共9页
学科网(北京)股份有限公司A. A B. B C. C D. D
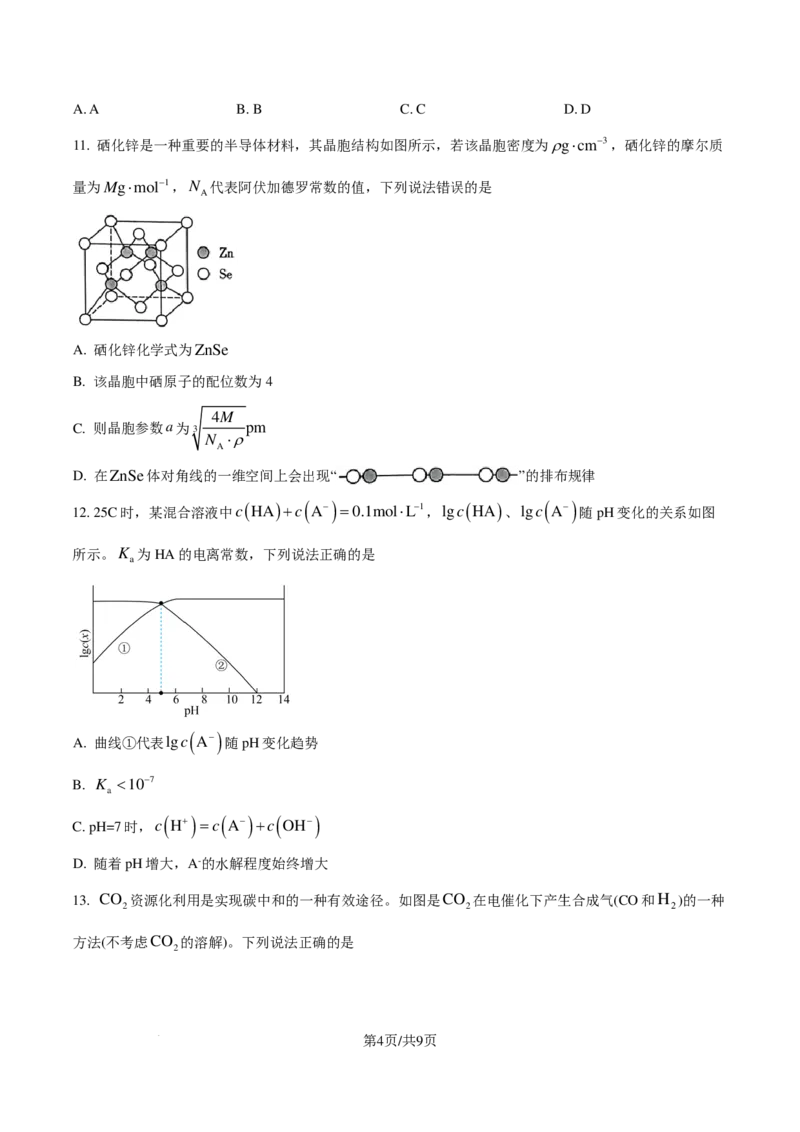
11. 硒化锌是一种重要的半导体材料,其晶胞结构如图所示,若该晶胞密度为ρg⋅cm−3,硒化锌的摩尔质
量为Mg⋅mol−1,N 代表阿伏加德罗常数的值,下列说法错误的是
A
A. 硒化锌化学式为ZnSe
B. 该晶胞中硒原子的配位数为4
4M
C. 则晶胞参数a为 3 pm
N ⋅ρ
A
D. 在ZnSe体对角线的一维空间上会出现“ ”的排布规律
12. 25C时,某混合溶液中c ( HA )+c ( A−) =0.1mol⋅L−1,lgc ( HA ) 、lgc ( A−) 随pH变化的关系如图
所示。K 为HA的电离常数,下列说法正确的是
a
A. 曲线①代表lgc
( A−)
随pH变化趋势
B. K <10−7
a
C. pH=7时,c
( H+)
=c
( A−)
+c
( OH−)
D. 随着pH增大,A-的水解程度始终增大
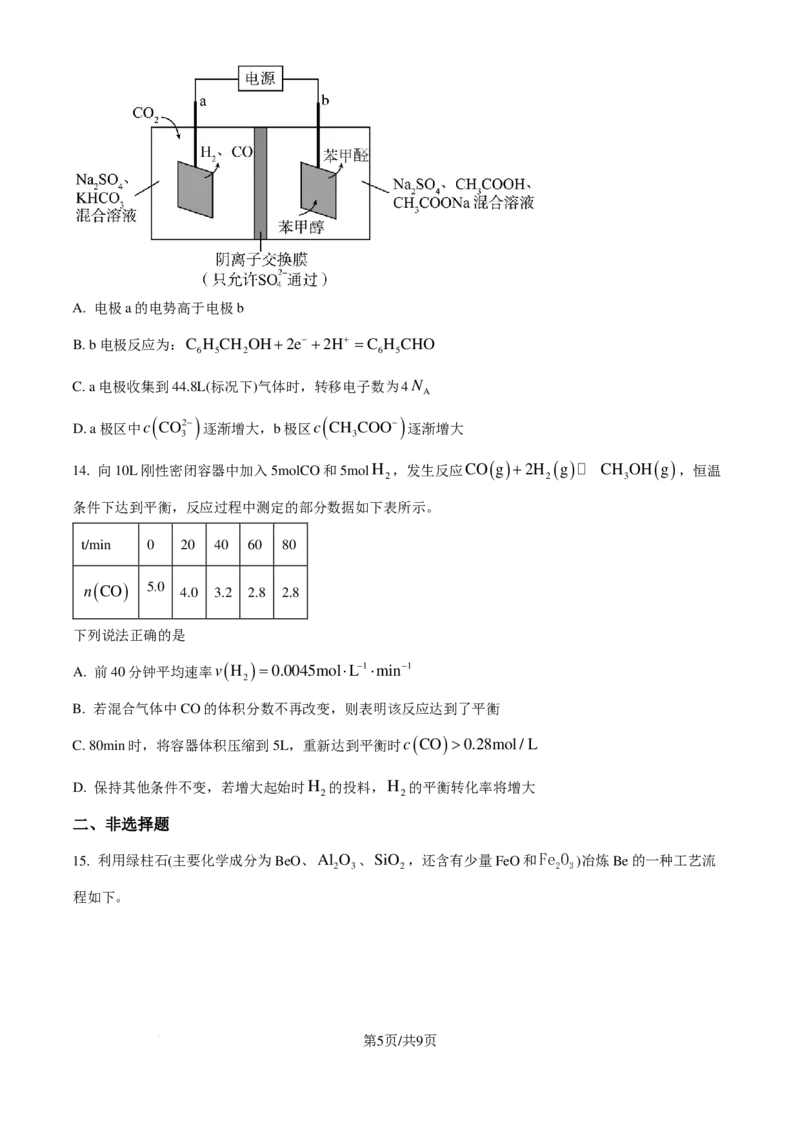
13. CO 资源化利用是实现碳中和的一种有效途径。如图是CO 在电催化下产生合成气(CO和H )的一种
2 2 2
方法(不考虑CO 的溶解)。下列说法正确的是
2
第4页/共9页
学科网(北京)股份有限公司A. 电极a的电势高于电极b
B. b电极反应为:C H CH OH+2e− +2H+ =C H CHO
6 5 2 6 5
C. a电极收集到44.8L(标况下)气体时,转移电子数为4N
A
D. a极区中c
( CO2−)
逐渐增大,b极区c
(
CH
COO−)
逐渐增大
3 3
14. 向10L刚性密闭容器中加入5molCO和5molH ,发生反应CO
(
g
)+2H (
g
)
CH OH
(
g
)
,恒温
2 2 3
条件下达到平衡,反应过程中测定的部分数据如下表所示。
t/min 0 20 40 60 80
n
(
CO
) 5.0
4.0 3.2 2.8 2.8
下列说法正确的是
A. 前40分钟平均速率v
(
H
)=0.0045mol⋅L−1⋅min−1
2
B. 若混合气体中CO的体积分数不再改变,则表明该反应达到了平衡
C. 80min时,将容器体积压缩到5L,重新达到平衡时c
(
CO
)>0.28mol/L
D. 保持其他条件不变,若增大起始时H 的投料,H 的平衡转化率将增大
2 2
二、非选择题
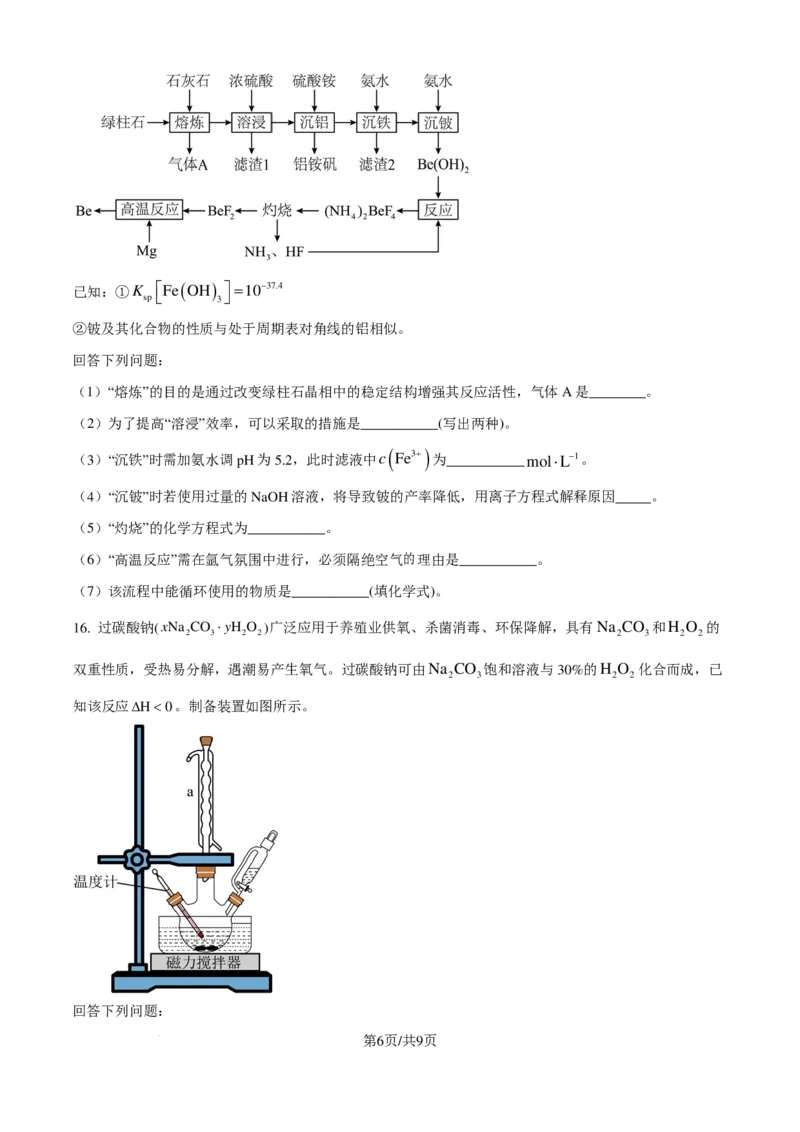
15. 利用绿柱石(主要化学成分为BeO、Al O 、SiO ,还含有少量FeO和Fe O )冶炼Be的一种工艺流
2 3 2 2 3
程如下。
第5页/共9页
学科网(北京)股份有限公司已知:①K
sp
Fe ( OH )
3
=10−37.4
②铍及其化合物的性质与处于周期表对角线的铝相似。
回答下列问题:
(1)“熔炼”的目的是通过改变绿柱石晶相中的稳定结构增强其反应活性,气体A是________。
(2)为了提高“溶浸”效率,可以采取的措施是___________(写出两种)。
(3)“沉铁”时需加氨水调pH为5.2,此时滤液中c
( Fe3+)
为___________mol⋅L−1。
(4)“沉铍”时若使用过量的NaOH溶液,将导致铍的产率降低,用离子方程式解释原因_____。
(5)“灼烧”的化学方程式为___________。
(6)“高温反应”需在氩气氛围中进行,必须隔绝空气的理由是___________。
(7)该流程中能循环使用的物质是___________(填化学式)。
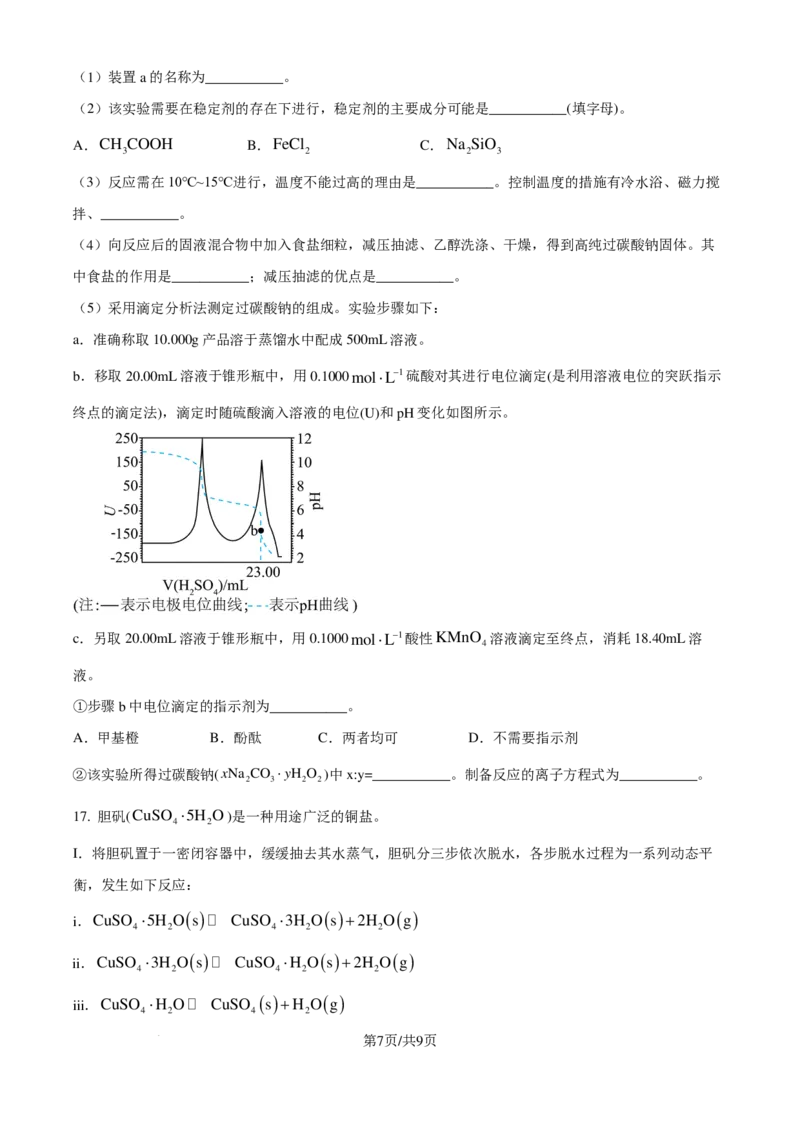
16. 过碳酸钠(xNa CO ⋅yH O )广泛应用于养殖业供氧、杀菌消毒、环保降解,具有Na CO 和H O 的
2 3 2 2 2 3 2 2
双重性质,受热易分解,遇潮易产生氧气。过碳酸钠可由Na CO 饱和溶液与30%的H O 化合而成,已
2 3 2 2
知该反应∆H<0。制备装置如图所示。
回答下列问题:
第6页/共9页
学科网(北京)股份有限公司(1)装置a的名称为___________。
(2)该实验需要在稳定剂的存在下进行,稳定剂的主要成分可能是___________(填字母)。
A.CH COOH B.FeCl C.Na SiO
3 2 2 3
(3)反应需在10℃~15℃进行,温度不能过高的理由是___________。控制温度的措施有冷水浴、磁力搅
拌、___________。
(4)向反应后的固液混合物中加入食盐细粒,减压抽滤、乙醇洗涤、干燥,得到高纯过碳酸钠固体。其
中食盐的作用是___________;减压抽滤的优点是___________。
(5)采用滴定分析法测定过碳酸钠的组成。实验步骤如下:
a.准确称取10.000g产品溶于蒸馏水中配成500mL溶液。
b.移取20.00mL溶液于锥形瓶中,用0.1000mol⋅L−1硫酸对其进行电位滴定(是利用溶液电位的突跃指示
终点的滴定法),滴定时随硫酸滴入溶液的电位(U)和pH变化如图所示。
c.另取20.00mL溶液于锥形瓶中,用0.1000mol⋅L−1酸性KMnO 溶液滴定至终点,消耗18.40mL溶
4
液。
①步骤b中电位滴定的指示剂为___________。
A.甲基橙 B.酚酞 C.两者均可 D.不需要指示剂
②该实验所得过碳酸钠(xNa CO ⋅yH O )中x:y=___________。制备反应的离子方程式为___________。
2 3 2 2
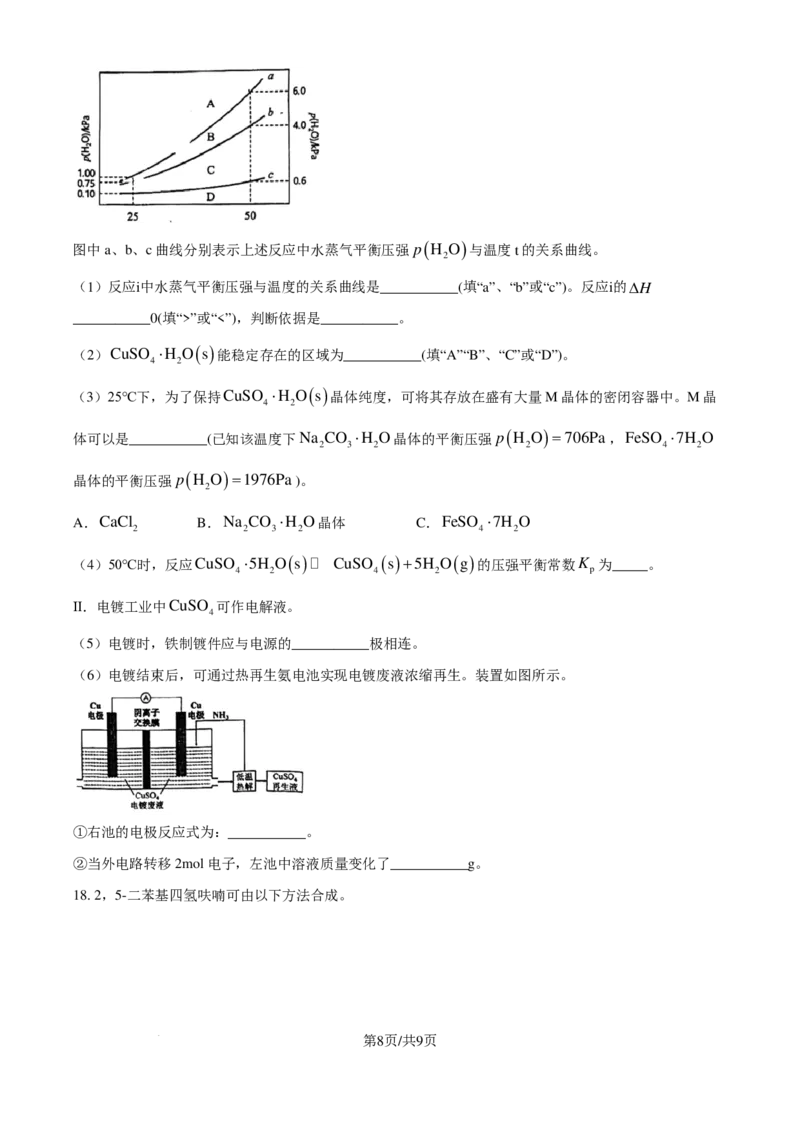
17. 胆矾(CuSO ⋅5H O)是一种用途广泛的铜盐。
4 2
I.将胆矾置于一密闭容器中,缓缓抽去其水蒸气,胆矾分三步依次脱水,各步脱水过程为一系列动态平
衡,发生如下反应:
i.CuSO ⋅5H O ( s ) CuSO ⋅3H O ( s )+2H O ( g )
4 2 4 2 2
ii.CuSO ⋅3H O ( s ) CuSO ⋅H O ( s )+2H O ( g )
4 2 4 2 2
iii.CuSO ⋅H O CuSO ( s )+H O ( g )
4 2 4 2
第7页/共9页
学科网(北京)股份有限公司( )
图中a、b、c曲线分别表示上述反应中水蒸气平衡压强 p H O 与温度t的关系曲线。
2
(1)反应ⅰ中水蒸气平衡压强与温度的关系曲线是___________(填“a”、“b”或“c”)。反应ⅰ的∆H
___________0(填“>”或“<”),判断依据是___________。
(2)CuSO ⋅H O ( s ) 能稳定存在的区域为___________(填“A”“B”、“C”或“D”)。
4 2
(3)25℃下,为了保持CuSO ⋅H O ( s ) 晶体纯度,可将其存放在盛有大量M晶体的密闭容器中。M晶
4 2
体可以是___________(已知该温度下Na CO ⋅H O晶体的平衡压强 p ( H O )=706Pa,FeSO ⋅7H O
2 3 2 2 4 2
晶体的平衡压强 p
(
H O
)=1976Pa)。
2
A.CaCl B.Na CO ⋅H O晶体 C.FeSO ⋅7H O
2 2 3 2 4 2
(4)50℃时,反应CuSO ⋅5H O ( s ) CuSO ( s )+5H O ( g ) 的压强平衡常数K 为_____。
4 2 4 2 p
Ⅱ.电镀工业中CuSO 可作电解液。
4
(5)电镀时,铁制镀件应与电源的___________极相连。
(6)电镀结束后,可通过热再生氨电池实现电镀废液浓缩再生。装置如图所示。
①右池的电极反应式为:___________。
②当外电路转移2mol电子,左池中溶液质量变化了___________g。
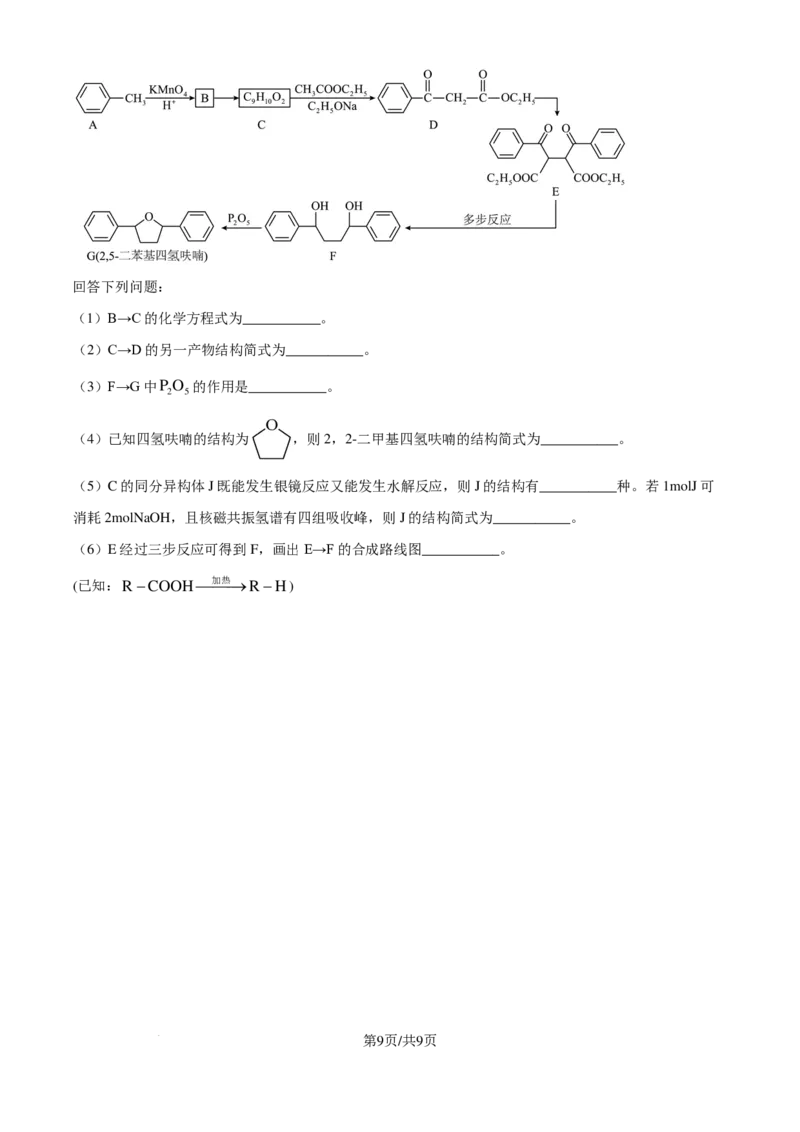
18. 2,5-二苯基四氢呋喃可由以下方法合成。
第8页/共9页
学科网(北京)股份有限公司回答下列问题:
(1)B→C的化学方程式为___________。
(2)C→D的另一产物结构简式为___________。
(3)F→G中PO 的作用是___________。
2 5
(4)已知四氢呋喃的结构为 ,则2,2-二甲基四氢呋喃的结构简式为___________。
(5)C的同分异构体J既能发生银镜反应又能发生水解反应,则J的结构有___________种。若1molJ可
消耗2molNaOH,且核磁共振氢谱有四组吸收峰,则J的结构简式为___________。
(6)E经过三步反应可得到F,画出E→F的合成路线图___________。
(已知:R−COOH加热→R−H)
第9页/共9页
学科网(北京)股份有限公司