文档内容
第三章 铁 金属材料
第二节 金属材料
第2课时 物质的量在化学方程式计算中的应用
1.相同质量的两份铝,分别放入足量的盐酸和氢氧化钠溶液中,放出的氢气在同温同压下体积之比为
( )
A.1:1 B.1:6
C.2:3 D.3:2
2.在一定温度和压强下,2L气体XY 与1L气体Y 化合,生成2L气体化合物,则该化合物的化学式为(
2 2
)
A.XY B.XY C.XY D.XY
3 3 2 2 3 3
3.把10.8gAl放入足量氢氧化钠溶液中完全反应,生成氢气的体积(标准状况下)为( )
A.8.96L B.13.44L
C.2.24L D.6.72
4.在2KMnO +16HCl(浓)=2KCl+2MnCl +5Cl↑+8H O反应中,生成Cl 体积为11.2L(标况下),则反应
4 2 2 2 2
中转移电子物质的量为( )
A.1.6mol B. 1mol C.0.5mol D.1.2mol
5.把22.4 LCO 通过一定量的固体过氧化钠后收集到16.8L气体(标况下),则这16.8L气体的质量是(
2
)
A.10g B.15g C.30g D.32g
6.甲、乙两烧杯中各盛有100mL1.5mol·L-1的盐酸和氢氧化钠溶液,向两烧杯中分别加入2.7g的铝粉,计
算反应结束后生成的气体的体积比是( )
A.1:1 B.1:2 C.2:1 D.3:2
7.把足量的铁粉投入到硫酸和硫酸铜的混合溶液中,充分反应后,残余固体的质量与原来加入的铁粉质
量相等,则原溶液中的H+和SO 2-的物质的量之比为( )
4
A.1:4 B.2:7 C.1:2 D.3:8
8.过氧化钠是常见的消毒剂与供氧剂,在呼吸面具中使用时发生反应:2NaO +2CO=2Na CO +O.已知
2 2 2 2 3 2
N 为阿伏加德罗常数的值,下列有关说法中正确的是( )
A
A.物质的量均为1mol的NaO 和NaCO 所含离子数目均为3N
2 2 2 3 A
B.反应过程中,固体每增重28g转移的电子数目为2N
A
C.该反应中,CO 是还原剂
2D.44.8LCO 与O 的混合气体中所含氧原子数目为4N
2 2 A
9.(2020·江苏启东中学高一开学考试)Mg、Al组成的混合物与足量盐酸反应,产生标准状况下的氢气
4.48 L,下列推断中不正确的是( )
A.参加反应的Mg、Al共0.2 mol
B.参加反应的HCl为0.4 mol
C.Mg、Al在反应中共失去0.4 mol电子
D.若与足量的稀硫酸反应能产生0.2mol H
2
10.4.6g钠与足量的水发生反应,得到100mL溶液,则所得到溶液的物质的量浓度是( )
A.1mol/L B.2mol/L
C.1.5mol/L D.3mol/L
11.用 表示阿伏加德罗常数的值,下列叙述正确的是( )
A.常温常压下, 含有的氧原子数为3 N
A
B.标准状况下, 与足量的 反应转移的电子数为3 N
A
C.N 个一氧化碳分子和 甲烷的质量比为7:4
A
D. 固体溶于1L的水中,所得溶液的物质的量浓度为
12.制取水处理剂ClO (其部分性质如表所示)的方法之一是利用草酸(H C O)与氯酸钾反应,反应的化学方
2 2 2 4
程式为2KClO+aH C O+H SO 2ClO ↑+K SO +2CO ↑+bH O。下列有关该反应的说法不正确的是
3 2 2 4 2 4 2 2 4 2 2
密度/(g·L−1) 熔点/℃ 沸点/℃ 水溶性
3.09 −59.5 11.0 极易溶解
A.化学方程式中的a=1,b=2
B.草酸只起到还原剂的作用
C.KClO 中只有Cl元素被还原
3
D.生成标准状况下5.6 L ClO ,转移0.25 mol电子
2
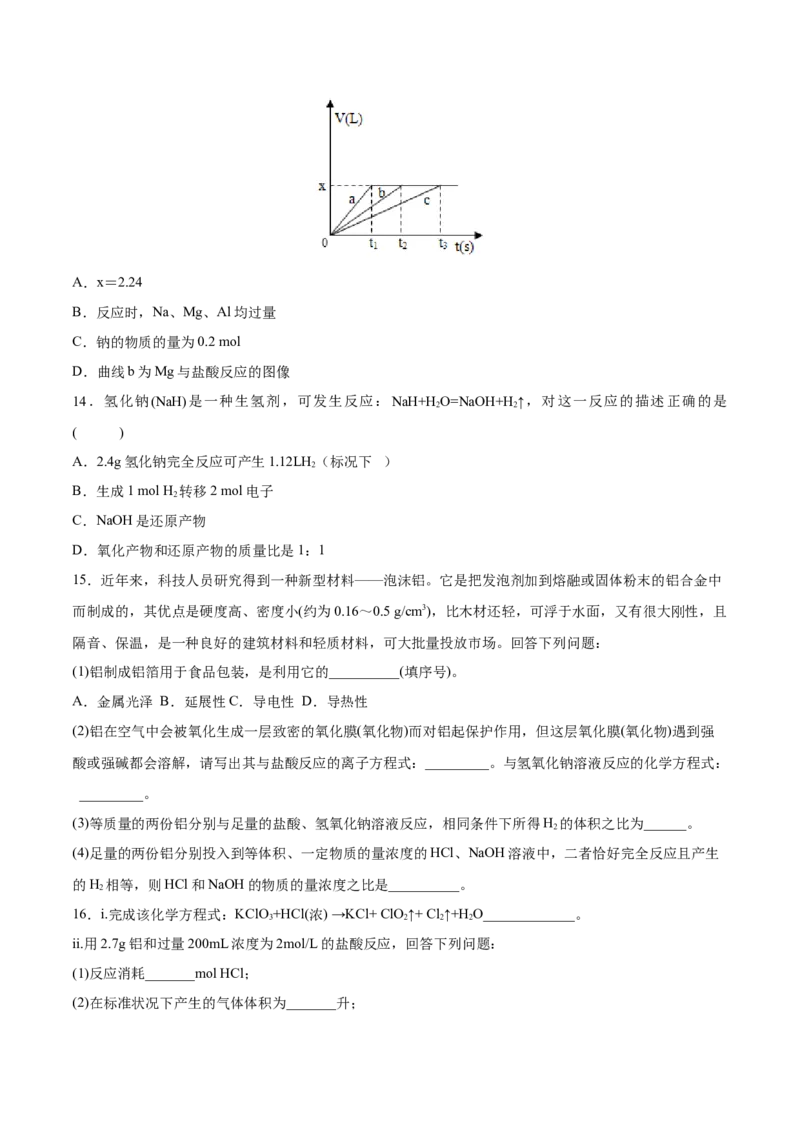
13.将等物质的量的金属Na、Mg、Al分别与100mL2mol/L盐酸反应,实验测得生成气体的体积V(已折合
为标准状况)与时间t的关系如图所示,则下列说法不正确的是( )A.x=2.24
B.反应时,Na、Mg、Al均过量
C.钠的物质的量为0.2 mol
D.曲线b为Mg与盐酸反应的图像
14.氢化钠(NaH)是一种生氢剂,可发生反应:NaH+H O=NaOH+H ↑,对这一反应的描述正确的是
2 2
( )
A.2.4g氢化钠完全反应可产生1.12LH (标况下 )
2
B.生成1 mol H 转移2 mol电子
2
C.NaOH是还原产物
D.氧化产物和还原产物的质量比是1:1
15.近年来,科技人员研究得到一种新型材料——泡沫铝。它是把发泡剂加到熔融或固体粉末的铝合金中
而制成的,其优点是硬度高、密度小(约为0.16~0.5 g/cm3),比木材还轻,可浮于水面,又有很大刚性,且
隔音、保温,是一种良好的建筑材料和轻质材料,可大批量投放市场。回答下列问题:
(1)铝制成铝箔用于食品包装,是利用它的__________(填序号)。
A.金属光泽 B.延展性C.导电性 D.导热性
(2)铝在空气中会被氧化生成一层致密的氧化膜(氧化物)而对铝起保护作用,但这层氧化膜(氧化物)遇到强
酸或强碱都会溶解,请写出其与盐酸反应的离子方程式:_________。与氢氧化钠溶液反应的化学方程式:
_________。
(3)等质量的两份铝分别与足量的盐酸、氢氧化钠溶液反应,相同条件下所得H 的体积之比为______。
2
(4)足量的两份铝分别投入到等体积、一定物质的量浓度的HCl、NaOH溶液中,二者恰好完全反应且产生
的H 相等,则HCl和NaOH的物质的量浓度之比是__________。
2
16.i.完成该化学方程式:KClO+HCl(浓) →KCl+ ClO ↑+ Cl ↑+H O_____________。
3 2 2 2
ii.用2.7g铝和过量200mL浓度为2mol/L的盐酸反应,回答下列问题:
(1)反应消耗_______mol HCl;
(2)在标准状况下产生的气体体积为_______升;(3)溶液中生成物的物质的量浓度为________。(假设反应后溶液体积不变)
17. 2019年8月,第二届全国青年运动会在我省举办,运动员的住所要经常用“84消毒液”(有效成分
NaClO)进行清洁。请计算:用112L氯气(标准状况下)制备“84消毒液”,至少需要NaOH的质量是
多少?