文档内容
1991年西藏高考化学真题及答案
第Ⅰ卷
可能用到的数据原子量H 1 C 12 N 14 O 16 Mg 24 S 32
Cl 35.5 Ca 40 Ag 108
一、选择题(每小题1分,共10分。每小题只有一个选项符合题意)
1.设某元素某原子核内的质子数为m,中子数为n,则下述论断正确的是( )
(A)不能由此确定该元素的原子量
(B)这种元素的原子量为m+n
(C)若碳原子质量为W克,此原子的质量为(m+n)W克
(D)核内中子的总质量小于质子的总质量
2.碳化硅(SiC)的一种晶体具有类似金刚石的结构,其中碳原子和硅原子的位置是交替的.
在下列三种晶体①金刚石、②晶体硅、③碳化硅中,它们的熔点从高到低的顺序是( )
(A)①③② (B)②③① (C)③①② (D)②①③
3.下列大气污染物中,能与人体中血红蛋白结合而引起中毒的气体是( )
(A)SO (B)CO (C)NO (D)CO
2 2 2
4.下列物质中,可用作冶炼镁的原料的是( )
(A)冰晶石 (B)光卤石 (C)萤石 (D)高岭石
5.用含硫量较高的生铁来炼钢时,应采取的措施是( )
(A)使用较多的生石灰 (B)加入较多的焦炭
(C)加入较多的硅铁 (D)掺入含磷较高的废钢
6.用石灰纯碱法软化硬水时,加入石灰的作用是( )
(A)只能降低水中的永久硬度
(B)能同时降低水中的永久硬度和暂时硬度
2+ 2+
(C)可把部分Ca 所形成的硬度转变为Mg 形成的硬度
2+ 2+
(D)可把部分Mg 所形成的硬度转变为Ca 形成的硬度
7.用下列方法来制备溶胶:①0.5摩/升BaCl 溶液和等体积2摩/升硫酸相混和并振荡;②把1
2
毫升饱和三氯化铁溶液逐滴加入20毫升沸水中,边加边振荡;③把1毫升水玻璃加入10毫
升1摩/升盐酸中,用力振荡.可行的是( )
(A)只有①② (B)只有①③ (C)只有②③ (D)①②③
3+
8.为了除去MgCl 酸性溶液中的Fe ,可在加热搅拌的条件下加入一种试剂,过滤后再加入
2
适量盐酸.这种试剂是( )
(A)NH ·H O (B)NaOH
3 2
(C)Na CO (D)MgCO
2 3 3
9.限用一种试液即可区别Na S、Na S O 、Na CO 、NaAlO 、Na SO 五种溶液.应选用
2 2 2 3 2 3 2 2 4
( )
(A)烧碱溶液 (B)盐酸 (C)氨水 (D)氯化钡溶液
1
10.某元素的原子最外层电子排布是5s ,下列描述中正确的是( )
(A)其单质常温下跟水反应不如钠剧烈
(B)其原子半径比钾原子半径小
第1页 | 共10页(C)其碳酸盐易溶于水
(D)其氢氧化物不能使氢氧化铝溶解
参考答案:
1.A 2.A 3.D 4.B 5.A 6.D 7.C 8.D 9.B 10.C
二、选择题(每小题2分,共30分。每小题有一个或两个选项符合题意。若正确答案只包
括一个选项,多选时,该题为0分;若正确答案包括两个选项,每选对一个给1分,但只要
选错一个,该小题就为0分.)
11.设N 表示阿佛加德罗常数。下列说法不正确的是( )
A
(A)醋酸的摩尔质量与N 个醋酸分子的质量在数值上相等
A
(B)N 个氧分子和N 个氢分子的质量比等于16:1
A A
(C)28克氮气所含的原子数目为N
A
(D)在标准状况下,0.5N 个氯气分子所占体积是11.2升
A
12.下列四种元素中,其单质氧化性最强的是( )
(A)原子含有未成对电子最多的第二周期元素
(B)位于周期表中第三周期ⅢA族的元素
2 6
(C)原子最外电子层排布为2s 2p 的元素
2 5
(D)原子最外电子层排布为3s 3P 的元素
13.下列说法中正确的是( )
(A)分子中键能越大,键越长,则分子越稳定
(B)失电子难的原子获得电子的能力一定强
(C)在化学反应中,某元素由化合态变为游离态,该元素被还原
(D)电子层结构相同的不同离子,其半径随核电荷数增多而减小
14.反应:X(气)+3Y(气) 2Z(气)+热量,在不同温度、不同压强(P >P )下,达到平衡时,混
1 2
和气体中Z的百分含量随温度变化的曲线应为( )
15.在四种化合物①NaHCO3、②Al(OH)3、③(NH4)2S、④ 中,跟盐酸
和氢氧化钠溶液都能反应的是( )
(A)只有②④ (B)只有①② (C)只有①②③ (D)①②③④
16.下列反应中,通入的气体物质只作为氧化剂的是( )
(A)二氧化硫通入氢硫酸中 (B)氯气通入NaOH溶液中
(C)少量氯气通入氯化亚铁酸性溶液中 (D)硫化氢通入溴水中
17.四种不含结晶水的固体:①NaHCO 、②NH HCO 、③Cu(NO ) 、④KNO ,各取1摩在高温
3 4 3 3 2 3
下(100℃以上)加热完全分解,得到的气体体积由大到小的顺序为( )
(A)③>②>①>④ (B)②>③>①>④
(C)②>③>④>① (D)③>②>④>①
18.将固体NH I置于密闭容器中,在某温度下发生下列反应:( )
4
第2页 | 共10页NH I(固) NH (气)+HI(气) 2HI(气) H (气)+I (气)
4 3 2 2
当反应达到平衡时[I ]=0.5摩/升,[HI]=4摩/升,则NH 的浓度为( )
2 3
(A)3.5摩/升 (B)4摩/升 (C)4.5摩/升 (D)5摩/升
+ -3 - -3
19.已知一种[H ]=1×10 摩/升的酸和一种[OH ]=1×10 摩/升的碱溶液等体积混和后溶
液呈酸性.其原因可能是( )
(A)浓的强酸和稀的强碱溶液反应 (B)浓的弱酸和稀的强碱溶液反应
(C)等浓度的强酸和弱碱溶液反应 (D)生成了一种强酸弱碱盐
- - - - -
20.甲、乙、丙三种溶液各含有一种X (X 为Cl 、Br 或I )离子,向甲中加淀粉溶液和氯水,
则溶液变为橙色,再加丙溶液,颜色无明显变化.则甲、乙、丙依次含有( )
- - - - - - - - - - - -
(A)Br 、Cl 、I (B)Br 、I 、Cl (C)I 、Br 、Cl (D)Cl 、I 、Br
21.在某无色透明的酸性溶液中,能共存的离子组是( )
(A)NH+、NO-、Al3+、Cl- (B)Na+、AlO-、K+、NO-
4 3 2 3
(C)MnO-、K+、SO2-、Na+ (D)K+、SO2-、HCO-、Na+
4 4 4 3
22.氢化钠(NaH)是一种白色的离子晶体,其中钠是+1价.NaH与水反应放出氢气.下列叙述中,
正确的是( )
(A)NaH在水中显酸性
(B)NaH中氢离子的电子层排布与氦原子的相同
(C)NaH中氢离子半径比锂离子半径大
(D)NaH中氢离子可被还原成氢气
2+ 2+ 2-
23.为了除去粗盐中的Ca 、Mg 、SO 及泥沙,可将粗盐溶于水,然后进行下列五项操作:
4
①过滤,②加过量NaOH溶液,③加适量盐酸,④加过量Na CO 溶液,⑤加过量BaCl 溶液.
2 3 2
正确的操作顺序是( )
(A)①④②⑤③ (B)④①②⑤③
(C)②⑤④①③ (D)⑤②④①③
24.能正确表示下列反应的离子方程式是( )
+ 2+
(A)硫化亚铁跟盐酸反应:FeS+2H =Fe +H S↑
2
+ - -
(B)氯气跟水反应:Cl +H O=2H +Cl +ClO
2 2
+ -
(C)钠跟水反应:Na+2H O=Na +2OH +H ↑
2 2
2+ 2-
(D)硫酸铜溶液跟氢氧化钡溶液反应:Ba +SO =BaSO ↓
4 4
25.用两支惰性电极插入500毫升AgNO 溶液中,通电电解.当电解液的pH值从6.0变为3.0时
3
(设电解时阴极没有氢气析出,且电解液在电解前后体积变化可以忽略),电极上应析出银
的质量是( )
(A)27毫克 (B)54毫克 (C)108毫克 (D)216毫克
参考答案:
第3页 | 共10页11.C 12.D 13.D 14.C 15.D 16.A、C 17.B 18.D 19.B
20.B
21.A 22.B、C 23.C、D 24.A 25.B
三、选择题(每小题3分,共15分。每小题只有一个选项符合题意。)
26.在标准状况下,将V升A气体(摩尔质量为M克/摩)溶于0.1升水中,所得溶液密度d克/毫升,
则此溶液的摩尔浓度为( )
27.实验测得乙烯与氧气混和气体的密度是氢气14.5倍,可知其中乙烯的质量百分比为
( )
(A)25.0% (B)27.6% (C)72.4% (D)75.0%
28.用0.1摩/升的NaSO溶液30毫升,恰好将2×10-3摩的XO-离子还原,则元素X在还原产
2 3 4
物中的化合价是( )
(A)+1 (B)+2 (C)+3 (D)+4
29.某有机物甲经氧化后得乙(分子式为C H O Cl);而甲经水解可得丙.1摩丙和2摩乙反应
2 3 2
得一种含氯的酯(C H O Cl ).由此推断甲的结构简式为( )
6 8 4 2
30.将0.2摩/升CH COOK与0.1摩/升盐酸等体积混和后,溶液中下列微粒的摩尔浓度的关系
3
正确的是( )
- - +
(A)[CH COO ]=[Cl ]=[H ]>[CH COOH]
3 3
- - +
(B)[CH COO ]=[Cl ]>[CH COOH]>[H ]
3 3
- - +
(C)[CH COO ]>[Cl ]>[H ]>[CH COOH]
3 3
- - +
(D)[CH COO ]>[Cl ]>[CH COOH]>[H ]
3 3
参考答案:
26.B 27.C 28.D 29.A 30.D
第Ⅱ卷
可能用到的数据:原子量
H 1 C 12 N 14 O 16 Mg 24 S 32 Cl 35.5 Ca 40 Ag
108
四、(本题共有2小题,共10分)
第4页 | 共10页31.(6分)某化学课外小组用海带为原料制取了少量碘水.现用CCl 从碘水中萃取碘并用分
4
液漏斗分离两种溶液.其实验操作可分解为如下几步:
(A)把盛有溶液的分液漏斗放在铁架台的铁圈中;
(B)把50毫升碘水和15毫升CCl 加入分液漏斗中,并盖好玻璃塞;
4
(C)检验分液漏斗活塞和上口的玻璃塞是否漏液;
(D)倒铁漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
(E)旋开活塞,用烧怀接收溶液;
(F)将分液漏斗上口倒出上层水溶液;
(G)将漏斗上口的玻璃塞打开或使塞上的凹槽或小孔对准漏斗口上的小孔;
(H)静置,分层.
就此实验,完成下列填空:
(1)正确操作步骤的顺序是:(用上述各操的编号字母填写)
→ → →A→G→ →E→F
(2)上述(E)步骤的操作中应注意
上述(G)步骤操作的目的是
(3)能选用CCl 从碘水中萃取碘的原因是
4
(4)下列物质,不能作为从溴水中萃取溴的溶剂的是
(A)热裂汽油 (B)苯 (C)酒精 (D)正庚烷
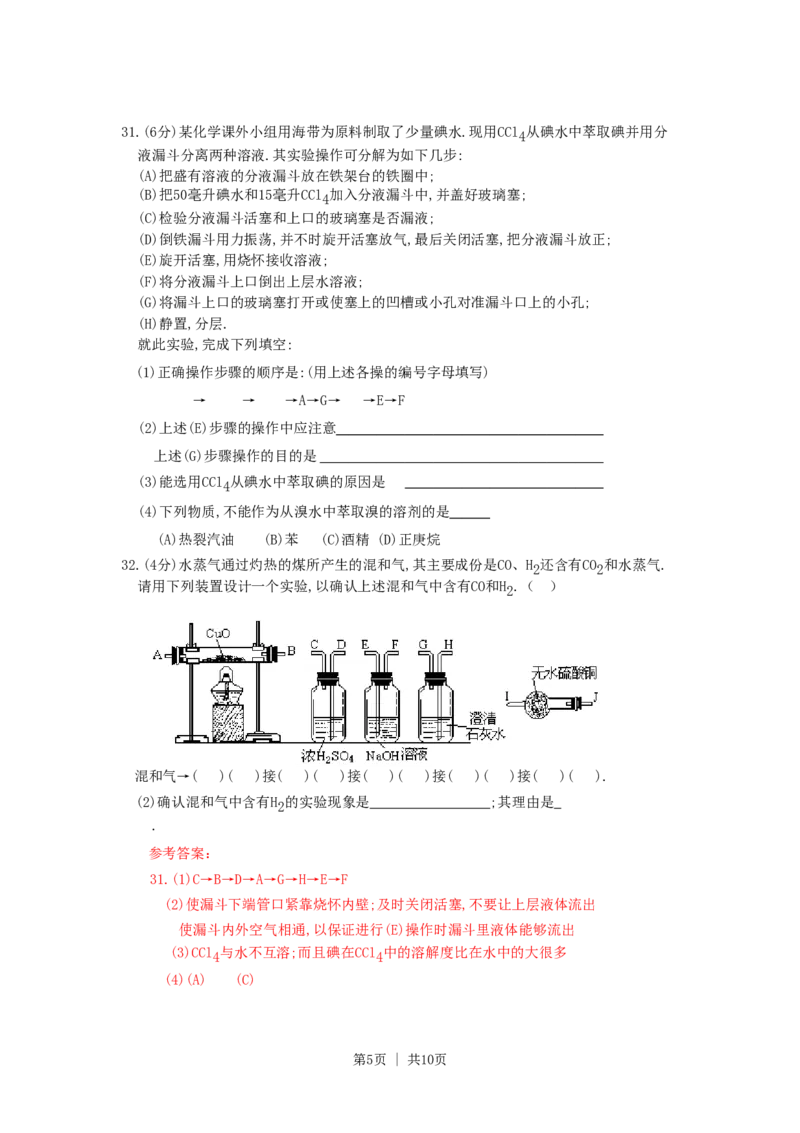
32.(4分)水蒸气通过灼热的煤所产生的混和气,其主要成份是CO、H 还含有CO 和水蒸气.
2 2
请用下列装置设计一个实验,以确认上述混和气中含有CO和H .( )
2
(1)连接上述装置的正确顺序是:(填各接口的代码字母)
混和气→( )( )接( )( )接( )( )接( )( )接( )( ).
(2)确认混和气中含有H 的实验现象是 ;其理由是
2
.
参考答案:
31.(1)C→B→D→A→G→H→E→F
(2)使漏斗下端管口紧靠烧怀内壁;及时关闭活塞,不要让上层液体流出
使漏斗内外空气相通,以保证进行(E)操作时漏斗里液体能够流出
(3)CCl 与水不互溶;而且碘在CCl 中的溶解度比在水中的大很多
4 4
(4)(A) (C)
第5页 | 共10页32.(1)(E)(F)接(D)(C)接(A)(B)[或(B)(A)]接(J)(I)接(H)(G)
(2)黑色CuO变红、无水硫酸铜变蓝因为H 通过灼热的CuO后生成铜和水蒸气,水蒸气
2
使无水硫酸铜变蓝
五、(本题共有8小题,共23分)
33.(2分)4克硫粉完全燃烧时放出37千焦热量,该反应的热化学方程式是:
34.(2分)完成并配平下列化学方程式:
35.(2分)浓度均为0.1摩/升的8种溶液:
①HNO ②H SO ③HCOOH④Ba(OH) ⑤NaOH⑥CH COONa⑦KCl⑧NH Cl,溶液pH值由小到大
3 2 4 2 3 4
的顺序是(填写编号)
36.(2分)在80℃时,纯水的pH值小于7,为什么?
37.(2分)若A是分子量为128的烃,则其分子式只可能是 或 .
若A是易升华的片状晶体,则其结构简式为 .
38.(4分)有机环状化合物的结构简式可进一步简化,例如A式可简写为B式.C式是1990年公
开报导的第1000万种新化合物.
则化合物C中的碳原子数是 ,分子式是 .若D是C的同分异构体,但D属
于酚类化合物,而且结构式中没有—CH 基团.请写出D可能的结构简式.(任意一种,填入
3
上列D方框中)
39.(3分)把AlCl 溶液蒸干灼烧,最后得到的主要固体产物是什么?为什么?(用化学方程式
3
表示,并配以必要的文字说明)
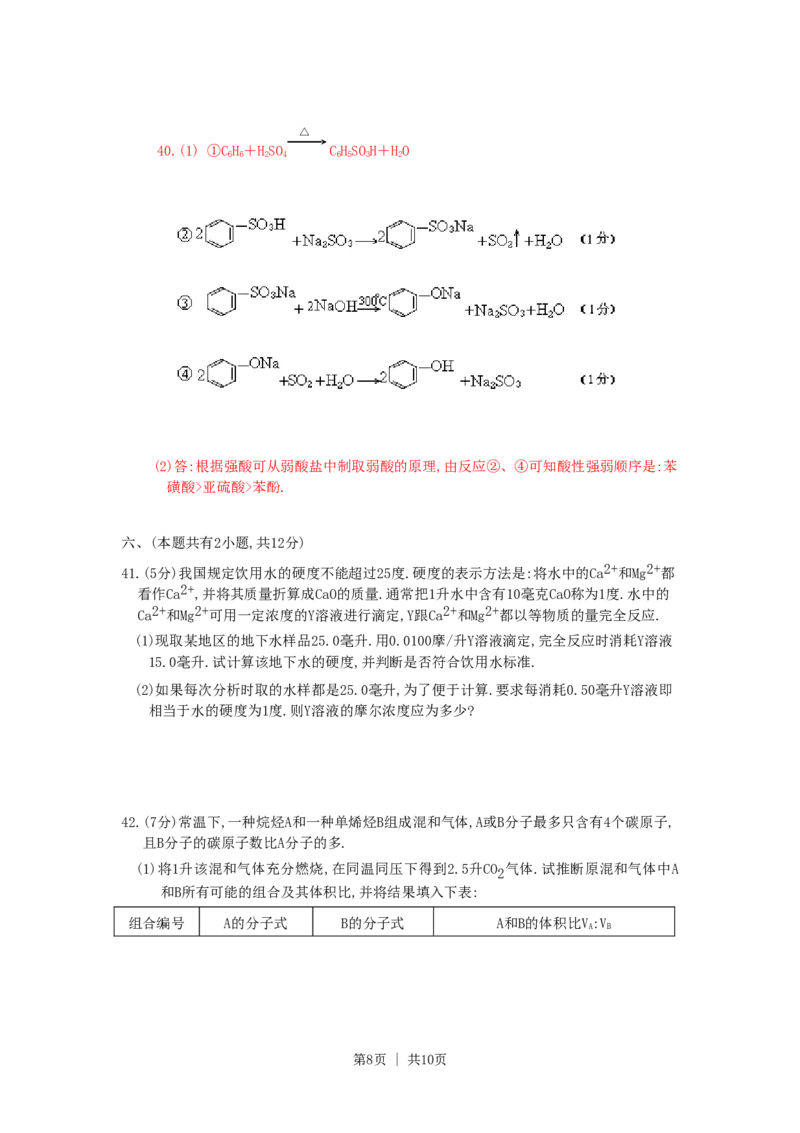
40.(5分)以苯、硫酸、氢氧化钠、亚硫酸钠为原料、经典的合成苯酚的方法可简单表示为:
第6页 | 共10页(1)写出第②、③、④步反应的化学方程式:
(2)根据上述反应判断苯磺酸、苯酚、亚硫酸三种物质的酸性强弱,并说明理由.
参考答案:
33.S(固)+O (气)SO (气)+296千焦 (2分)
2 2
35.②①③⑧⑦⑥⑤④
36.答:已知室温时,纯水中的[H + ]=[OH - ]=10 -7 摩/升,又因水的离解(HO H++OH
2
-)是吸热反应,故温度升高到80℃,电离度增大,致使[H + ]=[OH - ]>10 -7 摩/升,
即pH<7
37.CH ,C H,
9 20 10 8
38.14;C H O
14 20
39.答:AlCl 在水中存在如下平衡;
3
AlCl +3H OAl(OH) +3HCl蒸干和灼烧过程中,HCl挥发,Al(OH) 分解:
3 2 3 3
△
2Al(OH)
3
Al
2
O
3
+3H
2
O,因此固体产物是氧化铝。
(共3分)
第7页 | 共10页△
40.(1) ①CH+HSO CHSOH+HO
6 6 2 4 6 5 3 2
(2)答:根据强酸可从弱酸盐中制取弱酸的原理,由反应②、④可知酸性强弱顺序是:苯
磺酸>亚硫酸>苯酚.
六、(本题共有2小题,共12分)
2+ 2+
41.(5分)我国规定饮用水的硬度不能超过25度.硬度的表示方法是:将水中的Ca 和Mg 都
2+
看作Ca ,并将其质量折算成CaO的质量.通常把1升水中含有10毫克CaO称为1度.水中的
2+ 2+ 2+ 2+
Ca 和Mg 可用一定浓度的Y溶液进行滴定,Y跟Ca 和Mg 都以等物质的量完全反应.
(1)现取某地区的地下水样品25.0毫升.用0.0100摩/升Y溶液滴定,完全反应时消耗Y溶液
15.0毫升.试计算该地下水的硬度,并判断是否符合饮用水标准.
(2)如果每次分析时取的水样都是25.0毫升,为了便于计算.要求每消耗0.50毫升Y溶液即
相当于水的硬度为1度.则Y溶液的摩尔浓度应为多少?
42.(7分)常温下,一种烷烃A和一种单烯烃B组成混和气体,A或B分子最多只含有4个碳原子,
且B分子的碳原子数比A分子的多.
(1)将1升该混和气体充分燃烧,在同温同压下得到2.5升CO 气体.试推断原混和气体中A
2
和B所有可能的组合及其体积比,并将结果填入下表:
组合编号 A的分子式 B的分子式 A和B的体积比V:V
A B
第8页 | 共10页(2)120℃时取1升该混和气体与9升氧气混和,充分燃烧后,当恢复到120℃和燃烧前的压
强时,体积增大6.25%.试通过计算确定A和B的分子式.
参考答案:
2+ 2+
41.(1)25.0毫升水中含Ca 和Mg 的总物质的量为
-4
0.0100×0.0150=1.50×10 (摩)
-4 -3
折合成CaO的质量为1.50×10 ×56=8.40×10 (克)
因硬度超过25度,故不符合饮用水标准.
或列成总式:
因硬度超过25度,故不符合饮用水标准.
(2)[解法一]
25.0毫升水(硬度为1度)中含CaO的物质的量为
[解法二][利用(1)的结果计算]
设Y溶液的浓度为C,则(0.0100×15.0):33.6=(C×0.50):1
-3
C=8.92×10 (摩/升)(1分)
42.(7分)
(1)[解题思路]1升碳原子数为n的烷烃或烯烃充分燃烧后均得到n升CO ,由题意(1升
2
混和气体充分燃烧后生成2.5升CO ,且B分子的碳原子数比A分子的多)可推断,混
2
和气体只能由碳原子数小于2.5的烷烃(CH 和C H )和碳原子数大于2.5的烯烃
4 2 6
(C H 和C H )组成.它们有四种可能的组合.根据每一种组合中烷烃和烯烃的碳原
3 6 4 8
子数及燃烧后生成的CO 体积,可确定A和B的体积比.(以上内容不要求考生在卷面
2
上回答.)
第9页 | 共10页(2)设1升气态烃与氧充分燃烧后体积变化为△V升,则
CH +2O =CO +2H O(气) △V =0(升)
4 2 2 2 1
C H +6O =4CO +4H O(气) △V =1.0(升)
4 8 2 2 2 4
各种组合的1升混和气体与氧气充分燃烧,体积增大为:
故组合④符合题意,即A:C H ;B:C H .
2 6 4 8
第10页 | 共10页