文档内容
柳州高中 2024 级高一 10 月月考化学试卷
时间:75分钟 分值:100分
一、选择题(本题共16小题,每小题3分,共48分。在每小题给出的四个选项中,只有一
个是正确选项)
1.化学使人们的生活越来越美好,下列过程没有涉及化学变化的是( )
A.可燃冰作燃料 B.黄豆酿酱油
C.爆竹燃放 D.活性炭除味
2.吸入人体内的氧有 转化为氧化性极强的“活性氧”,它能加速人体衰老,被称为“生命杀手”,服
用含硒元素(Se)的化合物亚硒酸钠 能消除人体内的活性氧,由此判断 的作用是(
)
A.做还原剂 B.做氧化剂
C.既做氧化剂又做还原剂 D.做催化剂
3.以下物质间的各步转化中,均可通过一步反应实现的是( )
① ; ② ;
③ ; ④
A.①③ B.①② C.②③ D.②④
4.下列离子方程式错误的是( )
A.向 溶液中滴加 溶液:
B.往澄清石灰水中通入过量 :
C.用小苏打 治疗胃酸过多:
D. 和稀盐酸的反应:
5.下列分类或归类正确的是( )
①液氯、氨水、干冰、碘化银均为纯净物 ② 、 、 、 均为化合物
③明矾、水银、烧碱、硫酸均为电解质 ④碘酒、淀粉溶液、纳米材料均为胶体
⑤ 、 、金刚石、石墨均为碳的同素异形体
A.②⑤ B.②③ C.①③⑤ D.②③④⑤
6.已知氧化还原反应:
① ② ③ ④下列说法不正确的是( )
A.氧化性:
B.在含有 、 混合溶液中加入铁粉,若反应后固体中只有铜,则溶液中可能存在 和
C. 能与 反应
D. 在反应②中是氧化产物,在反应③中是还原产物
7.有关胶体等分散系的制备、性质的相关说法不正确的是( )
A.胶体区别于其他分散系的本质特征是分散质的微粒直径在 之间
B.向沸水中加入几滴氯化铁饱和溶液,继续煮沸至液体呈红褐色,即制得氢氧化铁胶体
C.依据丁达尔效应可将分散系分为溶液、胶体与浊液
D.根据分散剂不同,胶体可以分为气溶胶、液溶胶和固溶胶
8.下列各组粒子能大量共存的是( )
A.强酸性的溶液中: 、 、 、
B.澄清透明的溶液中: 、 、 、
C.含有大量 的溶液中: 、 、 、
D.使紫色石蕊溶液呈红色的溶液中: 、 、 、
9.某混合溶液中所含离子的浓度如表,则 离子可能为( )
所含离
M
子
个数 2a a 2a a
A. B. C. D.
10.下列关于氧化还原反应的说法正确的是( )
A. 反应中氧化产物和还原产物的个数之比为
B. 反应中硝酸只起酸的作用
C. 反应中, 是还原剂, 是还原产物
D. 反应中, 是氧化产物, 是还原产物
11.下列物质的分类正确的是( )
选项 酸 碱 盐 酸性氧化物 碱性氧化物A
B HCl NaOH NaCl CO
C NaHSO NaOH MgO
4
D HNO NH HCO CaO
3 4 3
12.油条的做法是将明矾、纯碱按比例加入温水中,再加入面粉搅拌成面团;放置,使面团产生气体,形成
孔洞。放置过程发生反应:
。
下列判断正确的是( )
A.从物质的分类角度来看,油条配方中的“明矾、纯碱”主要成分依次为盐、碱
B.放置过程发生的反应为氧化还原反应
C.放置过程发生的反应中,反应物和生成物均为电解质
D.反应的离子方程式为
13.已知反应: ;
② (未配平)
下列有关说法不正确的是( )
A.方程式①中 为
B.还原性强弱:
C. ,
D.反应 能发生
14.某无色溶液中只可能含有 、 、 、 、 、 、 中的一种或几种,对其进行
如下实验操作:
①另取少量溶液,加入足量 溶液,产生白色沉淀;
②向①所得混合物中加足量盐酸,沉淀部分溶解,并有气泡生成;
③将②所得混合物过滤,向滤液中加入 溶液,有白色沉淀生成。
下列对该溶液的说法正确的是( )
A.一定含有 、 、 B.一定含有 、 ,可能含有 、C.一定不含有 、 、 、 D.可能含有 、
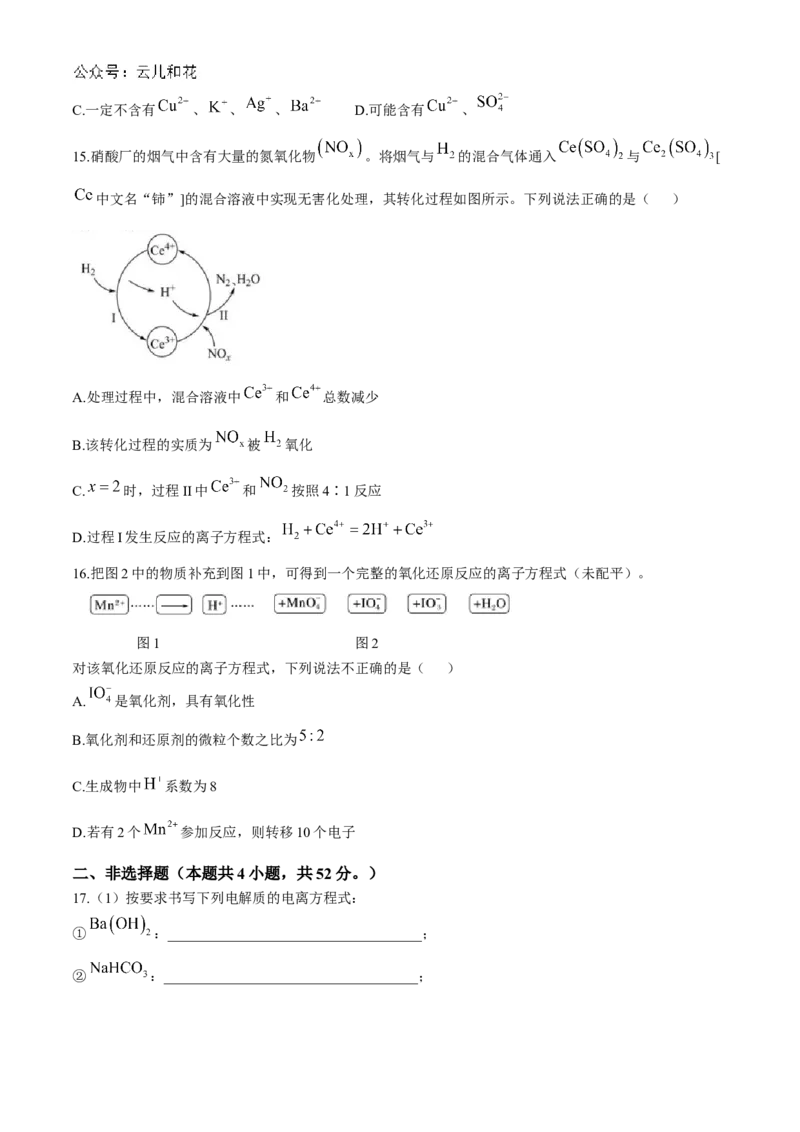
15.硝酸厂的烟气中含有大量的氮氧化物 。将烟气与 的混合气体通入 与 [
中文名“铈”]的混合溶液中实现无害化处理,其转化过程如图所示。下列说法正确的是( )
A.处理过程中,混合溶液中 和 总数减少
B.该转化过程的实质为 被 氧化
C. 时,过程II中 和 按照4∶1反应
D.过程I发生反应的离子方程式:
16.把图2中的物质补充到图1中,可得到一个完整的氧化还原反应的离子方程式(未配平)。
图1 图2
对该氧化还原反应的离子方程式,下列说法不正确的是( )
A. 是氧化剂,具有氧化性
B.氧化剂和还原剂的微粒个数之比为
C.生成物中 系数为8
D.若有2个 参加反应,则转移10个电子
二、非选择题(本题共4小题,共52分。)
17.(1)按要求书写下列电解质的电离方程式:
① :____________________________________;
② :____________________________________;③ :____________________________________;
(2)完成下列反应的离子方程式。
① 溶液与 溶液反应,反应后溶液恰好呈中性:__________________
② 溶液与 溶液反应:
不足:______________________________
过量:________________________
(3)完成下列方程式的配平
①
②
③______ ______ ______ ______ ______ ______
18.I、高铁酸钾 为暗紫色固体,可溶于水,是一种新型、高效、多功能绿色水处理剂,比
、 、 、 、 、 氧化性更强,无二次污染。工业上是先制得高铁酸钠,
然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。结合所学知识回答相关问题:
(1)在 、 、 、 、 、 几种物质中,属于电解质的是______(填化学
式), 的化学名称为______。
(2) 的电离方程式:________________________。
(3)制备高铁酸钠的主要反应为 (已知
中氧元素的化合价为-1价)。
①该反应中氧化剂是______(填化学式,下同);氧化产物是______,若有1分子 生成,反应转移电子
的个数为______个。
②用 与过量稀硫酸反应可以制取原料 ,若要将原料 转化为 ,可选用的最佳试
剂是______(填字母)。a. b. c. d.
(4)在碱性条件下也可制高铁酸钠,该反应的方程式中有六种粒子: 、 、 、 、
、 ,写出该反应的离子方程式为:__________________
II、氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:
。 、 、 、 四种物质中的一种物质
(甲)能使上述还原过程发生。
(5)物质(甲)为______(填化学式);反应中若产生5个NO分子,则转移电子的数目是______。
19.如图为氯及其化合物的“价—类”二维图。
(1)填写二维图缺失的类别A______和化学式B______
(2)已知:还原性顺序: ,这些离子遇到氧化剂会分别被氧化为 、 、 、
,请写出向 中通入少量氯气的化学方程式为__________________
(3)工业制取氯气原理为如下反应,请完成下列方程式(补充完整生成物并配平):
______HO+______NaCl ______ ______NaOH+______
2
(4)实验室可用高锰酸钾和浓盐酸制取,请完成该离子方程式的配平
______ ______ ______ ______ ______ ______
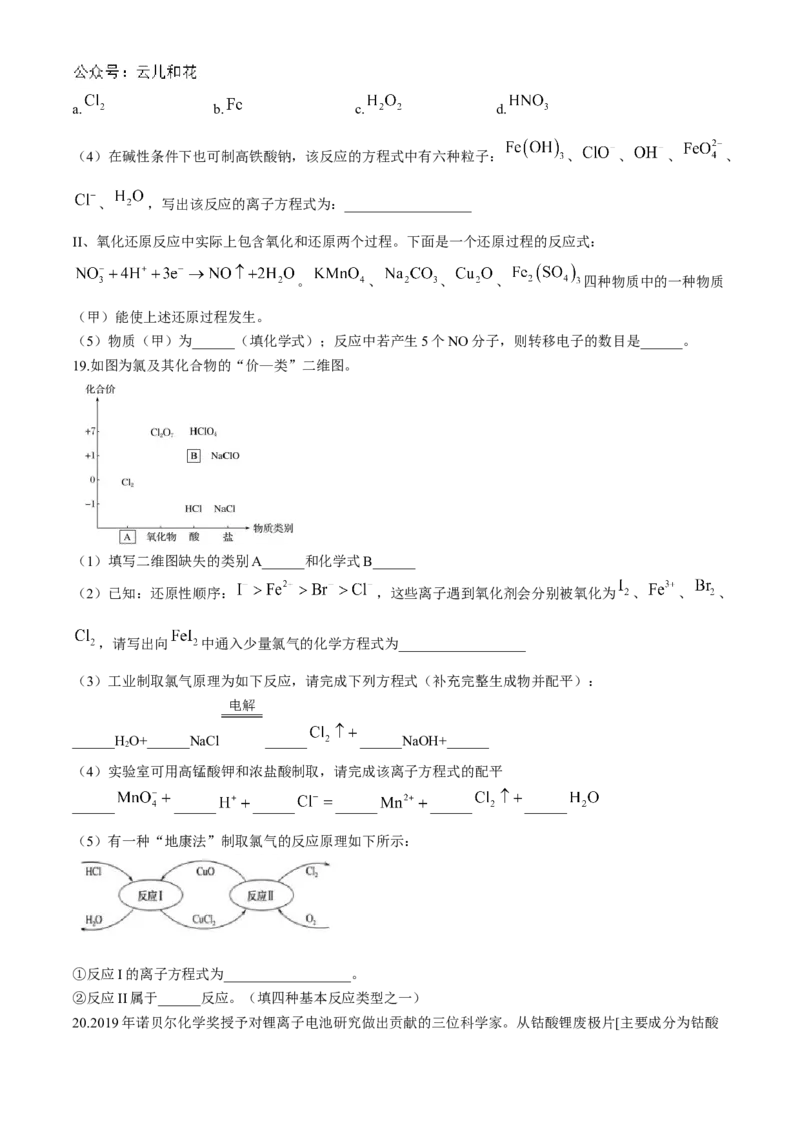
(5)有一种“地康法”制取氯气的反应原理如下所示:
①反应I的离子方程式为__________________。
②反应II属于______反应。(填四种基本反应类型之一)
20.2019年诺贝尔化学奖授予对锂离子电池研究做出贡献的三位科学家。从钴酸锂废极片[主要成分为钴酸锂 ]中回收得到 和 的一种工艺流程如图。
已知:常温下, 难溶于水。
回答下列问题:
(1)操作1中,粉碎废极片的目的是__________________。
(2)往废极片粉末中加入 溶液和 溶液,此时发生的反应为:
a b (已配平):
①该反应中, ______, ______。
②该反应出现的物质中,属于硫酸盐的共有______种,属于氧化物的共有______种。
③该反应的离子方程式为______(已知 为原子团)。
(3)操作2的名称为______,在实验室进行该操作时需要用到玻璃棒,其作用为__________________
(4)操作4的过程需要通空气,请写出该步骤发生的化学方程式为__________________(已知
中碳为+3价)
(5)操作5中, 晶体用热水洗涤比用冷水洗涤损耗更少,说明 的溶解度随温度升高而
______(填“升高”或“降低”),根据所学知识,请举一个溶解度随温度变化与 类似的物质为
______。柳州高中 2024 级高一 10 月月考化学答案
一、选择题(共48分)
1–5DABDA 6–10:BCBDC 11-15:DDCAC16:C
二、非选择题(共52分)
17.(电离方程式每个1分,其余2分,共15分)
(1)①
② 、
③
(2)① 。
② ; 。
(3)①2 9 3 3 5 ② 2 3 1 3 3 ③2 5 1 5 3 1
18、(共14分)(1) 、 、 (2分) 氯酸钠(1分)
(2) (1分)
(3)① (1分) 和 10(1分) ②c(1分)
(4) (2分)
(5) 15(1分)
19.(除标注外每空2分,共10分)
(1)单质(1分) HClO(1分)
(2)
(3)
(4)2 16 10 2 5 8
(5) (1分) 置换(1分)
20.(共13分)
(1)增大接触面积,增大酸浸速率,提高原料的利用率(1分)
(2)①2(1分) 3(1分) ②2(1分) 2(1分)③ (2分)
(3)过滤(1分) 引流(1分)
(4) (2分)
(5)降低(1分)