文档内容
2025 届高三一轮复习联考(一)
化学试题
注意事项:
1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上;
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案字母涂黑,如需改
动,用橡皮擦干净后,再选涂其他答案字母;回答非选择题时,将答案写在答题卡上,写在
本试卷上无效;
3.考试结束后,将本试卷和答题卡一并交回。
考试时间75分钟,满分100分
可能用到的相对原子质量:H—1 C—12 N—14 O—16 Na—23 S—32 Cl—35.5 Ba
—137
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一
项是符合题目要求的。
1.古诗词或谚语中蕴含着化学知识。下列描述的过程中包含氧化还原反应的是( )
A.“只要功夫深,铁杵磨成针”
B.“美人首饰侯王印,尽是沙中浪底来”
C.“飞流直下三千尺,疑是银河落九天”
D.“雷蟠电掣云滔滔,夜半载雨输亭皋”
2.生活中处处有化学。下列化学物质的应用中,错误的是( )
A.铁红 常用作油漆、涂料、油墨和橡胶的红色颜料
B.不锈钢是最常见的合金钢,合金元素主要是铬和镍,具有很强的抗腐蚀性
C.碳酸氢钠常用作加工面包、饼干等食品的膨松剂
D.五氧化二磷、碱石灰常用作食品的干燥剂
3.从不同的视角对物质进行分类是认识物质的常用方法。下列物质类别符合图形要求的是( )
选项 X Y 2
A 非金属氧化物 酸性氧化物 过氧化物
B 胶体 液溶胶 溶液
C 电解质 离子化合物 共价化合物
D 一元酸 含氧酸 无氧酸
4.下列物质之间的转化关系不能通过一步化学反应实现的是( )
A.B.
C.
D.
5.设 为阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下, 中含有的电子总数为
B. 溶液中:
C.标准状况下,当 中生成22.4L 时, 失去 电子
D.向沸水中加入含 的饱和溶液,形成的氢氧化铁胶体的数目为
6.对于多反应的复杂体系,考虑化学反应的先后顺序有利于问题的顺利解决。下列化学反应的顺序判断错
误的是( )
A. 与 、 共同反应时,可以认为 先与 反应,再与 反应
B.向含有等物质的量的 、 的溶液中滴加 溶液时, 先与 反应
C.向含有 、 的溶液中通入 ,反应的先后顺序为 、
D.向含有等物质的量的 、 的溶液中通入 ,反应的先后顺序为 、 、
7.粗盐中常含有杂质离子 、 、 ,实验室模拟粗盐提纯的实验流程如图所示,下列试剂选
择和主要实验目的表述正确的是( )
A.试剂1一定是 溶液,目的是除去 和
B.试剂1、2、3分别选用 溶液、 溶液、 溶液
C.“除杂4”发生反应的离子方程式为: 、D.“操作X”为蒸发浓缩、冷却结晶
8.下列两种试剂,相互滴加(试剂的浓度均为 ),反应现象没有明显差别的是( )
A. 溶液和盐酸 B.草酸溶液和 溶液
C.氨水和硝酸银溶液 D. 溶液和 溶液
9. 在电子、光学和高分子材料等领域具有重要的应用。下面是制备 的两种方法:方法一:将
与 在反应容器中加热到 ,经 反应制得 ,其反应方程式为
(未配平);
方法二:利用 与 反应制备: (未配平)。
下列有关说法正确的是( )
A.上述两种反应均为氧化还原反应 B. 的结构式为
C.方法二中生成 时则生成 D.产生等物质的量的 ,方法二更环保
10.过氧化钠可作织物的印染剂、潜艇中的供氧剂等。某实验小组利用如图装置探究过氧化钠的性质,下列
说法正确的是( )
A.试剂A可以是碱石灰,目的是除去
B.可以用带火星的木条检验收集的气体是氧气
C.试剂B可以是浓硫酸,作用是除去氧气中的水蒸气
D.若试剂A为饱和 溶液,硬质玻璃管中只发生反应:
11.下列实验方案能达到实验目的的是( )
选项 实验目的 实验方案
用干净的铂丝分别蘸取两种溶液在酒精灯外焰上灼烧,观察火
A 鉴别 溶液与
焰的颜色
溶液
B
检验 溶液是否完全变质 向 溶液中滴加酸性高锰酸钾溶液,观察溶液颜色
测定 和 混 取 该混合物与足量稀硫酸充分反应,逸出气体经干燥后用碱
C
石灰吸收,质量增加
合物中 的质量分数D 证明 与 的反应是可 将 溶液与 溶液混
逆反应 合,充分反应后,取样少许滴加2滴KSCN溶液,观察现象
12.控制试剂的用量是化学实验准确性的基础和保证。将过量的 通入 的下列溶液中,实验
现象及离子方程式的书写均正确的是( )
已知酸性强弱顺序: 。
选项 溶液 现象 离子方程式
A 产生淡黄色沉淀
水溶液
溶液由棕黄色变浅绿色,产生
B 淡黄色沉淀,后又产生黑色沉
溶液
淀
C 溶 溶液由红色变无色
液(含酚酞)
溶液紫红色褪去,产生淡黄色
D 酸性
沉淀
溶液
13.金属材料对于促进生产发展发挥了巨大的作用。如图是两种金属及其化合物的转化关系(每一步反应均
反应完全),其中X、Y是日常生活中常见的金属单质,M、N、Z是含有元素 的化合物,反应②是工
业上制备金属 的方法之一。下列说法错误的是( )
A.金属X、Y分别是 、
B.反应①和③中等量的 完全反应,则转移的电子数:①>③
C. 溶液与 的反应在工业上用于制作印刷电路板
D.由转化关系可推知氧化性:
14.随着新能源的发展,以再利用为目的对废旧磷酸铁锂电池(主要含有 、 、石墨以及其他难
溶性杂质)的回收显得非常重要。利用湿法回收磷酸铁锂电池材料制备碳酸锂的工艺流程如图。下列说法
错误的是( )已知:“滤渣1”中含有 ;“浸出”时温度为 ,浸出后溶液中还含有少量 。
A.预处理时,用饱和 溶液洗涤的目的是洗去表面的油污
B.“浸出”时发生的主要反应的离子方程式为
C.为了提高反应速率,“浸出”可以采用搅拌、加强热等措施
D.“滤渣2”的主要成分是 和
二、非选择题:本题共4小题,共58分。
15.(14分)对物质进行分类是进行性质研究的基本方法。将 、 、 、 、
按照一定的分类标准进行分类(如下图),相连的物质可以归为一类,相交部分以A、B、C、D
为分类代码。
(1)相连的两种物质都是弱电解质的是_______(填分类代码);请写出相连的两种物质反应产生气体的
离子方程式:_____________________。
(2)已知: 溶液的 , 溶液与 溶液反应时只能生成两种盐,则
为_______元酸, 与足量的 溶液反应的化学方程式为_____________________。
(3) 、 是两种强氧化性酸,但 不稳定,在室温下易发生歧化反应。
①请写出 分解的化学方程式:_____________________;
②已知硝酸被还原的半反应方程式为 , 对硝酸被还原的半反应有
催化作用,其催化机理分三步进行:
第一步: ;
第二步:……
第三步: 。
请补充催化机理的第二步反应:_____________________。
(4)肼 为二元弱碱,其在水中的电离方式与氨水相似, 被 溶液氧化可以制得肼。
①请写出肼与足量的硫酸反应生成正盐的化学方程式:_____________________;②已知肼的密度约为 ,若制备 的肼,理论上需要 溶液的体积为_______
。
16.(15分)氯化钡常用作分析试剂、脱水剂,制钡盐原料以及用于电子、仪表、冶金等工业。某实验小
组欲通过重量分析法测定 中钡元素的含量。
I.沉淀剂的配制
用 重量法测定 时,一般用稀硫酸作沉淀剂。实验中需用质量分数为 、密度为
的浓硫酸配制 溶液。
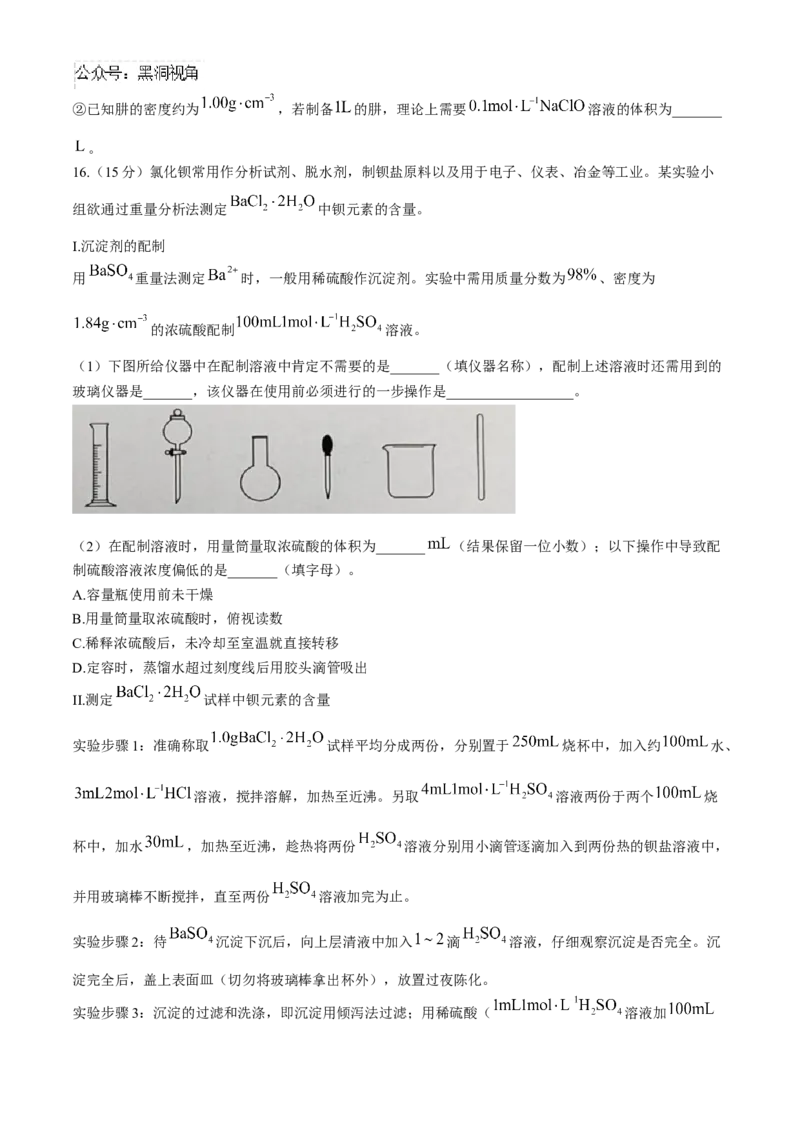
(1)下图所给仪器中在配制溶液中肯定不需要的是_______(填仪器名称),配制上述溶液时还需用到的
玻璃仪器是_______,该仪器在使用前必须进行的一步操作是__________________。
(2)在配制溶液时,用量筒量取浓硫酸的体积为_______ (结果保留一位小数);以下操作中导致配
制硫酸溶液浓度偏低的是_______(填字母)。
A.容量瓶使用前未干燥
B.用量筒量取浓硫酸时,俯视读数
C.稀释浓硫酸后,未冷却至室温就直接转移
D.定容时,蒸馏水超过刻度线后用胶头滴管吸出
II.测定 试样中钡元素的含量
实验步骤1:准确称取 试样平均分成两份,分别置于 烧杯中,加入约 水、
溶液,搅拌溶解,加热至近沸。另取 溶液两份于两个 烧
杯中,加水 ,加热至近沸,趁热将两份 溶液分别用小滴管逐滴加入到两份热的钡盐溶液中,
并用玻璃棒不断搅拌,直至两份 溶液加完为止。
实验步骤2:待 沉淀下沉后,向上层清液中加入 滴 溶液,仔细观察沉淀是否完全。沉
淀完全后,盖上表面皿(切勿将玻璃棒拿出杯外),放置过夜陈化。
实验步骤3:沉淀的过滤和洗涤,即沉淀用倾泻法过滤;用稀硫酸( 溶液加水配成)洗涤沉淀 次。
实验步骤4:沉淀的灼烧和恒重,即将两份折叠好的沉淀滤纸包分别置于已恒重的瓷坩埚中烘干、炭化、
灰化后,在 的马弗炉中灼烧至恒重。计算 中钡元素的含量。
(3)溶解 试样时加入稀盐酸的目的是__________________。
(4)检测沉淀洗涤干净的方法是__________________。
(5)若最终产生沉淀的平均质量为 ,则 中钡元素的含量为_______。
17.(15分)铁及其化合物在生产生活中具有重要的应用。铁及其化合物的化合价—物质类别二维图如图
所示。
(1)工业上冶炼 常用的方法是________(填字母)。
a.电解法 b.还原法 c.热分解法 d.物理方法
(2)下列有关铁及其化合物的说法正确的是________(填字母)。
a.纯净的铁是银白色
b.物质A不稳定,在空气中受热能迅速被氧化成物质D
c.物质E受热分解生成物质D
d.除去 溶液中混有的少量 杂质,可以向混合液中加入 溶液
(3)若上述二维图中的 为硫酸盐,请写出由物质D转化为物质 反应的离子方程式:
________________________。
(4)某实验小组欲采用下图装置制备物质B及验证其性质,其实验步骤如下所示。
实验步骤:
I.检查装置的气密性后,关闭……,打开……,使装置1中产生的气体进入装置2中,排尽装置2中的空气。
II.待装置2中的空气排尽后,关闭 ,打开 ,将装置1中溶液压入装置2中并观察现象。III.关闭 、 ,打开 ,使装置3中产生的气体通入装置2中并观察现象。
回答下列问题:
①仪器 的名称是________,装置2中的图像管的作用__________________。
②请补充步骤I实验操作:关闭_________,打开_________。
③步骤III装置2中的现象是__________________________,其发生反应的化学方程式为
__________________。
18.(14分)金属铬主要用于不锈钢、电镀和金属陶瓷等工业生产,工业上常用铝热法制备金属铬。由铝
铬铁矿(主要成分是 ,含有少量的 、 、 等杂质)制备金属铬的工艺流程如图。
(1) 中 的化合价为_________,“焙烧”前,将铝铬铁矿粉碎,其目的是
____________________________________。
(2)已知水浸取液中含有 等离子,“焙烧”时, 和 分别发生反应的化学方程式为
__________________、__________________。
(3)“浸渣”的主要成分为_________(填化学式,下同),“滤渣”的主要成分为__________________。
(4)请写出“中和、酸化”过程中生成 的离子方程式:___________________________;当
“还原1”步骤中生成 时,则还原剂和还原产物的物质的量之比为_________。
(5)已知 在高温条件下会分解。“还原2”发生反应时,点燃镁条引燃反应, 在铝热反
应中的作用可能是__________________。2025 届高三一轮复习联考(一)
化学参考答案及评分意见
1.D【解析】铁杵磨成针、沙中淘金都是物理变化,A、B项均错误;“飞流直下三千尺,疑是银河落九
天”不是化学反应,没有新物质生成,C项错误;“雷蟠电掣云滔滔,夜半载雨输亭皋”中电闪雷鸣中发
生反应: 、 、 ,硝酸随雨水进入土壤
转化为硝酸盐,氮元素被植物吸收,这个过程涉及氧化还原反应,D项正确。
2.D【解析】五氧化二磷与冷水反应生成偏磷酸,有毒,不能用作食品的干燥剂,而碱石灰吸水后为强碱,
则具有腐蚀性,D项错误。
3.C【解析】酸性氧化物不全是非金属氧化物,如 ,过氧化物中不全是金属氧化物,如 ,A
项错误;液溶胶属于胶体,但是溶液与胶体没有交集,B项错误;离子化合物都是电解质,部分共价化合
物是电解质,如HCl、 ,C项正确;含氧酸不全是一元酸,部分无氧酸是一元酸,D项错误。
4.D【解析】MgO不能与水直接反应转化为 ,D项符合题意。
5.B【解析】在标准状况下 不是气体,无法计算其物质的量,A项错误;由于 发生水解,则
,B项正确;标准状况下,当 中生成 时, 失去
电子,C项错误;胶体是一个大集合体,向沸水中加入含 的饱和溶液,形成的氢氧
化铁胶体的数目小于 ,D项错误。
6.C【解析】 与 、 共同反应时,可以认为 先与 反应,再与 反应,A项
正确;向含有等物质的量的 、 的溶液中滴加 溶液时, 先与 反应,再与 反
应,B项正确;向含有 、 的溶液中通入 ,反应的先后顺序为 、
,C项错误;根据还原性强弱 ,向含有等物质的量的 、 的溶液中通入
,反应的先后顺序为 、 、 ,D项正确。
7.C【解析】选择试剂为: 溶液、 溶液、 溶液,分别除去粗盐水中的 、 、,试剂添加顺序只需将 溶液放到 溶液之前即可,A、B项均错误;试剂4为稀盐酸,
故“除杂4”发生反应的离子方程式为: 、 ,C项正确;
“操作X”为蒸发结晶制得 固体,D项错误。
8.D【解析】将 溶液滴入盐酸中立即产生气体,而将盐酸滴入 溶液中,开始无气体产生,
A项不符合;将草酸溶液滴入 溶液中,紫红色溶液逐渐变浅,有气泡产生,而将 溶液滴
入草酸溶液中,有气泡产生,溶液无色,B项不符合;将氨水滴入硝酸银溶液中,先产生白色沉淀,氨水
过量后白色沉淀溶解,而将硝酸银溶液滴入氨水中,开始无明显现象,后产生白色沉淀,C项不符合;
溶液与 溶液相互滴加时,虽然产物不完全相同,但是现象相同,均产生白色沉淀,D
项符合。
9.D【解析】方法一的反应不是氧化还原反应,A项错误;根据成键规律,硫一般形成两个共价键,
的结构式应为 ,B项错误;方法二发生反应的化学方程式为
,当生成 时,则生成 ,C项错误;方法一的化
学方程式为 ,产生等物质的量的 ,方法二产生的 的量少,更加
环保,D项正确。
10.B【解析】若试剂A是碱石灰,会吸收二氧化碳和水蒸气,另外,固体碱石灰作为干燥剂,应放在U形
管或球形干燥管中,A项错误;可以用带火星的木条检验收集的气体是氧气,B项正确;若试剂B是浓硫
酸,作用是防止外界水蒸气进去硬质玻璃管中,不是为了除去水蒸气,因为后续还用排水法收集,C项错
误;若试剂A为饱和 溶液,硬质玻璃管中不仅发生反应: ,
还发生过氧化钠与水的反应,D项错误。公众号:高中试卷君
11.C【解析】用焰色试验鉴别 溶液与 溶液时,钾元素的焰色要通过蓝色的钴玻璃片观察,
A项错误; 溶液中含有氯离子,也能使酸性高锰酸钾溶液褪色,B项错误;根据实验方案,设
和 的物质的量分别为 、 ,列出两个方程, 和 ,即可求出 的质量分数,C项正确; 过量,不能用检验 的存在来证明是可逆反应,D项
错误。
12.C【解析】由氧化还原反应规律可知, 与 水溶液反应不能生成 ,A项错误;将 通入
溶液中,离子方程式应为 ,过量的 不能与 反应,因为
沉淀溶于强酸,B项错误;将 通入 溶液(含酚酞)中,根据强酸制弱酸的原理,离子方
程式为 ,C项正确;将 通入酸性 溶液中,离子方程式应为
,D项错误。
13.B【解析】分析转化关系和已知信息可知 为 , 为 ,A项正确;反应①的离子方程式为
,反应③是 在酸性溶液中将 氧化成 ,反应的离子方程
式为 ,等量的 完全反应,则转移的电子数相同,B项错误;
溶液( 溶液)与 的反应在工业上用于制作印刷电路板,C项正确;同一氧化还原反应
中,氧化剂的氧化性大于氧化产物的氧化性,根据题中的离子反应: 、
,可知氧化性: ,即 ,D项正确。
14.C【解析】预处理时,用饱和 溶液洗涤的目的是洗去表面的油污,A项正确;“浸出”时
发生反应的离子方程式为 ,B项正确;由
于双氧水易分解,在 温度基础上不宜再升温,C项错误;根据题意可知,“滤渣2”的主要成
分是 和 ,D项正确。
15.(14分)
(1)A、B(2分)
(2)二(1分) (2分)(3)① (2分)
② (2分)
(4)① (2分)
②312.5(2分)
【解析】(1) 、 、 均为弱电解质,故相连的两种物质都是弱电解质的是A、
B;
(2)由于 溶液与 溶液反应时只能生成两种盐,则 为二元酸,其与足量的 溶
液反应的化学方程式为 ;公众号:高中试卷君
(3)①亚硝酸不稳定,在室温下易发生歧化反应,化合价有升有降,升为+5价,降为+2价,亚硝酸分解
的化学方程式为 ;
②由硝酸被还原的半反应和分步反应可推知第二步反应为
(4)①肼为二元弱碱,硫酸为二元强酸,二者反应生成正盐的化学方程式为
②1L肼的质量为 ,其物质的量为 ,
根据关系式 可知理论上需要 溶液的体积为 。
16.(15分)
(1)分液漏斗、圆底烧瓶(2分;全对得2分,少答得1分,一对一错得0分)
容量瓶(2分) 检漏(1分)
(2)5.4(2分) BD(2分;全对得2分,少选得1分,一对一错得0分)
(3)排除杂质离子的干扰,保证产生的沉淀完全是硫酸钡沉淀(2分)
(4)取最后一次洗涤液于试管中,加入硝酸酸化的硝酸银溶液,若无白色沉淀产生,说明沉淀洗涤干净
(2分)
(5) (2分)
【解析】(1)稀释浓硫酸时肯定不需要的是分液漏斗、圆底烧瓶,还需要 容量瓶,容量瓶在使用
前要先检漏;(2)通过 计算可知浓硫酸的物质的量浓度为 ,稀释过程中溶质的物质的量不变,
可计算出需要浓硫酸的体积为 。容量瓶使用前未干燥,对实验结果没有影响,
A项不符合;用量筒量取浓硫酸时,俯视读数,会使量取的浓硫酸的体积偏小,导致配制的溶液浓度偏低,
B项符合;稀释浓硫酸后,未冷却至室温就直接转移,因为热胀冷缩,所加蒸馏水的体积偏小,则浓度偏
高,C项不符合;定容时,蒸馏水超过刻度线后用胶头滴管吸出,会导致溶液浓度偏低,需要重新配制,
D项符合。
(3)溶解 试样时加入稀盐酸的目的是防止生成碳酸钡等沉淀,使钡离子全部生成硫酸钡沉
淀;
(4)检验沉淀洗涤干净的方法是检验氯离子是否洗涤干净,操作是取最后一次洗涤液于试管中,加入硝
酸酸化的硝酸银溶液,若无白色沉淀产生,说明沉淀洗涤干净;
(5)根据题意可知 中钡元素的含量为
17.(15分)
(1)b(1分)
(2)ac(2分;全对得2分,少选得1分,一对一错得0分)
(3) (2分)
(4)①恒压滴液漏斗(1分) 平衡气压(或辅助排除装置2中的空气)(1分)
② 、 (2分) 、 、 (2分)
③白色沉淀逐渐变为灰绿色,最后变为红褐色(2分)
(2分)
【解析】由图示化合价可知, 是 , 是 , 是 , 是 , 是+2价铁
盐, 是+3价铁盐,据此分析回答问题。
(1)工业上常用碳生成一氧化碳来还原铁矿石冶炼 ,为还原法;
(2)纯净的铁是银白色的金属单质,a正确; 不稳定,在空气中受热能迅速被氧化成四氧化三铁,b
错误; 受热易分解生成 ,c正确;氢氧化钠与氯化亚铁、氯化铜都反应,d错误;
(3)根据价类二维图可知,D到F过程中铁的化合价未变,F为硫酸盐,则D为氧化铁,氧化铁与硫酸反应生成硫酸铁和水,离子方程式为 ;
(4)根据仪器a的特点,仪器a为恒压滴液漏斗;该实验制备氢氧化亚铁,氢氧化亚铁容易被氧气氧化,
因此打开 、 、 ,关闭 和 ,装置1中产生 ,排除装置2中的氧气,让空气沿长玻璃管排
除,因此长玻璃管作用之一是辅助排除装置2中的空气,同时作用之二是平衡压强,防止装置中压强过大,
发生危险;装置3中 在 催化剂下分解成 和 ,打开 ,关闭 、 ,氧气进入装
置2中,发生反应 ,观察到白色沉淀逐渐变为灰绿色,最后变为红
褐色。
18.(14分)
(1)+2(1分) 增大反应物的接触面积,加快焙烧反应速率,提高铝铬铁矿的利用率(1分)
(2) (2分,合理即可)
(2分)
(3) (1分,合理即可) 、 (2分)
(4) (2分) (2分)
(5)提供氧气支持燃烧(1分)
【解析】(1) 中 为+2价, 为+3价;
(2)根据信息可知“焙烧”时, 和 分别发生反应的化学方程式为
、
;
(3)水浸取时溶液中产生 、 、 , 不与纯碱反应,故以浸渣的形式除去,而通
后 转化为 , 、 均以沉淀[即 、 ]的形式除去;(4)“中和、酸化”过程中生成 的离子方程式为 ,
“还原1”中发生反应的化学方程式为 ,还原剂和
还原产物的物质的量之比为 ;
(5) 在高温条件下分解产生氧气可以供氧并支持燃烧。