文档内容
秘密★启用前
嘉陵一中高 2023 级高二下期期中考试
化学试卷
注意事项:
1. 答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2. 回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干
净后,再选涂其它答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
3. 考试结束后,将答题卡交回。
考试时间:75分钟 满分:100分
可能用到的相对原子质量:C-12 O-16 Ti-48 Fe-56
一、选择题:(本题共14 小题,每小题 3 分,共 42分。每小题给出的四个选项中,只有一项是符合
题目要求的。)
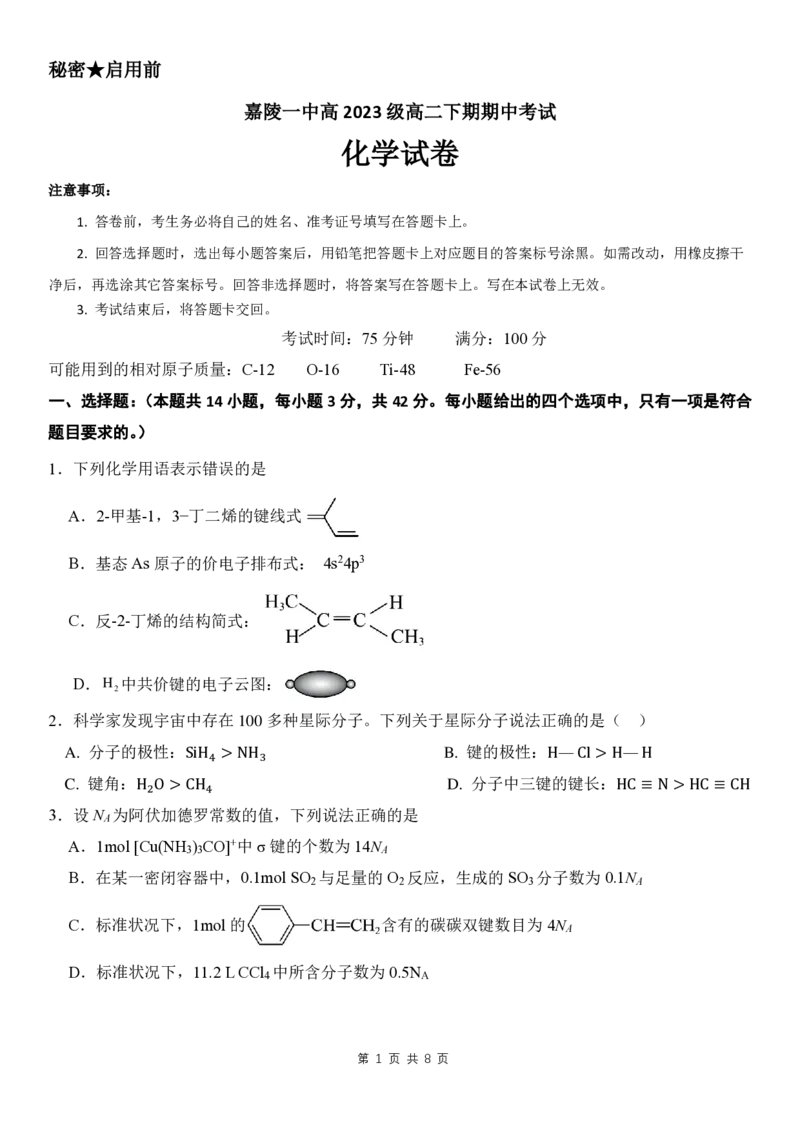
1.下列化学用语表示错误的是
A.2-甲基-1,3−丁二烯的键线式
B.基态As 原子的价电子排布式: 4s24p3
C.反-2-丁烯的结构简式:
D.H 中共价键的电子云图:
2
2.科学家发现宇宙中存在 100多种星际分子。下列关于星际分子说法正确的是( )
A. 分子的极性:SiH > NH B. 键的极性:H—Cl > H—H
4 3
C. 键角:H O > CH D. 分子中三键的键长:HC ≡ N > HC ≡ CH
2 4
3.设 N 为阿伏加德罗常数的值,下列说法正确的是
A
A.1mol [Cu(NH ) CO]+中σ 键的个数为14N
3 3 A
B.在某一密闭容器中,0.1mol SO 与足量的O 反应,生成的SO 分子数为 0.1N
2 2 3 A
C.标准状况下,1mol的 含有的碳碳双键数目为 4N
A
D.标准状况下,11.2 L CCl 中所含分子数为0.5N
4 A
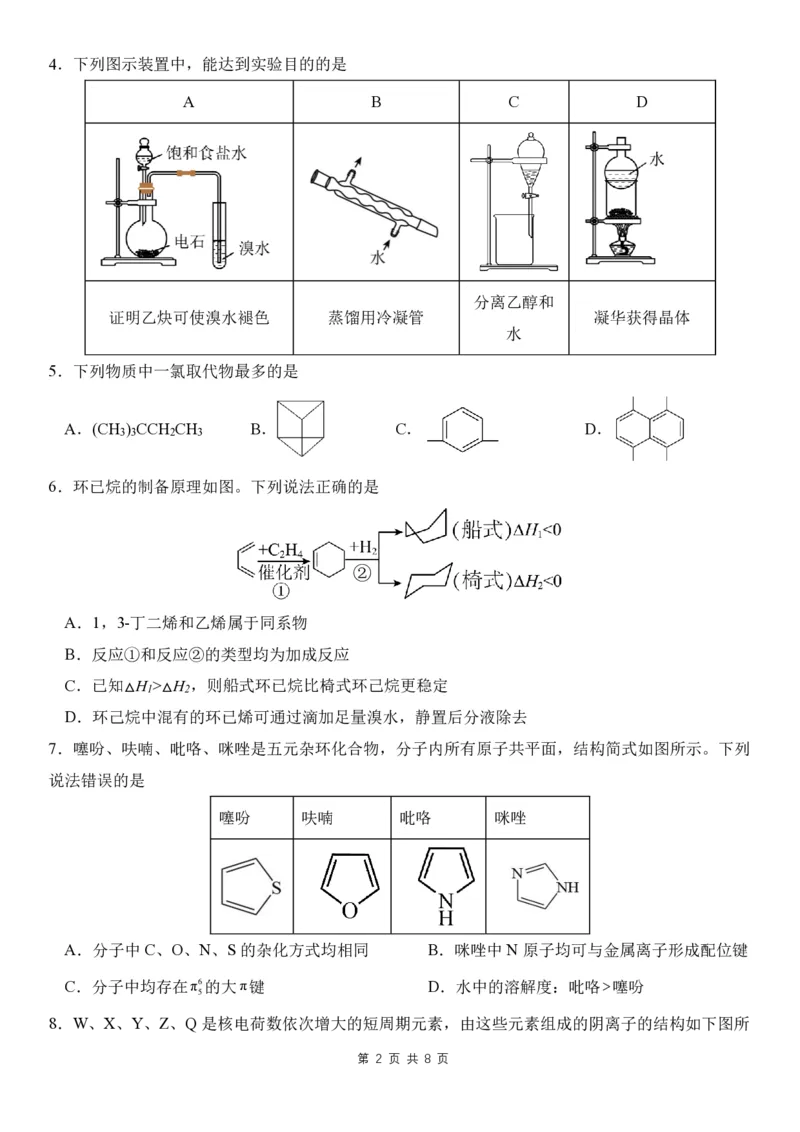
第 1 页 共 8 页4.下列图示装置中,能达到实验目的的是
A B C D
分离乙醇和
证明乙炔可使溴水褪色 蒸馏用冷凝管 凝华获得晶体
水
5.下列物质中一氯取代物最多的是
A.(CH ) CCH CH B. C. D.
3 3 2 3
6.环已烷的制备原理如图。下列说法正确的是
②
A.1,3-丁二烯和乙烯属于同系物
B.反应①和反应②的类型均为加成反应
C.已知△H >△H ,则船式环已烷比椅式环己烷更稳定
1 2
D.环己烷中混有的环已烯可通过滴加足量溴水,静置后分液除去
7.噻吩、呋喃、吡咯、咪唑是五元杂环化合物,分子内所有原子共平面,结构简式如图所示。下列
说法错误的是
噻吩 呋喃 吡咯 咪唑
A.分子中C、O、N、S 的杂化方式均相同 B.咪唑中N原子均可与金属离子形成配位键
C.分子中均存在π6的大π键 D.水中的溶解度:吡咯噻吩
5
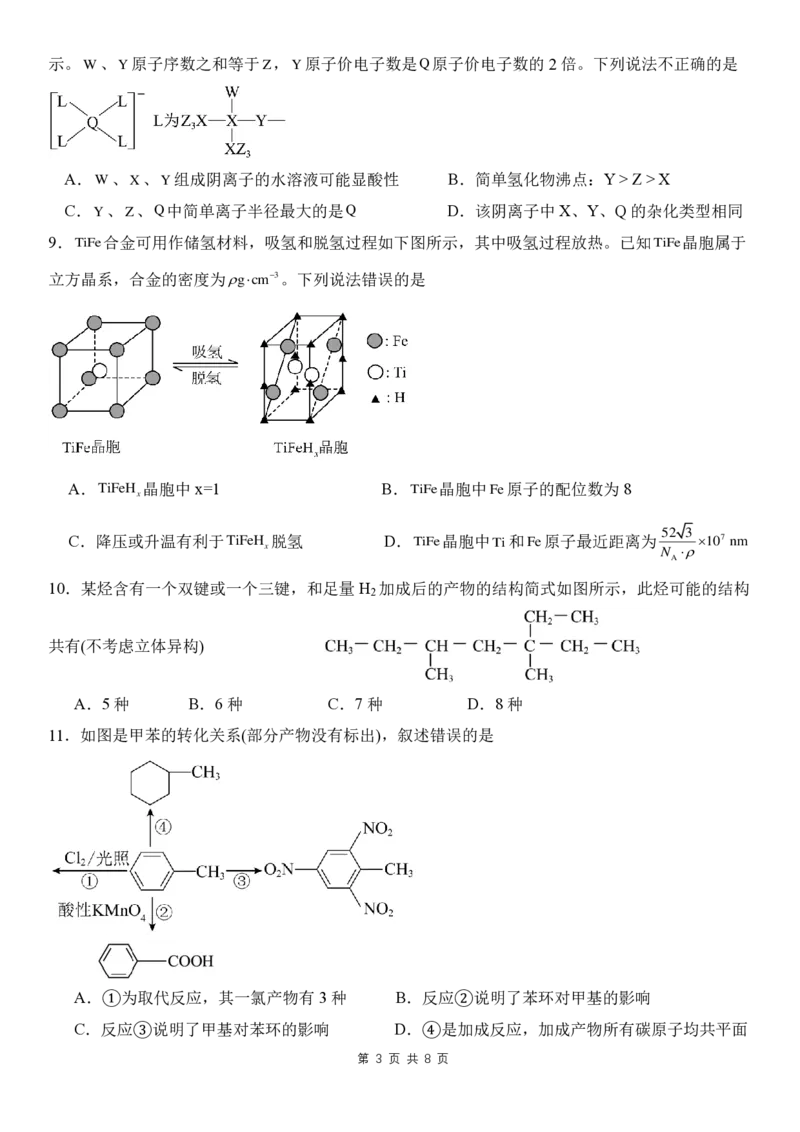
8.W、X、Y、Z、Q 是核电荷数依次增大的短周期元素,由这些元素组成的阴离子的结构如下图所
第 2 页 共 8 页示。
第 3 页 共 8 页
W 、 Y 原子序数之和等于Z,Y原子价电子数是 Q 原子价电子数的2 倍。下列说法不正确的是
A. W 、X、 Y 组成阴离子的水溶液可能显酸性 B.简单氢化物沸点:Y > Z > X
C.Y、 Z 、 Q 中简单离子半径最大的是 Q D.该阴离子中 X、Y、Q的杂化类型相同
9. T iF e 合金可用作储氢材料,吸氢和脱氢过程如下图所示,其中吸氢过程放热。已知 T iF e 晶胞属于
立方晶系,合金的密度为 g c m 3 。下列说法错误的是
A. T iF e H
x
晶胞中x=1 B.TiFe晶胞中 F e 原子的配位数为 8
C.降压或升温有利于TiFeH 脱氢 D.
x
T iF e 晶胞中 T i 和Fe原子最近距离为
5
N
2
A
3
1 0 7 n m
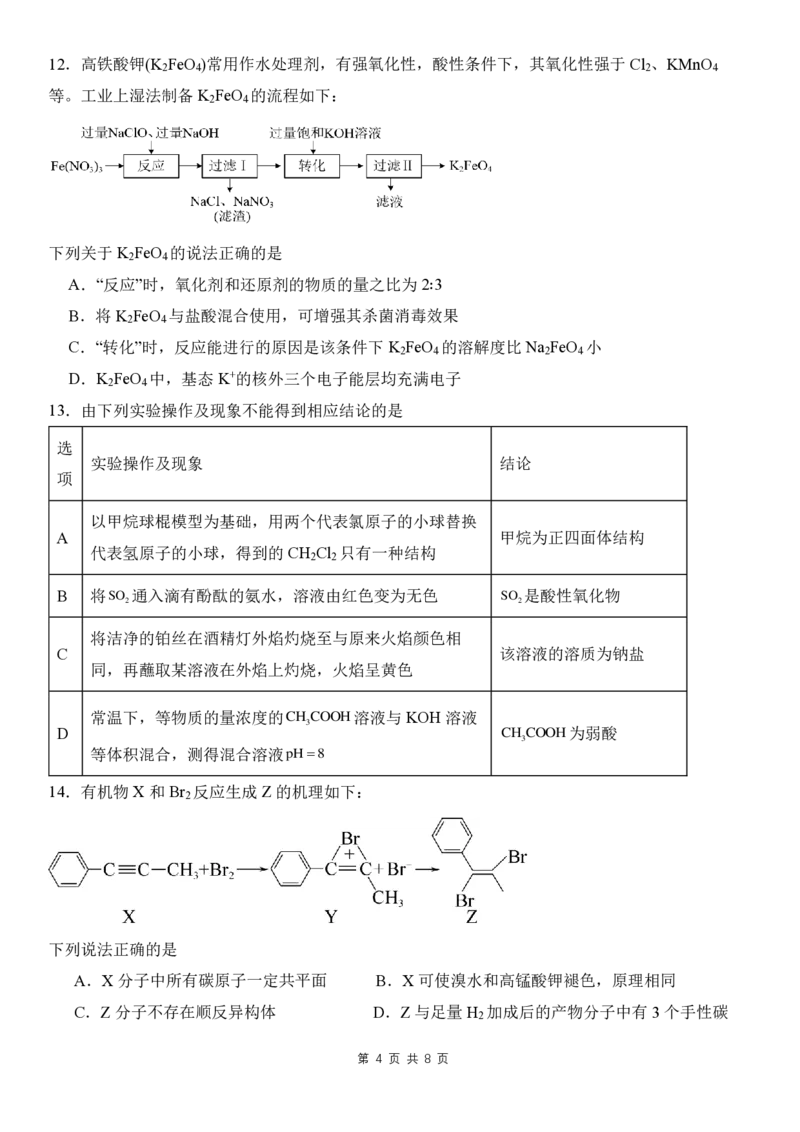
10.某烃含有一个双键或一个三键,和足量 H 加成后的产物的结构简式如图所示,此烃可能的结构
2
共有(不考虑立体异构)
A.5种 B.6种 C.7种 D.8种
11.如图是甲苯的转化关系(部分产物没有标出),叙述错误的是
A.①为取代反应,其一氯产物有3种 B.反应②说明了苯环对甲基的影响
C.反应③说明了甲基对苯环的影响 D.④是加成反应,加成产物所有碳原子均共平面12.高铁酸钾(K FeO )常用作水处理剂,有强氧化性,酸性条件下,其氧化性强于 Cl 、KMnO
2 4 2 4
等。工业上湿法制备 K FeO 的流程如下:
2 4
下列关于 K FeO 的说法正确的是
2 4
A.“反应”时,氧化剂和还原剂的物质的量之比为 2∶3
B.将K FeO 与盐酸混合使用,可增强其杀菌消毒效果
2 4
C.“转化”时,反应能进行的原因是该条件下 K FeO 的溶解度比Na FeO 小
2 4 2 4
D.K FeO 中,基态 K+的核外三个电子能层均充满电子
2 4
13.由下列实验操作及现象不能得到相应结论的是
选
实验操作及现象 结论
项
以甲烷球棍模型为基础,用两个代表氯原子的小球替换
A 甲烷为正四面体结构
代表氢原子的小球,得到的CH Cl 只有一种结构
2 2
B 将
第 4 页 共 8 页
S O
2
通入滴有酚酞的氨水,溶液由红色变为无色 SO 是酸性氧化物
2
将洁净的铂丝在酒精灯外焰灼烧至与原来火焰颜色相
C 该溶液的溶质为钠盐
同,再蘸取某溶液在外焰上灼烧,火焰呈黄色
常温下,等物质的量浓度的
D
C H
3
C O O H 溶液与 KOH溶液
等体积混合,测得混合溶液pH8
C H
3
C O O H 为弱酸
14.有机物 X和Br 反应生成 Z的机理如下:
2
下列说法正确的是
A.X分子中所有碳原子一定共平面 B.X可使溴水和高锰酸钾褪色,原理相同
C.Z分子不存在顺反异构体 D.Z与足量H 加成后的产物分子中有 3个手性碳
2二、非选择题:(包括第 15-18题,共计 58分)
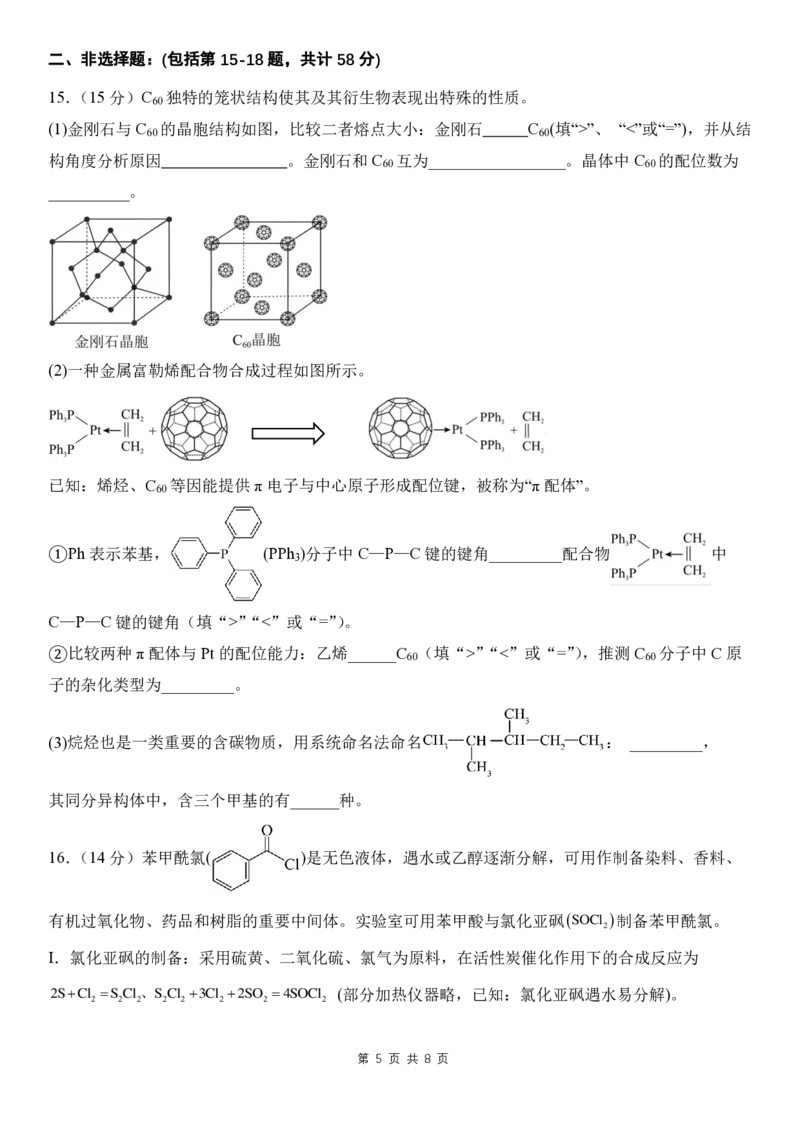
15.(15分)C 独特的笼状结构使其及其衍生物表现出特殊的性质。
60
(1)金刚石与 C 的晶胞结构如图,比较二者熔点大小:金刚石 C (填“>”、 “<”或“=”),并从结
60 60
构角度分析原因 。金刚石和C 互为_________________。晶体中C 的配位数为
60 60
__________。
(2)一种金属富勒烯配合物合成过程如图所示。
已知:烯烃、C 等因能提供 π电子与中心原子形成配位键,被称为“π配体”。
60
①Ph 表示苯基, (PPh )分子中C—P—C 键的键角_________配合物 中
3
C—P—C 键的键角(填“>”“<”或“=”)。
②比较两种 π配体与Pt 的配位能力:乙烯______C (填“>”“<”或“=”),推测C 分子中C 原
60 60
子的杂化类型为_________。
(3)烷烃也是一类重要的含碳物质,用系统命名法命名 : _________,
其同分异构体中,含三个甲基的有______种。
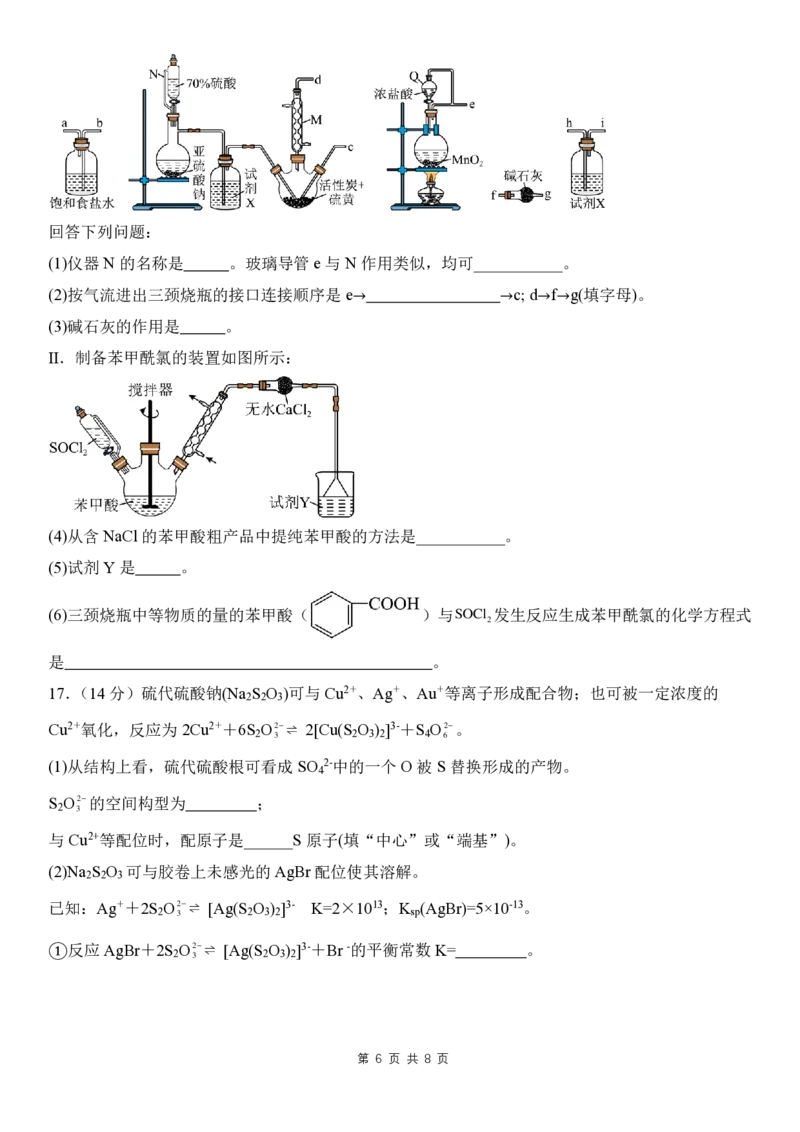
16.(14分)苯甲酰氯( )是无色液体,遇水或乙醇逐渐分解,可用作制备染料、香料、
有机过氧化物、药品和树脂的重要中间体。实验室可用苯甲酸与氯化亚砜
第 5 页 共 8 页
S O C l
2
制备苯甲酰氯。
I.氯化亚砜的制备:采用硫黄、二氧化硫、氯气为原料,在活性炭催化作用下的合成反应为
2SCl S Cl、S Cl 3Cl 2SO 4SOCl (部分加热仪器略,已知:氯化亚砜遇水易分解)。
2 2 2 2 2 2 2 2回答下列问题:
(1)仪器 N的名称是 。玻璃导管e与N 作用类似,均可___________。
(2)按气流进出三颈烧瓶的接口连接顺序是 e→ →c; d→f→g(填字母)。
(3)碱石灰的作用是 。
II.制备苯甲酰氯的装置如图所示:
(4)从含 NaCl 的苯甲酸粗产品中提纯苯甲酸的方法是___________。
(5)试剂 Y是 。
(6)三颈烧瓶中等物质的量的苯甲酸( )与
第 6 页 共 8 页
S O C l
2
发生反应生成苯甲酰氯的化学方程式
是 。
17.(14分)硫代硫酸钠(Na S O )可与Cu2+、Ag+、Au+等离子形成配合物;也可被一定浓度的
2 2 3
Cu2+氧化,反应为2Cu2++6S O2⇌ 2[Cu(S O ) ]3-+S O2。
2 3 2 3 2 4 6
(1)从结构上看,硫代硫酸根可看成 SO 2-中的一个 O被S 替换形成的产物。
4
S O2的空间构型为 ;
2 3
与Cu2+等配位时,配原子是______S 原子(填“中心”或“端基”)。
(2)Na S O 可与胶卷上未感光的 AgBr配位使其溶解。
2 2 3
已知:Ag++2S O
2
23 ⇌ [Ag(S O ) ]3- K=2×1013;K (AgBr)=5×10-13。
2 3 2 sp
①反应 AgBr+2S O2⇌ [Ag(S O ) ]3-+Br -的平衡常数 K= 。
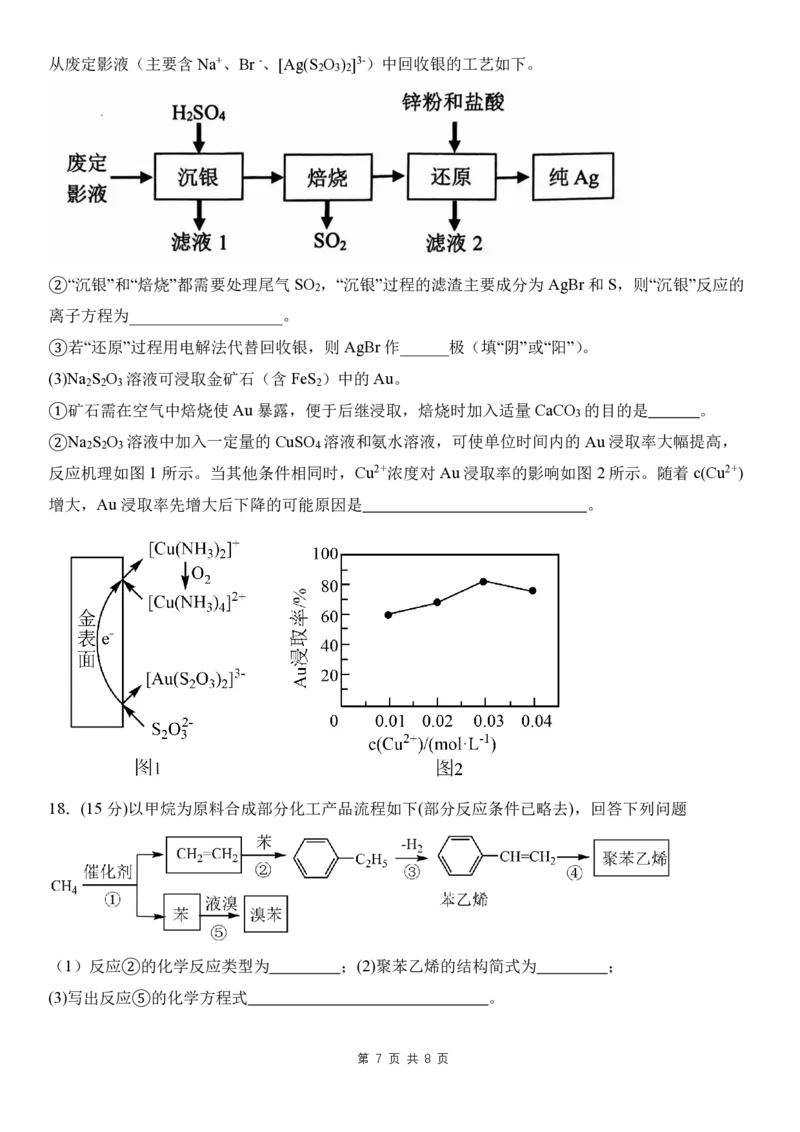
2 3 2 3 2从废定影液(主要含 Na+、Br -、[Ag(S O ) ]3-)中回收银的工艺如下。
2 3 2
②“沉银”和“焙烧”都需要处理尾气 SO ,“沉银”过程的滤渣主要成分为 AgBr和S,则“沉银”反应的
2
离子方程为___________________。
③若“还原”过程用电解法代替回收银,则AgBr作______极(填“阴”或“阳”)。
(3)Na S O 溶液可浸取金矿石(含FeS )中的Au。
2 2 3 2
①矿石需在空气中焙烧使 Au 暴露,便于后继浸取,焙烧时加入适量CaCO 的目的是 。
3
②Na S O 溶液中加入一定量的 CuSO 溶液和氨水溶液,可使单位时间内的 Au浸取率大幅提高,
2 2 3 4
反应机理如图 1所示。当其他条件相同时,Cu2+浓度对 Au浸取率的影响如图 2所示。随着c(Cu2+)
增大,Au浸取率先增大后下降的可能原因是 。
18.(15分)以甲烷为原料合成部分化工产品流程如下(部分反应条件已略去),回答下列问题
(1)反应②的化学反应类型为 ;(2)聚苯乙烯的结构简式为 ;
(3)写出反应⑤的化学方程式 。
第 7 页 共 8 页(4)已知:R -C≡C-R
1 2
第 8 页 共 8 页
一 H定 O2条
件
(R 、R 均可以为烃基
1 2
或H原子)。M 相对分子质量为 102,碳的质量分数约为 94.1%,则M 的分子式为_________。
一定条件下 M 与氢气反应可得到苯乙烯, 则M 与 H O在一定条件下反应最终生成 或
2
(填结构简式)。
(5)已知① R N O
2
F e H
C
l R N H
2
②
③苯环上原有的取代基对新导入苯环上的取代基的位置有一定的影响:
邻对位定位基主要使新导入的取代基进入苯环的邻位和对位,如 O H 、CH (或烃基)、
3
C l 等;
间位定位基主要使新导入的取代基进入苯环的间位,如 N O
2
、 S O
3
H 等。
写出以苯和CH Cl 为原料合成 的路线流程图(无机试剂任用,合成路线流程图即由原料
3
指向主要有机产物,在箭头上标明所加试剂及反应条件,无需配平,示例见本题题干)
。