文档内容
2024 年湖北云学部分重点高中高二年级 12 月联考
化学试卷
命题学校:沙市中学 命题人:高二化学组 审题人:黄石市教科院杨彩云
考试时间:2024年12月17日14:30-17:05 时长:75分钟 满分:100分
可能用到的相对原子质量:O16 S32
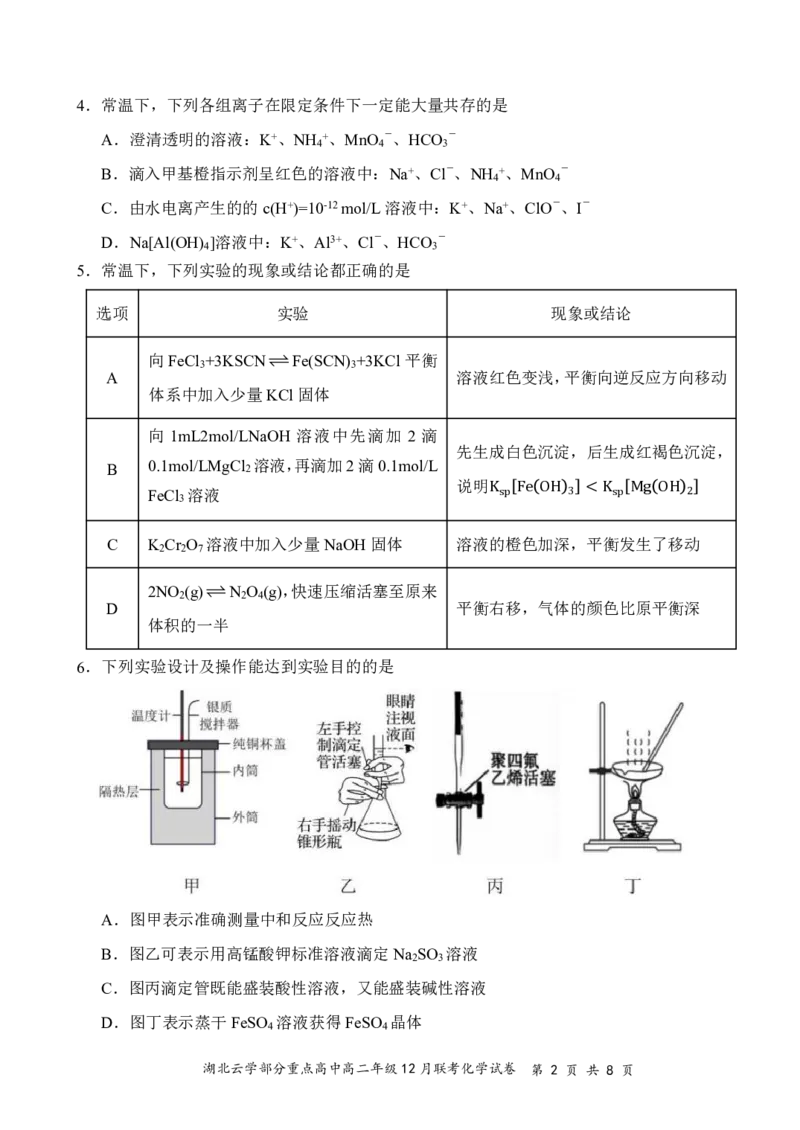
一、选择题:本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一
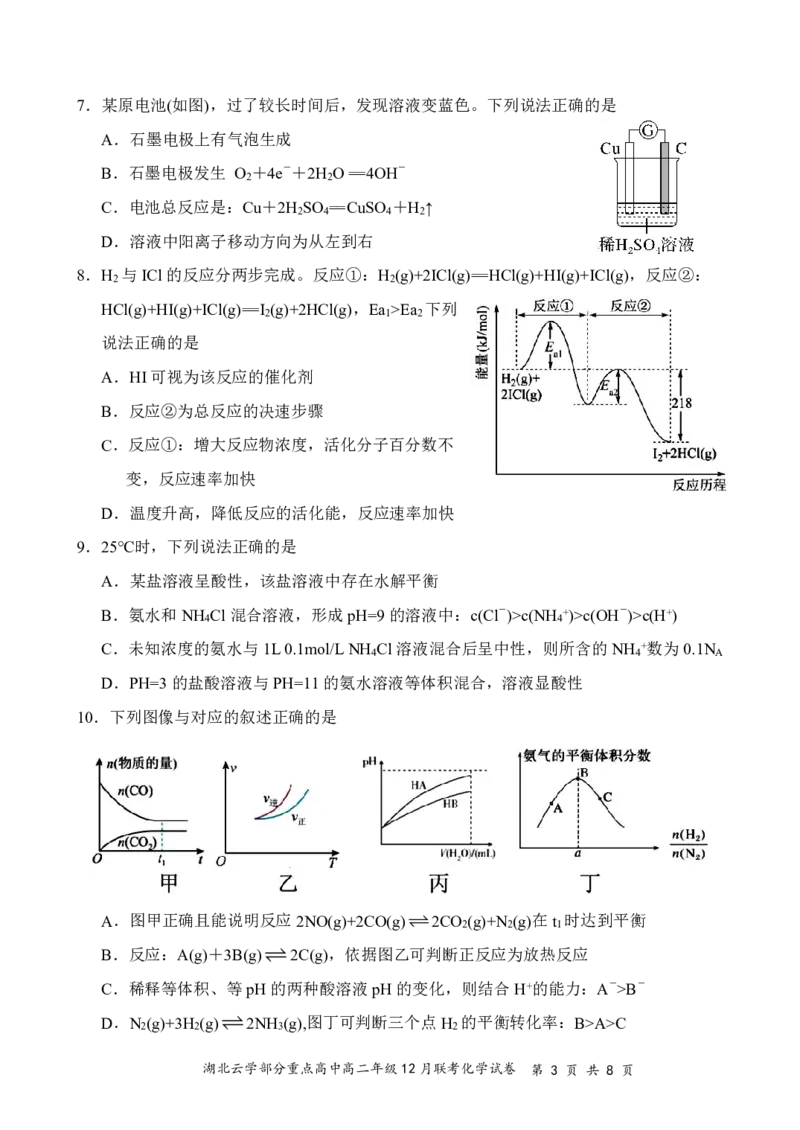
项是符合题目要求的。
1.化学与生产、生活密切相关,下列说法正确的是
A.氯碱工业中使用阴离子交换膜
B.海水中钢闸门主要是发生吸氧腐蚀,其正极反应式为O +4e-+4H+==2H O
2 2
C.在钢铁表面进行发蓝处理,生成四氧化三铁薄膜保护金属
D.在铁制品表面镀锡,镀层有损坏后,仍可对铁制品起到保护作用
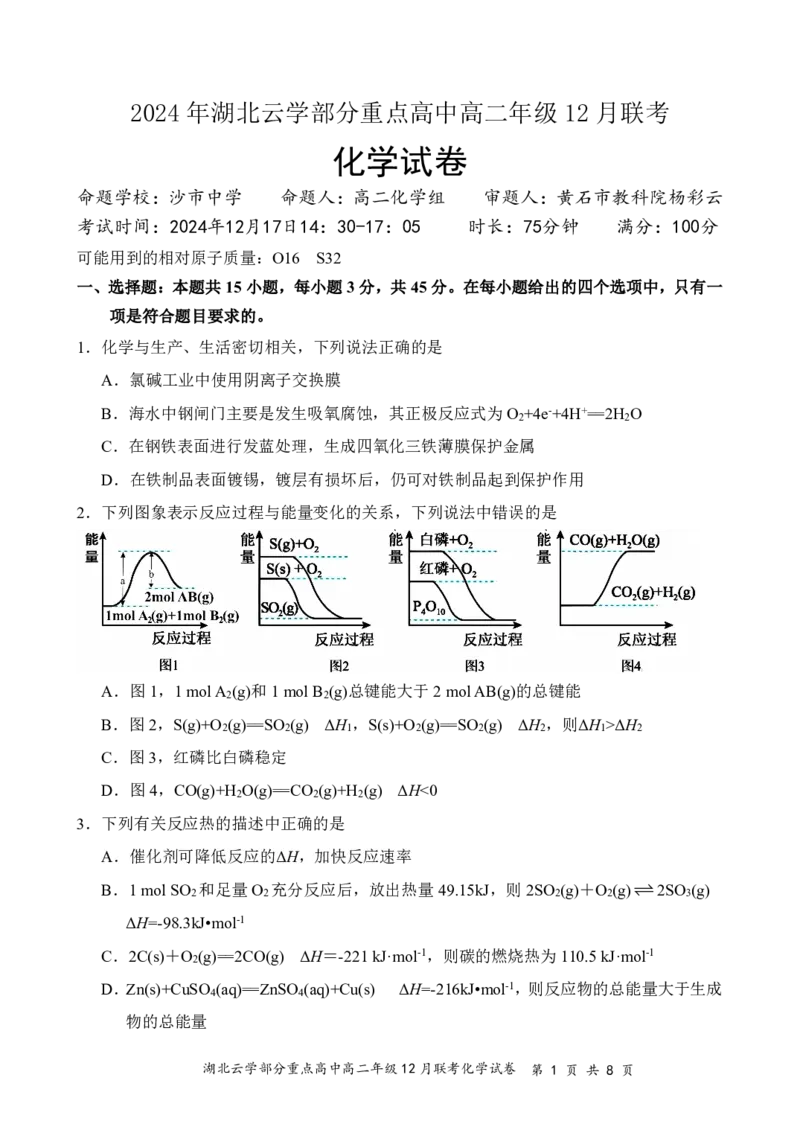
2.下列图象表示反应过程与能量变化的关系,下列说法中错误的是
A.图1,1molA (g)和1molB (g)总键能大于2molAB(g)的总键能
2 2
B.图2,S(g)+O (g)==SO (g) ΔH ,S(s)+O (g)==SO (g) ΔH ,则ΔH >ΔH
2 2 1 2 2 2 1 2
C.图3,红磷比白磷稳定
D.图4,CO(g)+H O(g)==CO (g)+H (g) ΔH<0
2 2 2
3.下列有关反应热的描述中正确的是
A.催化剂可降低反应的ΔH,加快反应速率
B.1molSO 和足量O 充分反应后,放出热量49.15kJ,则2SO (g)+O (g)2SO (g)
2 2 2 2 3
ΔH=-98.3kJ•mol-1
C.2C(s)+O (g)==2CO(g) ΔH=-221kJ·mol-1,则碳的燃烧热为110.5kJ·mol-1
2
D.Zn(s)+CuSO (aq)==ZnSO (aq)+Cu(s) ΔH=-216kJ•mol-1,则反应物的总能量大于生成
4 4
物的总能量
湖北云学部分重点高中高二年级12月联考化学试卷 第 1 页 共 8 页
{#{QQABAQYEogAgABBAABhCEwUQCAEQkgAAAYgOgAAMIAABSQFABAA=}#}4.常温下,下列各组离子在限定条件下一定能大量共存的是
A.澄清透明的溶液:K+、NH +、MnO -、HCO -
4 4 3
B.滴入甲基橙指示剂呈红色的溶液中:Na+、Cl-、NH +、MnO -
4 4
C.由水电离产生的的c(H+)=10-12mol/L溶液中:K+、Na+、ClO-、I-
D.Na[Al(OH) ]溶液中:K+、Al3+、Cl-、HCO -
4 3
5.常温下,下列实验的现象或结论都正确的是
选项 实验 现象或结论
向FeCl +3KSCNFe(SCN) +3KCl平衡
3 3
A 溶液红色变浅,平衡向逆反应方向移动
体系中加入少量KCl固体
向 1mL2mol/LNaOH 溶液中先滴加 2 滴
先生成白色沉淀,后生成红褐色沉淀,
B 0.1mol/LMgCl 2 溶液,再滴加2滴0.1mol/L
说明
FeCl 溶液
3
Ksp Fe OH 3 Ea 下列
2 1 2
说法正确的是
A.HI可视为该反应的催化剂
B.反应②为总反应的决速步骤
C.反应①:增大反应物浓度,活化分子百分数不
变,反应速率加快
D.温度升高,降低反应的活化能,反应速率加快
9.25℃时,下列说法正确的是
A.某盐溶液呈酸性,该盐溶液中存在水解平衡
B.氨水和NH Cl混合溶液,形成pH=9的溶液中:c(Cl-)>c(NH +)>c(OH-)>c(H+)
4 4
C.未知浓度的氨水与1L0.1mol/LNH Cl溶液混合后呈中性,则所含的NH +数为0.1N
4 4 A
D.PH=3的盐酸溶液与PH=11的氨水溶液等体积混合,溶液显酸性
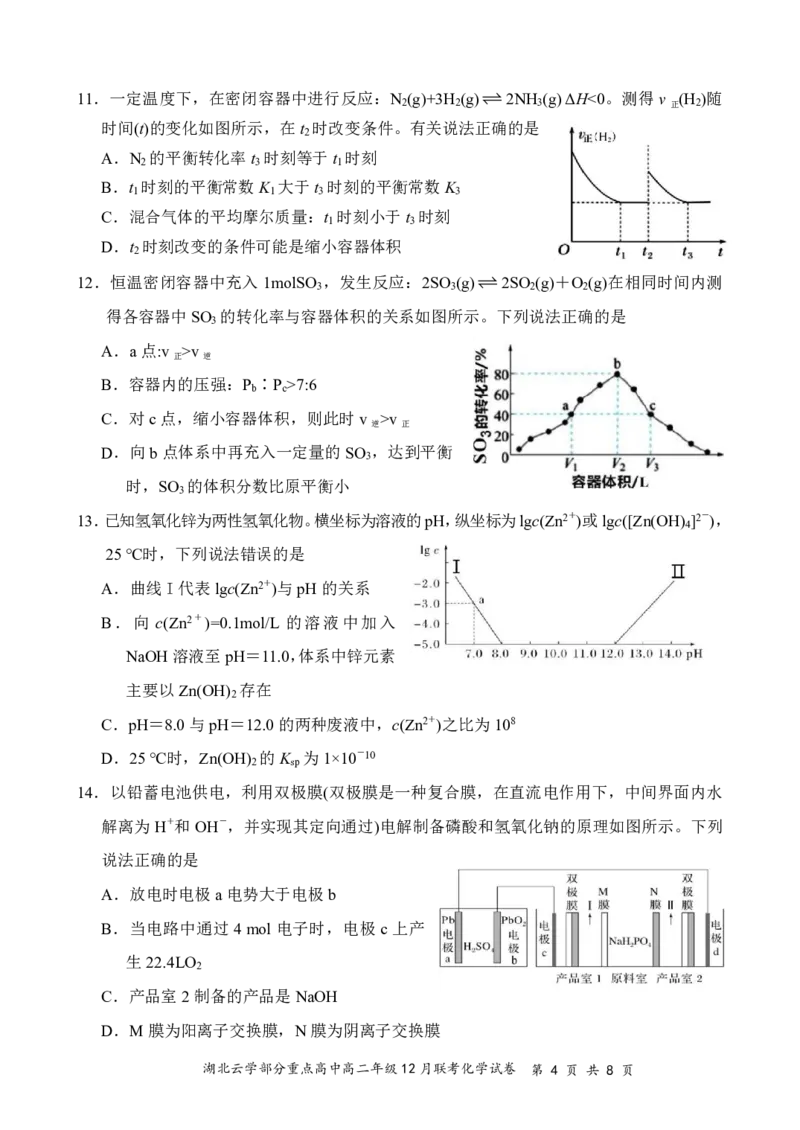
10.下列图像与对应的叙述正确的是
A.图甲正确且能说明反应2NO(g)+2CO(g)2CO (g)+N (g)在t 时达到平衡
2 2 1
B.反应:A(g)+3B(g)2C(g),依据图乙可判断正反应为放热反应
C.稀释等体积、等pH的两种酸溶液pH的变化,则结合H+的能力:A->B-
D.N (g)+3H (g)2NH (g),图丁可判断三个点H 的平衡转化率:B>A>C
2 2 3 2
湖北云学部分重点高中高二年级12月联考化学试卷 第 3 页 共 8 页
{#{QQABAQYEogAgABBAABhCEwUQCAEQkgAAAYgOgAAMIAABSQFABAA=}#}11.一定温度下,在密闭容器中进行反应:N (g)+3H (g)2NH (g)ΔH<0。测得v (H )随
2 2 3 正 2
时间(t)的变化如图所示,在t 时改变条件。有关说法正确的是
2
A.N 的平衡转化率t 时刻等于t 时刻
2 3 1
B.t 时刻的平衡常数K 大于t 时刻的平衡常数K
1 1 3 3
C.混合气体的平均摩尔质量:t 时刻小于t 时刻
1 3
D.t 时刻改变的条件可能是缩小容器体积
2
12.恒温密闭容器中充入1molSO ,发生反应:2SO (g)2SO (g)+O (g)在相同时间内测
3 3 2 2
得各容器中SO 的转化率与容器体积的关系如图所示。下列说法正确的是
3
A.a点:v >v
正 逆
B.容器内的压强:P ∶P >7:6
b c
C.对c点,缩小容器体积,则此时v >v
逆 正
D.向b点体系中再充入一定量的SO ,达到平衡
3
时,SO 的体积分数比原平衡小
3
13.已知氢氧化锌为两性氢氧化物。横坐标为溶液的pH,纵坐标为lgc(Zn2+)或lgc([Zn(OH) ]2-),
4
25℃时,下列说法错误的是
A.曲线I代表lgc(Zn2+)与pH的关系
B.向 c(Zn2+)=0.1mol/L 的溶液中加入
NaOH溶液至pH=11.0,体系中锌元素
主要以Zn(OH) 存在
2
C.pH=8.0与pH=12.0的两种废液中,c(Zn2+)之比为108
D.25℃时,Zn(OH) 的K 为1×10-10
2 sp
14.以铅蓄电池供电,利用双极膜(双极膜是一种复合膜,在直流电作用下,中间界面内水
解离为H+和OH-,并实现其定向通过)电解制备磷酸和氢氧化钠的原理如图所示。下列
说法正确的是
A.放电时电极a电势大于电极b
B.当电路中通过4mol电子时,电极c上产
生22.4LO
2
C.产品室2制备的产品是NaOH
D.M膜为阳离子交换膜,N膜为阴离子交换膜
湖北云学部分重点高中高二年级12月联考化学试卷 第 4 页 共 8 页
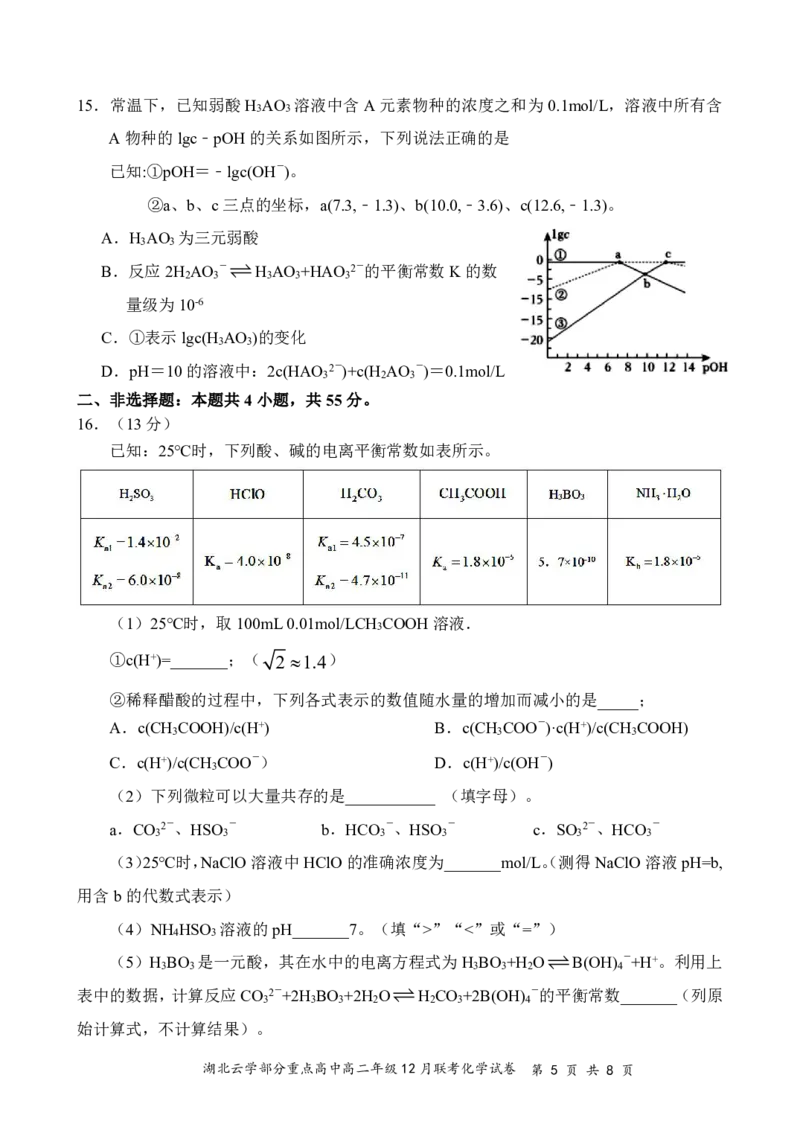
{#{QQABAQYEogAgABBAABhCEwUQCAEQkgAAAYgOgAAMIAABSQFABAA=}#}15.常温下,已知弱酸H AO 溶液中含A元素物种的浓度之和为0.1mol/L,溶液中所有含
3 3
A物种的lgc﹣pOH的关系如图所示,下列说法正确的是
已知:①pOH=﹣lgc(OH-)。
②a、b、c三点的坐标,a(7.3,﹣1.3)、b(10.0,﹣3.6)、c(12.6,﹣1.3)。
A.H AO 为三元弱酸
3 3
B.反应2H AO -H AO +HAO 2-的平衡常数K的数
2 3 3 3 3
量级为10-6
C.①表示lgc(H AO )的变化
3 3
D.pH=10的溶液中:2c(HAO 2-)+c(H AO -)=0.1mol/L
3 2 3
二、非选择题:本题共4小题,共55分。
16.(13分)
已知:25℃时,下列酸、碱的电离平衡常数如表所示。
(1)25℃时,取100mL0.01mol/LCH COOH溶液.
3
①c(H+)=_______;( 2 1.4)
②稀释醋酸的过程中,下列各式表示的数值随水量的增加而减小的是_____;
A.c(CH COOH)/c(H+) B.c(CH COO-)·c(H+)/c(CH COOH)
3 3 3
C.c(H+)/c(CH COO-) D.c(H+)/c(OH-)
3
(2)下列微粒可以大量共存的是___________ (填字母)。
a.CO 2-、HSO - b.HCO -、HSO - c.SO 2-、HCO -
3 3 3 3 3 3
(3)25℃时,NaClO溶液中HClO的准确浓度为_______mol/L。(测得NaClO溶液pH=b,
用含b的代数式表示)
(4)NH HSO 溶液的pH_______7。(填“>”“<”或“=”)
4 3
(5)H BO 是一元酸,其在水中的电离方程式为H BO +H OB(OH) -+H+。利用上
3 3 3 3 2 4
表中的数据,计算反应CO 2-+2H BO +2H OH CO +2B(OH) -的平衡常数_______(列原
3 3 3 2 2 3 4
始计算式,不计算结果)。
湖北云学部分重点高中高二年级12月联考化学试卷 第 5 页 共 8 页
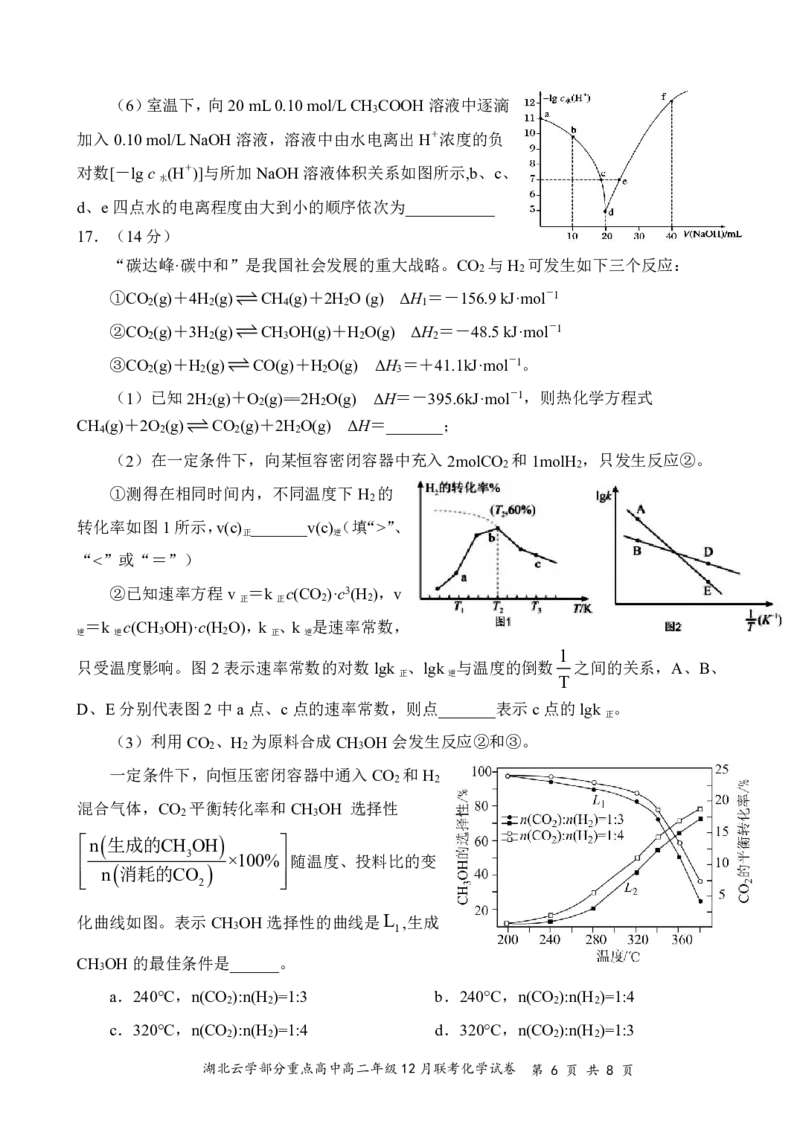
{#{QQABAQYEogAgABBAABhCEwUQCAEQkgAAAYgOgAAMIAABSQFABAA=}#}(6)室温下,向20mL0.10mol/LCH COOH溶液中逐滴
3
加入0.10mol/LNaOH溶液,溶液中由水电离出H+浓度的负
对数[-lgc (H+)]与所加NaOH溶液体积关系如图所示,b、c、
水
d、e四点水的电离程度由大到小的顺序依次为___________
17.(14分)
“碳达峰·碳中和”是我国社会发展的重大战略。CO 与H 可发生如下三个反应:
2 2
①CO (g)+4H (g)CH (g)+2H O(g) ΔH =-156.9kJ·mol-1
2 2 4 2 1
②CO (g)+3H (g)CH OH(g)+H O(g) ΔH =-48.5kJ·mol-1
2 2 3 2 2
③CO (g)+H (g)CO(g)+H O(g) ΔH =+41.1kJ·mol-1。
2 2 2 3
(1)已知2H (g)+O (g)==2H O(g) ΔH=-395.6kJ·mol-1,则热化学方程式
2 2 2
CH (g)+2O (g)CO (g)+2H O(g) ΔH=_______;
4 2 2 2
(2)在一定条件下,向某恒容密闭容器中充入2molCO 和1molH ,只发生反应②。
2 2
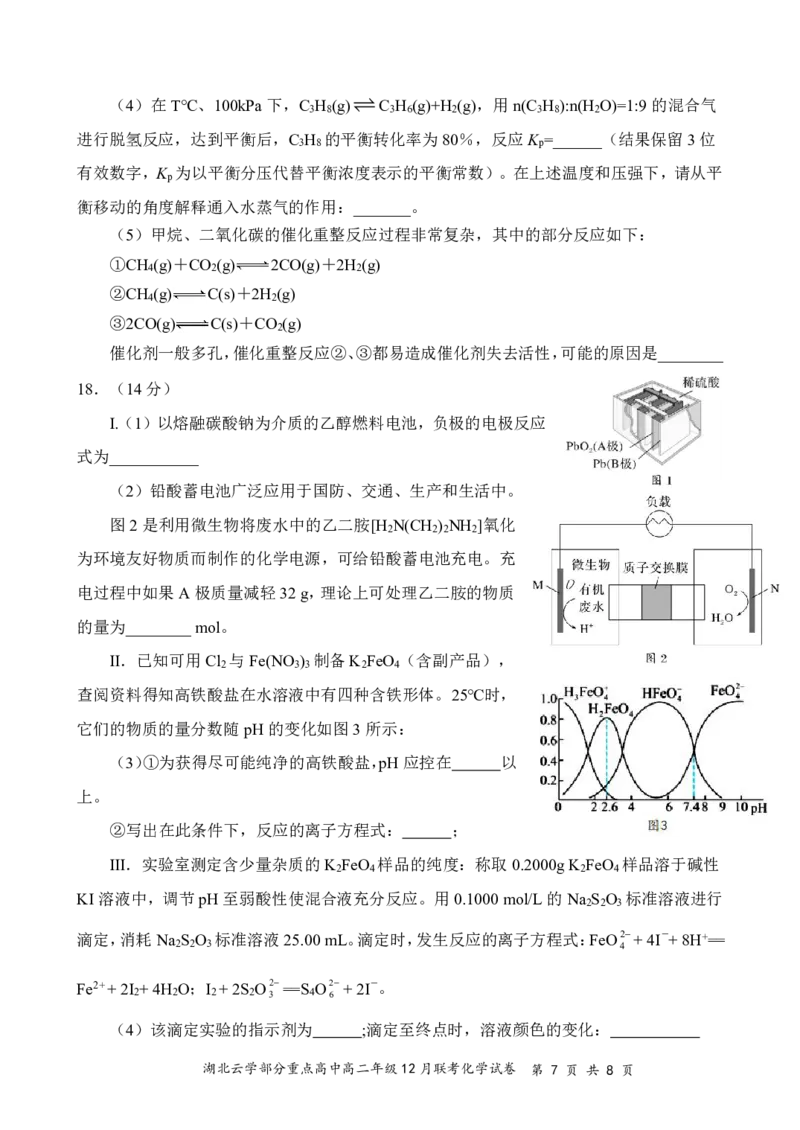
①测得在相同时间内,不同温度下H 的
2
转化率如图1所示,v(c) _______v(c)(填“>”、
正 逆
“<”或“=”)
②已知速率方程v =k c(CO )·c3(H ),v
正 正 2 2
=k c(CH OH)·c(H O),k 、k 是速率常数,
逆 逆 3 2 正 逆
1
只受温度影响。图2表示速率常数的对数lgk 、lgk 与温度的倒数 之间的关系,A、B、
正 逆
T
D、E分别代表图2中a点、c点的速率常数,则点_______表示c点的lgk 。
正
(3)利用CO 、H 为原料合成CH OH会发生反应②和③。
2 2 3
一定条件下,向恒压密闭容器中通入CO 和H
2 2
混合气体,CO 平衡转化率和CH OH 选择性
2 3
n 生成的CH OH
3 ×100%随温度、投料比的变
n
消耗的CO
2
化曲线如图。表示CH OH选择性的曲线是L ,生成
3 1
CH OH的最佳条件是______。
3
a.240°C,n(CO ):n(H )=1:3 b.240°C,n(CO ):n(H )=1:4
2 2 2 2
c.320°C,n(CO ):n(H )=1:4 d.320°C,n(CO ):n(H )=1:3
2 2 2 2
湖北云学部分重点高中高二年级12月联考化学试卷 第 6 页 共 8 页
{#{QQABAQYEogAgABBAABhCEwUQCAEQkgAAAYgOgAAMIAABSQFABAA=}#}(4)在T℃、100kPa下,C H (g)C H (g)+H (g),用n(C H ):n(H O)=1:9的混合气
3 8 3 6 2 3 8 2
进行脱氢反应,达到平衡后,C H 的平衡转化率为80%,反应K =______(结果保留3位
3 8 p
有效数字,K 为以平衡分压代替平衡浓度表示的平衡常数)。在上述温度和压强下,请从平
p
衡移动的角度解释通入水蒸气的作用:_______。
(5)甲烷、二氧化碳的催化重整反应过程非常复杂,其中的部分反应如下:
①CH (g)+CO (g) 2CO(g)+2H (g)
4 2 2
②CH (g) C(s)+2H (g)
4 2
③2CO(g) C(s)+CO (g)
2
催化剂一般多孔,催化重整反应②、③都易造成催化剂失去活性,可能的原因是________
18.(14分)
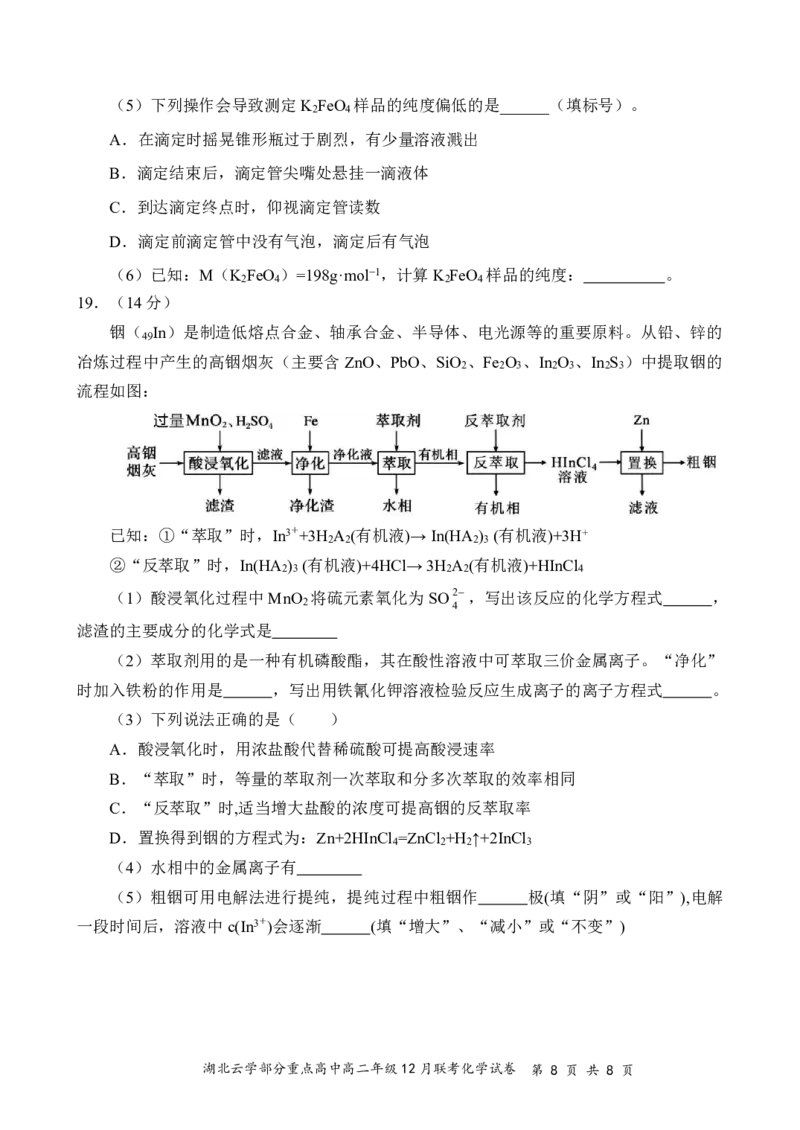
Ⅰ.(1)以熔融碳酸钠为介质的乙醇燃料电池,负极的电极反应
式为___________
(2)铅酸蓄电池广泛应用于国防、交通、生产和生活中。
图2是利用微生物将废水中的乙二胺[H N(CH ) NH ]氧化
2 2 2 2
为环境友好物质而制作的化学电源,可给铅酸蓄电池充电。充
电过程中如果A极质量减轻32g,理论上可处理乙二胺的物质
的量为________mol。
Ⅱ.已知可用Cl 与Fe(NO ) 制备K FeO (含副产品),
2 3 3 2 4
查阅资料得知高铁酸盐在水溶液中有四种含铁形体。25℃时,
它们的物质的量分数随pH的变化如图3所示:
(3)①为获得尽可能纯净的高铁酸盐,pH应控在 以
上。
②写出在此条件下,反应的离子方程式: ;
Ⅲ.实验室测定含少量杂质的K FeO 样品的纯度:称取0.2000gK FeO 样品溶于碱性
2 4 2 4
KI溶液中,调节pH至弱酸性使混合液充分反应。用0.1000mol/L的Na S O 标准溶液进行
2 2 3
滴定,消耗Na S O 标准溶液25.00mL。滴定时,发生反应的离子方程式:FeO2 +4I-+8H+==
2 2 3 4
Fe2++2I +4H O;I +2S O2==S O2+2I-。
2 2 2 2 3 4 6
(4)该滴定实验的指示剂为 ;滴定至终点时,溶液颜色的变化:
湖北云学部分重点高中高二年级12月联考化学试卷 第 7 页 共 8 页
{#{QQABAQYEogAgABBAABhCEwUQCAEQkgAAAYgOgAAMIAABSQFABAA=}#}(5)下列操作会导致测定K FeO 样品的纯度偏低的是______(填标号)。
2 4
A.在滴定时摇晃锥形瓶过于剧烈,有少量溶液溅出
B.滴定结束后,滴定管尖嘴处悬挂一滴液体
C.到达滴定终点时,仰视滴定管读数
D.滴定前滴定管中没有气泡,滴定后有气泡
(6)已知:M(K FeO )=198g·mol−1,计算K FeO 样品的纯度: 。
2 4 2 4
19.(14分)
铟( In)是制造低熔点合金、轴承合金、半导体、电光源等的重要原料。从铅、锌的
49
冶炼过程中产生的高铟烟灰(主要含ZnO、PbO、SiO 、Fe O 、In O 、In S )中提取铟的
2 2 3 2 3 2 3
流程如图:
已知:①“萃取”时,In3++3H A (有机液)→In(HA ) (有机液)+3H+
2 2 2 3
②“反萃取”时,In(HA ) (有机液)+4HCl→3H A (有机液)+HInCl
2 3 2 2 4
(1)酸浸氧化过程中MnO 将硫元素氧化为SO2,写出该反应的化学方程式 ,
2 4
滤渣的主要成分的化学式是
(2)萃取剂用的是一种有机磷酸酯,其在酸性溶液中可萃取三价金属离子。“净化”
时加入铁粉的作用是 ,写出用铁氰化钾溶液检验反应生成离子的离子方程式 。
(3)下列说法正确的是( )
A.酸浸氧化时,用浓盐酸代替稀硫酸可提高酸浸速率
B.“萃取”时,等量的萃取剂一次萃取和分多次萃取的效率相同
C.“反萃取”时,适当增大盐酸的浓度可提高铟的反萃取率
D.置换得到铟的方程式为:Zn+2HInCl =ZnCl +H ↑+2InCl
4 2 2 3
(4)水相中的金属离子有
(5)粗铟可用电解法进行提纯,提纯过程中粗铟作 极(填“阴”或“阳”),电解
一段时间后,溶液中c(In3+)会逐渐 (填“增大”、“减小”或“不变”)
湖北云学部分重点高中高二年级12月联考化学试卷 第 8 页 共 8 页
{#{QQABAQYEogAgABBAABhCEwUQCAEQkgAAAYgOgAAMIAABSQFABAA=}#}