文档内容
惠州中学2023级高二年级上学期期中考试 化学试卷
本试卷分第I卷和第II卷两部分,共100分。考试时间75分钟。
第I卷(选择题 共44分)
注意事项:
1、答卷前,考生务必将自己的姓名、考号等信息填写在答题纸上。
2、答案必须填写在答题纸的相应位置上,答案写在试题卷上无效。
相对原子质量:H:1 C:12 O:16 Ni:59
一、选择题 (本题共16小题,共44分。第1~10题,每小题2分;第11~16题,每小题4分。在每小题
给出的四个选项中,只有一项是符合题目要求的)
1.广东省博物馆馆藏集岭南文物之大成,汇聚诸多种类于一体,下列文物不含硅酸盐材料的是( )
A.南朝波斯鎏金 B.明万历款黄釉五彩双龙纹 C.清起降款青花船形 D.清康熙宜兴紫砂象
器 盘 碟 生瓜形壶
2.化学与生活密切相关,下列说法正确的是( )
A.日常生活中所用的花生油、牛油、石蜡油分子中均含有酯基
B.泡沫灭火器中所用硫酸铝、碳酸氢钠溶于水后,溶液均显酸性
C.用激光笔照射淀粉溶液、鸡蛋白溶液均能观察到丁达尔效应
D.计算机芯片、硅太阳能电池、光导纤维的主要材料均为高纯硅
3.能使反应 的反应速率增大,且平衡向正反应方向移动的是( )
A.及时分离出 气体 B.增大 的浓度 C.适当降低温度 D.选择高效催化剂
4.劳动创造美好生活,下列物质的应用与所述的化学知识无关联性的是( )
选项 生活实践或劳动项目 化学知识
A 实验老师用稀硝酸清洗做过银镜反应的试管 硝酸具有强氧化性
B 用“84”消毒液进行消毒 NaClO溶液显碱性
C 校医开紫外灯给教室消毒 紫外线可以使蛋白质变性
D 使用碳酸氢钠作食品膨松剂 碳酸氢钠在加热条件下分解产生CO
2
5. 为阿伏加德罗常数的值。下列叙述正确的是( )
A.在25℃时,1LpH为12的Ba(OH) 溶液中含有OH-数目为0.01N
2 A
B.0.1 L 0.5 mol·L-1乙醇溶液中含有的氧原子数为0.05N
AC.一定条件下,32 g SO 与足量O 反应,转移的电子数为N
2 2 A
D. 的 溶液中 的数目为
6.有关热化学方程式书写与对应表述均正确的是( )
A. ; ,则有
B.稀硫酸与 溶液反应:
C.在 下 的燃烧热为 ,则水分解的热化学方程式:
D.已知 的燃烧热为 ,则有:
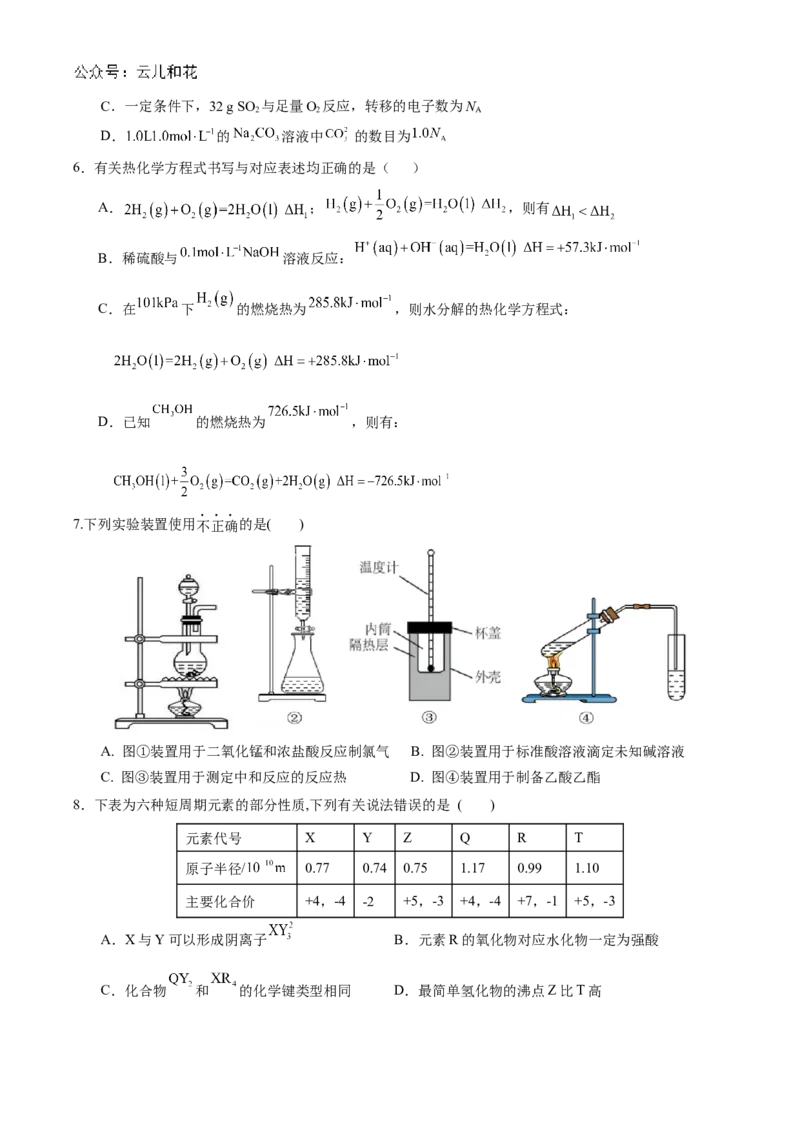
7.下列实验装置使用不正确的是( )
A. 图①装置用于二氧化锰和浓盐酸反应制氯气 B. 图②装置用于标准酸溶液滴定未知碱溶液
C. 图③装置用于测定中和反应的反应热 D. 图④装置用于制备乙酸乙酯
8.下表为六种短周期元素的部分性质,下列有关说法错误的是 ( )
元素代号 X Y Z Q R T
原子半径/ 0.77 0.74 0.75 1.17 0.99 1.10
主要化合价 +4,-4 -2 +5,-3 +4,-4 +7,-1 +5,-3
A.X与Y可以形成阴离子 B.元素R的氧化物对应水化物一定为强酸
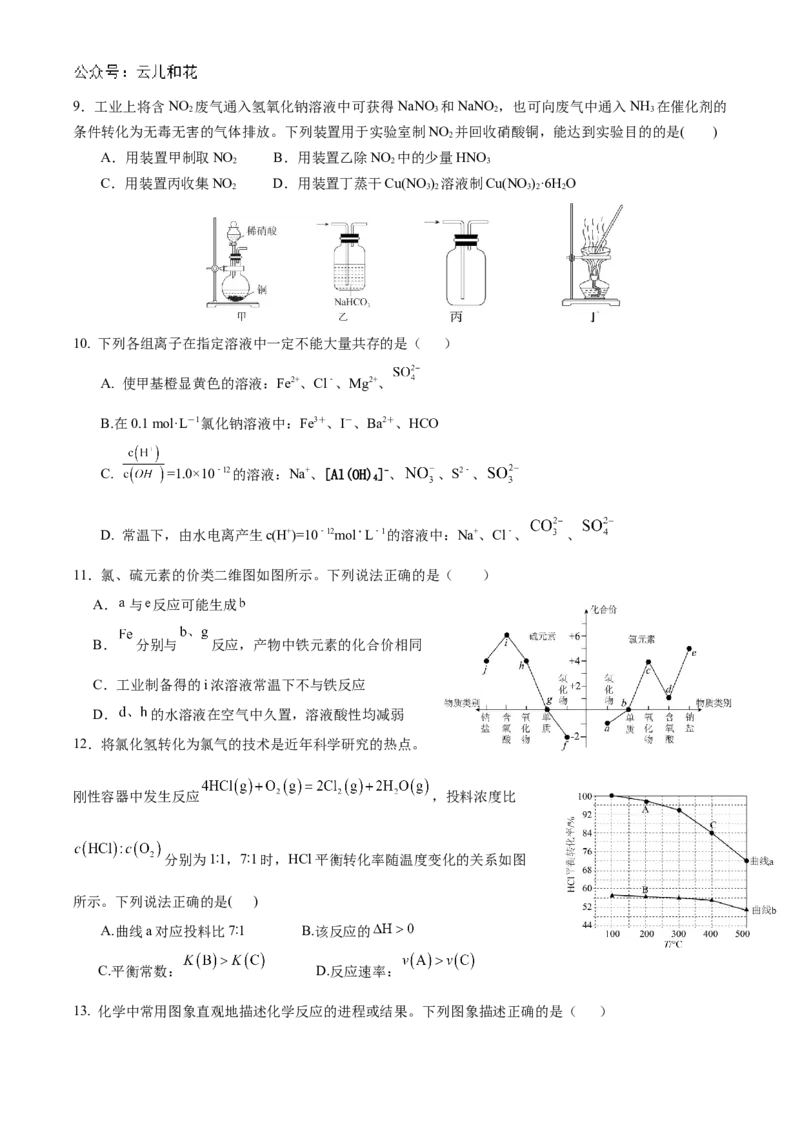
C.化合物 和 的化学键类型相同 D.最简单氢化物的沸点Z比T高9.工业上将含NO 废气通入氢氧化钠溶液中可获得NaNO 和NaNO ,也可向废气中通入NH 在催化剂的
2 3 2 3
条件转化为无毒无害的气体排放。下列装置用于实验室制NO 并回收硝酸铜,能达到实验目的的是( )
2
A.用装置甲制取NO B.用装置乙除NO 中的少量HNO
2 2 3
C.用装置丙收集NO D.用装置丁蒸干Cu(NO ) 溶液制Cu(NO )·6H O
2 3 2 3 2 2
10. 下列各组离子在指定溶液中一定不能大量共存的是( )
A. 使甲基橙显黄色的溶液:Fe2+、Cl﹣、Mg2+、
B.在0.1 mol·L-1氯化钠溶液中:Fe3+、I-、Ba2+、HCO
C. =1.0×10﹣12的溶液:Na+、[Al(OH)]-、 、S2﹣、
4
D. 常温下,由水电离产生c(H+)=10﹣12mol L﹣1的溶液中:Na+、Cl﹣、 、
11.氯、硫元素的价类二维图如图所示。下列说法正确的是( )
A. 与 反应可能生成
B. 分别与 反应,产物中铁元素的化合价相同
C.工业制备得的i浓溶液常温下不与铁反应
D. 的水溶液在空气中久置,溶液酸性均减弱
12.将氯化氢转化为氯气的技术是近年科学研究的热点。
刚性容器中发生反应 ,投料浓度比
分别为1∶1,7∶1时,HCl平衡转化率随温度变化的关系如图
所示。下列说法正确的是( )
A.曲线a对应投料比7∶1 B.该反应的
C.平衡常数: D.反应速率:
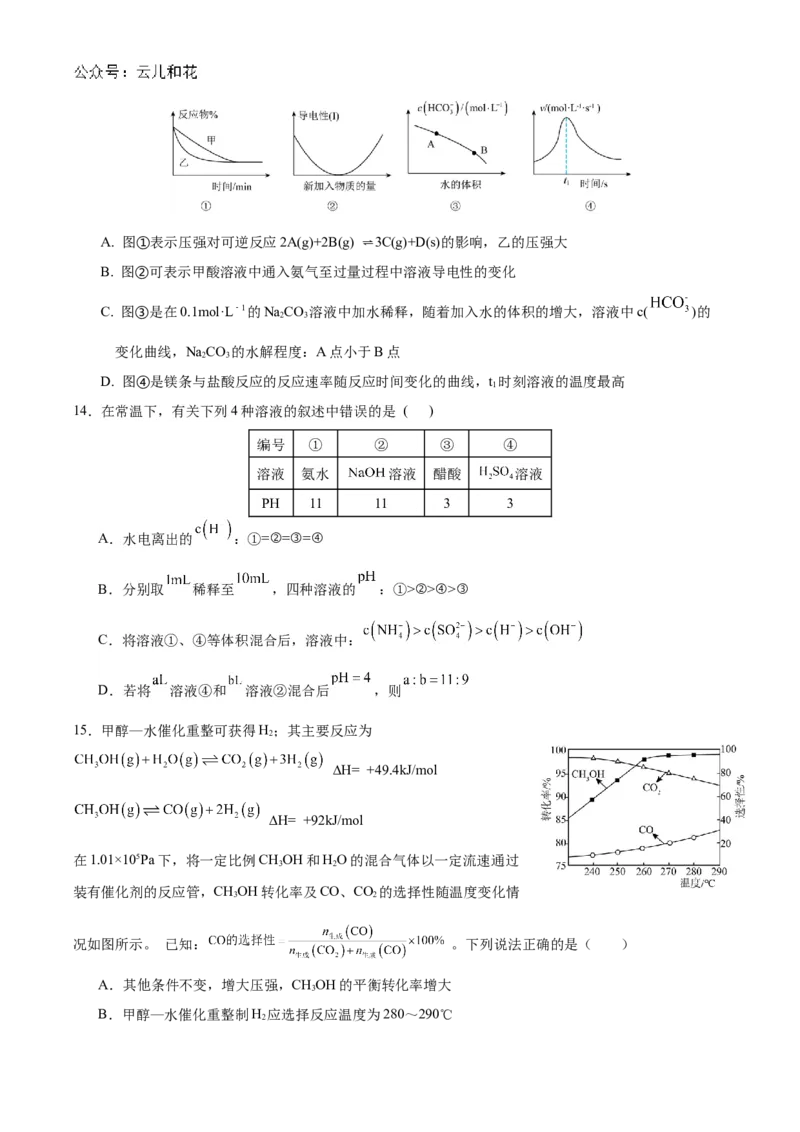
13. 化学中常用图象直观地描述化学反应的进程或结果。下列图象描述正确的是( )A. 图①表示压强对可逆反应2A(g)+2B(g) ⇌3C(g)+D(s)的影响,乙的压强大
B. 图②可表示甲酸溶液中通入氨气至过量过程中溶液导电性的变化
C. 图③是在0.1mol·L﹣1的NaCO 溶液中加水稀释,随着加入水的体积的增大,溶液中c( )的
2 3
变化曲线,NaCO 的水解程度:A点小于B点
2 3
D. 图④是镁条与盐酸反应的反应速率随反应时间变化的曲线,t 时刻溶液的温度最高
1
14.在常温下,有关下列4种溶液的叙述中错误的是 ( )
编号 ① ② ③ ④
溶液 氨水 溶液 醋酸 溶液
PH 11 11 3 3
A.水电离出的 :①=②=③=④
B.分别取 稀释至 ,四种溶液的 :①>②>④>③
C.将溶液①、④等体积混合后,溶液中:
D.若将 溶液④和 溶液②混合后 ,则
15.甲醇—水催化重整可获得H;其主要反应为
2
∆H= +49.4kJ/mol
∆H= +92kJ/mol
在1.01×105Pa下,将一定比例CHOH和HO的混合气体以一定流速通过
3 2
装有催化剂的反应管,CHOH转化率及CO、CO 的选择性随温度变化情
3 2
况如图所示。 已知: 。下列说法正确的是( )
A.其他条件不变,增大压强,CHOH的平衡转化率增大
3
B.甲醇—水催化重整制H 应选择反应温度为280~290℃
2C.其他条件不变,增大 可以提高平衡时H 产率
2
D.其他条件不变,在270~290℃温度范围,随着温度升高,出口处CO 的量不断减小,CO、H 的量
2 2
不断增大
16.对反应 (I为中间产物),相同条件下:①加入催化剂,反应达到平衡所需时间大幅缩短;
②提高反应温度, 增大, 减小。基于以上事实,可能的反应历程示意图为 (------
为有催化剂) ( )
A. B. C. D.
第II卷(非选择题 共56分)
17.下表是几种常见弱酸的电离平衡常数(25 ℃),回答下列各题:
酸 CHCOOH HCN HC O
3 2 2 4
电离平衡常数 K =1.0×10-1.2
a1
1.8×10-5 5×10-10
(K) K =6.0×10-4.2
a a2
(1)下列能使CHCOOH溶液中CHCOOH的电离程度增大,而电离平衡常数不变的操作是 (填字
3 3
母)。
A.升高温度 B.加水稀释 C.加少量的CHCOONa固体 D.加少量冰醋酸
3
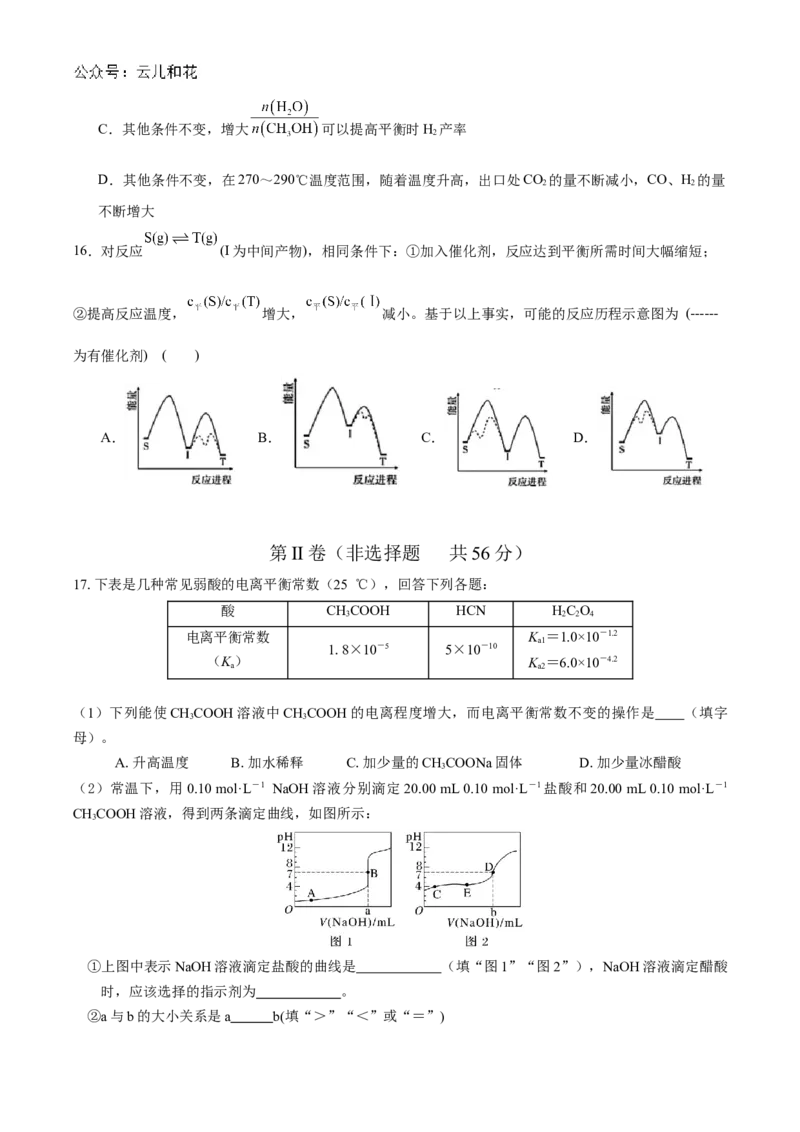
(2)常温下,用0.10 mol·L-1 NaOH溶液分别滴定20.00 mL 0.10 mol·L-1盐酸和20.00 mL 0.10 mol·L-1
CHCOOH溶液,得到两条滴定曲线,如图所示:
3
①上图中表示NaOH溶液滴定盐酸的曲线是 (填“图1”“图2”),NaOH溶液滴定醋酸
时,应该选择的指示剂为 。
②a与b的大小关系是a b(填“>”“<”或“=”)(3)判断NaCN溶液呈________性,用离子方程式表示其原因:____________________________________
常温下,将等物质的量浓度的HCN与NaCN混合,判断混合溶液显____(填“酸”“碱”或“中”)性。
(4)草酸 广泛分布在植物、动物和真菌体内。某小组同学从菠菜中提取了 粗草酸晶体
,配制成 溶液。用 酸性 溶液滴定,测其纯度(杂质不参加反应)。
①当最后半滴 溶液滴入锥形瓶, (填实验现象),且半分钟不变色,说明反应达到终
点。
②三次实验数据如下:
实验序号 锥形瓶中草酸溶液体积 滴定管初始读数 滴定管终点读数
ⅰ 25.00ml 0.22ml 20.24ml
ⅱ 25.00ml 0.25ml 21.75ml
ⅲ 25.00ml 0.20ml 20.18ml
该粗品中草酸晶体的质量分数为 (保留3位有效数字,已知HC O·2HO的相对分子质量为126)
2 2 4 2
③下列操作使得测定结果偏高的是 (填标号)。
a.锥形瓶水洗后未用待测草酸溶液润洗
b.滴加 溶液时,少量液体挂在锥形瓶内壁,未用洗瓶冲下
c.滴定管滴定前尖嘴无气泡,滴定结束后发现尖嘴有气泡
18.氮的化合物广泛应用于工业、航天、医药等领域。
(1)氨气可作为脱硝剂,在恒温恒容密闭容器中充入一定量的NO和NH ,在一定条件下发生反应:
3
6NO(g) + 4NH (g) 5N(g) + 6HO(g)。该反应已达到平衡状态的标志是 。
3 ⇌ 2 2
a.混合气体的密度不变 b.容器内N 的物质的量分数不再变化
2
c.12molN-H键断裂的同时生成5molN≡N键 d.混合气体的平均相对分子质量不再改变
(2)肼(N H)是火箭的高能燃料,该物质燃烧时生成水蒸气和氮气,已知某些化学键的键能如表:
2 4
化学键 O-H N-N N-H O=O N≡N
键能kJ·mol-1 467 160 391 498 945
则1molN H(g)在氧气中完全燃烧的热化学方程式 。
2 4
(3)一定条件下,在5L密闭容器内,反应2NO (g) NO(g),NO 的物质的量随时间变化如表:
2 2 4 2时间/s 0 1 2 3 4 5
n(NO )/mol 0.40 0.20 0.10 0.05 0.05 0.05
2
①用NO 表示0~2s内该反应的平均速率为 mol·L−1·s−1.达平衡时,该反应的平衡常数K=
2 4
。
②为加快反应速率,可以采取的措施是 。
a.升高温度 b.恒容时充入He(g) c.恒压时充入He(g) d.恒容时充入NO
2
(4)已知:2NO = 2N + O ,不同温度(T)下,NO分解半衰期随起始压强
2 2 2 2
的变化关系如图所示:(图中半衰期指任一浓度NO消耗一半时所需的相应
2
时间),则T T(填“>”、“=”或“<”)。当温度为T、起始压强为p,反
1 2 1 0
应至tmin时,此时体系压强p= (用p 表示)。
1 0
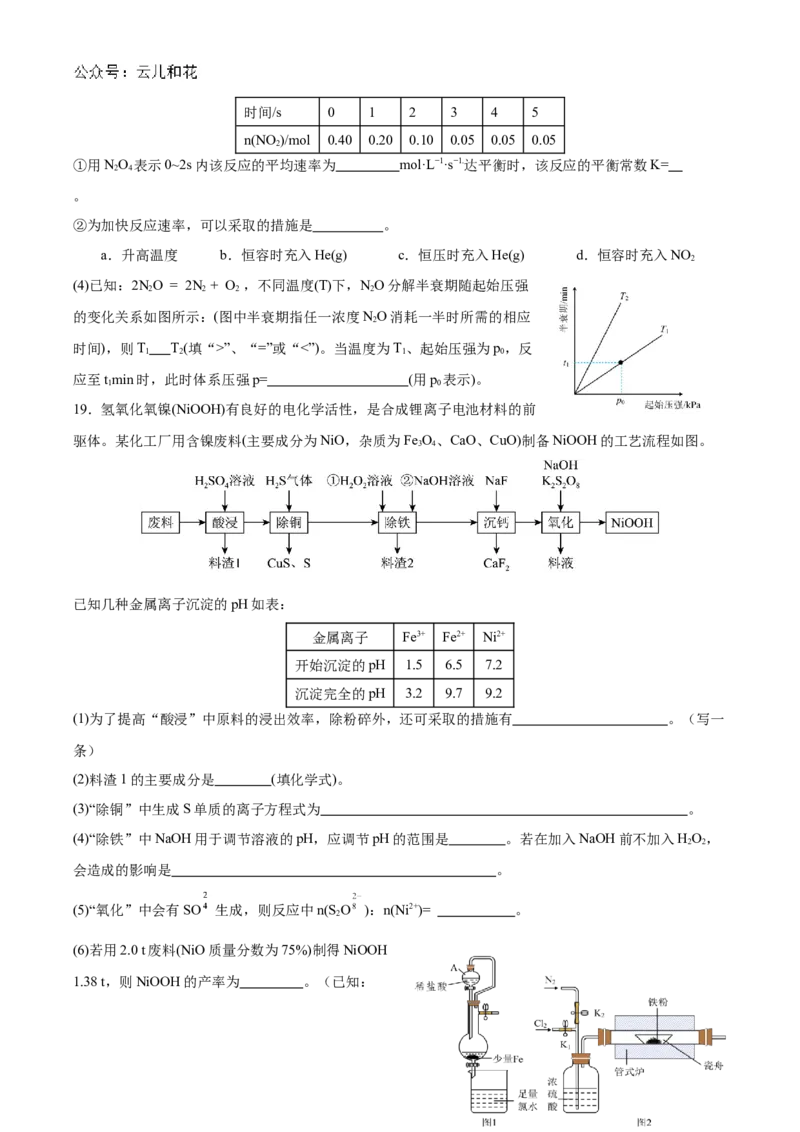
19.氢氧化氧镍(NiOOH)有良好的电化学活性,是合成锂离子电池材料的前
驱体。某化工厂用含镍废料(主要成分为NiO,杂质为Fe O、CaO、CuO)制备NiOOH的工艺流程如图。
3 4
已知几种金属离子沉淀的pH如表:
金属离子 Fe3+ Fe2+ Ni2+
开始沉淀的pH 1.5 6.5 7.2
沉淀完全的pH 3.2 9.7 9.2
(1)为了提高“酸浸”中原料的浸出效率,除粉碎外,还可采取的措施有 。(写一
条)
(2)料渣1的主要成分是 (填化学式)。
(3)“除铜”中生成S单质的离子方程式为 。
(4)“除铁”中NaOH用于调节溶液的pH,应调节pH的范围是 。若在加入NaOH前不加入HO,
2 2
会造成的影响是 。
(5)“氧化”中会有SO 生成,则反应中n(S O ):n(Ni2+)= 。
2
(6)若用2.0 t废料(NiO质量分数为75%)制得NiOOH
1.38 t,则NiOOH的产率为 。(已知:NiOOH的产率= ×100%)
20.氯化铁是一种很重要的铁盐,主要用于污水处理、印染工业、电子工业、建筑工业等。氯化铁有吸水
性,遇水极易水解。某化学兴趣小组设计实验制备氯化铁并探究其性质。回答下列问题:
I.氯化铁的制备:
(1)图1为湿法制备的装置。仪器A的名称为_______,烧杯中发生反应的离子方程式为
____________________。
(2)图2为干法制备的装置。反应前后都要鼓入氮气,目的是
__________________________________________;氮气和氯气都必须经过浓硫酸,原因是
_________________________________________。
Ⅱ.氯化铁的性质探究:
(3)查阅资料:氯化铁在水溶液中分多步水解,生成净水性能更好的聚合氯化铁[ ]。已知
聚合氯化铁极易溶于水,写出氯化铁水解反应的总离子方程式
_______________________________________。
(4)为了探究外界条件对氯化铁水解平衡的影响,该兴趣小组设计实验方案(FeCl 的浓度为1mol·L-1 ,忽略
3
溶液体积的变化),获得如下数据:
实验 V(FeCl )/mL V(H O)/mL n(NaCl)/mol n(Na SO )/mol 温度/℃ pH
3 2 2 4
1 10.00 0 0 0 25 0.74
2 10.00 90.00 0 0 25 1.62
3 10.00 90.00 0 0 35 1.47
4 10.00 90.00 a 0 25 x
5 10.00 90.00 0 b 25 y
①由实验1和2可知,稀释FeCl 溶液,FeCl 水解平衡 (填“正”或“逆”)向移动;
3 3
结合表中数据,给出判断理由:
。
②实验2和实验3的目的是
,实验2和实验3说明FeCl 的水解是
3
(填“吸热”或“放热”)反应。
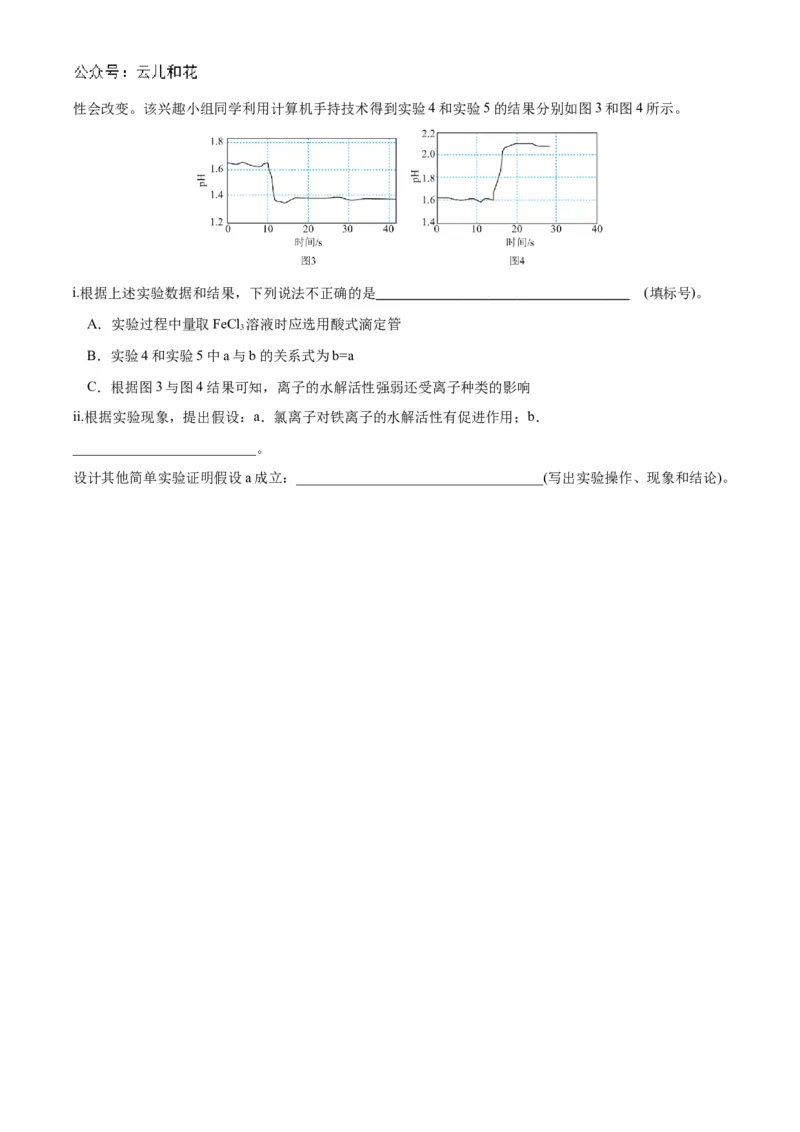
③查阅资料:加入强电解质后,由于溶液中离子总浓度增大,离子间的相互牵制作用增强,水解离子的活性会改变。该兴趣小组同学利用计算机手持技术得到实验4和实验5的结果分别如图3和图4所示。
i.根据上述实验数据和结果,下列说法不正确的是 (填标号)。
A.实验过程中量取FeCl 溶液时应选用酸式滴定管
3
B.实验4和实验5中a与b的关系式为b=a
C.根据图3与图4结果可知,离子的水解活性强弱还受离子种类的影响
ii.根据实验现象,提出假设:a.氯离子对铁离子的水解活性有促进作用;b.
__________________________。
设计其他简单实验证明假设a成立:___________________________________(写出实验操作、现象和结论)。