文档内容
阳朔中学等校 2024-2025 学年高二上学期 10 月检测化学
本试卷满分100分,考试用时75分钟。
注意事项:
1.答题前,考生务必将自己的姓名、考生号、考场号、座位号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改
动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在
本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
4.本试卷主要考试内容:苏教版选择性必修1专题1第一单元至第二单元。
5.可能用到的相对原子质量:
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一
项是符合题目要求的。
1.古代典籍中蕴含丰富的化学知识,下列古诗词的描述中存在吸热反应的是( )。
A.李白——日照香炉生紫烟 B.王安石——爆竹声中一岁除
C.李商隐——蜡炬成灰泪始干 D.苏轼——投泥泼水愈光明
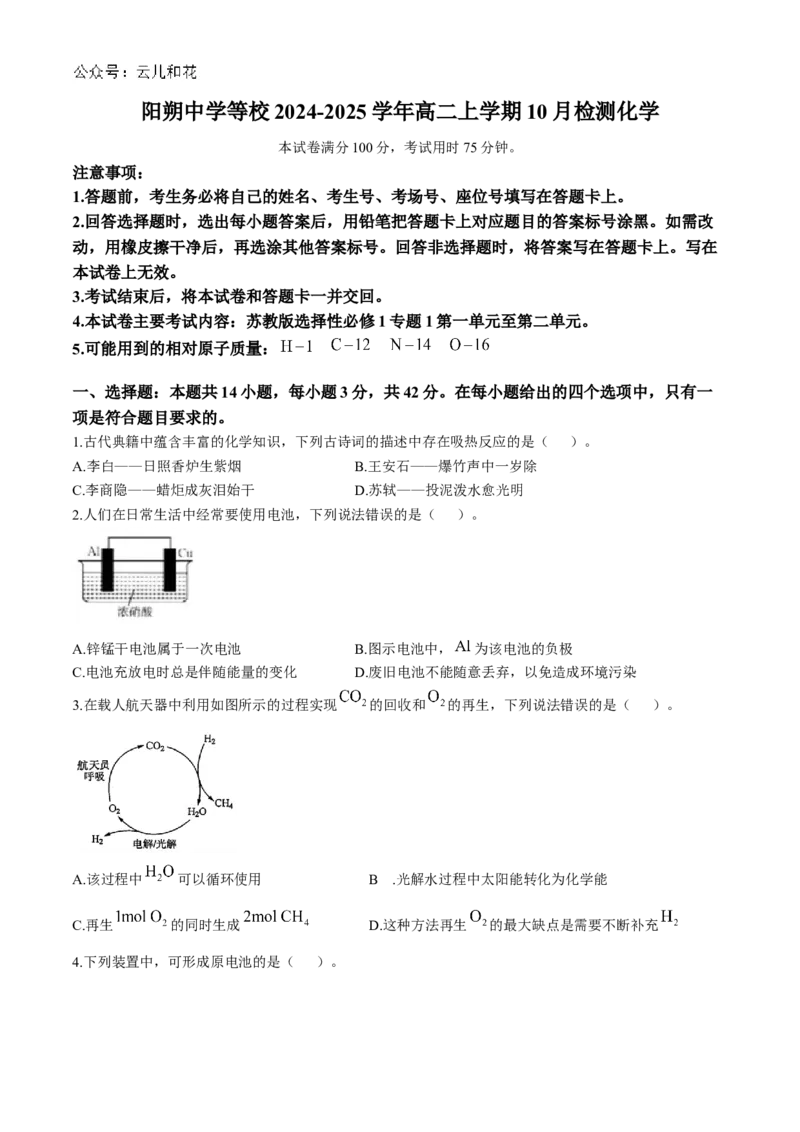
2.人们在日常生活中经常要使用电池,下列说法错误的是( )。
A.锌锰干电池属于一次电池 B.图示电池中, 为该电池的负极
C.电池充放电时总是伴随能量的变化 D.废旧电池不能随意丢弃,以免造成环境污染
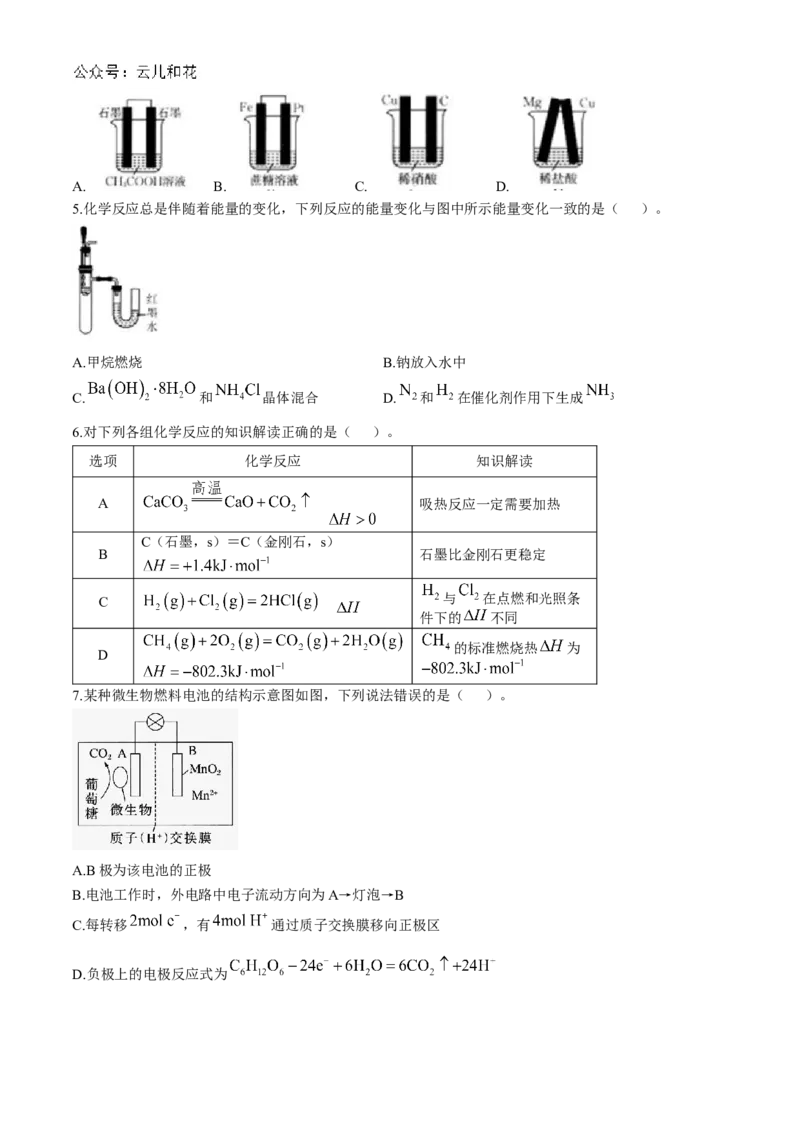
3.在载人航天器中利用如图所示的过程实现 的回收和 的再生,下列说法错误的是( )。
A.该过程中 可以循环使用 B .光解水过程中太阳能转化为化学能
C.再生 的同时生成 D.这种方法再生 的最大缺点是需要不断补充
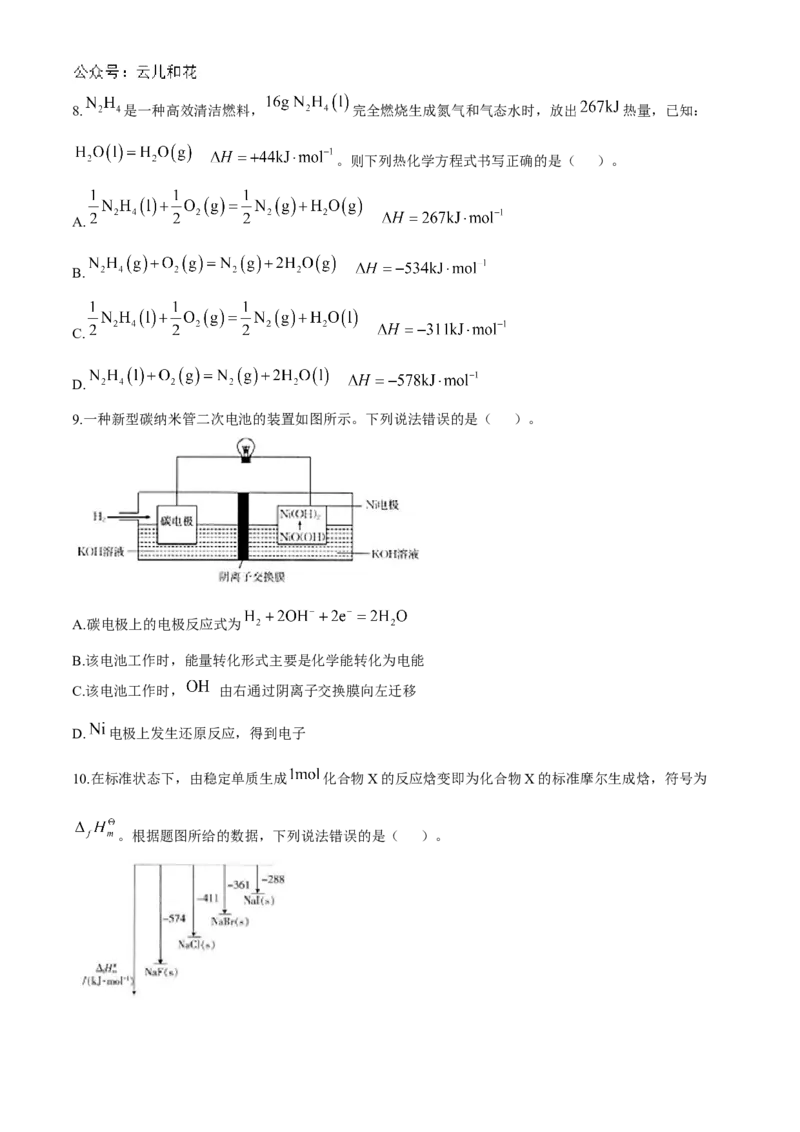
4.下列装置中,可形成原电池的是( )。A. B. C. D.
5.化学反应总是伴随着能量的变化,下列反应的能量变化与图中所示能量变化一致的是( )。
A.甲烷燃烧 B.钠放入水中
C. 和 晶体混合 D. 和 在催化剂作用下生成
6.对下列各组化学反应的知识解读正确的是( )。
选项 化学反应 知识解读
A 吸热反应一定需要加热
C(石墨,s)=C(金刚石,s)
B 石墨比金刚石更稳定
与 在点燃和光照条
C
件下的 不同
的标准燃烧热 为
D
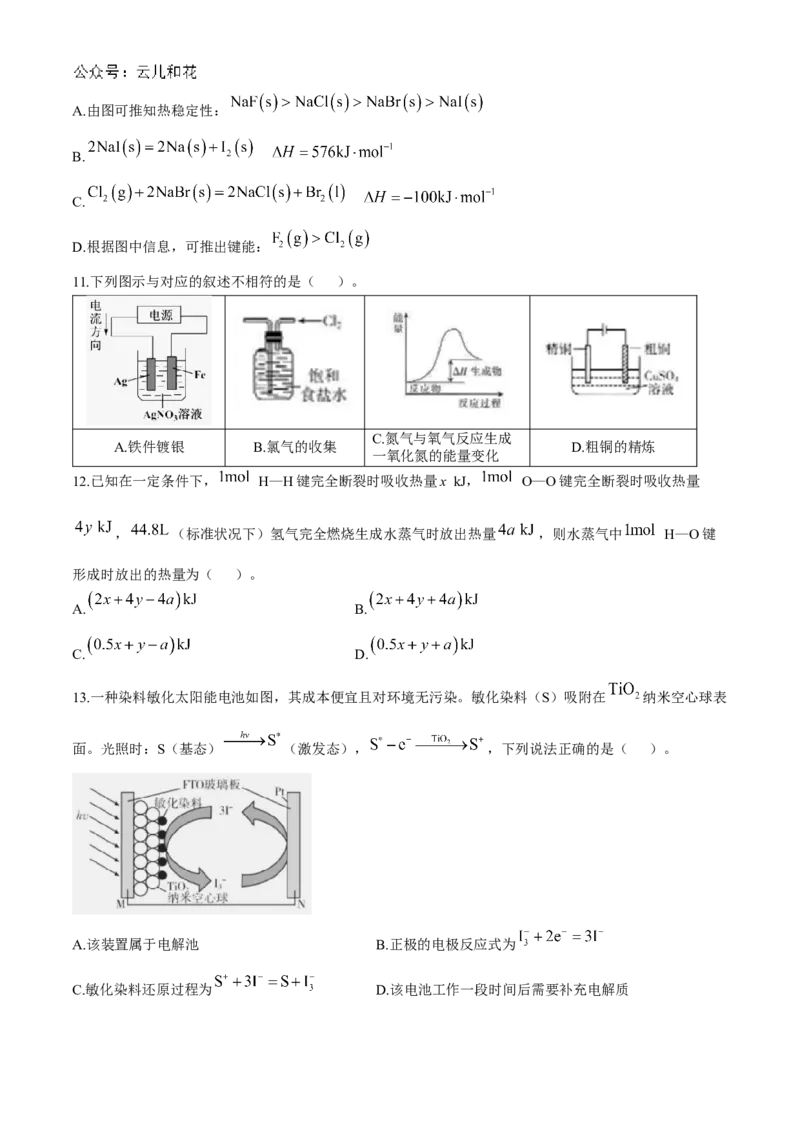
7.某种微生物燃料电池的结构示意图如图,下列说法错误的是( )。
A.B极为该电池的正极
B.电池工作时,外电路中电子流动方向为A→灯泡→B
C.每转移 ,有 通过质子交换膜移向正极区
D.负极上的电极反应式为8. 是一种高效清洁燃料, 完全燃烧生成氮气和气态水时,放出 热量,已知:
。则下列热化学方程式书写正确的是( )。
A.
B.
C.
D.
9.一种新型碳纳米管二次电池的装置如图所示。下列说法错误的是( )。
A.碳电极上的电极反应式为
B.该电池工作时,能量转化形式主要是化学能转化为电能
C.该电池工作时, 由右通过阴离子交换膜向左迁移
D. 电极上发生还原反应,得到电子
10.在标准状态下,由稳定单质生成 化合物X的反应焓变即为化合物X的标准摩尔生成焓,符号为
。根据题图所给的数据,下列说法错误的是( )。A.由图可推知热稳定性:
B.
C.
D.根据图中信息,可推出键能:
11.下列图示与对应的叙述不相符的是( )。
C.氮气与氧气反应生成
A.铁件镀银 B.氯气的收集 D.粗铜的精炼
一氧化氮的能量变化
12.已知在一定条件下, H—H键完全断裂时吸收热量x kJ, O—O键完全断裂时吸收热量
, (标准状况下)氢气完全燃烧生成水蒸气时放出热量 ,则水蒸气中 H—O键
形成时放出的热量为( )。
A. B.
C. D.
13.一种染料敏化太阳能电池如图,其成本便宜且对环境无污染。敏化染料(S)吸附在 纳米空心球表
面。光照时:S(基态) (激发态), ,下列说法正确的是( )。
A.该装置属于电解池 B.正极的电极反应式为
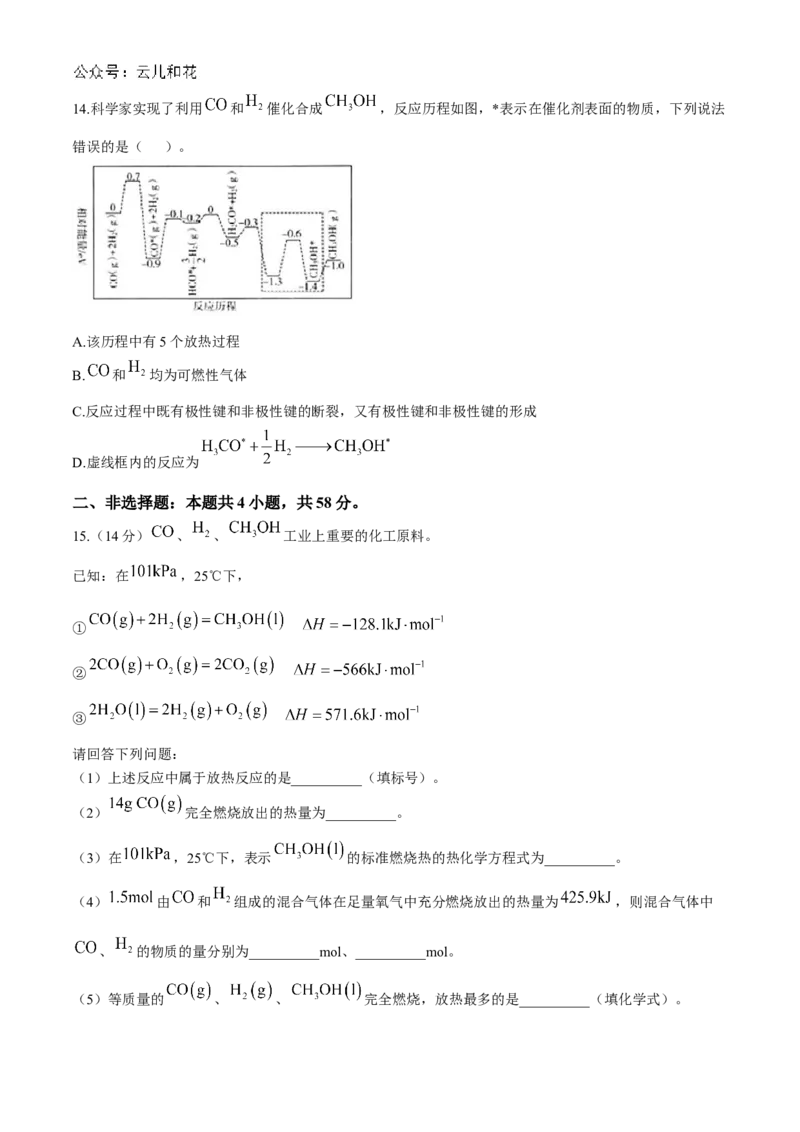
C.敏化染料还原过程为 D.该电池工作一段时间后需要补充电解质14.科学家实现了利用 和 催化合成 ,反应历程如图,*表示在催化剂表面的物质,下列说法
错误的是( )。
A.该历程中有5个放热过程
B. 和 均为可燃性气体
C.反应过程中既有极性键和非极性键的断裂,又有极性键和非极性键的形成
D.虚线框内的反应为
二、非选择题:本题共4小题,共58分。
15.(14分) 、 、 工业上重要的化工原料。
已知:在 ,25℃下,
①
②
③
请回答下列问题:
(1)上述反应中属于放热反应的是__________(填标号)。
(2) 完全燃烧放出的热量为__________。
(3)在 ,25℃下,表示 的标准燃烧热的热化学方程式为__________。
(4) 由 和 组成的混合气体在足量氧气中充分燃烧放出的热量为 ,则混合气体中
、 的物质的量分别为__________mol、__________mol。
(5)等质量的 、 、 完全燃烧,放热最多的是__________(填化学式)。(6)某些常见化学键的键能数据如下表:
化学键 C=O H—O H—H
803 463 436 1076
键能
则 __________ 。
16.(15分)原电池反应一般是氧化还原反应,但区别于一般的氧化还原反应的是,电子转移不是通过氧
化剂和还原剂之间的有效碰撞完成的,而是还原剂在负极上失电子,电子通过外电路输送到正极上,氧化
剂在正极上得电子,使两个电极反应不断进行,发生有序的电子转移过程,产生电流,实现化学能向电能
的转化。
(1)化学反应 ,__________(填“能”或“不能”)通过原电池原理设
计成化学电源,理由是__________。
(2)甲醇燃料电池结构简单,能量转化率高,工作原理如图1所示。加入的a是__________(填名称),
其所在的电极是__________(填“正”或“负”)极,发生的电极反应为__________。
图1 图2
(3)我国科学工作者从环境污染物中分离出一株假单胞菌,该菌株能够在分解有机物的同时产生电能,
其原理如图2所示。
①该电池的电流方向:由__________(填“左”或“右”,下同)侧电极经过负载流向__________侧电极。
②当 参与电极反应时,从__________(填“左”或“右”,下同)侧穿过质子交换膜进入
_________侧的 数目为__________ 。
17.(14分)中和反应反应热的测定是中学化学重要的定量实验。实验步骤如下:
Ⅰ.反应物温度的测量
用量筒量取 盐酸,倒入量热计的内筒,盖上杯盖,测量并记录温度,洗净温度计,擦干备用。用另一量筒量取 的 溶液,用温度计测其温度并记录。
Ⅱ.反应后体系温度的测量
打开杯盖,将 溶液迅速倒入量热计内筒,立即盖上杯盖,密切关注温度变化,记录反应后体系温度
。
Ⅲ.重复上述步骤三次
Ⅳ.数据处理
取盐酸、 溶液平均温度记为反应前体系温度 ,计算温度差 ,填入下表:
反应物温度/℃ 反应前体系温度 反应后体系温度 温度差
实验次数
盐酸 溶液 /℃ /℃ /℃
1 26.9 27.1 30.3
2 27.1 27.1 30.3
3 27.0 27.0 29.3
4 27.1 27.1 30.5
请回答下列问题:
(1)仪器a搅拌的目的是__________;取反应时溶液的__________(填“最低温度”“最高温度”或“平
均温度”)作为反应后体系温度。
(2)量热计内筒与外壳上口相平且垫隔热层的原因是__________;若将盐酸浓度改为 ,
溶液浓度改为 ,测得的温度差__________(填“更大”“更小”或“相同”,下同),
测得的中和反应反应热 __________。
(3)设实验所用的酸、碱溶液的密度均为 ,且比热容与水的相同,发生中和反应后溶液的比热
容 ,上述实验测得的中和反应反应热 __________ [提示
]。又知25℃、 下,中和反应反应热 为 ,实
验值与理论值相差较大的原因可能是__________(任写一点)。
(4)进行中和反应反应热 的测定时,保持其他条件相同,使用下列酸碱组合:
①稀硫酸、 溶液 ②醋酸溶液、氨水 ③稀硫酸、 溶液
理论上测得的中和反应反应热 由大到小的顺序为__________(填标号)。18.(15分)汽车等机动车往往需要配备电池,人造卫星、宇宙飞船等必须携带电池,回答下列问题:
(1)铅蓄电池因性能优良,造价低而得到广泛使用:
①铅蓄电池放电时,能量的转化形式主要为__________(填“电能”或“化学能”,下同)转化为
__________。
②铅蓄电池充电时,阴极上的电极反应式为__________。
(2)工业上利用电解熔融的氯化钠的方法生产钠,装置如图1所示,电池工作时:
图1 图2
①M为铅蓄电池的__________(填“正极”或“负极”)。
②左侧石墨电极上发生__________(填“氧化”或“还原”)反应。
③右侧石墨电极上的电极反应式为__________,每转移 电子,该电极上生成气体的体积为
__________mL(换算成标准状况下)。
(3)燃料电池因反应物、产物基本上对环境不产生污染而备受青睐。图2所示燃料电池工作时:
①电解质溶液中的 往__________(填“左”或“右”)侧 电极迁移。
②左侧 电极上的电极反应式为__________。
③每消耗 ,消耗空气的体积为__________L[换算成标准状况下, ]。