文档内容
射洪中学高 2022 级高二(下)期末模拟考试
化学试题
(考试时间:75分钟 满分:100分)
注意事项:
1.答卷前,考生务必将自己的班级、姓名、考号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用2B铅笔把答题卡上对应题目的答案标号涂
黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。写在本试卷上无效。
3.回答非选择题时,将答案写在答题卡对应题号的位置上。写在本试卷上无效。
4.考试结束后,将答题卡交回。
第 I 卷(选择题)
可能用到的相对原子质量 H—1 C—12 O—16 Na—23 Cl—35.5 Fe—56
一、单选题(每题3分,共42分)
1.化学与生产、生活、科技、医药等密切相关。下列说法不正确的是( )
A.可用X射线衍射仪区分普通玻璃和水晶
B.利用超分子的分子识别特征可以分离C 和C
60 70
C.用于文物年代鉴定的 和 互为同素异形体
D.中国天眼(FAST)使用的SiC是新型无机非金属材料
2.掌握化学用语能让我们更快速的理解化学知识。下列对化学用语的理解正确的是( )
A.基态Al原子最高能级的电子云图为:
B.基态O原子的轨道表示式:
C.硫离子的结构示意图:
D.乙烯分子的空间填充模型:
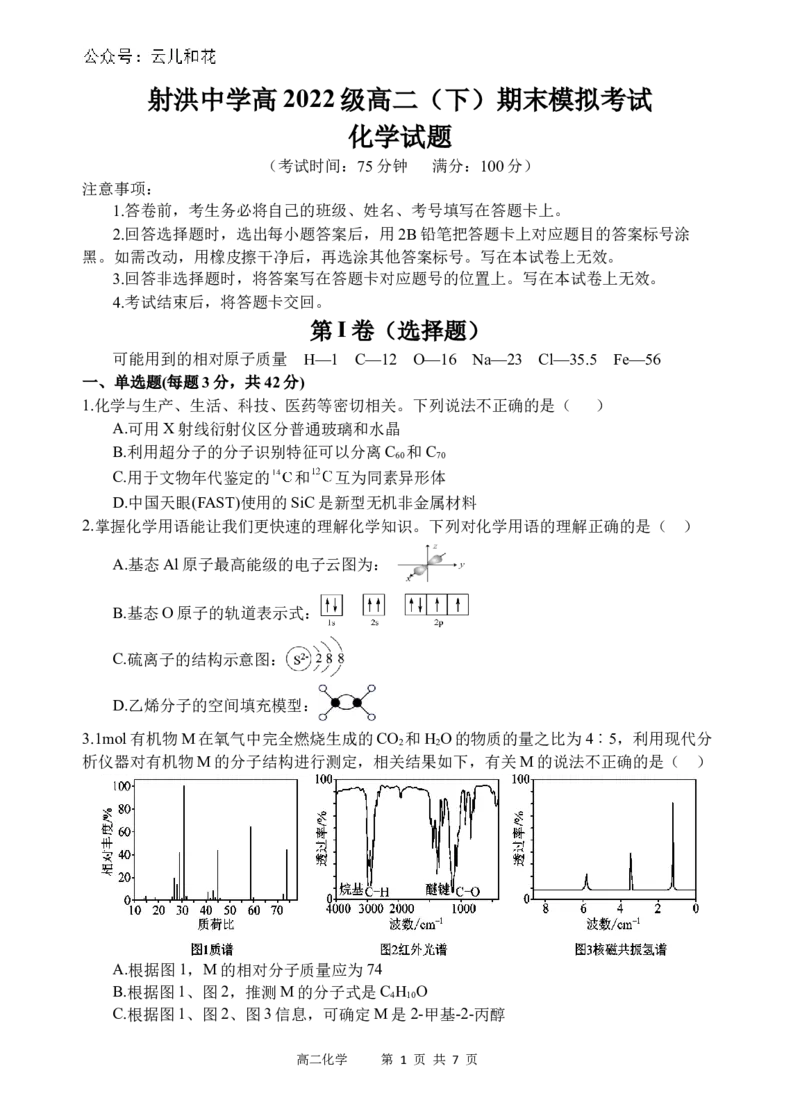
3.1mol有机物M在氧气中完全燃烧生成的CO 和H O的物质的量之比为4︰5,利用现代分
2 2
析仪器对有机物M的分子结构进行测定,相关结果如下,有关M的说法不正确的是( )
A.根据图1,M的相对分子质量应为74
B.根据图1、图2,推测M的分子式是C H O
4 10
C.根据图1、图2、图3信息,可确定M是2-甲基-2-丙醇
高二化学 第 1 页 共 7 页D.根据图1、图2、图3信息,M分子内有三种化学环境不同的H,个数比为6︰3︰1
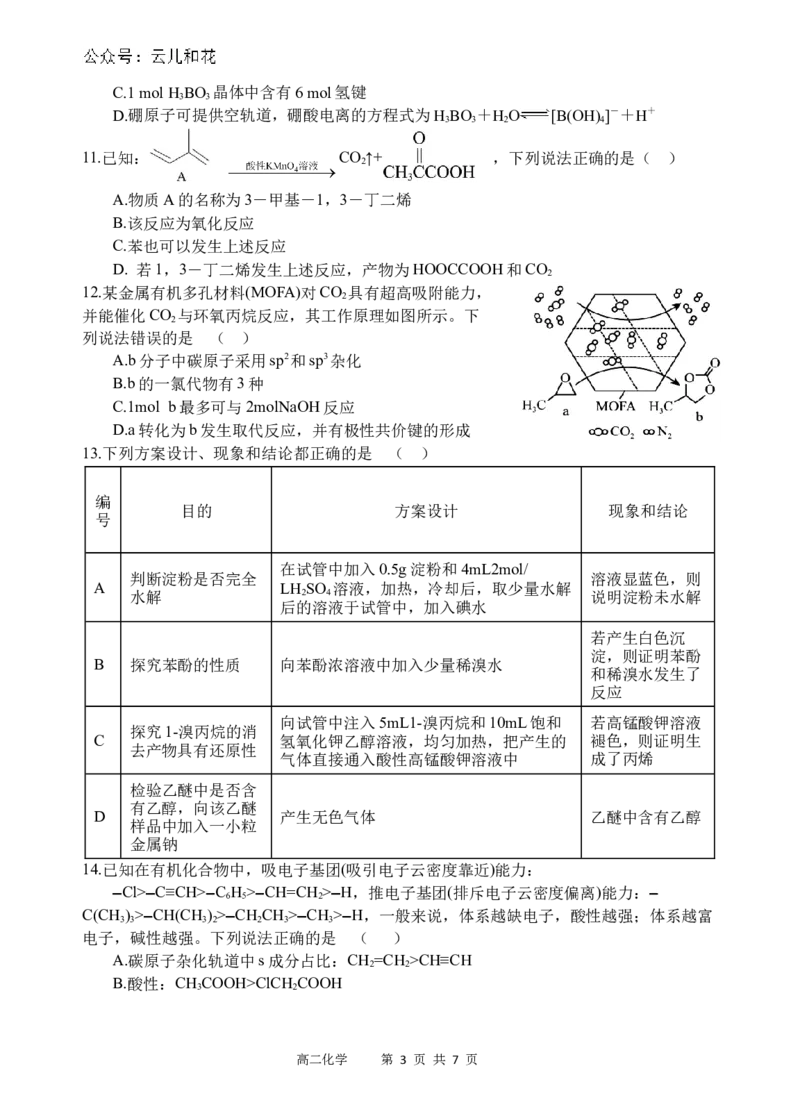
4.下列除杂方法(括号内为杂质)正确的是 ( )
A.KNO 固体(NaCl固体):重结晶 B.溴苯(Br ):加苯萃取
3 2
C.乙烷(乙烯):KMnO (H+),洗气 D.乙炔(H S):溴水,洗气
4 2
5.设N 为阿伏加德罗常数的值。下列说法正确的是 ( )
A
A.标准状况下,11.2L己烷中所含分子数目为0.5N
A
B.1L0.1mol·L-1乙酸溶液中含H+的数目为0.1N
A
C.常温常压下,16g甲烷中含有的质子数目为10N
A
D.在含2molSi-O键的SiO 晶体中,氧原子的数目为2N
2 A
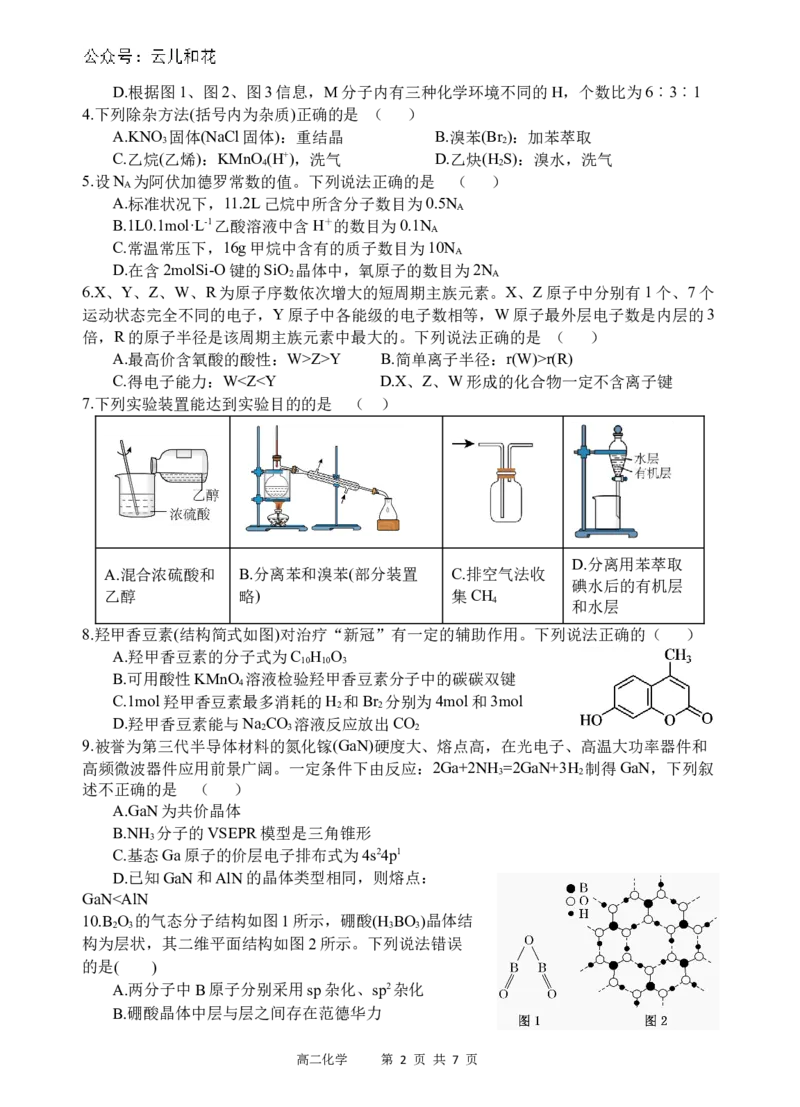
6.X、Y、Z、W、R为原子序数依次增大的短周期主族元素。X、Z原子中分别有1个、7个
运动状态完全不同的电子,Y原子中各能级的电子数相等,W原子最外层电子数是内层的3
倍,R的原子半径是该周期主族元素中最大的。下列说法正确的是 ( )
A.最高价含氧酸的酸性:W>Z>Y B.简单离子半径:r(W)>r(R)
C.得电子能力:W C≡CH> C H > CH=CH > H,推电子基团(排斥电子云密度偏离)能力:
6 5 2
C(CH ) > CH(CH ) > CH CH > CH > H,一般来说,体系越缺电子,酸性越强;体系越富
3 3 3 2 2 3 3
电子,碱性越强。下列说法正确的是 ( )
A.碳原子杂化轨道中s成分占比:CH =CH >CH≡CH
2 2
B.酸性:CH COOH>ClCH COOH
3 2
高二化学 第 3 页 共 7 页C.羟基的活性: >CH CH OH
3 2
D.碱性: >
第 II 卷(非选择题)
二、非选择题(共58分)
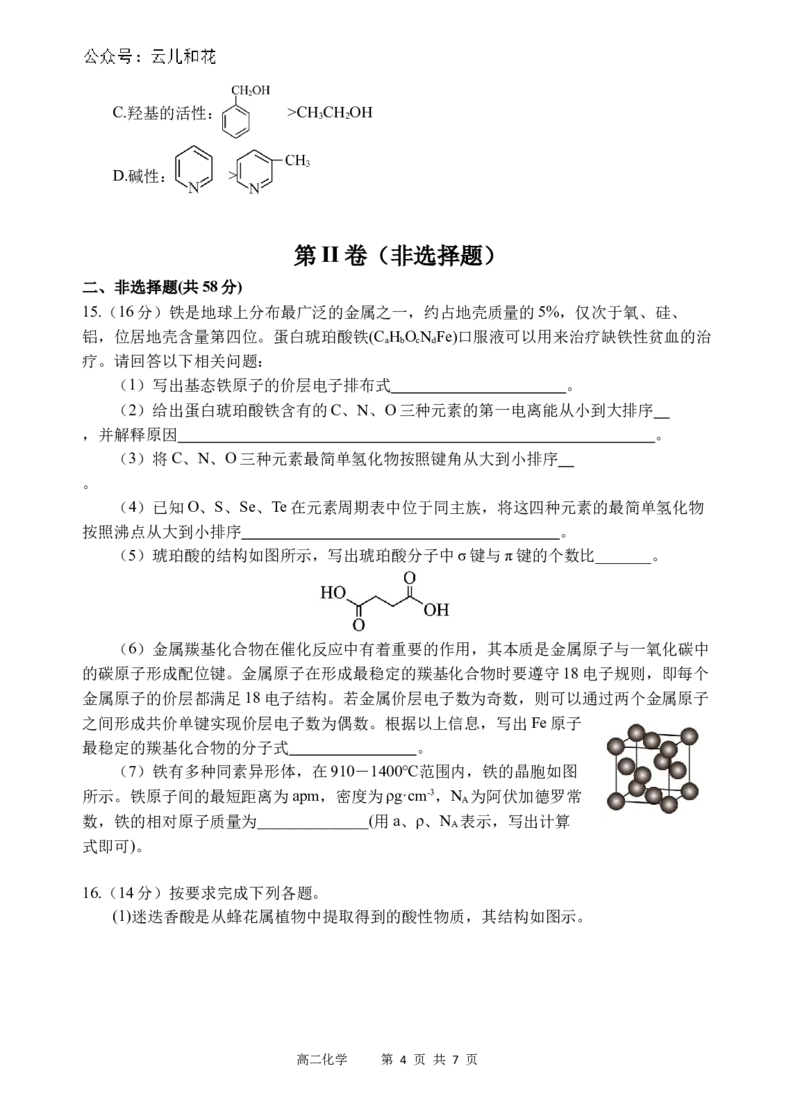
15.(16分)铁是地球上分布最广泛的金属之一,约占地壳质量的5%,仅次于氧、硅、
铝,位居地壳含量第四位。蛋白琥珀酸铁(CH ON Fe)口服液可以用来治疗缺铁性贫血的治
a b c d
疗。请回答以下相关问题:
(1)写出基态铁原子的价层电子排布式 。
(2)给出蛋白琥珀酸铁含有的C、N、O三种元素的第一电离能从小到大排序
,并解释原因 。
(3)将C、N、O三种元素最简单氢化物按照键角从大到小排序
。
(4)已知O、S、Se、Te在元素周期表中位于同主族,将这四种元素的最简单氢化物
按照沸点从大到小排序 。
(5)琥珀酸的结构如图所示,写出琥珀酸分子中σ键与π键的个数比_______。
(6)金属羰基化合物在催化反应中有着重要的作用,其本质是金属原子与一氧化碳中
的碳原子形成配位键。金属原子在形成最稳定的羰基化合物时要遵守18电子规则,即每个
金属原子的价层都满足18电子结构。若金属价层电子数为奇数,则可以通过两个金属原子
之间形成共价单键实现价层电子数为偶数。根据以上信息,写出Fe原子
最稳定的羰基化合物的分子式 。
(7)铁有多种同素异形体,在910-1400℃范围内,铁的晶胞如图
所示。铁原子间的最短距离为apm,密度为ρg·cm-3,N 为阿伏加德罗常
A
数,铁的相对原子质量为______________(用a、ρ、N 表示,写出计算
A
式即可)。
16.(14分)按要求完成下列各题。
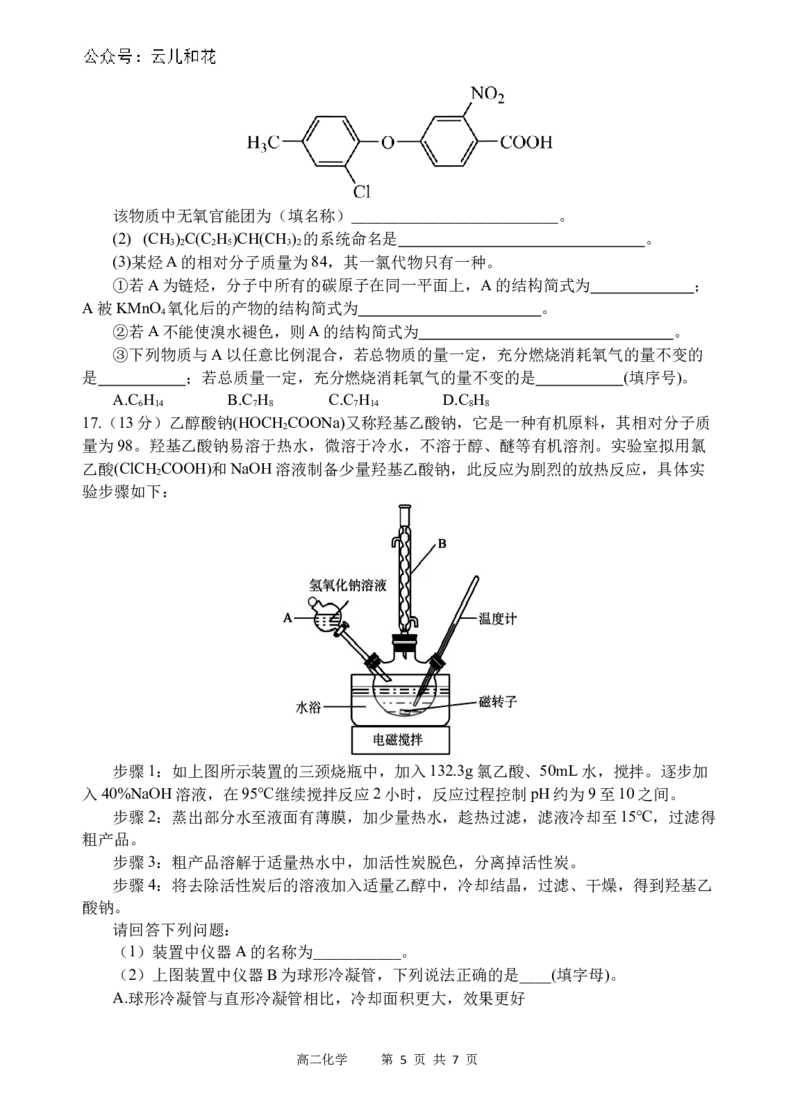
(1)迷迭香酸是从蜂花属植物中提取得到的酸性物质,其结构如图示。
高二化学 第 4 页 共 7 页该物质中无氧官能团为(填名称)__________________________。
(2) (CH ) C(C H )CH(CH ) 的系统命名是 。
3 2 2 5 3 2
(3)某烃A的相对分子质量为84,其一氯代物只有一种。
①若A为链烃,分子中所有的碳原子在同一平面上,A的结构简式为 ;
A被KMnO 氧化后的产物的结构简式为 。
4
②若A不能使溴水褪色,则A的结构简式为 。
③下列物质与A以任意比例混合,若总物质的量一定,充分燃烧消耗氧气的量不变的
是 ;若总质量一定,充分燃烧消耗氧气的量不变的是 (填序号)。
A.C H B.C H C.C H D.C H
6 14 7 8 7 14 8 8
17.(13分)乙醇酸钠(HOCH COONa)又称羟基乙酸钠,它是一种有机原料,其相对分子质
2
量为98。羟基乙酸钠易溶于热水,微溶于冷水,不溶于醇、醚等有机溶剂。实验室拟用氯
乙酸(ClCH COOH)和NaOH溶液制备少量羟基乙酸钠,此反应为剧烈的放热反应,具体实
2
验步骤如下:
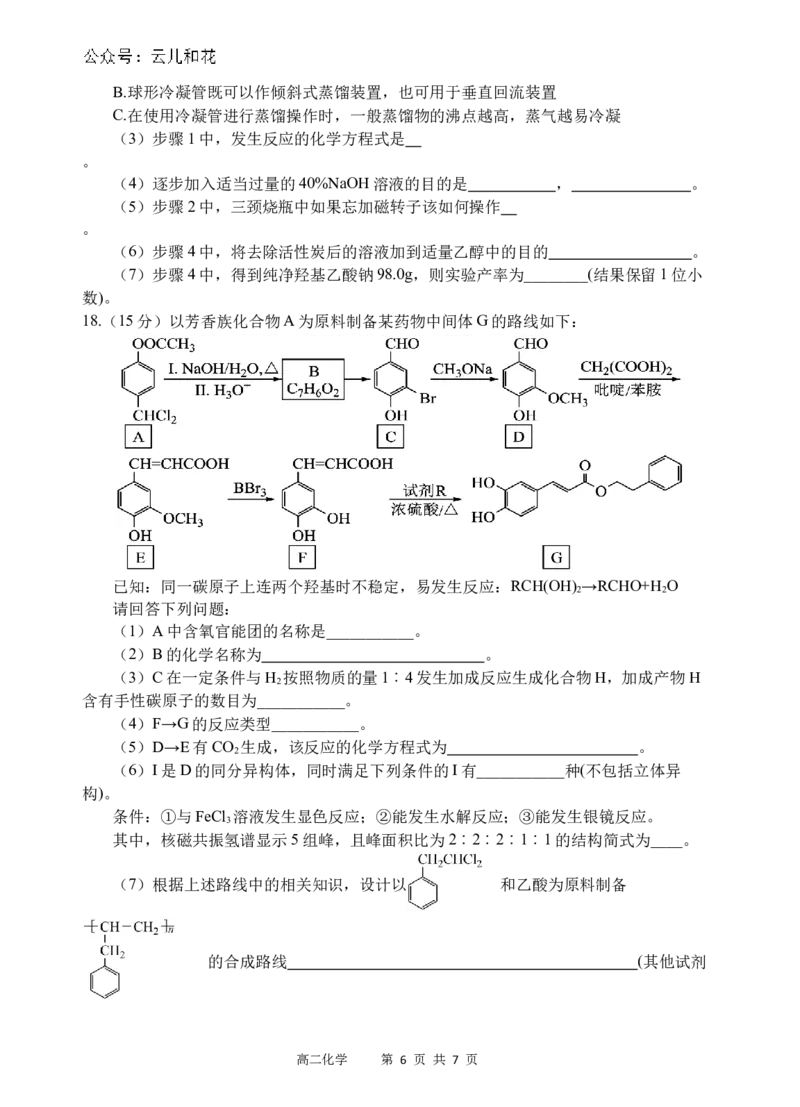
步骤1:如上图所示装置的三颈烧瓶中,加入132.3g氯乙酸、50mL水,搅拌。逐步加
入40%NaOH溶液,在95℃继续搅拌反应2小时,反应过程控制pH约为9至10之间。
步骤2:蒸出部分水至液面有薄膜,加少量热水,趁热过滤,滤液冷却至15℃,过滤得
粗产品。
步骤3:粗产品溶解于适量热水中,加活性炭脱色,分离掉活性炭。
步骤4:将去除活性炭后的溶液加入适量乙醇中,冷却结晶,过滤、干燥,得到羟基乙
酸钠。
请回答下列问题:
(1)装置中仪器A的名称为___________。
(2)上图装置中仪器B为球形冷凝管,下列说法正确的是____(填字母)。
A.球形冷凝管与直形冷凝管相比,冷却面积更大,效果更好
高二化学 第 5 页 共 7 页B.球形冷凝管既可以作倾斜式蒸馏装置,也可用于垂直回流装置
C.在使用冷凝管进行蒸馏操作时,一般蒸馏物的沸点越高,蒸气越易冷凝
(3)步骤1中,发生反应的化学方程式是
。
(4)逐步加入适当过量的40%NaOH溶液的目的是 , 。
(5)步骤2中,三颈烧瓶中如果忘加磁转子该如何操作
。
(6)步骤4中,将去除活性炭后的溶液加到适量乙醇中的目的 。
(7)步骤4中,得到纯净羟基乙酸钠98.0g,则实验产率为________(结果保留1位小
数)。
18.(15分)以芳香族化合物A为原料制备某药物中间体G的路线如下:
已知:同一碳原子上连两个羟基时不稳定,易发生反应:RCH(OH) →RCHO+H O 。
2 2
请回答下列问题:
(1)A中含氧官能团的名称是___________。
(2)B的化学名称为 。
(3)C在一定条件与H 按照物质的量1︰4发生加成反应生成化合物H,加成产物H
2
含有手性碳原子的数目为___________。
(4)F→G的反应类型___________。
(5)D→E有CO 生成,该反应的化学方程式为 。
2
(6)I是D的同分异构体,同时满足下列条件的I有___________种(不包括立体异
构)。
条件:①与FeCl 溶液发生显色反应;②能发生水解反应;③能发生银镜反应。
3
其中,核磁共振氢谱显示5组峰,且峰面积比为2︰2︰2︰1︰1的结构简式为____。
(7)根据上述路线中的相关知识,设计以 和乙酸为原料制备
的合成路线 (其他试剂
高二化学 第 6 页 共 7 页任选)。
高二化学 第 7 页 共 7 页