文档内容
_____________________:号考
_____________________:名姓
_____________________:级班
_____________________:校学
题
答
要
不
内
线
封
密
高二化学试卷
②
本试卷满分100分,考试用时75分钟。
注意事项:
1.答题前,考生务必将自己的姓名、考生号、考场号、座位号填写在答题卡上。 合成路线Ⅱ:CH
3
CCHCOCH
3
OHCH
2
C CH
3
COOCH
3
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需 下列说法错误的是( )
改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。 A.有机物CH C CH COOCH 中含有的官能团的名称为碳碳双键、羧基
2 3 3
写在本试卷上无效。
B.HCN的结构式为HC N
3.考试结束后,将本试卷和答题卡一并交回。
C.CH CCH属于不饱和烃,能发生加聚反应
3
4.本试卷主要考试内容:人教版必修第一册、必修第二册、选择性必修1第一章至第三章。
D.相比于合成路线Ⅰ,合成路线Ⅱ的优点是没有副产物,原料利用率高,对设备腐蚀性小
5.可能用到的相对原子质量:H 1 C 12 N 14 O 16 Nd 144
8.常温下,为证明NH H O是弱电解质,设计以下实验方案。下列方案错误的是( )
3 2
A.测定0.01molL1氨水的pH
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项
B.测定0.01molL1NH Cl溶液的酸碱性
是符合题目要求的。 4
1.中华文明源远流长,衣、食、住、行中都蕴含着中华民族智慧的结晶。下列文明载体与硅酸
C.测定pH为10的氨水稀释十倍后的pH
盐材料有关的是( ) D.比较0.01molL1氨水和1molL1NaOH溶液的导电能力
衣 食 住 行 9.下列说法正确的是( )
A.酸式滴定管用蒸馏水润洗后,不需要再用标准液润洗
B.酸碱中和滴定时,待测液可盛放在锥形瓶中
C.酸碱中和滴定时,碱性溶液应当盛装在酸式滴定管中
D.用量筒量取25.00mL稀硫酸时,应将残留在量筒中的稀硫酸用水洗涤并全部倾倒在同一容
A.民族服饰 B.蒸饺 C.碉楼 D.碳纤维自行车 器中
2.增大下列过程的化学反应速率对人类有益的是( ) 10.根据以下三个热化学方程式:
A.氨的合成 B.钢铁的腐蚀 C.废旧电池的焚烧 D.肉质食品的腐败 2H S g 3O g 2SO g 2H O l H QkJmol1
2 2 2 2 1
3.从科技前沿到人类的日常生活,化学无处不在。下列说法错误的是( )
2H S g O g 2S s 2H O l H Q kJmol1
2 2 2 2
A.国产大型飞机 C919用到的氮化硅陶瓷是新型无机非金属材料
2H S g O g 2S s 2H O g H QkJmol1
B.光化学烟雾、臭氧层空洞、白色污染的形成都与氮氧化物有关 2 2 2 3
Q 、Q 、Q 三者关系正确的是( )
C.漂粉精既可作棉麻织物的漂白剂,又可用作环境的消毒剂 1 2 3
D.粒子直径为1nm~100nm的铁粉材料,不属于胶体 A.Q
3
Q
2
Q
1
B.Q
2
Q
1
Q
3
C.Q
1
Q
2
Q
3
D.Q
1
Q
3
Q
2
4.冰融化成水的过程中,其熵变和焓变均正确的是( ) 11.设N 为阿伏加德罗常数的值,下列说法正确的是( )
A
A.S 0,H 0 B.S 0,H 0 A.常温下,0.1molL1NaHCO 溶液中,所含的Na的数目为0.1N
3 A
C.S 0,H 0 D.S 0,H 0 B.常温下,由4.6gNO 和N O 组成的混合气体中,所含的原子总数为0.3N
2 2 4 A
5.下列物质中属于强电解质且水溶液显酸性的是( )
C.常温下,1LpH2的盐酸中,所含的OH的数目为0.01N
A
A.FeCl B.NaHCO C.CH COOH D.Na SO
3 3 3 2 4 D.在某一密闭容器中,0.1molSO 与足量的O 反应,生成的SO 分子数为0.1N
2 2 3 A
6.对于有气体参与的反应,下列条件改变能增大活化分子百分数并引起平衡移动的是( )
12.下列说法错误的是( )
A.增大反应物浓度 B.升高温度
A.相同温度下,pH相等的氨水、NaOH溶液中,c
OH
相等
C.增大气体反应体系的压强 D.使用催化剂
7.甲基丙烯酸甲酯是合成有机玻璃的单体。
B.VLpH4的醋酸溶液加水稀释至10VL,此时pH5
C.pH均为4的盐酸和硫酸溶液等体积混合后,所得溶液的pH4
合成路线Ⅰ:① D.用同浓度的NaOH溶液分别与等体积、等pH的盐酸和醋酸溶液反应,反应恰好完全时,
盐酸消耗NaOH溶液的体积更大
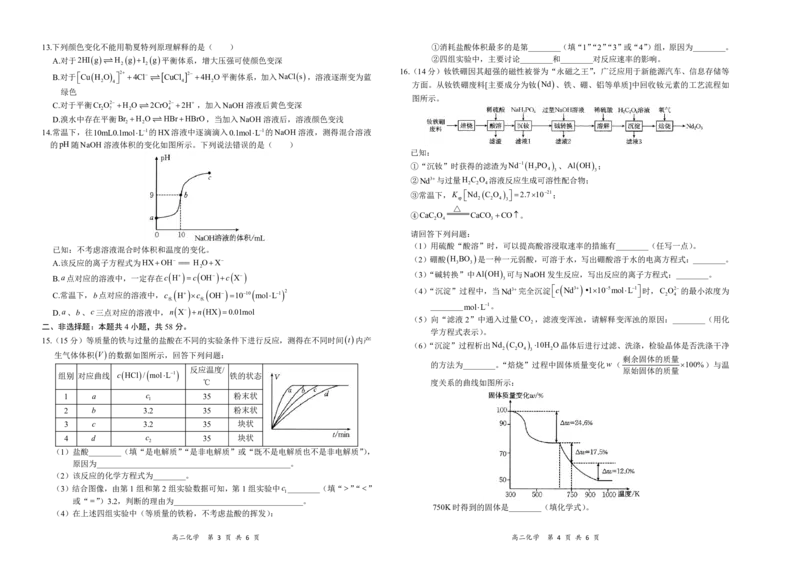
高二化学 第 1 页 共 6 页 高二化学 第 2 页 共 6 页13.下列颜色变化不能用勒夏特列原理解释的是( ) ①消耗盐酸体积最多的是第________(填“1”“2”“3”或“4”)组,原因为________。
A.对于2HI g H g I g 平衡体系,增大压强可使颜色变深 ②四组实验中,主要讨论________和________对反应速率的影响。
2 2
B.对于 Cu H O 2 4Cl CuCl 2 4H O平衡体系,加入NaCl s ,溶液逐渐变为蓝
16.(14分)钕铁硼因其超强的磁性被誉为“永磁之王”,广泛应用于新能源汽车、信息存储等
2 4 4 2 方面。从钕铁硼废料[主要成分为钕 Nd 、铁、硼、铝等单质]中回收钕元素的工艺流程如
绿色
图所示。
C.对于平衡Cr O2 H O 2CrO2 2H ,加入NaOH溶液后黄色变深
2 7 2 4
D.溴水中存在平衡Br H O HBrHBrO,当加入NaOH溶液后,溶液颜色变浅
2 2
14.常温下,往10mL0.1molL1的HX溶液中逐滴滴入0.1molL1的NaOH溶液,测得混合溶液
的pH随NaOH溶液体积的变化如图所示。下列说法错误的是( )
已知:
①“沉钕”时获得的滤渣为Nd1 H PO 、Al OH ;
2 4 3 3
②Nd3与过量H C O 溶液反应生成可溶性配合物;
2 2 4
③常温下,K Nd C O 2.71021;
sp 2 2 4 3
△
④CaC O CaCO CO。
2 4 3
请回答下列问题:
(1)用硫酸“酸溶”时,可以提高酸溶浸取速率的措施有________(任写一点)。
已知:不考虑溶液混合时体积和温度的变化。
A.该反应的离子方程式为HXOH H OX
(2)硼酸
H
3
BO
3
是一种一元弱酸,可溶于水,写出硼酸溶于水的电离方程式:________。
2
B.a点对应的溶液中,一定存在c
H
c
OH
c
X (3)“碱转换”中Al OH
3
可与NaOH发生反应,写出反应的离子方程式:________。
C.常温下,b点对应的溶液中,c H c OH 1010 molL1 2 (4)“沉淀”过程中,当Nd3完全沉淀 c Nd3 1105molL1 时,C 2 O2 4 的最小浓度为
水 水
D.a、b、c三点对应的溶液中,n X n HX 0.01mol
________molL1。
(5)向“滤液 2”中通入过量CO ,滤液变浑浊,请解释变浑浊的原因:________(用化
2
二、非选择题:本题共4小题,共58分。
学方程式表示)。
15.(15分)等质量的铁与过量的盐酸在不同的实验条件下进行反应,测得在不同时间
t
内产
(6)“沉淀”过程析出Nd C O 10H O晶体后进行过滤、洗涤,检验晶体是否洗涤干净
2 2 4 3 2
生气体体积
V
的数据如图所示,回答下列问题:
剩余固体的质量
的方法为________。“焙烧”过程中固体质量变化w( 100%)与温
组别 对应曲线 c HCl / molL1
反应温度/
铁的状态
原始固体的质量
℃ 度关系的曲线如图所示:
1 a c 35 粉末状
1
2 b 3.2 35 粉末状
3 c 3.2 35 块状
4 d c 35 块状
2
(1)盐酸________(填“是电解质”“是非电解质”或“既不是电解质也不是非电解质”),
原因为________________________________________________。
(2)该反应的化学方程式为________。
(3)结合图像,由第1组和第2组实验数据可知,第1组实验中c ________(填“”“”
1
或“”)3.2,判断的理由为________________________________。
750K时得到的固体是________(填化学式)。
(4)在上述四组实验中(等质量的铁粉,不考虑盐酸的挥发):
高二化学 第 3 页 共 6 页 高二化学 第 4 页 共 6 页题
答
要
不
内
线
封
密
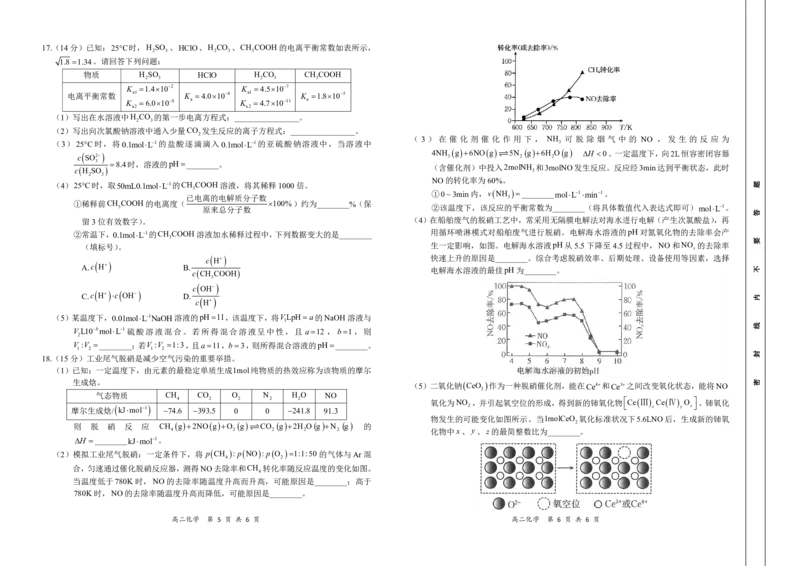
17.(14分)已知:25C时,H SO 、HClO、H CO 、CH COOH的电离平衡常数如表所示,
2 3 2 3 3
1.8 1.34。请回答下列问题:
物质 H SO HClO H CO CH COOH
2 3 2 3 3
K 1.4102 K 4.5107
电离平衡常数 a1 K 4.0108 a1 K 1.8105
K 6.0108 a K 4.71011 a
a2 a2
(1)写出在水溶液中H CO 的第一步电离方程式:________________。
2 3
(2)写出向次氯酸钠溶液中通入少量CO 发生反应的离子方程式:________________。
2
( 3 ) 在 催 化 剂 催 化 作 用 下 , NH 可 脱 除 烟 气 中 的 NO , 发 生 的 反 应 为
(3)25C时,将0.1molL1的盐酸逐滴滴入0.1molL1的亚硫酸钠溶液中,当溶液中 3
c
SO2 4NH
3
g 6NO g 5N
2
g 6H
2
O g H 0。一定温度下,向2L恒容密闭容器
3
8.4时,溶液的pH________。
(含催化剂)中投入2molNH 和3molNO发生反应。反应经3min达到平衡状态,此时
c H SO 3
2 3
NO的转化率为60%。
(4)25C时,取50mL0.1molL1的CH COOH溶液,将其稀释1000倍。
3
①0~3min内,v NH ________molL1min1。
已电离的电解质分子数 3
①稀释前CH COOH的电离度( 100%)约为________%(保
3 原来总分子数 ②该温度下,该反应的平衡常数为________(将具体数值代入表达式即可)molL1。
留3位有效数字)。 (4)在船舶废气的脱硝工艺中,常采用无隔膜电解法对海水进行电解(产生次氯酸盐),再
②常温下,0.1molL1的CH COOH溶液加水稀释过程中,下列数据变大的是________ 用循环喷淋模式对船舶废气进行脱硝。电解海水溶液的pH对氮氧化物的去除率会产
3
(填标号)。 生一定影响,如图。电解海水溶液pH从5.5下降至4.5过程中,NO和NO 的去除率
x
c
H 快速上升的原因是________。综合考虑脱硝效率、后期处理、设备使用等因素,选择
A.c
H
B.
电解海水溶液的最佳pH为________。
c CH COOH
3
c
OH
C.c
H
c
OH
D.
c
H
(5)某温度下,0.01molL1NaOH溶液的pH11,该温度下,将VLpHa的NaOH溶液与
1
V L10bmolL1 硫酸溶液混合。若所得混合溶液呈中性,且 a12 , b1,则
2
V :V ________;若V :V 1:3,且a11,b3,则所得混合溶液的pH________。
1 2 1 2
18.(15分)工业尾气脱硝是减少空气污染的重要举措。
(1)已知:一定温度下,由元素的最稳定单质生成1mol纯物质的热效应称为该物质的摩尔
生成焓。 (5)二氧化钠
CeO
作为一种脱硝催化剂,能在Ce4和Ce3之间改变氧化状态,能将NO
2
气态物质 CH CO O N H O NO
4 2 2 2 2 氧化为NO ,并引起氧空位的形成,得到新的铈氧化物 Ce Ⅲ Ce Ⅳ O 。铈氧化
摩尔生成焓/ kJmol1 74.6 393.5 0 0 241.8 91.3 2 x y z
物发生的可能变化如图所示。当1molCeO 氧化标准状况下5.6LNO后,生成新的铈氧
则 脱 硝 反 应 CH g 2NO g O g CO g 2H O g N g 的 2
4 2 2 2 2 化物中x、y、z的最简整数比为________。
H ________kJmol1。
(2)模拟工业尾气脱硝:一定条件下,将 p CH : p NO : p O 1:1:50 的气体与Ar 混
4 2
合,匀速通过催化脱硝反应器,测得NO去除率和CH 转化率随反应温度的变化如图。
4
当温度低于780K 时,NO的去除率随温度升高而升高,可能原因是________;高于
780K时,NO的去除率随温度升高而降低,可能原因是________。
高二化学 第 5 页 共 6 页 高二化学 第 6 页 共 6 页