文档内容
1
吉林省普通高中 G8 教考联盟 2024-2025 学年上学期期末考试
高二年级 化学 C 卷
本试卷共10页。考试结束后,将答题卡交回。
注意事项:1.答卷前,考生先将自己的姓名、准考证号码填写清楚,将条形码准确粘贴在考生信息条形
码粘贴区。
2.答题时请按要求用笔。
3.请按照题号顺序在答题卡各题目的答题区域内作答,超出答题区域书写的答案无效;在草
稿纸、试卷上答题无效。
4.作图可先使用铅笔画出,确定后必须用黑色字迹的签字笔描黑。
5.保持卡面清洁,不要折叠,不要弄破、弄皱,不准使用涂改液、修正带、刮纸刀。
可能用到的相对原子质量: H-1 B-11 C-12 O-16 K-39 S-32 Cu-64
I卷(共45分)
一、选择题(本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一
项符合题目要求)
1.化学与生活、生产及环境密切相关,下列说法错误的是
A.天然气的主要成分CH 是非极性分子
4
B.神舟飞船上硅太阳能电池板主要成分为Si
C.配合物和超分子有着广泛的应用,其中超分子的特性是“分子识别”和“自组装”
D.烟花的焰色是原子吸收光谱的体现
2.下列说法不正确的是
A.邻羟基苯甲醛( )的熔、沸点比对羟基苯甲醛( )的熔、沸点
高
B.某元素气态基态原子的逐级电离能(kJ·mol )分别为 738、1451、7733、10540、
13630、17995、21703,当它与氯气反应时可能生成的阳离子是X2+
C.“雪花→水→水蒸气→氧气和氢气”的变化中各阶段被破坏的粒子间的主要相互作
用依次是氢键、分子间作用力、极性键
D.乳酸( )分子中含有一个手性碳原子
3.下列说法正确的是
A.原子最外层电子排布式为4s1的元素一定是s区元素
B.价电子排布为5s25p1的元素位于第五周期第ⅠA族,是p区元素
C.电子排布式( Ti)1s22s22p63s23p10违反了洪特规则
22
D.ns电子的能量一定高于(n−1)p电子的能量
第1页1
4.下列事实不能用勒夏特列原理解释的是
A.对于反应体系CO(g)+NO (g) CO (g)+NO (g),给平衡体系增大压强可使颜色变深
2 2
B.在K Cr O 溶液中存在如下平衡,Cr O 2−+H O 2CrO 2−+2H+,若向K Cr O 溶液中
2 2 7 2 7 2 4 2 2 7
滴入5~15滴浓硫酸,溶液颜色橙色加深
C.工业上生产硫酸的过程中使用过量的空气以提高SO 的利用率
2
D.将AlCl 溶液加热、蒸干、灼烧,最终得到Al O
3 2 3
5.X、Y、Z、W是原子序数依次增大的短周期主族元素,其最外层电子数之和 19。X与
Y、Z、W位于不同周期,Y、Z相邻,基态X原子核外未成对电子数是基态Y原子核外
未成对电子数的3倍,W的单质常用于自来水的消毒。下列说法正确的是
A.第一电离能:X>Y>Z
B.电负性:Z>Y>X
C.最简单氢化物的熔点:W>X>Z
D.YW 晶体为分子晶体
3
6. 下列各组离子在指定溶液中一定能大量共存的是
A. 在c(Al3+)=0.1mol/L的溶液中:K+、Na+、SO 2−、S2−
4
B. 的溶液中:Fe2+、NH +、Cl−、NO −
4 3
C. 常温下,水电离出的c(H+)=10−13mol/L溶液中:ClO−、K+、Na+、SO 2−
4
D. 透明溶液中:Cu2+、Ba2+、Cl−、NO −
3
7.金属硫化物(M S )催化反应 CH (g)+2H S(g)===CS (g)+4H (g),既可以除去天然气中的
x y 4 2 2 2
H S,又可以获得H 。下列说法正确的是
2 2
INCLUDEPICTURE "I:\\王真\\2024\\同步\\化学 人教版 选择性必修1\\T61.TIF" \*
MERGEFORMATINET INCLUDEPICTURE "I:\\王真\\2024\\同步\\化学 人教版 选择性必修1\
\T61.TIF" \* MERGEFORMATINET INCLUDEPICTURE "I:\\王真\\2024\\同步\\化学 人教版
选择性必修1\\T61.TIF" \* MERGEFORMATINET INCLUDEPICTURE "I:\\王真\\2024\\同步\
\化学 人教版 选择性必修1\\T61.TIF" \* MERGEFORMATINET INCLUDEPICTURE "I:\\王真
\\2024\\同步\\化学 人教版 选择性必修1\\T61.TIF" \* MERGEFORMATINET
INCLUDEPICTURE "I:\\王真\\2024\\同步\\化学 人教版 选择性必修1\\T61.TIF" \*
MERGEFORMATINET INCLUDEPICTURE "I:\\王真\\2024\\同步\\化学 人教版 选择性必修1\
\T61.TIF" \* MERGEFORMATINET INCLUDEPICTURE "I:\\王真\\2024\\同步\\化学 人教版
选择性必修1\\T61.TIF" \* MERGEFORMATINET INCLUDEPICTURE "I:\\王真\\2024\\同步\
\教师 word化学 人教版 选择性必修1(活页分不对)\\T61.TIF" \* MERGEFORMATINET
INCLUDEPICTURE "\\\\王真\\i\\王真\\2024\\同步\\教师 word化学 人教版 选择性必修1(活页
分不对)\\T61.TIF" \* MERGEFORMATINET INCLUDEPICTURE "\\\\王真\\i\\王真\\2024\\同步\
\教师 word化学 人教版 选择性必修1(活页分不对)\\T61.TIF" \* MERGEFORMATINET
第2页1
A.题图所示的反应机理中,步骤Ⅰ可理解为 H S中带部分负电荷的 S与催化剂中的M
2
之间发生作用
B.该反应的平衡常数K=
C.该反应的ΔS<0
D.该反应中每消耗1 mol H S,转移电子的数目约为2×6.02×1023
2
8.下列关于微粒的结构和性质的叙述正确的是
A.O 是由极性键构成的极性分子
3
B.ClO −的空间结构为平面三角形
3
C.CS 是空间结构为V形的极性分子
2
D.P 和CH 都是正四面体形分子且键角都为
4 4
9.下列实验中,由实验现象不能得到正确结论的是
选项 实验 现象 结论
将FeCl 溶液加入Mg(OH) 沉淀由白色变为红 Fe(OH) 的溶解度小于
3 2 3
A
悬浊液中,振荡 褐色 Mg(OH) 的溶解度
2
在醋酸钠溶液中滴入酚酞 证明盐类水解是吸热
B 加热后红色加深
溶液并加热 反应
向 1.0 mol·L-1的 NaHCO
3
C 溶液呈黄色 NaHCO 溶液呈碱性
3
溶液中滴加2滴甲基橙
相同的铝片分别与同温同
铝与盐酸反应产生 可能是Cl-对该反应起
D 体积且 c(H+)=1 mol·L-1
气泡较快 到促进作用
的盐酸、硫酸反应
10.室温下,用含少量Mg2+的MnSO 溶液制备MnCO 的过程如图所示。
4 3
已知K (MgF )=5.2×10-11,K (HF)=6.3×10-4。下列说法正确的是
sp 2 a
INCLUDEPICTURE "I:\\王真\\2024\\同步\\化学 人教版 选择性必修1\\T152.TIF" \*
MERGEFORMATINET INCLUDEPICTURE "I:\\王真\\2024\\同步\\化学 人教版 选择性必修1\
\T152.TIF" \* MERGEFORMATINET INCLUDEPICTURE "I:\\王真\\2024\\同步\\教师 word化
学 人教版 选择性必修1(活页分不对)\\T152.TIF" \* MERGEFORMATINET
A.0.1 mol·L-1 NaF溶液中:c(F-)=c(Na+)+c(H+)
第3页1
B.“除镁”得到的上层清液中:c(Mg2+)=
C.0.1 mol·L-1 NaHCO 溶液中:c(CO)=c(H+)+c(H CO )-c(OH-)
3 2 3
D.“沉锰”后的滤液中:c(Na+)+c(H+)=c(OH-)+c(HCO)+2c(CO)
11.下列比较不正确的是
A.晶体熔点由低到高:F < Cl < Br < I
2 2 2 2
B.晶体熔点由高到低:金刚石>碳化硅>晶体硅
C.晶体熔点由高到低:Rb>K>Na
D.晶体熔点由高到低:NaF>NaCl>NaBr>NaI
12.向蓝色CuSO 溶液中滴加氨水会生成蓝色沉淀,再滴加氨水到沉淀刚好全部溶解可得到
4
深蓝色溶液。设N 为阿伏加德罗常数的值,下列说法不正确的是
A
A.SO 2−的VSEPR模型与其空间构型一致
4
B.1mol[Cu(H O) ]2+中含σ键个数为8N
2 4 A
C.标准状况下,22.4LNH 中所含质子数为10N
3 A
D.[Cu(H O) ]2+与[Cu(NH ) ]2+中配位原子分别是O和N
2 4 3 4
13.设N 为阿伏加德罗常数的值。下列说法错误的是
A
A.冰晶体中,1molH O所含的氢键数目为2N
2 A
B.1mol SiO 中含4N 个Si−O键
2 A
C.通常状况下,1molSiO 晶体中含有的分子数为N
2 A
D.12 g金刚石中的共价键数目为2N
A
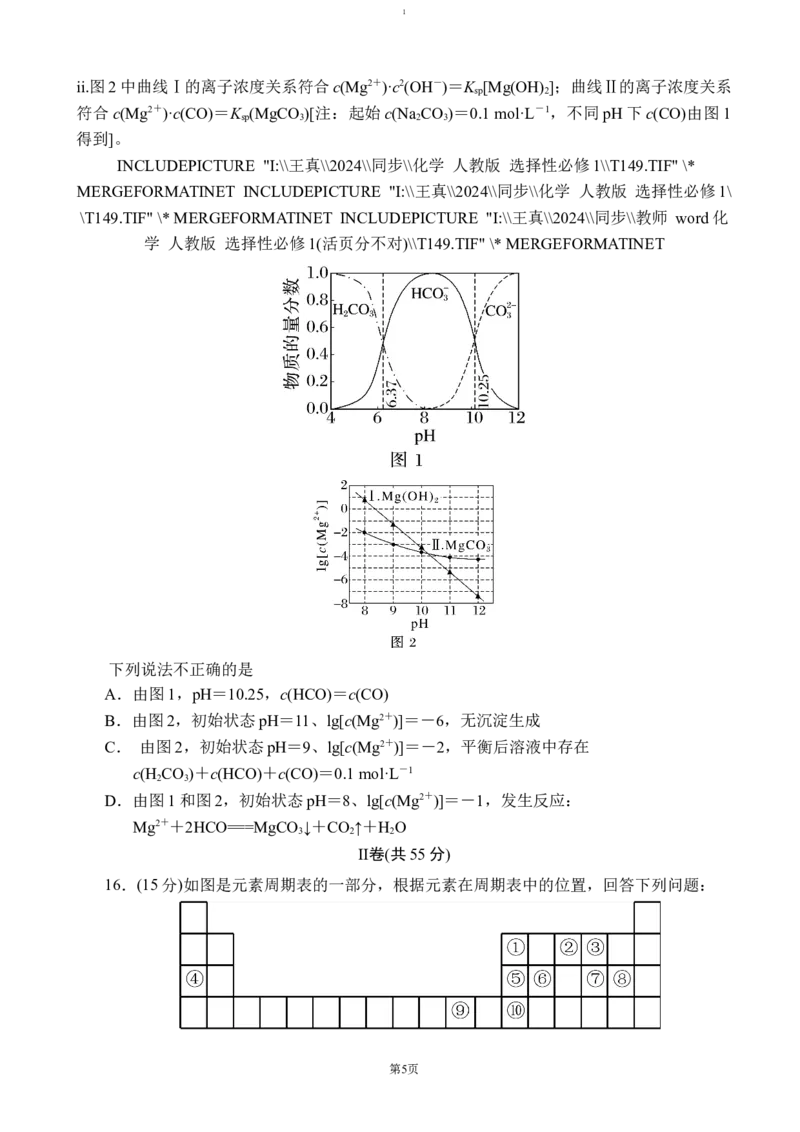
14.我国古代四大发明之一的黑火药爆炸时发生的反应:
2KNO +S+3C=K S+N ↑+3CO ↑。生成物K S的晶体结构如图所示。下列有关说法错误的
3 2 2 2 2
是
A.K元素位于元素周期表s区
B.K+位于S2−构成的四面体空隙中
C.K S晶体中S2−周围最近的K+有4个
2
D.若K S晶体的晶胞边长为a nm,则该晶体的密度为 g·cm−3
2
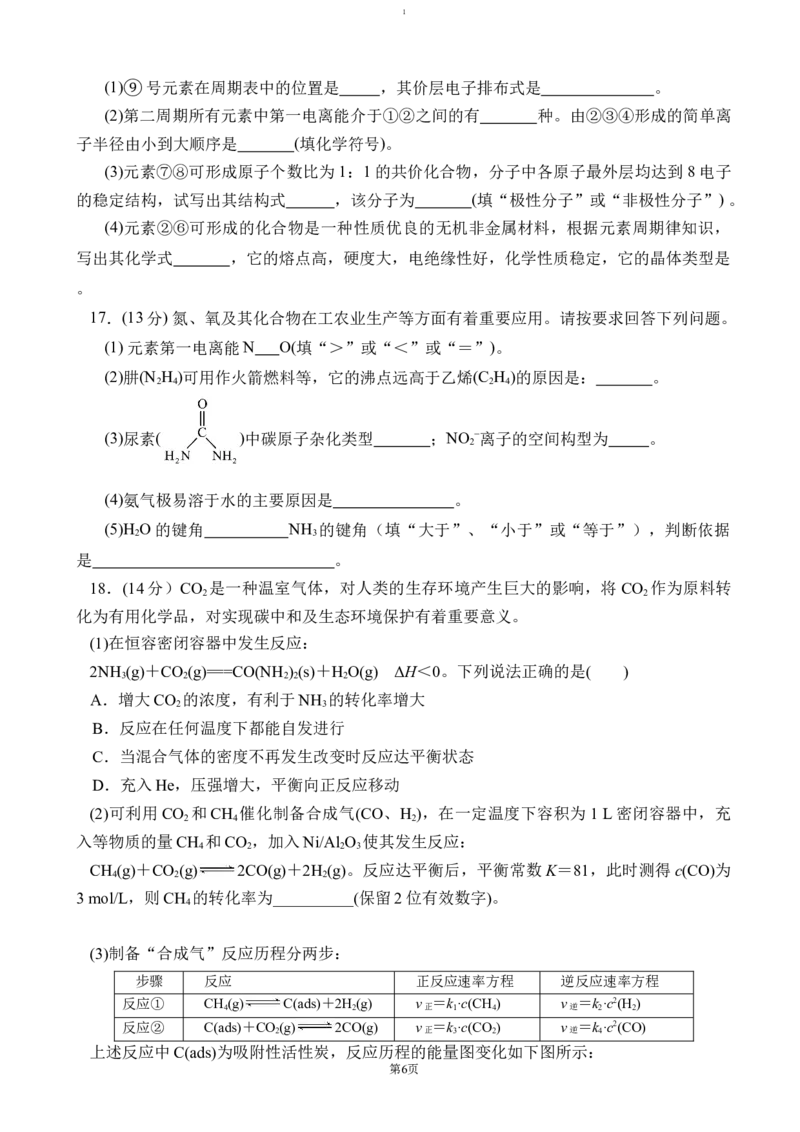
15.利用平衡移动原理,分析一定温度下Mg2+在不同pH的Na CO 体系中的可能产物。
2 3
已知:i.图1中曲线表示Na CO 体系中各含碳粒子的物质的量分数与pH的关系。
2 3
第4页1
ii.图2中曲线Ⅰ的离子浓度关系符合c(Mg2+)·c2(OH-)=K [Mg(OH) ];曲线Ⅱ的离子浓度关系
sp 2
符合c(Mg2+)·c(CO)=K (MgCO )[注:起始c(Na CO )=0.1 mol·L-1,不同pH下c(CO)由图1
sp 3 2 3
得到]。
INCLUDEPICTURE "I:\\王真\\2024\\同步\\化学 人教版 选择性必修1\\T149.TIF" \*
MERGEFORMATINET INCLUDEPICTURE "I:\\王真\\2024\\同步\\化学 人教版 选择性必修1\
\T149.TIF" \* MERGEFORMATINET INCLUDEPICTURE "I:\\王真\\2024\\同步\\教师 word化
学 人教版 选择性必修1(活页分不对)\\T149.TIF" \* MERGEFORMATINET
下列说法不正确的是
A.由图1,pH=10.25,c(HCO)=c(CO)
B.由图2,初始状态pH=11、lg[c(Mg2+)]=-6,无沉淀生成
C. 由图2,初始状态pH=9、lg[c(Mg2+)]=-2,平衡后溶液中存在
c(H CO )+c(HCO)+c(CO)=0.1 mol·L-1
2 3
D.由图1和图2,初始状态pH=8、lg[c(Mg2+)]=-1,发生反应:
Mg2++2HCO===MgCO ↓+CO ↑+H O
3 2 2
II卷(共55分)
16.(15分)如图是元素周期表的一部分,根据元素在周期表中的位置,回答下列问题:
第5页1
(1) 号元素在周期表中的位置是 ,其价层电子排布式是 。
(2)第二周期所有元素中第一电离能介于①②之间的有 种。由②③④形成的简单离
⑨
子半径由小到大顺序是 (填化学符号)。
(3)元素⑦⑧可形成原子个数比为1:1的共价化合物,分子中各原子最外层均达到 8电子
的稳定结构,试写出其结构式 ,该分子为 (填“极性分子”或“非极性分子”) 。
(4)元素②⑥可形成的化合物是一种性质优良的无机非金属材料,根据元素周期律知识,
写出其化学式 ,它的熔点高,硬度大,电绝缘性好,化学性质稳定,它的晶体类型是
。
17.(13分) 氮、氧及其化合物在工农业生产等方面有着重要应用。请按要求回答下列问题。
(1) 元素第一电离能N O(填“>”或“<”或“=”)。
(2)肼(N H )可用作火箭燃料等,它的沸点远高于乙烯(C H )的原因是: 。
2 4 2 4
(3)尿素( )中碳原子杂化类型 ;NO −离子的空间构型为 。
2
(4)氨气极易溶于水的主要原因是 。
(5)H O的键角 NH 的键角(填“大于”、“小于”或“等于”),判断依据
2 3
是 。
18.(14分)CO 是一种温室气体,对人类的生存环境产生巨大的影响,将CO 作为原料转
2 2
化为有用化学品,对实现碳中和及生态环境保护有着重要意义。
(1)在恒容密闭容器中发生反应:
2NH (g)+CO (g)===CO(NH ) (s)+H O(g) ΔH<0。下列说法正确的是( )
3 2 2 2 2
A.增大CO 的浓度,有利于NH 的转化率增大
2 3
B.反应在任何温度下都能自发进行
C.当混合气体的密度不再发生改变时反应达平衡状态
D.充入He,压强增大,平衡向正反应移动
(2)可利用CO 和CH 催化制备合成气(CO、H ),在一定温度下容积为 1 L密闭容器中,充
2 4 2
入等物质的量CH 和CO ,加入Ni/Al O 使其发生反应:
4 2 2 3
CH (g)+CO (g) 2CO(g)+2H (g)。反应达平衡后,平衡常数 K=81,此时测得c(CO)为
4 2 2
3 mol/L,则CH 的转化率为__________(保留2位有效数字)。
4
(3)制备“合成气”反应历程分两步:
步骤 反应 正反应速率方程 逆反应速率方程
反应① CH(g) C(ads)+2H(g) v =k·c(CH) v =k·c2(H )
4 2 正 1 4 逆 2 2
反应② C(ads)+CO(g) 2CO(g) v =k·c(CO) v =k·c2(CO)
2 正 3 2 逆 4
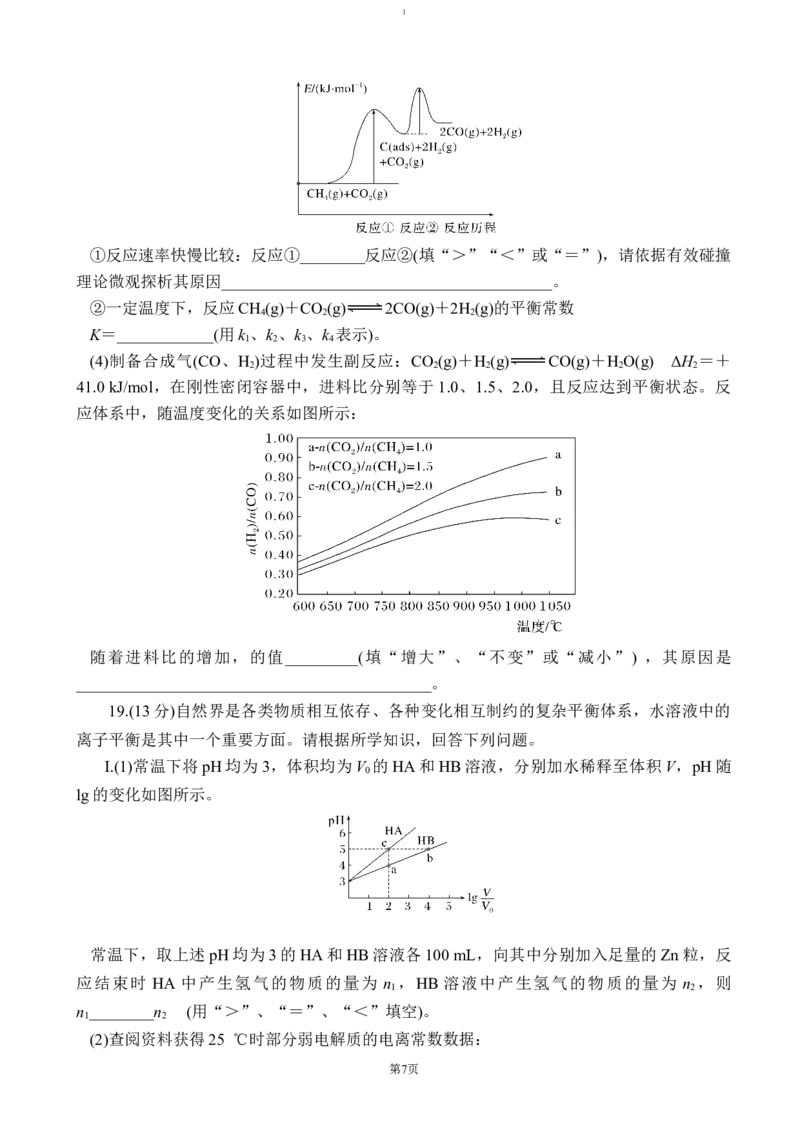
上述反应中C(ads)为吸附性活性炭,反应历程的能量图变化如下图所示:
第6页1
①反应速率快慢比较:反应①________反应②(填“>”“<”或“=”),请依据有效碰撞
理论微观探析其原因_________________________________________。
②一定温度下,反应CH (g)+CO (g) 2CO(g)+2H (g)的平衡常数
4 2 2
K=____________(用k 、k 、k 、k 表示)。
1 2 3 4
(4)制备合成气(CO、H )过程中发生副反应:CO (g)+H (g) CO(g)+H O(g) ΔH =+
2 2 2 2 2
41.0 kJ/mol,在刚性密闭容器中,进料比分别等于 1.0、1.5、2.0,且反应达到平衡状态。反
应体系中,随温度变化的关系如图所示:
随着进料比的增加,的值_________(填“增大”、“不变”或“减小”) ,其原因是
____________________________________________。
19.(13分)自然界是各类物质相互依存、各种变化相互制约的复杂平衡体系,水溶液中的
离子平衡是其中一个重要方面。请根据所学知识,回答下列问题。
Ⅰ.(1)常温下将pH均为3,体积均为V 的HA和HB溶液,分别加水稀释至体积V,pH随
0
lg的变化如图所示。
常温下,取上述pH均为3的HA和HB溶液各100 mL,向其中分别加入足量的Zn粒,反
应结束时 HA 中产生氢气的物质的量为 n ,HB 溶液中产生氢气的物质的量为 n ,则
1 2
n ________n (用“>”、“=”、“<”填空)。
1 2
(2)查阅资料获得25 ℃时部分弱电解质的电离常数数据:
第7页1
化学式 NH ·H O HClO HCO CHCOOH HSCN HCN
3 2 2 3 3
电离 K =4.5×10-7
1.8×10-5 4.0×10-8 1 1.75×10-5 0.13 6.2×10-10
常数 K =4.7×10-11
2
KSCN溶液呈弱碱性,用离子方程式____________________________________。
②现有25 ℃时等浓度的5种溶液:
①
A.NH Cl B.CH COONH C.NH SCN D.NH HCO E.NH HSO
4 3 4 4 4 3 4 4
这5种溶液中NH浓度由大到小的顺序排列是:___________________(填字母)。
③次氯酸钠溶液中通入少量二氧化碳的离子方程式为 _____________________
Ⅱ.亚硫酸盐是一种常见的食品添加剂。为检验某食品中亚硫酸盐含量(通常以1 kg样品中含
SO 的质量计),某研究小组用“碘氧化还原滴定法”进行测定,
2
滴定反应为:H O+SO+I ===SO+2I-+2H+
2 2
实验流程如下:
(3)溶液 B 放于锥形瓶中,加入的指示剂为____________,判断达到滴定终点的依据是
_________________________________________________________________。
(4)下列操作会使测定结果偏大的有__________(填字母)。
A.起始读数时平视,终点读数时俯视
B.未用标准液润洗滴定管
C.装标准液的滴定管,滴定前尖嘴有气泡,滴定后气泡消失
(5)若取样品w g,按方案测得消耗0.010 00 mol·L-1 I 标准溶液V mL,则1 kg样品中含SO
2 2
的质量是________g(用含w、V的代数式表示)。
第8页1
吉林省普通高中 G8 教考联盟 2024-2025 学年上学期期末考试
高二年级 化学学科参考答案(C 卷)
一、 选择题
1 2 3 4 5 6 7 8
D A D A D D A A
9 10 11 12 13 14 15
C C C B C C C
二、填空题
16.【答案】(15分,除特殊标记外,每空2分)
(1)第四周期第ⅠB族 3d104s1
(2) 3 Na+