文档内容
2024~2025 学年度第一学期期中重点校联考
高二化学
可能用到的原子量:H-1 C-12 O-16 S-32
第I卷(共42分)
一、选择题(本题共14小题,每题3分,共42分,每题只有一个正确选项)
1.我国提出2060年实现碳中和的目标,下列措施有助于实现该目标的是
A.加速可燃冰的开采
B.光伏发电替代燃煤发电
C.利用三元催化剂减少汽车尾气的污染
D.将生活垃圾进行集中燃烧
2.2023年5月10日,,天舟六号货运飞船成功发射,标志着我国航天事业进入到高质量发展新阶段。下列
不能作为火箭推进剂的是
A.液氮——液氢 B.液氧——液氢
C.液态二氧化氮——肼 D.液氧——煤油
3.下列有关描述正确的是
A.已知:H+(aq)+OH-(aq)=H O(1) H=-57.3kJ/mol,则稀氨水和稀HSO 溶液完全反应生成1molH O(1)时,
2 2 4 2
放出热量少于57.3kJ
△
B.热化学方程式各物质前的化学计量数既可以是整数也可以是分数,既表示分子数也表示物质的量
C.温度和压强都是通过增大活化分子百分数来加快化学反应速率
D.活化能大小不仅意味着一般分子成为活化分子的难易,也会对化学反应前后的能量变化产生影响
4.二氧化硫的催化氧化反应:2SO (g)+O(g) 2SO (g)是工业制硫酸的重要反应之一,下列说法不正确的
2 2 3
是
A.该反应加入催化剂是为了加快反应速率
B.已知该催化氧化反应K(300℃)>K(350℃),则该反应正向是放热反应
C.煅烧硫铁矿(主要成分FeS)可获得SO ,将矿石粉碎成小颗粒可提高反应的平衡转化率
2 2
D.保持温度不变,平衡后增大O 的浓度,SO 转化率变大
2 2
5.室温下,下列各组离子在指定条件下,一定能大量共存的是
A.能使蓝色石蕊试纸变红色的溶液中:K+、Na+、 、
B.c(H+)=1×10-1mol/L的溶液中:Cu2+、Al3+、 、
C.能使淀粉碘化钾试纸变蓝的溶液中:Na+、 、S2-、Br-
D.水电离出的c(H+)=1x10-12mo!L~I的溶液中:Na+、Mg2+、Cl-、
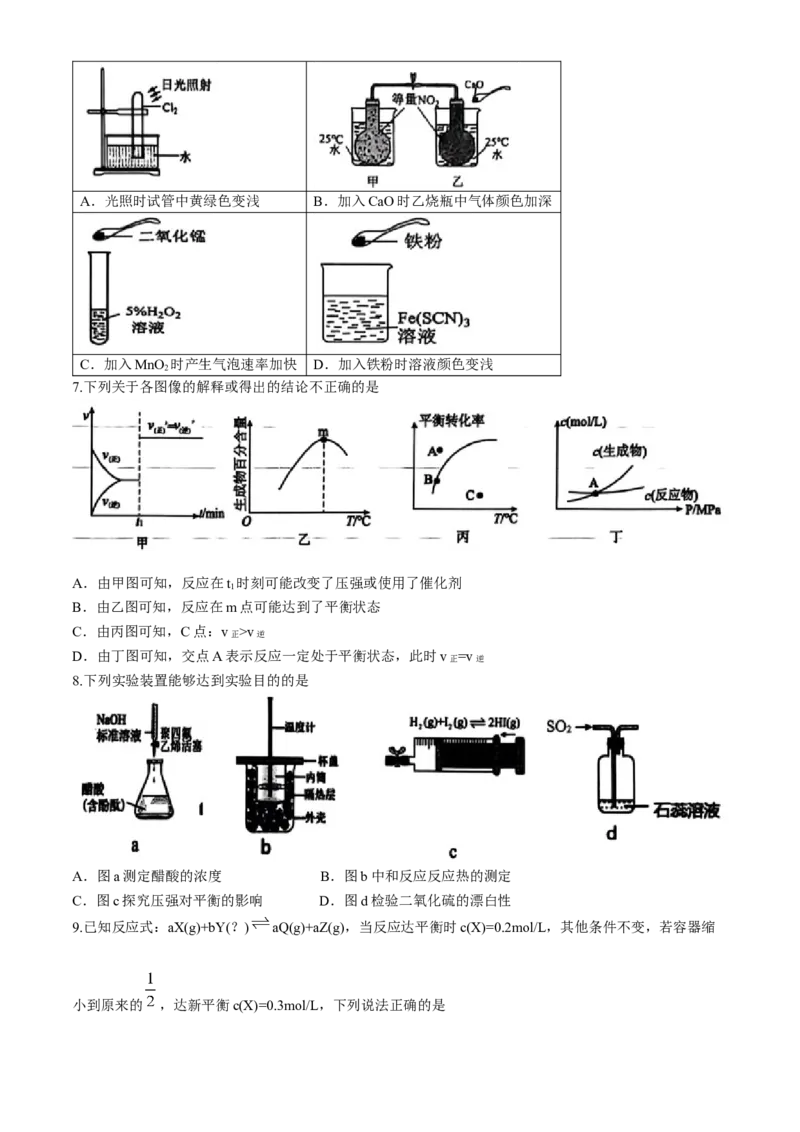
6.下列装置所示的过程与勒夏特列原理无关的是A.光照时试管中黄绿色变浅 B.加入CaO时乙烧瓶中气体颜色加深
C.加入MnO 时产生气泡速率加快 D.加入铁粉时溶液颜色变浅
2
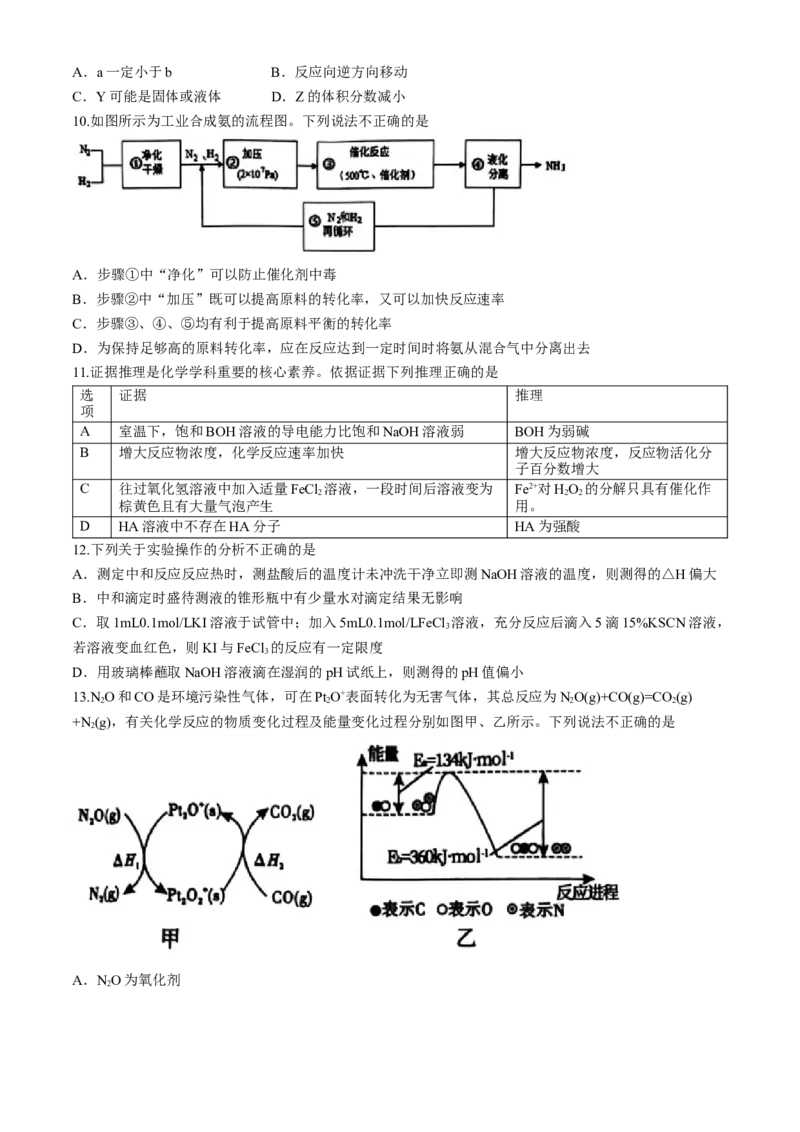
7.下列关于各图像的解释或得出的结论不正确的是
A.由甲图可知,反应在t 时刻可能改变了压强或使用了催化剂
1
B.由乙图可知,反应在m点可能达到了平衡状态
C.由丙图可知,C点:v >v
正 逆
D.由丁图可知,交点A表示反应一定处于平衡状态,此时v =v
正 逆
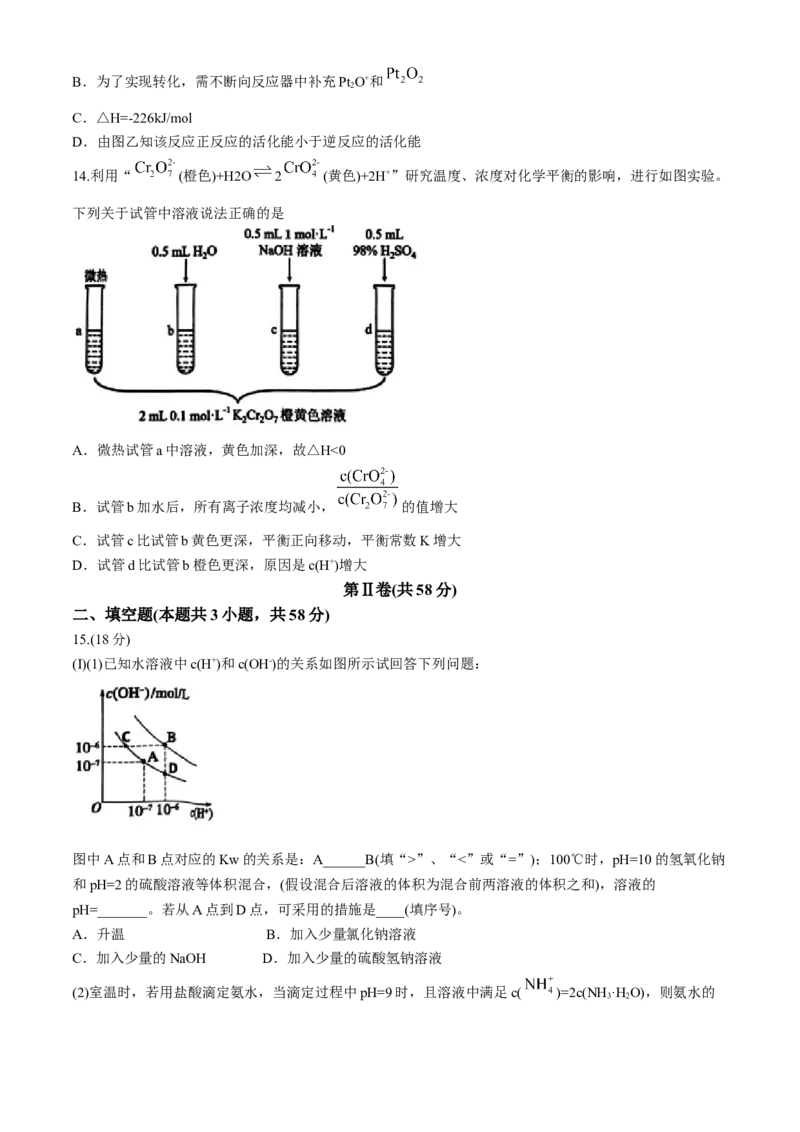
8.下列实验装置能够达到实验目的的是
A.图a测定醋酸的浓度 B.图b中和反应反应热的测定
C.图c探究压强对平衡的影响 D.图d检验二氧化硫的漂白性
9.已知反应式:aX(g)+bY(?) aQ(g)+aZ(g),当反应达平衡时c(X)=0.2mol/L,其他条件不变,若容器缩
小到原来的 ,达新平衡c(X)=0.3mol/L,下列说法正确的是A.a一定小于b B.反应向逆方向移动
C.Y可能是固体或液体 D.Z的体积分数减小
10.如图所示为工业合成氨的流程图。下列说法不正确的是
A.步骤①中“净化”可以防止催化剂中毒
B.步骤②中“加压”既可以提高原料的转化率,又可以加快反应速率
C.步骤③、④、⑤均有利于提高原料平衡的转化率
D.为保持足够高的原料转化率,应在反应达到一定时间时将氨从混合气中分离出去
11.证据推理是化学学科重要的核心素养。依据证据下列推理正确的是
选 证据 推理
项
A 室温下,饱和BOH溶液的导电能力比饱和NaOH溶液弱 BOH为弱碱
B 增大反应物浓度,化学反应速率加快 增大反应物浓度,反应物活化分
子百分数增大
C 往过氧化氢溶液中加入适量FeCl 溶液,一段时间后溶液变为 Fe2+对HO 的分解只具有催化作
2 2 2
棕黄色且有大量气泡产生 用。
D HA溶液中不存在HA分子 HA为强酸
12.下列关于实验操作的分析不正确的是
A.测定中和反应反应热时,测盐酸后的温度计未冲洗干净立即测NaOH溶液的温度,则测得的△H偏大
B.中和滴定时盛待测液的锥形瓶中有少量水对滴定结果无影响
C.取1mL0.1mol/LKI溶液于试管中;加入5mL0.1mol/LFeCl 溶液,充分反应后滴入5滴15%KSCN溶液,
3
若溶液变血红色,则KI与FeCl 的反应有一定限度
3
D.用玻璃棒蘸取NaOH溶液滴在湿润的pH试纸上,则测得的pH值偏小
13.N O和CO是环境污染性气体,可在Pt O+表面转化为无害气体,其总反应为NO(g)+CO(g)=CO (g)
2 2 2 2
+N (g),有关化学反应的物质变化过程及能量变化过程分别如图甲、乙所示。下列说法不正确的是
2
A.NO为氧化剂
2B.为了实现转化,需不断向反应器中补充Pt O+和
2
C.△H=-226kJ/mol
D.由图乙知该反应正反应的活化能小于逆反应的活化能
14.利用“ (橙色)+H2O 2 (黄色)+2H+”研究温度、浓度对化学平衡的影响,进行如图实验。
下列关于试管中溶液说法正确的是
A.微热试管a中溶液,黄色加深,故△H<0
B.试管b加水后,所有离子浓度均减小, 的值增大
C.试管c比试管b黄色更深,平衡正向移动,平衡常数K增大
D.试管d比试管b橙色更深,原因是c(H+)增大
第Ⅱ卷(共58分)
二、填空题(本题共3小题,共58分)
15.(18分)
(I)(1)已知水溶液中c(H+)和c(OH-)的关系如图所示试回答下列问题:
图中A点和B点对应的Kw的关系是:A______B(填“>”、“<”或“=”);100℃时,pH=10的氢氧化钠
和pH=2的硫酸溶液等体积混合,(假设混合后溶液的体积为混合前两溶液的体积之和),溶液的
pH=_______。若从A点到D点,可采用的措施是____(填序号)。
A.升温 B.加入少量氯化钠溶液
C.加入少量的NaOH D.加入少量的硫酸氢钠溶液
(2)室温时,若用盐酸滴定氨水,当滴定过程中pH=9时,且溶液中满足c( )=2c(NH·H O),则氨水的
3 2电离平衡常数K(NH ·H O)= _______(填数值)。
b 3 2
(Ⅱ)室温下,现有四种溶液,按要求填空:
①pH=3的CHCOOH溶液(Ka≈10-5),②pH=3的盐酸,③pH=11的氨水,④pH=11的NaOH溶液。
3
(3)分别向各溶液中加入100mL水后,溶液的氢离子浓度由大到小顺序是_______(填对应序号)。
(4)②、③溶液混合后,pH=7,消耗溶液的体积:②_______③(填“>”、“<”或“=”)。
(5)等体积的①、②溶液分别与足量铝粉反应,生成H 的量最大的是_______(填对应序号)。
2
(Ⅲ)次磷酸(H PO )是一种精细化工产品,向10mLH PO 溶液中加入30mL等物质的量浓度的NaOH溶液后,
3 2 3 2
所得的溶液中只有 和OH-两种阴离子。(已知,K(H PO )=5.9×10-2)
a 3 2
(6)写出次磷酸的电离方程式______________。
(7)H PO 溶液加水稀释过程中, 的数值_______(填“变大”“变小”或“不变”)。
3 2
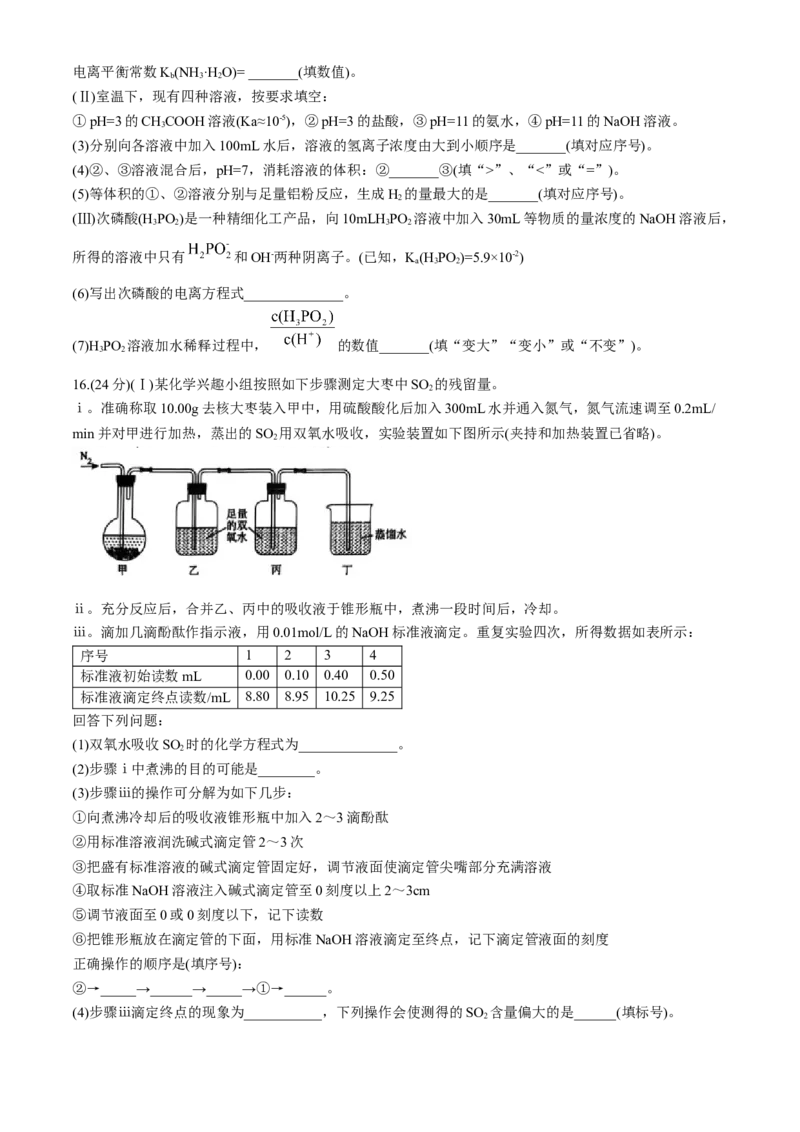
16.(24分)(Ⅰ)某化学兴趣小组按照如下步骤测定大枣中SO 的残留量。
2
ⅰ。准确称取10.00g去核大枣装入甲中,用硫酸酸化后加入300mL水并通入氮气,氮气流速调至0.2mL/
min并对甲进行加热,蒸出的SO 用双氧水吸收,实验装置如下图所示(夹持和加热装置已省略)。
2
ⅱ。充分反应后,合并乙、丙中的吸收液于锥形瓶中,煮沸一段时间后,冷却。
ⅲ。滴加几滴酚酞作指示液,用0.01mol/L的NaOH标准液滴定。重复实验四次,所得数据如表所示:
序号 1 2 3 4
标准液初始读数mL 0.00 0.10 0.40 0.50
标准液滴定终点读数/mL 8.80 8.95 10.25 9.25
回答下列问题:
(1)双氧水吸收SO 时的化学方程式为______________。
2
(2)步骤ⅰ中煮沸的目的可能是________。
(3)步骤ⅲ的操作可分解为如下几步:
①向煮沸冷却后的吸收液锥形瓶中加入2~3滴酚酞
②用标准溶液润洗碱式滴定管2~3次
③把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴部分充满溶液
④取标准NaOH溶液注入碱式滴定管至0刻度以上2~3cm
⑤调节液面至0或0刻度以下,记下读数
⑥把锥形瓶放在滴定管的下面,用标准NaOH溶液滴定至终点,记下滴定管液面的刻度
正确操作的顺序是(填序号):
②→_____→______→_____→①→______。
(4)步骤ⅲ滴定终点的现象为___________,下列操作会使测得的SO 含量偏大的是______(填标号)。
2a.滴定前尖嘴处有气泡,滴定后消失
b.盛装0.01mol/L的NaOH标准液的仪器未用标准液润洗
c.滴定前读数时仰视刻度线,滴定终点读数时俯视刻度线
d.氮气流速过快
(5)该大枣中SO 的残留量为________g/Kg(保留小数点后两位)。
2
(Ⅱ)同学们研究化学反应速率时设计了如下实验。
ⅰ。甲同学用量气法测量化学反应的速率
(1)图2与图1相比的优点是_________。
(2)也可以将图1中的注射器改为连通器如图3,为了准确地测量H2的体积,在读取反应后甲管中液面的读
数时,应注意________(填写序号)。
a.视线与凹液面最低处相平
b.恢复室温时读数
c.等待片刻,至乙管内液面不再上升时读数
d.读数时应上、下移动乙管,使甲、乙两管液面相平
(3)若想用图3测定二氧化碳的体积,结合平衡移动理论,为了减小误差,乙管中应盛放________(填试剂名
称,已知:CO+H O HCO,HCO H++ )
2 2 2 3 2 3
ⅱ。乙同学多角度探究硫代硫酸钠溶液与稀硫酸的反应速率的影响因素,设计了以下方案:
实验编号 实验温 NaSO HSO HO
2 2 3 2 4 2
度
0.1mol/L 0.2mol/L
① 20℃ 10mL 10mL 20mL
② 20℃ 10mL 15mL V
1
③ 40℃ 10mL V 20mL
2
(4)写出NaSO 溶液与稀硫酸反应的离子反应方程式为:__________。
2 2 3
(5)依据探究方案,表中V=________mL,设计实验②的目的是探究_________。
2
17.(16分)CO 资源化是实现“双碳”目标的重要途径。利用CO 可制备CHCHOH。
2 2 3 2
已知:①2H(g)+O(g)=2HO(g) H=-484kJ/mol
2 2 2 1
②C HOH(g)+3O (g)=3HO(g)+2CO(g) H=-1277 kJ/mol
2 5 2 2 △2 2
(1) H_______(填“是”或“不是”)H (g)的燃烧热。
1 2 △
(2)根据已知,反应2CO(g)+6H(g)=C HOH(g)+3H O(g) H=________。
△ 2 2 2 5 2
(3)在恒温恒容条件下,发生(2)反应,下列情况一定表明反应达到平衡状态的是______(填标号)。
△A.气体总压强保持不变 B.混合气体密度保持不变
C.气体平均摩尔质量保持不变 D.反应物转化率之比保持不变
(4)在起始容积相同、温度相同的甲、乙、两三个容器中都充入1molCO (g)、3molH (g),发生(2)的反应,
2 2
在不同条件下达到平衡,如下表所示:
容器 甲 乙 丙
条件 恒温、恒容 绝热、恒 恒温、恒压
容
二氧化碳转化率 α α α
甲 乙 丙
平衡常数K K K K
甲 乙 丙
达到平衡时所用时间/min t t t
甲 乙 丙
则K _______K (填“>”、“<”或“=”,下同);t ______t ;α ______α ;
甲 乙 甲 乙 乙 丙
(5)在一定温度下,向容积为1L的恒容密闭容器中,充入1molCO (g)、xmolH (g),发生(2)的反应,测得平
2 2
衡体系中,C HOH(g)的体积分数φ与x的关系如图所示。
2 5
①在m、n、p点中,CO 的转化率最大的是_______点(填字母);
2
②n点氢气的转化率为__________。
2024~2025 学年度第一学期期中重点校联考高二化学参考答案
一、选择题(每道题3分,共42分)
1-5:BAACB 6-10:CDAAC 11-14:DCBD
二、填空题(共58分)
15.(每空2分,共18分)
(I)(1)<;6;D(每空2分)
(2)2×10-5(2分)
(Ⅱ)(3)①>②>④>③(2分)
(4)>(2分)
(5)①(2分)
(Ⅲ)(6)H PO H++ (可逆号写错得1分、物质写错0分)(2分)
3 2
(7)变小(2分)
16.(每空2分,共24分)
(I)(1)H O+SO=H SO
2 2 2 2 4
(2)除去(未和SO 反应的或者过量的)H O(合理即可)
2 2 2
(3)②④③⑤①⑥
(4)滴入最后半滴标准液,溶液由无色变为浅红色(1分,答红色不给分),且半分钟内不褪色(1分)ab(多选不
得分,漏选一个得1分)
(5)0.28
(II)(1)可以控制反应的发生与停止
(2)abd(多选不得分,漏选一个得1分)
(3)饱和NaHCO 溶液(不答饱和得1分)
3
(4) +2H+=S↓+SO ↑+H O(未配平得1分,物质写错0分)
2 2
(5)10;其他条件相同时,不同浓度硫酸对反应速率的影响(合理即可)
17.(共16分)
(1)不是(2分)
(2) H=-175kJ/mol(2分)(不写单位不给分)
(3)AC(2分,多选不得分,漏选一个得1分)
△
(4)>(2分);>(2分);<(2分)
(5)p(2分);75%(2分)