文档内容
怀远县 2024-2025 学年第一学期期中教学质量检测
高二化学试卷
时间:75分钟 满分:100分
注意事项:
1.考试范围:选择性必修1【第一章第二章(1-3节)】
2所有答案必须用0.5mm黑色水笔写在答题卷上,写在本试卷上无效。
3.可能用到的相对原子质量:H-1 C-12 O-16 Na-23 Mg-24 Al-27 S-32
Cl-35.5 Fe-56 Cu-64 Ag-108 Pb-207
一、选择题:本题共14小题,每题3分,共42分。在每小题给出的四个选项中,只有一项
是符合题目要求的。
1.化学与生活、生产联系密切,下列说法错误的是( )
A.“冰寒于水”,说明相同条件下等质量冰的能量比液态水低
B.将煤气化,有利于提供更多的能量,而且有效地减少温室气体的产生
C.食品放入冰箱中,因为温度低,变质速率慢,所以食品能够保存较长时间
D.“暖贴”主要成分为铁粉、活性炭、无机盐等合成的聚合物,其发热利用了原电池原理
2. 为阿伏加德罗常数的值,下列叙述正确的是( )
A.常温常压下, 气体含有的分子数小于
B. 的水溶液中含氧原子的数目为
C.56g Fe与 在点燃条件下充分反应可最多转移电子为
D. 分别与足量 和 完全反应,得到的HCl分子数均为
3.对可逆反应 下列叙述正确的是( )
A.达到化学平衡时, 和NO的物质的量一定相等
B.化学反应速率关系是:
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.单位时间内生成x mol NO的同时,生成 ,则反应达到平衡状态
4.关于 的化学反应,下列表示的反应速率最大的是( )
A. B.C. D.
5.下列说法错误的有几项( )
①放热反应不需要加热就能发生
②需要加热才能发生的反应都是吸热反应
③等量的氢气和氧气分别完全燃烧生成气态水和液态水,前者放出的热量多
④化学反应放热还是吸热,决定于生成物具有的总能量和反应物具有的总能量的大小
⑤ 表示常温常压下,在恒温密闭容器中当有 和
反应生成2molHI时放出的热量小于( )
A.2项 B.3项 C.4项 D.5项
6.下图电解池I和II中, 、 、 和d均为Pt电极。电解过程中,电极b和d上没有气体逸出,但质量均
增大,且增重 。符合上述实验结果的盐溶液是( )
选项 X Y
A
B
C
D
7.下列推论正确的是( )
A. ,碳的燃烧热等于
B.C(石墨,s) (金刚石,s) ,则由石墨制取金刚石的反应是吸热反应,石墨
比金刚石稳定
C. ,则含20gNaOH的稀溶液与稀硫酸完全反应,
通过计算得中和热为
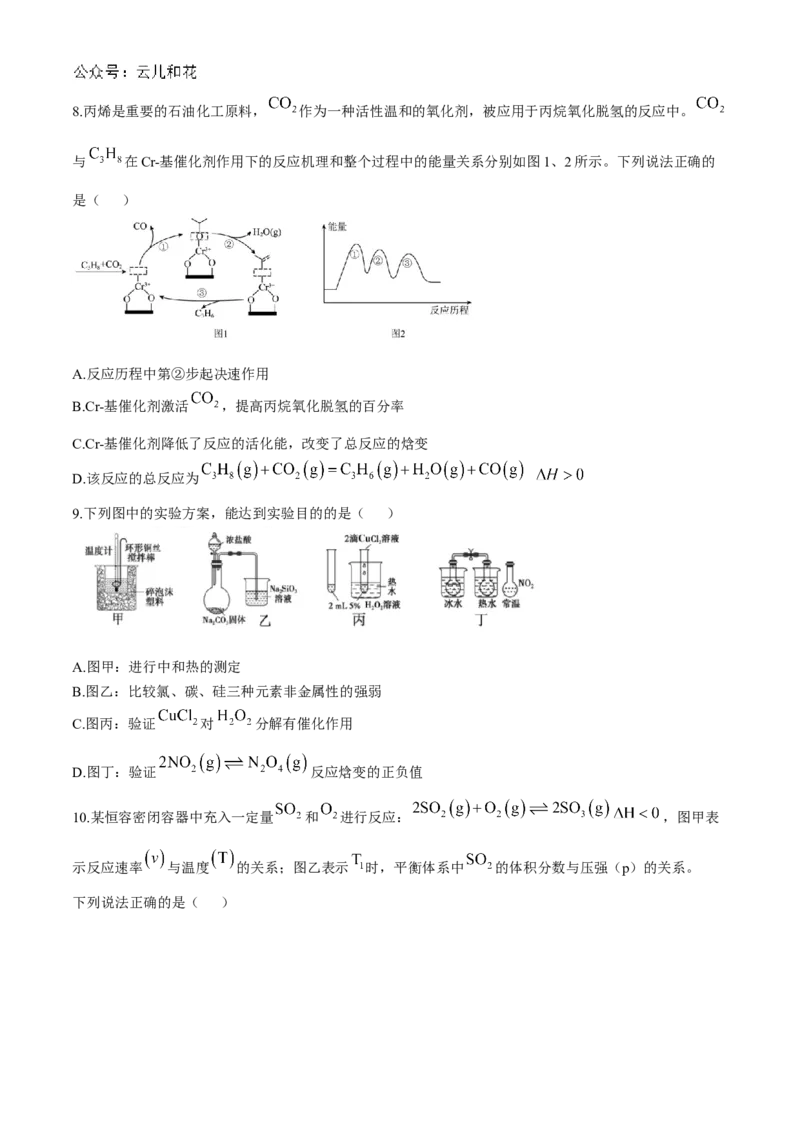
D. ; ,则8.丙烯是重要的石油化工原料, 作为一种活性温和的氧化剂,被应用于丙烷氧化脱氢的反应中。
与 在Cr-基催化剂作用下的反应机理和整个过程中的能量关系分别如图1、2所示。下列说法正确的
是( )
A.反应历程中第②步起决速作用
B.Cr-基催化剂激活 ,提高丙烷氧化脱氢的百分率
C.Cr-基催化剂降低了反应的活化能,改变了总反应的焓变
D.该反应的总反应为
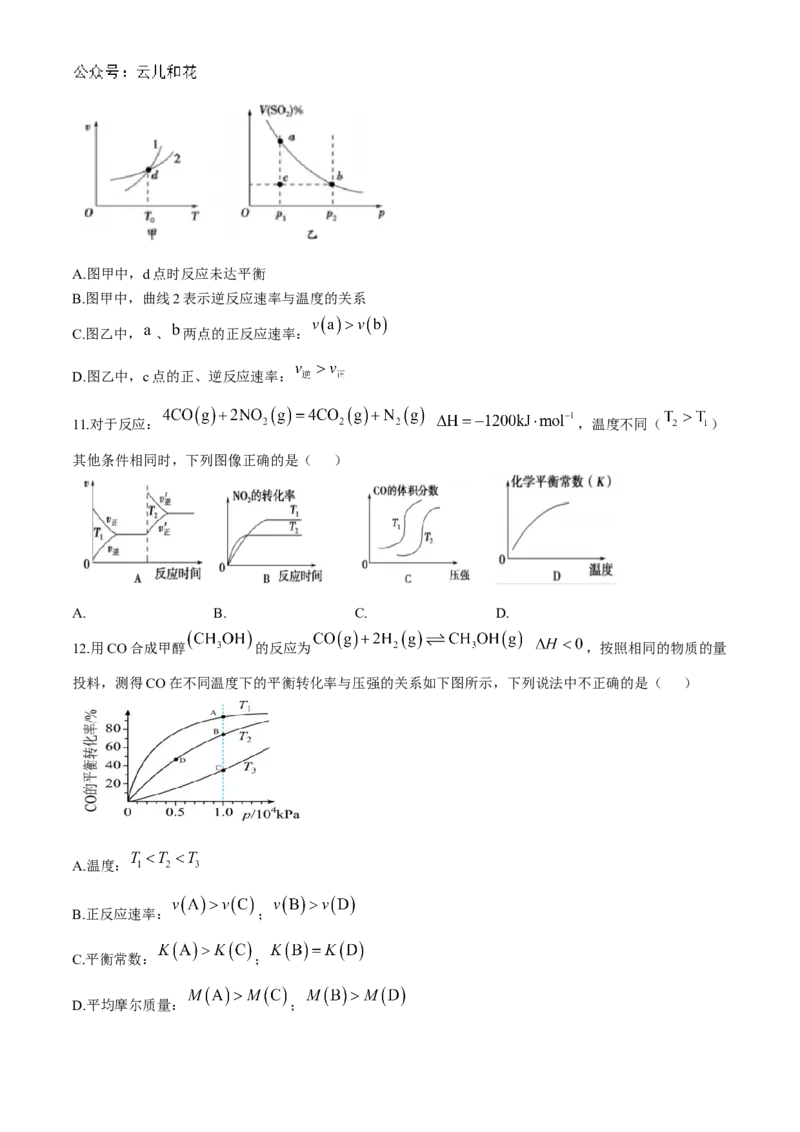
9.下列图中的实验方案,能达到实验目的的是( )
A.图甲:进行中和热的测定
B.图乙:比较氯、碳、硅三种元素非金属性的强弱
C.图丙:验证 对 分解有催化作用
D.图丁:验证 反应焓变的正负值
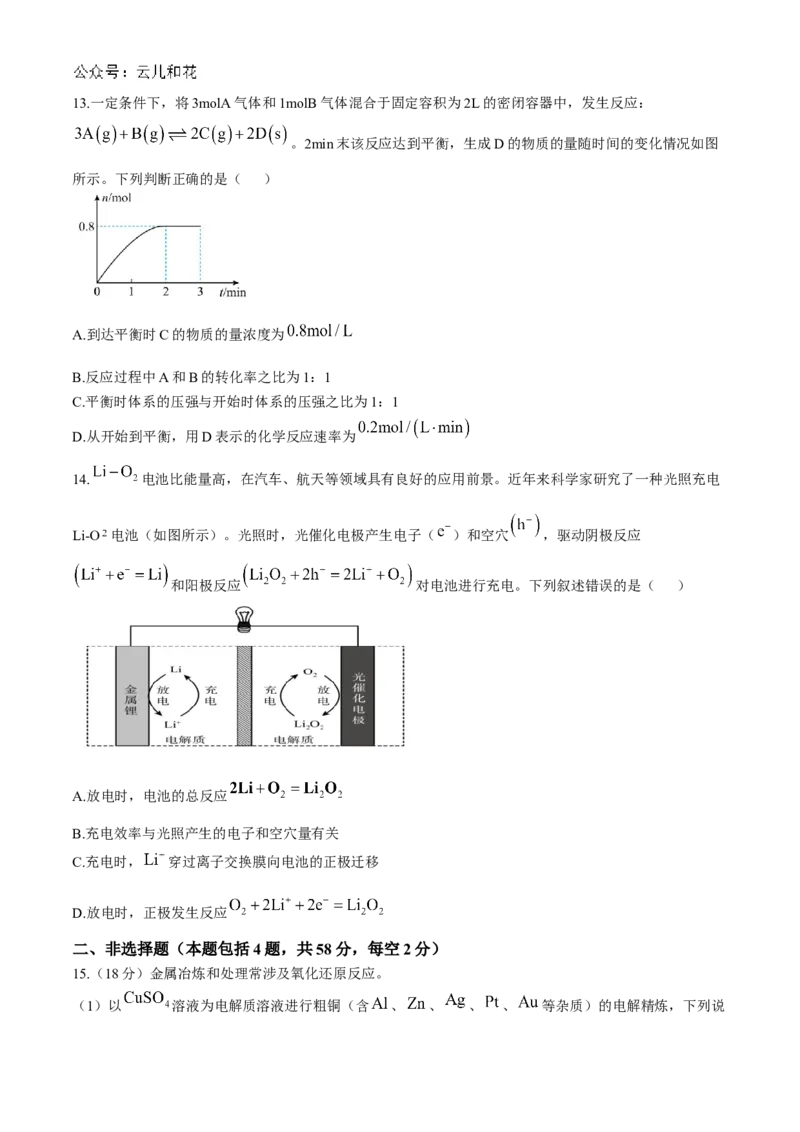
10.某恒容密闭容器中充入一定量 和 进行反应: ,图甲表
示反应速率 与温度 的关系;图乙表示 时,平衡体系中 的体积分数与压强(p)的关系。
下列说法正确的是( )A.图甲中,d点时反应未达平衡
B.图甲中,曲线2表示逆反应速率与温度的关系
C.图乙中, 、 两点的正反应速率:
D.图乙中,c点的正、逆反应速率:
11.对于反应: ,温度不同( )
其他条件相同时,下列图像正确的是( )
A. B. C. D.
12.用CO合成甲醇 的反应为 ,按照相同的物质的量
投料,测得CO在不同温度下的平衡转化率与压强的关系如下图所示,下列说法中不正确的是( )
A.温度:
B.正反应速率: ;
C.平衡常数: ;
D.平均摩尔质量: ;13.一定条件下,将3molA气体和1molB气体混合于固定容积为2L的密闭容器中,发生反应:
。2min末该反应达到平衡,生成D的物质的量随时间的变化情况如图
所示。下列判断正确的是( )
A.到达平衡时C的物质的量浓度为
B.反应过程中A和B的转化率之比为1:1
C.平衡时体系的压强与开始时体系的压强之比为1:1
D.从开始到平衡,用D表示的化学反应速率为
14. 电池比能量高,在汽车、航天等领域具有良好的应用前景。近年来科学家研究了一种光照充电
Li-O 电池(如图所示)。光照时,光催化电极产生电子( )和空穴 ,驱动阴极反应
和阳极反应 对电池进行充电。下列叙述错误的是( )
A.放电时,电池的总反应
B.充电效率与光照产生的电子和空穴量有关
C.充电时, 穿过离子交换膜向电池的正极迁移
D.放电时,正极发生反应
二、非选择题(本题包括4题,共58分,每空2分)
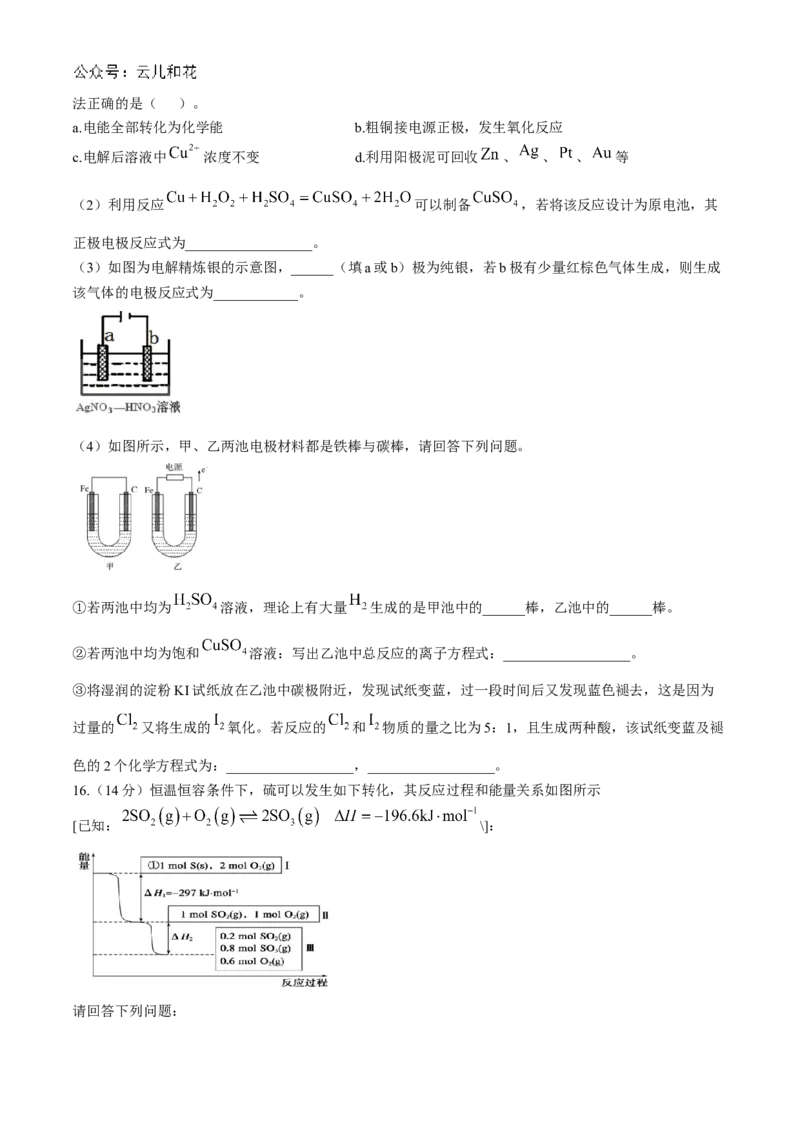
15.(18分)金属冶炼和处理常涉及氧化还原反应。
(1)以 溶液为电解质溶液进行粗铜(含 、 、 、 、 等杂质)的电解精炼,下列说法正确的是( )。
a.电能全部转化为化学能 b.粗铜接电源正极,发生氧化反应
c.电解后溶液中 浓度不变 d.利用阳极泥可回收 、 、 、 等
(2)利用反应 可以制备 ,若将该反应设计为原电池,其
正极电极反应式为__________________。
(3)如图为电解精炼银的示意图,______(填a或b)极为纯银,若b极有少量红棕色气体生成,则生成
该气体的电极反应式为____________。
(4)如图所示,甲、乙两池电极材料都是铁棒与碳棒,请回答下列问题。
①若两池中均为 溶液,理论上有大量 生成的是甲池中的______棒,乙池中的______棒。
②若两池中均为饱和 溶液:写出乙池中总反应的离子方程式:__________________。
③将湿润的淀粉KI试纸放在乙池中碳极附近,发现试纸变蓝,过一段时间后又发现蓝色褪去,这是因为
过量的 又将生成的 氧化。若反应的 和 物质的量之比为5:1,且生成两种酸,该试纸变蓝及褪
色的2个化学方程式为:__________________,__________________。
16.(14分)恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图所示
[已知: \]:
请回答下列问题:(1)16g固态硫充分燃烧放出的热量为__________________。
(2) ____________。
(3)将Ⅲ中的混合气体通入足量的NaOH溶液中充分反应后最多消耗NaOH______克,若溶液中发生了氧
化还原反应,则该过程的离子方程式为________________________。
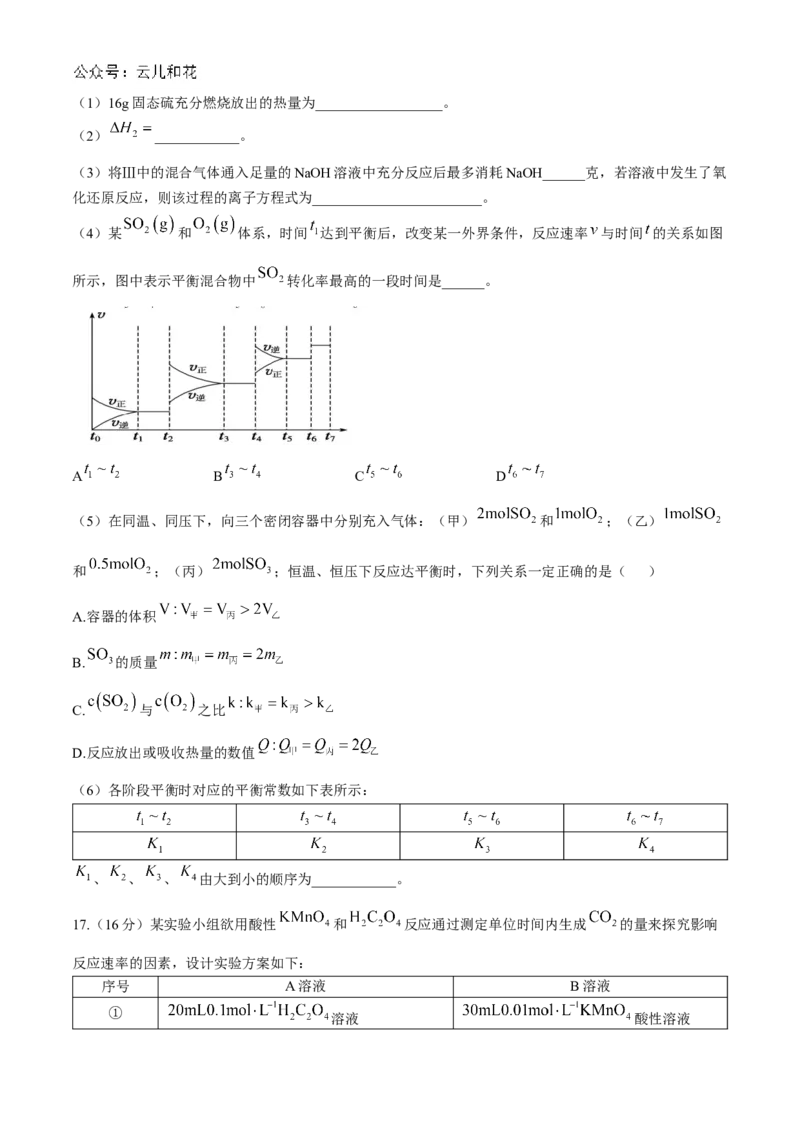
(4)某 和 体系,时间 达到平衡后,改变某一外界条件,反应速率 与时间 的关系如图
所示,图中表示平衡混合物中 转化率最高的一段时间是______。
A B C D
(5)在同温、同压下,向三个密闭容器中分别充入气体:(甲) 和 ;(乙)
和 ;(丙) ;恒温、恒压下反应达平衡时,下列关系一定正确的是( )
A.容器的体积
B. 的质量
C. 与 之比
D.反应放出或吸收热量的数值
(6)各阶段平衡时对应的平衡常数如下表所示:
、 、 、 由大到小的顺序为____________。
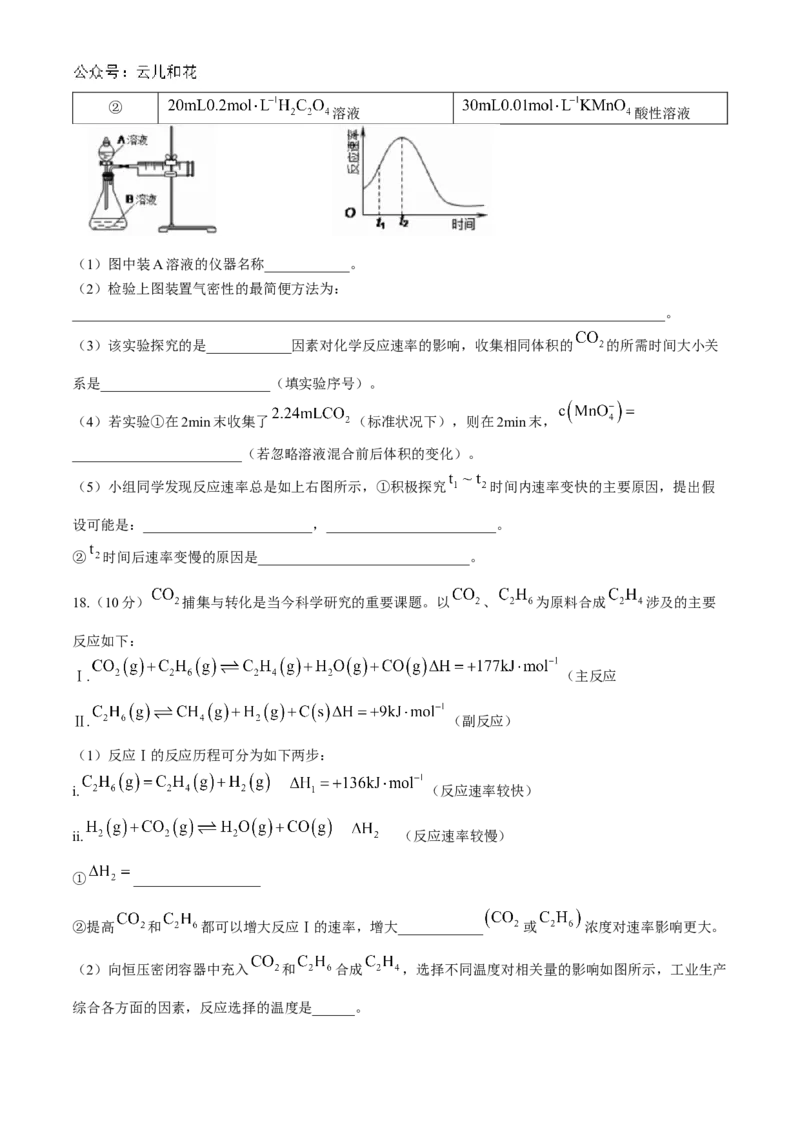
17.(16分)某实验小组欲用酸性 和 反应通过测定单位时间内生成 的量来探究影响
反应速率的因素,设计实验方案如下:
序号 A溶液 B溶液
①
溶液 酸性溶液②
溶液 酸性溶液
(1)图中装A溶液的仪器名称____________。
(2)检验上图装置气密性的最简便方法为:
____________________________________________________________________________________。
(3)该实验探究的是____________因素对化学反应速率的影响,收集相同体积的 的所需时间大小关
系是________________________(填实验序号)。
(4)若实验①在2min末收集了 (标准状况下),则在2min末,
________________________(若忽略溶液混合前后体积的变化)。
(5)小组同学发现反应速率总是如上右图所示,①积极探究 时间内速率变快的主要原因,提出假
设可能是:________________________,________________________。
② 时间后速率变慢的原因是______________________________。
18.(10分) 捕集与转化是当今科学研究的重要课题。以 、 为原料合成 涉及的主要
反应如下:
Ⅰ. (主反应
Ⅱ. (副反应)
(1)反应Ⅰ的反应历程可分为如下两步:
i. (反应速率较快)
ii. (反应速率较慢)
① __________________
②提高 和 都可以增大反应Ⅰ的速率,增大____________ 或 浓度对速率影响更大。
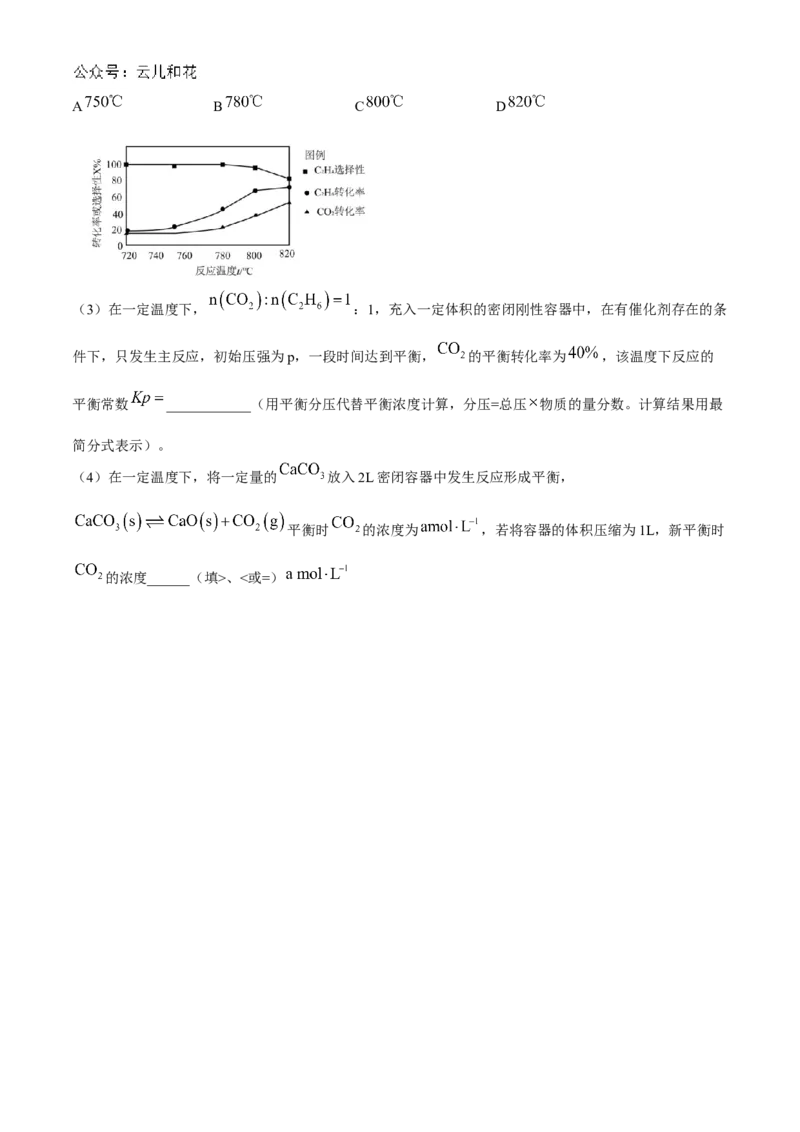
(2)向恒压密闭容器中充入 和 合成 ,选择不同温度对相关量的影响如图所示,工业生产
综合各方面的因素,反应选择的温度是______。A B C D
(3)在一定温度下, :1,充入一定体积的密闭刚性容器中,在有催化剂存在的条
件下,只发生主反应,初始压强为p,一段时间达到平衡, 的平衡转化率为 ,该温度下反应的
平衡常数 ____________(用平衡分压代替平衡浓度计算,分压=总压 物质的量分数。计算结果用最
简分式表示)。
(4)在一定温度下,将一定量的 放入2L密闭容器中发生反应形成平衡,
平衡时 的浓度为 ,若将容器的体积压缩为1L,新平衡时
的浓度______(填>、<或=)怀远县 2024-2025 学年度第一学期期中教学质量检测
高二化学答案
一、单选题(本题共14小题,每题3分,共42分)
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14
答案 B A D A C A B D D D B B B C
二、填空题(共58分)(没有配平的反应式均不给分)
15.(每空2分,共18分)
(1)b
(2)
(3)b
(4)①C Fe(答名称也可以)
② (不写电解或通电条件的不给分,↑不写不扣分)
(3)
16.(每空2分,共14分).
(1)148.5KJ(单位写成 不给分)
(2) (不写单位 不给分)
(3)80
(4)B
(5)B
(6) (用<表达不给分)
17.(每空2分,共16分))
(1)分液漏斗(错别字不给分)
(2)先关闭分液漏斗的活塞,再轻轻向外拉(或向内压)注射器的活塞,松手后恢复原位,表明气密性
良好。(若未答“先关闭分液漏斗活塞”不给分,其余答案均不给分。)
(3)浓度,①>②(表达①>②也可以)
18.(每空2分,共10分)
(1)①+41(不写+也可以)
②
(2)C(3)
(4)=