文档内容
四川省名校联盟高 2022 级 12 月联考化学试题
本试卷分为试题卷和答题卡两部分,其中试题卷由选择题和非选择题组成,共6页;答题卡共2页。满
分100分,考试时间75分钟。
注意事项:
1. 答题前,考生务必将自己的学校、班级、姓名用0.5毫米黑色墨水签字笔填写清楚,同时用2B铅笔
将考号准确填涂在“考号”栏目内。
2. 选择题使用2B铅笔填涂在答题卡对应题目标号的位置上,如需改动,用橡皮擦擦干净后再选涂其它
答案;非选择题用0.5毫米黑色墨水签字笔书写在答题卡的对应框内,超出答题区域书写的答案无效;
在草稿纸、试题卷上答题无效。
3. 考试结束后将答题卡收回。
可能用到的相对原子质量:H—1 O—16 Na—23 Al—27 P—31 Cl—35.5 Cr—52 Br—80
第Ⅰ卷(选择题,共 42 分)
一、选择题(本题共14小题,每小题3分,共42分。每小题只有一个选项最符合题意)
1.科学、安全、有效、合理使用化学品是每位生产者和消费者的要求和责任,下列有关说法正确的是
A.非处方药不需要凭医生处方,消费者可自行购买和使用
B.铁强化酱油中的添加剂乙二胺四乙酸铁钠属于增味剂
C.长期服用阿司匹林可预防某些疾病,没有副作用
D.火腿中加入过量亚硝酸钠可调味、增色和防腐
2.川菜是中国八大菜系之一,下列有关说法错误的是
A.烹饪“糖醋排骨”时用蔗糖炒出焦糖色,蔗糖属于寡糖
B.烹饪“麻婆豆腐”时用到的豆腐,其制作原理与胶体的性质有关
C.烹饪“回锅肉”时用到蒜苗,它富含维生素C,维生素C又称抗坏血酸,具有氧化性
D.烹饪“青椒土豆丝”时,应先将土豆丝放入水中浸泡,会产生主要成分为淀粉的白色沉淀
3.实验室安全至关重要,下列做法正确的是
A.BaSO 等钡的化合物均有毒,相关废弃物应进行无害化处理
4
B.蒸馏实验时,如果忘记加沸石,应停止实验,立即补加沸石
C.做“钾与水的反应”实验时需佩戴护目镜
D.苯酚不慎沾到手上,先用NaOH溶液冲洗,再用水冲洗
4.下列化学用语正确的是
A.氯化钠的分子式:NaCl B.OF 分子的空间结构:V形
2
C.邻羟基苯甲醛的分子内氢键: D.CS 的空间填充模型:
2
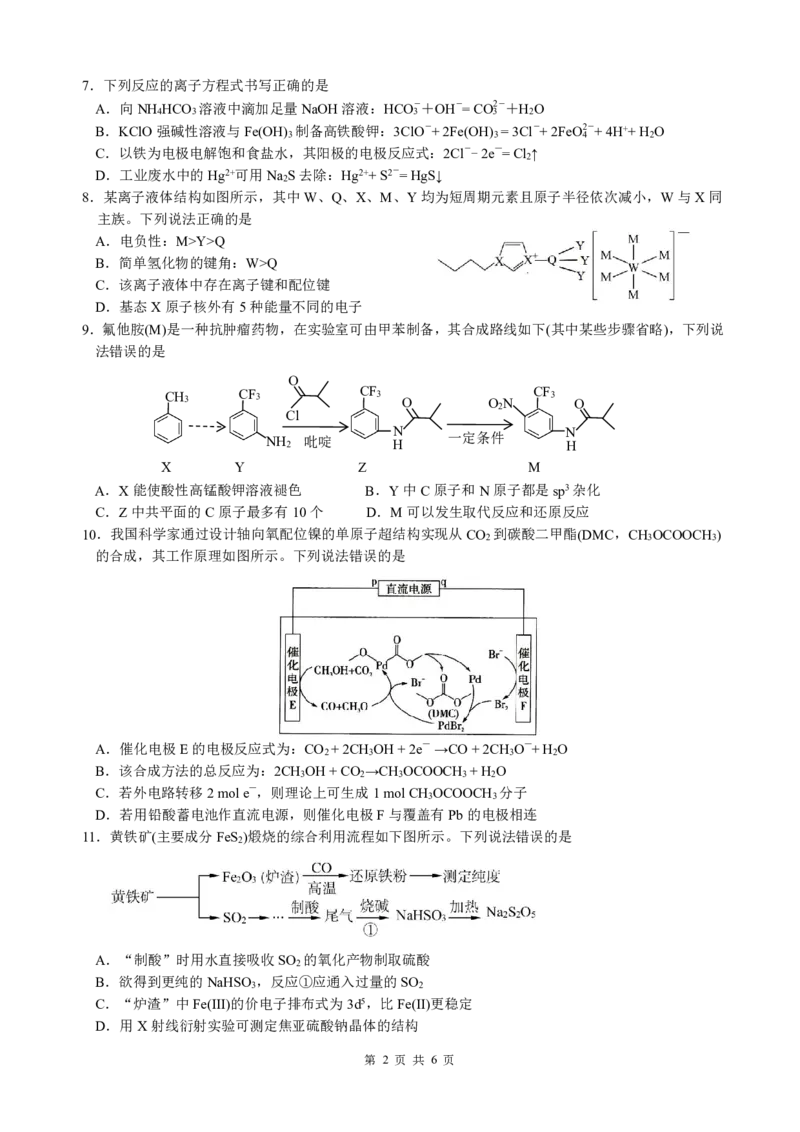
5.下列实验操作正确且能达到相应实验目的的是
C.验证改变压强能
A.电解精炼铜 B.检验氯化铵受热分解产物 D.干燥Cl
破坏化学平衡状态 2
6.已知2P +3Ba(OH) +6H O=3Ba(H PO ) +2PH ↑为制备次磷酸(H PO )的第一步反应,设N 为阿伏加
4 2 2 2 2 2 3 3 2 A
德罗常数的值(已知H PO 是一元弱酸)。下列说法错误的是
3 2
A.0.1mol/L的Ba(H PO ) 溶液中:c(H PO )+c(H PO-)+c(HPO2-)+c(PO3-)=0.2mol/L
2 2 2 3 2 2 2 2 2
B.31gP 含有1.5N 个P-P键
4 A
C.pH=12的Ba(OH) 溶液中由水电离出的c(OH-)=1.0×10-12 mol/L
2
D.当生成4.48LPH (标况下),转移0.6N 个电子
3 A
第 1 页 共 6 页7.下列反应的离子方程式书写正确的是
A.向NH HCO 溶液中滴加足量NaOH溶液:HCO-+OH-=CO2-+H O
4 3 3 3 2
B.KClO强碱性溶液与Fe(OH) 制备高铁酸钾:3ClO-+2Fe(OH) =3Cl-+2FeO2-+4H++H O
3 3 4 2
C.以铁为电极电解饱和食盐水,其阳极的电极反应式:2Cl--2e—=Cl ↑
2
D.工业废水中的Hg2+可用Na S去除:Hg2++S2-=HgS↓
2
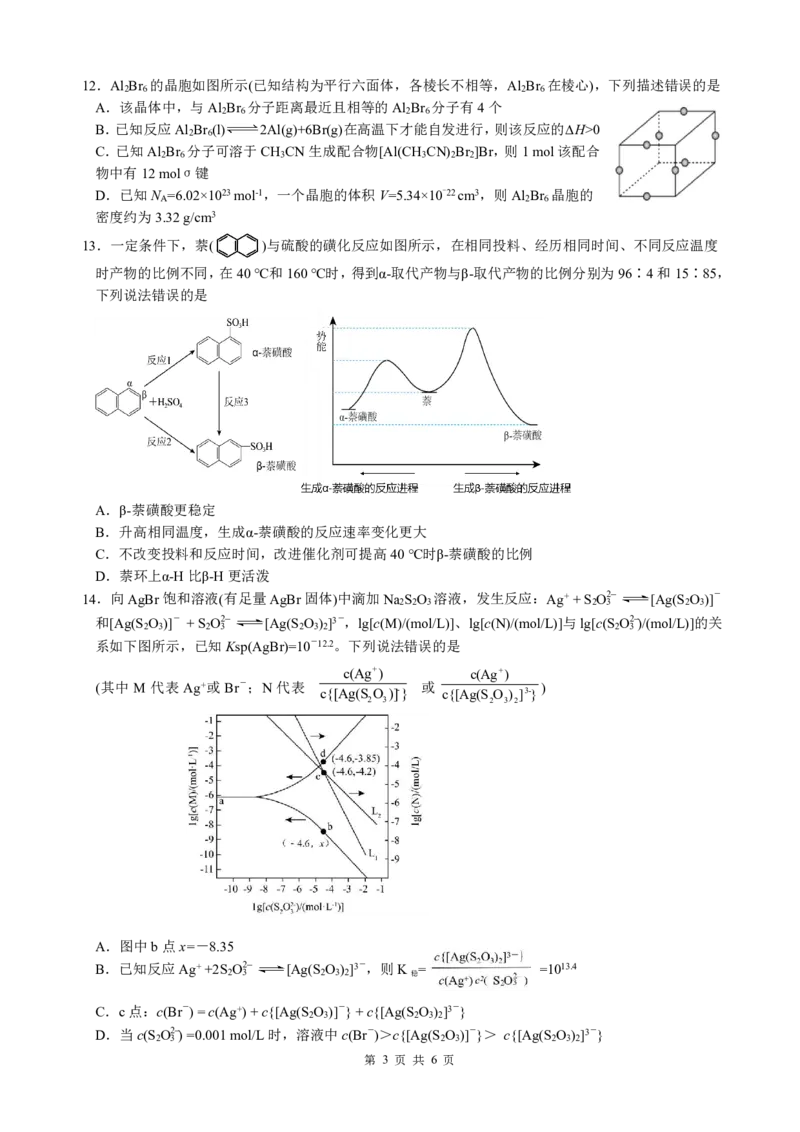
8.某离子液体结构如图所示,其中W、Q、X、M、Y均为短周期元素且原子半径依次减小,W与X同
主族。下列说法正确的是
A.电负性:M>Y>Q
B.简单氢化物的键角:W>Q
C.该离子液体中存在离子键和配位键
D.基态X原子核外有5种能量不同的电子
9.氟他胺(M)是一种抗肿瘤药物,在实验室可由甲苯制备,其合成路线如下(其中某些步骤省略),下列说
法错误的是
O
CH 3 CF 3 CF 3 O O N CF 3 O
2
Cl
NH 2 吡啶 N H 一定条件 N H
X Y Z M
A.X能使酸性高锰酸钾溶液褪色 B.Y中C原子和N原子都是sp3杂化
C.Z中共平面的C原子最多有10个 D.M可以发生取代反应和还原反应
10.我国科学家通过设计轴向氧配位镍的单原子超结构实现从CO 到碳酸二甲酯(DMC,CH OCOOCH )
2 3 3
的合成,其工作原理如图所示。下列说法错误的是
A.催化电极E的电极反应式为:CO +2CH OH+2e— →CO+2CH O—+H O
2 3 3 2
B.该合成方法的总反应为:2CH OH+CO →CH OCOOCH +H O
3 2 3 3 2
C.若外电路转移2mole—,则理论上可生成1molCH OCOOCH 分子
3 3
D.若用铅酸蓄电池作直流电源,则催化电极F与覆盖有Pb的电极相连
11.黄铁矿(主要成分FeS )煅烧的综合利用流程如下图所示。下列说法错误的是
2
A.“制酸”时用水直接吸收SO 的氧化产物制取硫酸
2
B.欲得到更纯的NaHSO ,反应①应通入过量的SO
3 2
C.“炉渣”中Fe(III)的价电子排布式为3d5,比Fe(II)更稳定
D.用X射线衍射实验可测定焦亚硫酸钠晶体的结构
第 2 页 共 6 页12.Al Br 的晶胞如图所示(已知结构为平行六面体,各棱长不相等,Al Br 在棱心),下列描述错误的是
2 6 2 6
A.该晶体中,与Al Br 分子距离最近且相等的Al Br 分子有4个
2 6 2 6
B.已知反应Al Br (l) 2Al(g)+6Br(g)在高温下才能自发进行,则该反应的∆H>0
2 6
C.已知Al Br 分子可溶于CH CN生成配合物[Al(CH CN) Br ]Br,则1mol该配合
2 6 3 3 2 2
物中有12molσ键
D.已知N =6.02×1023mol-1,一个晶胞的体积V=5.34×10-22cm3,则Al Br 晶胞的
A 2 6
密度约为3.32g/cm3
13.一定条件下,萘( )与硫酸的磺化反应如图所示,在相同投料、经历相同时间、不同反应温度
时产物的比例不同,在40℃和160℃时,得到α-取代产物与β-取代产物的比例分别为96∶4和15∶85,
下列说法错误的是
A.β-萘磺酸更稳定
B.升高相同温度,生成α-萘磺酸的反应速率变化更大
C.不改变投料和反应时间,改进催化剂可提高40℃时β-萘磺酸的比例
D.萘环上α-H比β-H更活泼
14.向AgBr饱和溶液(有足量AgBr固体)中滴加Na S O 溶液,发生反应:Ag++S O2- [Ag(S O )]-
2 2 3 2 3 2 3
和[Ag(S O )]- +S O2- [Ag(S O ) ]3-,lg[c(M)/(mol/L)]、lg[c(N)/(mol/L)]与lg[c(S O2-)/(mol/L)]的关
2 3 2 3 2 3 2 2 3
系如下图所示,已知Ksp(AgBr)=10-12.2。下列说法错误的是
c(Ag+) c(Ag+)
(其中 M 代表 Ag+或 Br-;N 代表 c{[Ag(S O )]-} 或 c{[Ag(S O ) ]3-} )
2 3 2 3 2
A.图中b点x=-8.35
B.已知反应Ag++2S O2- [Ag(S O ) ]3-,则K = =1013.4
2 3 2 3 2 稳
C.c点:c(Br-)=c(Ag+)+c{[Ag(S O )]-}+c{[Ag(S O ) ]3-}
2 3 2 3 2
D.当c(S O2-)=0.001mol/L时,溶液中c(Br-)>c{[Ag(S O )]-}> c{[Ag(S O ) ]3-}
2 3 2 3 2 3 2
第 3 页 共 6 页第ⅠI 卷(非选择题,共 58 分)
二、(本题共1小题,共14分)
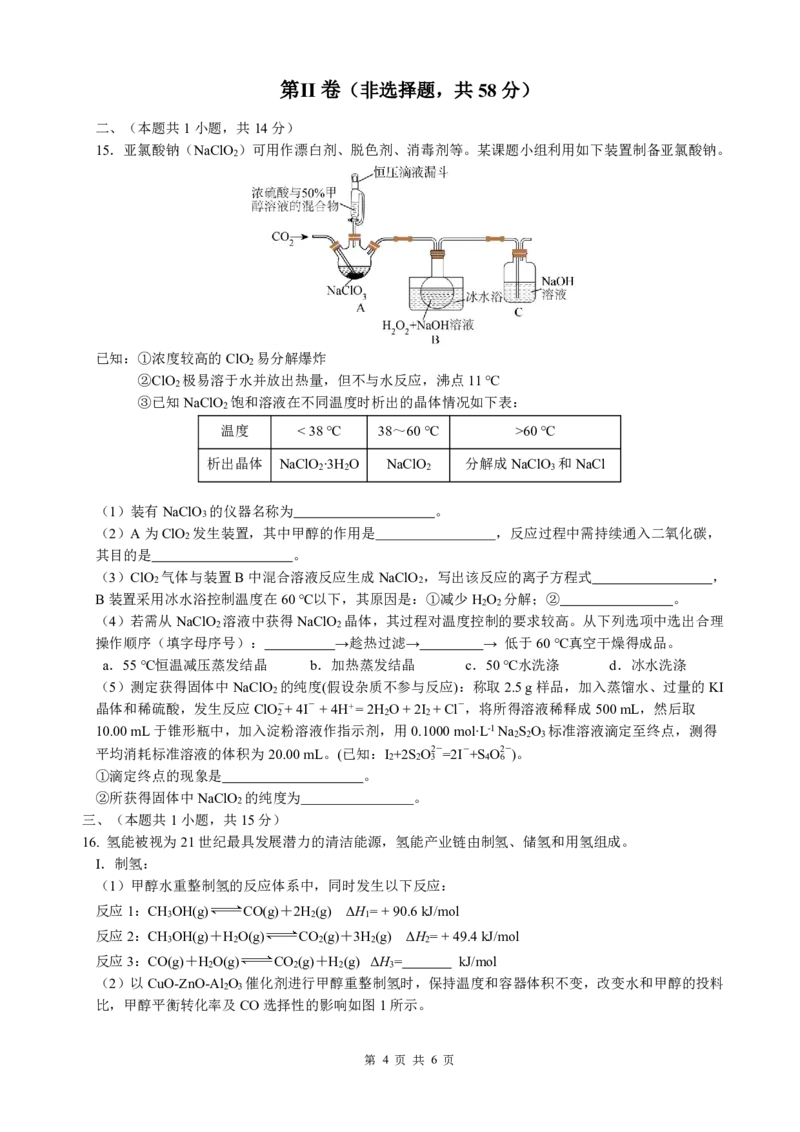
15.亚氯酸钠(NaClO )可用作漂白剂、脱色剂、消毒剂等。某课题小组利用如下装置制备亚氯酸钠。
2
已知:①浓度较高的ClO 易分解爆炸
2
②ClO 极易溶于水并放出热量,但不与水反应,沸点11℃
2
③已知NaClO 饱和溶液在不同温度时析出的晶体情况如下表:
2
温度 <38℃ 38~60℃ >60℃
析出晶体 NaClO ∙3H O NaClO 分解成NaClO 和NaCl
2 2 2 3
(1)装有NaClO 的仪器名称为 。
3
(2)A为ClO 发生装置,其中甲醇的作用是 ,反应过程中需持续通入二氧化碳,
2
其目的是 。
(3)ClO 气体与装置B中混合溶液反应生成NaClO ,写出该反应的离子方程式 ,
2 2
B装置采用冰水浴控制温度在60℃以下,其原因是:①减少H O 分解;② 。
2 2
(4)若需从NaClO 溶液中获得NaClO 晶体,其过程对温度控制的要求较高。从下列选项中选出合理
2 2
操作顺序(填字母序号): →趁热过滤→ → 低于60℃真空干燥得成品。
a.55℃恒温减压蒸发结晶 b.加热蒸发结晶 c.50℃水洗涤 d.冰水洗涤
(5)测定获得固体中NaClO 的纯度(假设杂质不参与反应):称取2.5g样品,加入蒸馏水、过量的KI
2
晶体和稀硫酸,发生反应ClO-+4I- +4H+=2H O+2I +Cl-,将所得溶液稀释成500mL,然后取
2 2 2
10.00mL于锥形瓶中,加入淀粉溶液作指示剂,用0.1000mol∙L-1Na S O 标准溶液滴定至终点,测得
2 2 3
平均消耗标准溶液的体积为20.00mL。(已知:I +2S O2-=2I-+S O2-)。
2 2 3 4 6
①滴定终点的现象是 。
②所获得固体中NaClO 的纯度为 。
2
三、(本题共1小题,共15分)
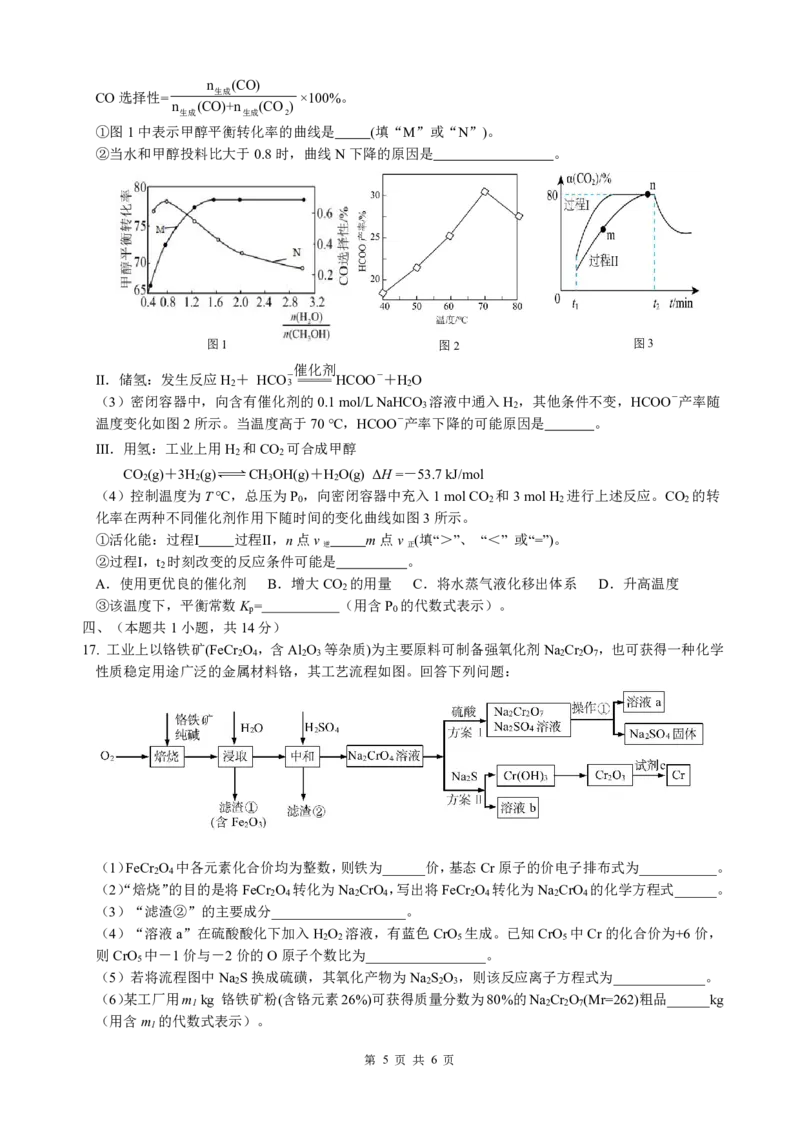
16. 氢能被视为21世纪最具发展潜力的清洁能源,氢能产业链由制氢、储氢和用氢组成。
Ⅰ.制氢:
(1)甲醇水重整制氢的反应体系中,同时发生以下反应:
反应1:CH OH(g) CO(g)+2H (g) ΔH =+90.6kJ/mol
3 2 1
反应2:CH OH(g)+H O(g) CO (g)+3H (g) ΔH =+49.4kJ/mol
3 2 2 2 2
反应3:CO(g)+H O(g) CO (g)+H (g) ΔH = kJ/mol
2 2 2 3
(2)以CuO-ZnO-Al O 催化剂进行甲醇重整制氢时,保持温度和容器体积不变,改变水和甲醇的投料
2 3
比,甲醇平衡转化率及CO选择性的影响如图1所示。
第 4 页 共 6 页n (CO)
CO选择性= 生成 ×100%。
n (CO)+n (CO )
生成 生成 2
①图1中表示甲醇平衡转化率的曲线是 (填“M”或“N”)。
②当水和甲醇投料比大于0.8时,曲线N下降的原因是 。
图1 图2 图3
催化剂
Ⅱ.储氢:发生反应H + HCO-=====HCOO-+H O
2 3 2
(3)密闭容器中,向含有催化剂的0.1mol/LNaHCO 溶液中通入H ,其他条件不变,HCOO-产率随
3 2
温度变化如图2所示。当温度高于70℃,HCOO-产率下降的可能原因是 。
Ⅲ.用氢:工业上用H 和CO 可合成甲醇
2 2
CO (g)+3H (g) CH OH(g)+H O(g) ΔH=-53.7kJ/mol
2 2 3 2
(4)控制温度为T℃,总压为P ,向密闭容器中充入1molCO 和3molH 进行上述反应。CO 的转
0 2 2 2
化率在两种不同催化剂作用下随时间的变化曲线如图3所示。
①活化能:过程Ⅰ 过程Ⅱ,n点v m点v (填“>”、 “<” 或“=”)。
逆 正
②过程Ⅰ,t 时刻改变的反应条件可能是 。
2
A.使用更优良的催化剂 B.增大CO 的用量 C.将水蒸气液化移出体系 D.升高温度
2
③该温度下,平衡常数K = (用含P 的代数式表示)。
p 0
四、(本题共1小题,共14分)
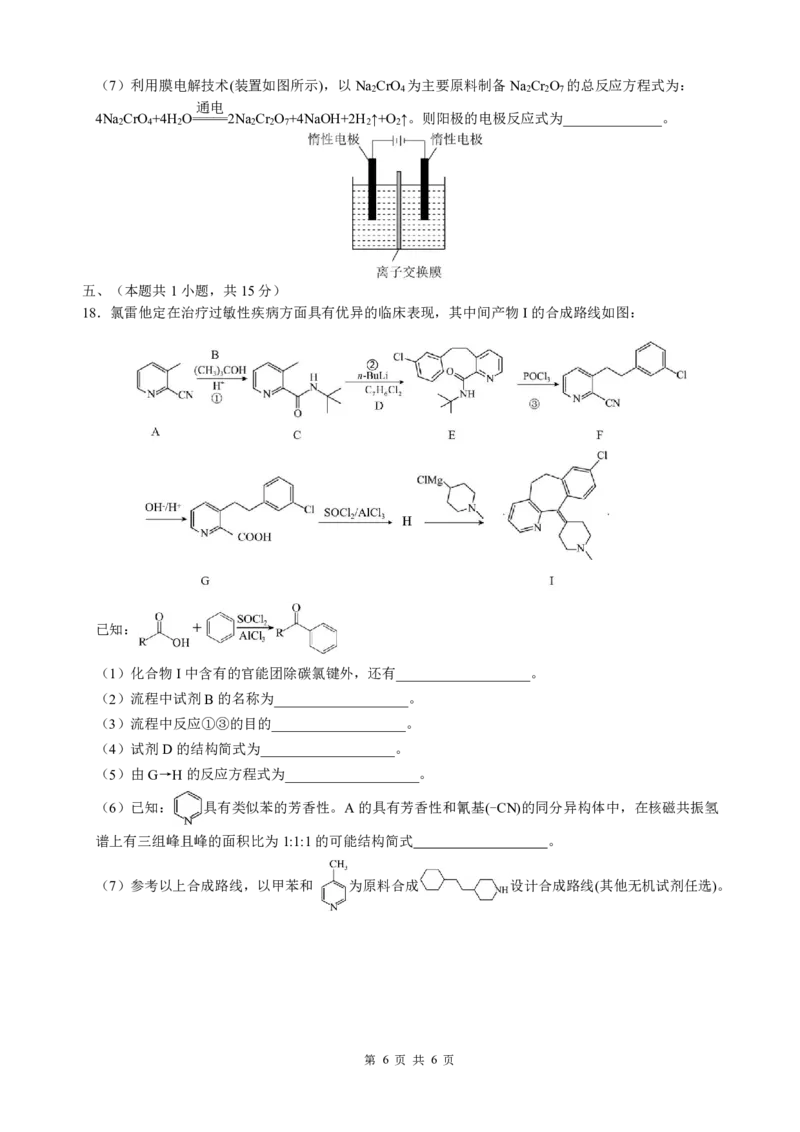
17. 工业上以铬铁矿(FeCr O ,含Al O 等杂质)为主要原料可制备强氧化剂Na Cr O ,也可获得一种化学
2 4 2 3 2 2 7
性质稳定用途广泛的金属材料铬,其工艺流程如图。回答下列问题:
(1)FeCr O 中各元素化合价均为整数,则铁为______价,基态Cr原子的价电子排布式为___________。
2 4
(2)“焙烧”的目的是将FeCr O 转化为Na CrO ,写出将FeCr O 转化为Na CrO 的化学方程式______。
2 4 2 4 2 4 2 4
(3)“滤渣②”的主要成分___________________。
(4)“溶液a”在硫酸酸化下加入H O 溶液,有蓝色CrO 生成。已知CrO 中Cr的化合价为+6价,
2 2 5 5
则CrO 中-1价与-2价的O原子个数比为_________________。
5
(5)若将流程图中Na S换成硫磺,其氧化产物为Na S O ,则该反应离子方程式为_____________。
2 2 2 3
(6)某工厂用m kg 铬铁矿粉(含铬元素26%)可获得质量分数为80%的Na Cr O (Mr=262)粗品______kg
1 2 2 7
(用含m 的代数式表示)。
1
第 5 页 共 6 页(7)利用膜电解技术(装置如图所示),以Na CrO 为主要原料制备Na Cr O 的总反应方程式为:
2 4 2 2 7
通电
4Na CrO +4H O=====2Na Cr O +4NaOH+2H ↑+O ↑。则阳极的电极反应式为______________。
2 4 2 2 2 7 2 2
五、(本题共1小题,共15分)
18.氯雷他定在治疗过敏性疾病方面具有优异的临床表现,其中间产物I的合成路线如图:
已知:
(1)化合物I中含有的官能团除碳氯键外,还有___________________。
(2)流程中试剂B的名称为___________________。
(3)流程中反应①③的目的___________________。
(4)试剂D的结构简式为___________________。
(5)由G→H的反应方程式为___________________。
(6)已知: 具有类似苯的芳香性。A的具有芳香性和氰基(-CN)的同分异构体中,在核磁共振氢
谱上有三组峰且峰的面积比为1:1:1的可能结构简式 。
(7)参考以上合成路线,以甲苯和 为原料合成 设计合成路线(其他无机试剂任选)。
第 6 页 共 6 页