文档内容
丰城中学 2023-2024 学年上学期高三期中考试试卷
化 学
考试时间:2023.11.15 时长:75分钟 试卷总分:100分
考试范围:必修第一章-第五章 原子结构
可能用到的相对原子质量:H:1 Li :7 C:12 N:14 O:16 Na:23 Al:27 Si:28
S:32 Mn:55
第I卷(选择题)
一、单选题(每小题3分,共42分。每小题只有一个选项符合题意。)
1.我国古代文化博大精深,下列与化学有关的描述涉及氧化还原反应的是( )
A.《荀子·劝学》中“冰,水为之,而寒于水,木直中绳……”描述人类对结
冰的认识
B.《寒食》中“日暮汉宫传蜡烛,轻烟散入五侯家。”描述蜡烛燃烧的情况
C.《晚春二首·其二》中“榆荚只能随柳絮,等闲缭乱走空园。”描述榆荚随
柳絮飘荡的画面
D.《本草纲目》中“用浓酒和糟入甑,蒸令气上,用器承滴露。”描述蒸馏
的过程
2.阿伏加德罗常数的值为N ,下列叙述中正确的是( )
A
A.标准状况下,2.24L水中含有0.1N 个水分子
A
B.常温常压下,32gSO 含有的分子数约为3.01×1023
2
C.2molNaOH的摩尔质量为80g/mol
D.H 的气体摩尔体积约为22.4L/mol
2
3.常温下,下列溶液中的微粒能大量共存的是( )
A.加入铁产生氢气的溶液:K+、SO 、Na+、ClO—
B.pH<7的溶液:Ba2+、Na+、I—、HCO -
3
C.加入硫酸镁的溶液:K+、Na+、NO -、Cl—
3
D.加入氢氧化钠的溶液:Na+、Mg2+、Cl—、S2—
4.下列离子方程式书写错误的是( )
A.向NH HSO 溶液滴加少量Ba(OH) 溶液:Ba2++2OH—+H++NH
4 4 2
4
+
+SO =
BaSO ↓+H O+NH ·H O
4 2 3 2
B.向Mg(HCO ) 溶液中加入足量NaOH溶液:Mg2++2HCO
3 2
3—
+4OH—=Mg(OH) ↓+2CO
2
3
-2
+2H O
2
C.向饱和Na CO 溶液中通入过量CO 气体:2Na++CO
2 3 2
3
-2
+CO +H O=2NaHCO ↓
2 2 3
D.新制氯水中加入少量CaCO :2Cl +H O+CaCO =Ca2++2Cl—+CO ↑+2HClO
3 2 2 3 2
5.化学用语就是化学的专用术语,是化学界统一规定的用来表示物质的组成、
结构和变化规律的特殊符号。下列化学用语表示正确的是( )
A.基态Fe的电子排布式:[Ar]3d6
B.S Cl 的结构式:Cl—S—S—Cl
2 2
C.MgH 的电子式:Mg2+[:H] -
2 2
D.基态Cr的价层电子轨道表示式:
6.下列有关物质性质与用途对应关系不正确的是( )
A.Al表面有致密的氧化铝保护层,可用铝制餐具存放酸性及碱性食物
B.NaHCO 受热易分解,可用作焙制糕点的膨松剂
3
C.CaO能与SO 反应,可作为工业废气处理时的脱硫剂
2
D.氢气热值高,液氢可作运载火箭的高能清洁燃料
7.下列实验装置能达到实验目的的是( )
A.配制
B.制备少 C.证明氧化性 D.验证NaHCO 和Na CO 的
3 2 3
0.10 mol/L
量Fe(OH) Cl >Br >I 热稳定性
2 2 2 2
的食盐水
A.A B.B C.C D.D
8.氮化硅(Si N )常用作飞船返回舱耐高温结构材料,可由石英和焦炭在高温的
3 4
氮气中通过以下反应制备: 。设N 为阿伏加德罗
A
常数的值。下列说法正确的是( )
A.SiO 是太阳能电池的主要材料
2
B.60gSiO 中Si-O共价键的数目为2N
2 AC.14g由N 和CO组成的混合气体含有的电子数为7N
2 A
D.上述反应中,每消耗11.2LN ,最多生成0.25 mol Si N
2 3 4
9.铅元素有+2、+4两种价态,铅的氧化物均难溶于水,已知有下列两个反
应:
①Pb O +4HNO =PbO +2Pb(NO ) +2H O;
3 4 3 2 3 2 2
②PbO+NaClO=PbO +NaCl
2
下列有关叙述不正确的是( )
A.Pb O 可写成2PbO·PbO 的形式
3 4 2
B.反应②中PbO 是氧化产物
2
C.根据反应可推测在题给条件下氧化性:NaClO>HNO
3
D.生成相同质量的PbO ,反应①②转移电子数之比为2:3
2
10.化石燃料燃烧会产生大气污染物SO 、NO 等,科学家实验探究用硫酸铈
2 x
循环法吸收SO ,其转化原理如图所示,下列说法正确的是(
2
)
A.检验SO
4
-2
可以选用盐酸酸化的BaCl 溶液
2
B.反应①的离子方程式为2Ce4++SO +2H O=2Ce3++SO
2 2
4
-2
+4H+
C.反应②中氧化剂与氧化产物的物质的量之比为1:2
D.理论上每吸收标准状况下224mLSO ,一定消耗0.32O
2 2
11.50.70gMnSO ·H O样品受热分解过程的热重曲线(固体质量随温度变化的曲
4 2
线)如图所示。下列说法正确的是( )
A.MnSO ·H O属于混合物
4 2
B.结晶水在第一个失重台阶并未全部失去
C.第二个失重台阶得到的固体为MnO
2
D.第三个失重台阶得到的固体为MnO
12.氮循环是全球生物地球化学循环的重要组成部分,
全球每年通过人类活动新增的“活性”氮导致全球氮循环严重失衡,并引起水
体的富营养化、水体酸化、温室气体排放等一系列环境问题。海洋生物参与氮
循环的过程如图所示。下列叙述不正确的是( )A.图中5个反应中包含4个氧化还原反应
B.1molNH
4
+
与1molNH 所含电子数相等
3
C.水华和赤潮都是水体富营养化的表现
D.反应③和⑤生成等质量N 时,反应⑤转移的电子数少
2
13.某溶液仅由NO -、Cl—、SO
3
4
-2
、CO
3
-2
、NH
4
+
、Fe3+、Al3+和K+中的若
干种离子组成,且各离子浓度相等,取适量溶液进行如下实验:
①取该溶液加入过量NaOH溶液,加热,产生无色气体;
②将①过滤、洗涤、灼烧,得到固体a;
③向上述滤液中加足量BaCl 溶液,产生白色沉淀;
2
根据以上实验,下列推断错误的是( )
A.根据操作①,推断一定存在
B.②中固体a为氧化铁
C.原溶液中一定不存在CO
3
-2
、Al3+,可能含有K+
D.说明原溶液中一定存在NO -、Cl—、SO
3
4
-2
、NH
4
+
、Fe3+、
14.实验室模拟以磷石膏(含CaSO ·2H O及杂质Al O 、Fe O 等)为原料制取
4 2 2 3 2 3
轻质CaCO ,流程如下:
3
下列说法错误的是( )
A.滤渣1的主要成分为CaCO
3
B.“浸取1”时,应先通NH 再通CO ,滤液1中浓度最大的阴离子为SO
3 2
4
-2
C.“浸取2”时,发生反应的离子方程式为CaO+2NH
4
+
+H O=Ca2+
2+2NH ·H O
3 2
D.“浸取2”时,所得滤渣2的主要成分为Al(OH) 、Fe(OH)
3 3
第II卷(非选择题)
二、非选择题(共4小题,每空2分,共58分。)
15.经检测,某化工厂排出的废水呈酸性,且其中含有大量Na+、Cu2+、SO
4
-2
、Cl—、NO -。回答下列问题:
3
(1)下列离子中,能大量存在于该废水中的是___________(填字母)。
A.Ag+ B.Mg2+ C.S2— D.HCO
3—
(2)取100mL该废水于烧杯中,向烧杯中逐滴加入NaOH溶液至溶液呈碱性,
此过程中,发生反应的离子方程式为 、
。
(3)某化学社团小组成员欲除去废水样品中的Cu2+和SO
4
-2
,最终得到中性溶液,
设计的方案流程如图所示。
①试剂a、c分别为 、 (写化学式);“溶液3”所含的溶质离子
有Cl—、 (写离子符号)。
②“分离操作”的名称是 。
③向“白色沉淀2”中加入足量盐酸,发生反应的离子方程式为 。
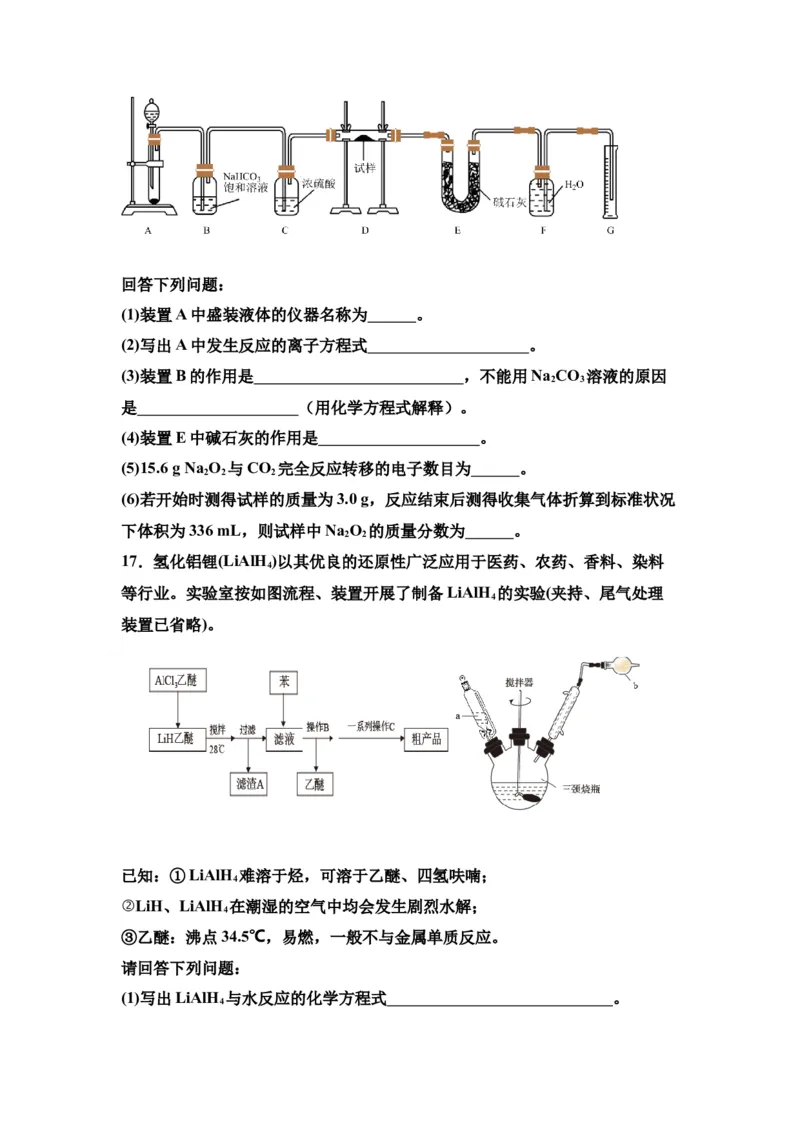
16.现有一定量含有Na O杂质的Na O 试样,用如下图所示的实验装置测定
2 2 2
Na O 试样的纯度(通过CO 与样品反应后生成O 的量测定Na O 的含量,可
2 2 2 2 2 2
供选用的反应物:CaCO 固体、盐酸、稀硫酸和蒸馏水)。
3回答下列问题:
(1)装置A中盛装液体的仪器名称为 。
(2)写出A中发生反应的离子方程式 。
(3)装置B的作用是 ,不能用Na CO 溶液的原因
2 3
是 (用化学方程式解释)。
(4)装置E中碱石灰的作用是 。
(5)15.6 g Na O 与CO 完全反应转移的电子数目为 。
2 2 2
(6)若开始时测得试样的质量为3.0 g,反应结束后测得收集气体折算到标准状况
下体积为336 mL,则试样中Na O 的质量分数为 。
2 2
17.氢化铝锂(LiAlH )以其优良的还原性广泛应用于医药、农药、香料、染料
4
等行业。实验室按如图流程、装置开展了制备LiAlH 的实验(夹持、尾气处理
4
装置已省略)。
已知:①LiAlH 难溶于烃,可溶于乙醚、四氢呋喃;
4
②LiH、LiAlH 在潮湿的空气中均会发生剧烈水解;
4
③乙醚:沸点34.5℃,易燃,一般不与金属单质反应。
请回答下列问题:
(1)写出LiAlH 与水反应的化学方程式 。
4(2)仪器a的名称是 ;装置b的作用是 。
(3)乙醚中的少量水分也会对LiAlH 的制备产生严重的影响,以下试剂或操作可
4
有效降低市售乙醚(含水体积分数为0.2%)含水量的是_______。
A.钠 B.分液 C.五氧化二磷 D.通入乙烯
(4)下列说法正确的是
a.AlCl 能溶于乙醚可能与配位键有关
3
b.滤渣A的主要成分是LiCl
c.为提高过滤出滤渣A的速度,可先加水让滤纸紧贴漏斗内壁
d.为提高合成LiAlH 的速率,可将反应温度提高到50℃
4
e.操作B可以在分液漏斗中进行
(5)LiAlH (不含LiH)纯度可采用如下方法测定(装置如图所示):25℃,常压下,
4
准确称取产品LiAlH m g,记录量气管B起始体积读数V mL,在分液漏斗中
4 1
准确加入过量的四氢呋喃、水混合液15.0 mL,打开旋塞至滴加完所有液体,
立即关闭旋塞,调整量气管B.读数V mL。过量四氢呋喃的作用 ;
2
LiAlH 的质量分数为 (用含m、V 、V 的代数式表示,已知气体摩尔体
4 1 2
积为V L/mol)。
m
18.高铁酸钾(K FeO )具有强氧化性,是一种环保、高效、多功能的饮用水处
2 4
理剂,可用如下流程进行制备。请回答下列问题:
(1) K FeO 中铁元素的化合价是 。
2 4
(2)“氧化”过程中,生成Fe3+的离子方程式为 。
(3)“制备Na FeO ”中还原剂和氧化剂的物质的量之比为 。
2 4(4)“转化”中析出K FeO 晶体的原因可能是 。
2 4
(5) K FeO 溶于水后,会缓慢放出气体,并杀菌消毒,同时还能达到净水目
2 4
的。请结合有关离子方程式解释K FeO 杀菌、净水的原理 。
2 4
(6)“熔融法”是最早发现+6价高铁酸盐的方法,该法制备高铁酸盐的原理如
下:
①反应中被氧化的Na O 与被FeSO 还原的Na O 的物质的量比为1:4,请写出
2 2 4 2 2
该反应配平后的方程式 。
②若反应产生16.8L(标准状况)O ,则转移的电子为 mol。
2化学参考答案
1-14 BBCAB AACDB CDCD
15.(1)B
(2)H++OH—=H O Cu2++2OH—=Cu(OH) ↓
2 2
(3) 过滤
16.(1)分液漏斗
(2)
(3) 除去CO 中混有的HCl气体
2
(4)除去没有反应完的CO(或除去O 中混有的CO 杂质)
2 2 2
(5) (或 )
(6)78.0%(或78%)
17.(1)LiAlH +4H O=LiOH+Al(OH) +4H (2) 恒压滴液漏斗 保持反应体系干燥(防
4 2 3 2
止外界水蒸气干扰等合理答案也可得分)
(3)AC
(4)ab
(5) 可减缓 与 的反应速率 ×100%
18.(1)+6
(2)4Fe2++O +4H+=4Fe3++2H O
2 2
(3)2:3
(4)K FeO 的溶解度小于NaFeO
2 4 2 4
(5)K FeO 有强氧化性,故能杀菌,4KFeO+10H O=4 Fe(OH) (胶体)+8KOH+3O ↑,新生成
2 4 2 4 2 3 2
的Fe(OH) (胶体)能吸附水中的悬浮颗粒物并沉降,可用于净水
3
(6) 2FeSO +6Na O 2NaFeO+2Na O+2Na SO +O ↑ 7.5
4 2 2 2 4 2 2 4 2