文档内容
2024~2025 学年度第一学期阶段性质量监测(一)
高三年级 化学学科
本试卷分为第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共 100 分,考试用时 60
分钟。第Ⅰ卷1至5页,第Ⅱ卷6至8页。
答卷前,考生务必将自己的姓名、准考证号填写在答题卡上,并在规定位置粘贴考试用
条形码。答题时,考生务必将答案涂写在答题卡上,答在试卷上无效。
第Ⅰ卷
注意事项:
1.每小题选出答案后,用铅笔将答题卡上对应题目的答案标号涂黑。如需改动,用橡
皮擦干净后,再选涂其他答案标号。
2.本卷共18题,每题 3分,共54分。在每题给出的四个选项中,只有一项是最符合
题目要求的。
可能用到的相对原子质量:H-1 He-4 C-12 N-14 O-16 S-32 Fe-56
1.近年来我国航天事业发展迅速,下列所涉及化学知识的叙述正确的是
A.“天舟六号”壳体使用的硬铝是纯净物
B.“长征七号”表面防热材料所用的镍基合金熔点高于镍
C.“天宫”空间站太阳能电池帆板的主要成分是二氧化硅
D.“嫦娥五号”取回的月壤样品中含有的石墨烯与地球上的石墨都是碳元素的同素异形
体
2.分类思想是研究化学的常用方法。下列物质的分类正确的是
A.电解质:盐酸、BaSO
4
B.酸性氧化物:NO 、SiO
2 2
C.碱:NaOH、Cu (OH) CO
2 2 3
D.胶体:有色玻璃、Fe(OH) 胶体
3
第 1 页 共 8 页
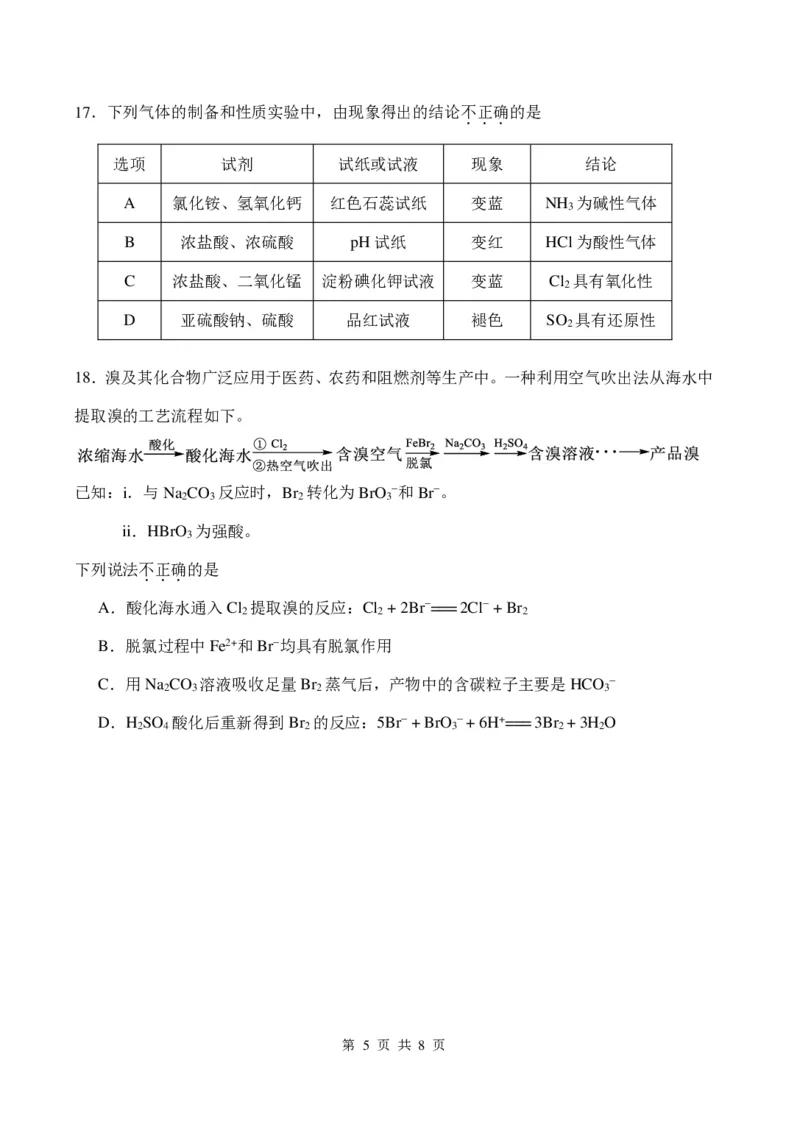
{{##{{QQQQAABBJKYYKeEo4oggICQAgAAASAAACAQQ5hLCUUUQGXCSCCQAuCQQkokgOAhAJeCgaEgBORRABFAqIMAwADACBSZNQANFAIBAA=}A#=}}#}3.化学品在食品工业中也有重要应用。下列叙述不正确的是
...
A.SO 有毒,不能用作食品添加剂
2
B.抗坏血酸常用于水果罐头中的抗氧化剂
C.谷氨酸钠能增加食品的鲜味,是一种常用的增味剂
D.亚硝酸钠是一种防腐剂和护色剂,可用于一些肉制品的生产
4.下列说法正确的是
A.酸性:HCOOH > CH COOH
3
B.最高正化合价:Si > N
C.还原性:HCl > HBr
D.半径:Na+ > S2−
5.将足量的稀盐酸加到下列固体混合物中,只能发生一种反应的是
A.Mg、AlCl 、NaAlO
3 2
B.NaClO、Na SO 、BaCl
2 3 2
C.KNO 、NaCl、CH COONa
3 3
D.Ba(NO ) 、FeSO 、NH HCO
3 2 4 4 3
6.下列反应的离子方程式正确的是
A.硝酸银溶液中加入过量的氨水:Ag+ + 2NH ∙H O === [Ag(NH ) ]+ + H O
3 2 3 2 2
B.碳酸氢钙与过量的氢氧化钙溶液反应:Ca2+ + HCO − + OH− === CaCO ↓+ H O
3 3 2
C.向沸水中滴加饱和氯化铁溶液得到红褐色液体:Fe3+ + 3H O === Fe(OH) ↓+ 3H+
2 3
D.二氧化硫使酸性高锰酸钾溶液褪色:3SO + 2MnO −+ 4H+ === 3SO 2− + 2Mn2+ + 2H O
2 4 4 2
7.离子化合物Na O 和CaC 均可与水反应产生气体,下列说法不正确的是
2 2 2 ...
A.Na O 、CaC 中均含有非极性共价键
2 2 2
B.Na O 、CaC 中阴、阳离子个数比均为1∶1
2 2 2
C.二者与水反应时,水既不是氧化剂也不是还原剂
D.相同物质的量的Na O 和CaC 与足量的水反应,产生气体的物质的量n(O ) 。
②实验室中可用如下方法制备Se单质:向Na SeO 水溶液中加入N H ·H O,在得到
2 3 2 4 2
Se单质的同时会产生一种对环境无污染的气体,则该反应的离子方程式为 。
(3)砷(As)与氮、磷均为氮族元素。
①砷有多种同位素原子,其中一种稳定的核素是75As,它的中子数为 。
②PH I中的化学键有__________(填序号)。
4
a.离子键 b.极性共价键 c.非极性共价键 d.配位键
第 6 页 共 8 页
{{##{{QQQQAABBJKYYKeEo4oggICQAgAAASAAACAQQ5hLCUUUQGXCSCCQAuCQQkokgOAhAJeCgaEgBORRABFAqIMAwADACBSZNQANFAIBAA=}A#=}}#}20.(16分)氮及其化合物在工业上有广泛的用途。回答下列问题:
(1)氮气的化学性质很稳定,但在一定条件下能够与镁发生反应生成氮化镁,氮化镁的
电子式是 。
(2)人类通过控制条件实现人工固氮,为农作物的生长提供必需的氮元素。常用于人工
固氮的化学方程式是 。
(3)液氨常用作制冷剂的原因是 。
(4)实验室常用向固体氢氧化钠中滴入浓氨水的方法制备氨气。
①NaOH的主要作用是 。
②下列固体可以替代NaOH的是 。
a.石灰石 b.熟石膏 c.生石灰
③为收集干燥氨气,常用的干燥剂是 。
(5)NH NO 常作为水培植物营养液的氮肥来源,若用容量瓶配制0.2 mol/L的NH NO
4 3 4 3
溶液480 mL,需要称量NH NO 固体的质量是 g。
4 3
(6)NH 催化还原氮氧化物(SCR)技术是目前应用最广泛的氮氧化物脱除技术,可用于
3
硝酸生产工艺的废气处理,反应原理如下图所示,若催化剂表面参与反应的NO和NO 的物
2
质的量之比为1∶1,则总反应的化学方程式是 。
当生成1mol N 时,转移电子的数目是 。
2
第 7 页 共 8 页
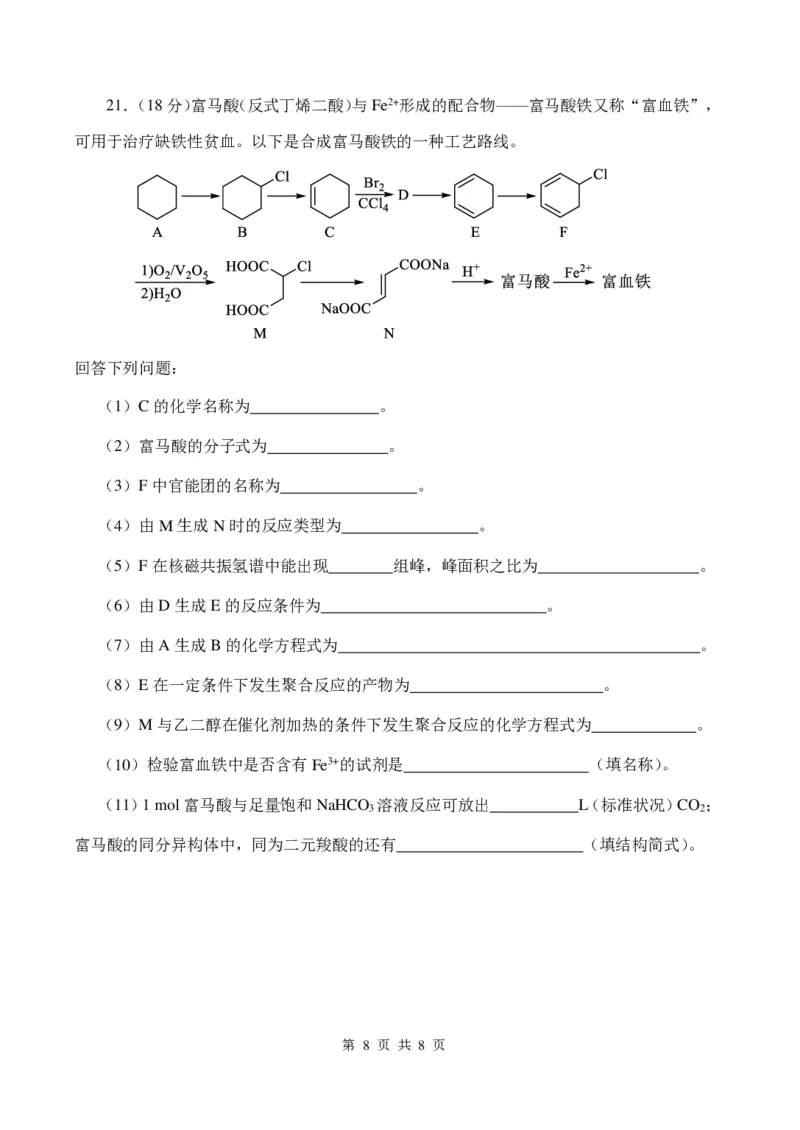
{{##{{QQQQAABBJKYYKeEo4oggICQAgAAASAAACAQQ5hLCUUUQGXCSCCQAuCQQkokgOAhAJeCgaEgBORRABFAqIMAwADACBSZNQANFAIBAA=}A#=}}#}21.(18分)富马酸(反式丁烯二酸)与Fe2+形成的配合物——富马酸铁又称“富血铁”,
可用于治疗缺铁性贫血。以下是合成富马酸铁的一种工艺路线。
回答下列问题:
(1)C的化学名称为 。
(2)富马酸的分子式为 。
(3)F中官能团的名称为 。
(4)由M生成N时的反应类型为 。
(5)F在核磁共振氢谱中能出现 组峰,峰面积之比为 。
(6)由D生成E的反应条件为 。
(7)由A生成B的化学方程式为 。
(8)E在一定条件下发生聚合反应的产物为 。
(9)M与乙二醇在催化剂加热的条件下发生聚合反应的化学方程式为 。
(10)检验富血铁中是否含有Fe3+的试剂是 (填名称)。
(11)1 mol富马酸与足量饱和NaHCO 溶液反应可放出 L(标准状况)CO ;
3 2
富马酸的同分异构体中,同为二元羧酸的还有 (填结构简式)。
第 8 页 共 8 页
{{##{{QQQQAABBJKYYKeEo4oggICQAgAAASAAACAQQ5hLCUUUQGXCSCCQAuCQQkokgOAhAJeCgaEgBORRABFAqIMAwADACBSZNQANFAIBAA=}A#=}}#}2024~2025 学年度第一学期阶段性质量监测(一)
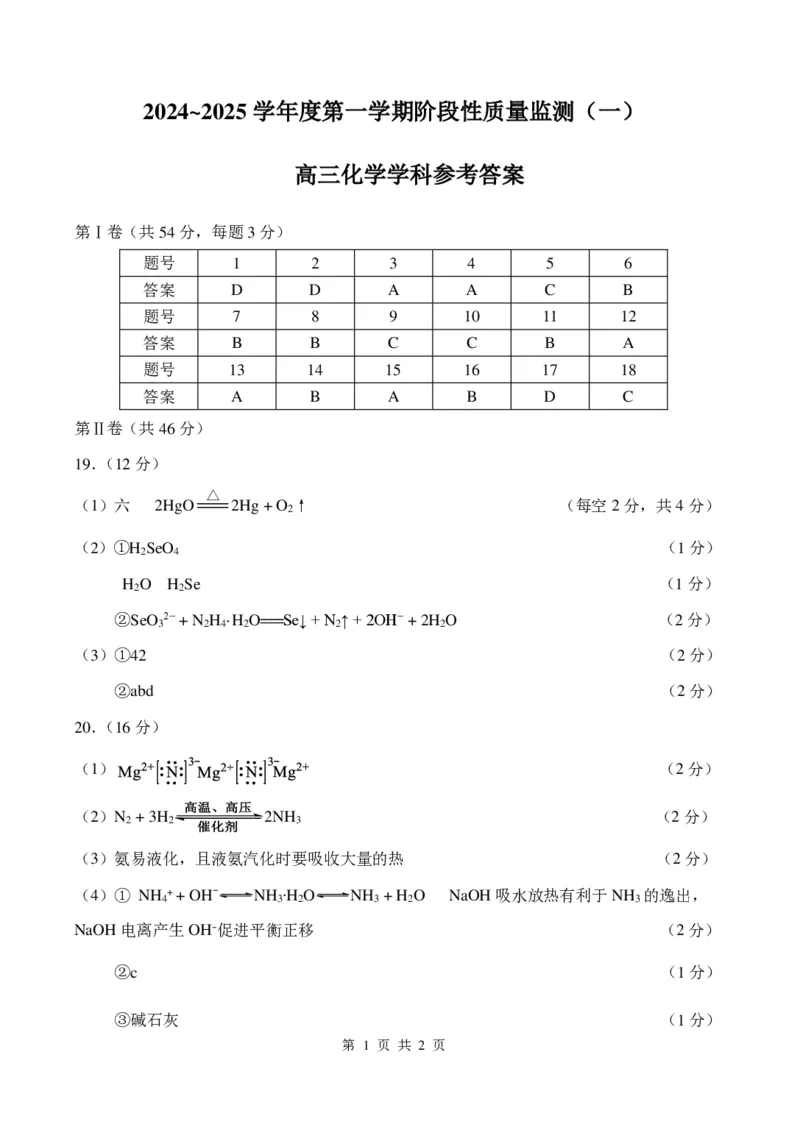
高三化学学科参考答案
第Ⅰ卷(共54分,每题3分)
题号 1 2 3 4 5 6
答案 D D A A C B
题号 7 8 9 10 11 12
答案 B B C C B A
题号 13 14 15 16 17 18
答案 A B A B D C
第Ⅱ卷(共46分)
19.(12分)
(1)六 2HgO 2Hg + O ↑ (每空2分,共4分)
2
(2)①H SeO (1分)
2 4
H O H Se (1分)
2 2
②SeO 2− + N H ·H O===Se↓ + N ↑ + 2OH− + 2H O (2分)
3 2 4 2 2 2
(3)①42 (2分)
②abd (2分)
20.(16分)
(1) (2分)
(2)N + 3H 2NH (2分)
2 2 3
(3)氨易液化,且液氨汽化时要吸收大量的热 (2分)
(4)① NH + + OH- NH ∙H O NH + H O NaOH吸水放热有利于NH 的逸出,
4 3 2 3 2 3
NaOH电离产生OH-促进平衡正移 (2分)
②c (1分)
③碱石灰 (1分)
第 1 页 共 2 页
{{##{{QQQQAABBJKYYKeEo4oggICQAgAAASAAACAQQ5hLCUUUQGXCSCCQAuCQQkokgOAhAJeCgaEgBORRABFAqIMAwADACBSZNQANFAIBAA=}A#=}}#}(5)8.0 (2分)
(6)NO + NO + 2NH 2N + 3H O 1.806×1024 (每空2分,共4分)
2 3 2 2
21.(18分)
(1)环己烯 (1分)
(2)C H O (1分)
4 4 4
(3)碳氯键 碳碳双键 (2分)
(4)消去反应 (1分)
(5)六 1∶1∶1∶1∶1∶2 (每空1分,共2分)
(6)氢氧化钠的醇溶液 加热 (1分)
(7) (2分)
(8) (2分)
(9)
(2分)
(10)硫氰化钾 (1分)
(11)44.8 (1分)
(2分)
第 2 页 共 2 页
{{##{{QQQQAABBJKYYKeEo4oggICQAgAAASAAACAQQ5hLCUUUQGXCSCCQAuCQQkokgOAhAJeCgaEgBORRABFAqIMAwADACBSZNQANFAIBAA=}A#=}}#}