文档内容
2024~2025 学年度第一学期期中调研试卷
高二化学
(试卷满分:100分考试时间:75分钟)
一、单项选择题:共13题,每题3分,共39分。每题只有一个选项最符合题意。
1.我国科学家通过电化学与生物技术将 还原为乙酸( ),再转化成葡萄糖 等
有机物,实现了 资源化利用。下列说法不正确的是( )
A.该研究利于实现“碳中和” B. 中 键与 键数目之比为
C. 是分子晶体 D.该反应中涉及电能与化学能的转化
2. 是良好的氧化剂和氟化剂,其制备原理: ,下列说法正确
的是( )
A. 的电子式为 B. 是非极性分子
C.基态F原子价层电子排布式为 D. 中含有离子键和共价键
3.轻质多孔 复合纳米线可有效吸收电磁波。下列说法正确的是( )
A.原子半径:
B.第一电离能:
C.酸性强弱:
D.晶体硅、金刚石、固态氮的晶体类型相同
4.下列实验装置,能达到实验目的的是( )
A.用装置甲设计铜锌原电池
B.用装置乙定量测定 的分解速率C.用装置丙采集到的压强数据判断铁钉发生析氢腐蚀还是吸氧腐蚀
D.用装置丁制备 并能较长时间观察其颜色
5.前4周期主族元素X、Y、Z、W的原子序数依次增大。基态时,X原子核外有6个电子,Y原子3p原子
轨道半充满,Z原子3p原子轨道上有2个未成对电子。W与Y处于同一主族。下列说法正确的是( )
A.第一电离能:
B.Y的简单气态氢化物的热稳定性比W的弱
C.原子半径:
D.X的最高价氧化物对应水化物的酸性比Z的强阅读下列材料,完成6~8题:
周期表中VIA族元素及其化合物应用广泛。 可用作燃料电池的氧化剂,还能与大部分元素形成氧化物,
如 、 等。 (燃烧热为 )是一种易燃的有毒气体,可制取多种硫化物。
是一种重要的工业原料,可通过煅烧黄铁矿制取。 在 催化下与 反应生成 ,每生成
释放出 的热量。碲 的单质及其化合物在电子、冶金、材料等领域有广阔的发展前
景,以电解强碱性 溶液制备 。
6.下列说法正确的是( )
A. 、 、 互为同素异形体
B. 的中心原子杂化轨道类型为
C.硫氧化合物中硫为正价、氧为负价是因为硫的电负性小于氧
D. 晶体中含有 键
7.下列关于反应 的说法正确的是( )
A.基态V原子核外电子排布为
B.反应达到平衡状态时,
C.使用 的目是为了增大 的平衡转化率
D.其他条件相同,增大压强,平衡常数增大
8.下列关于化学反应的表示或说法正确的是( )
A.碱性氢氧燃料电池的正极反应:B. 的燃烧:
C. 催化氧化:
D.电解强碱性 溶液的阴极反应:
9.电解法制备 的装置如题9图所示。下列说法正确的是( )
A.该装置工作时将化学能转化为电能
B.电极b与电源负极相连接
C.电解时a极电极反应式:
D.电解生成 时,理论上有 从a极室通过质子交换膜进入b极室
10.下列有关说法正确的是( )
A.铅蓄电池放电一段时间后,负极的质量减小
B. 在室温下可自发进行,说明该反应
C.在电解精炼铜过程中,阳极质量的减少等于阴极质量的增加
D.高压氧仓治疗 中毒的原理是 ,增大 有利于
反应正向进行
11. 可用于低温下催化氧化 ,
下列关于 催化氧化甲醛的反应说法正确的是( )
A.该反应 ,
B. 、 均为极性分子
C.升高温度, 增大, 减小D.使用 催化剂降低了该反应的焓变
12.下列实验方案不能达到探究目的是( )
选 探究目的 实验方案
项
A 温度对化学反应
向两支试管中各加入 溶液,分别放入盛有冷水和热水的
速率的影响
两个烧杯中,再同时分别向两支试管中加入 溶液,振荡,
观察现象
B
能否催化 向 溶液中滴加几滴 溶液,观察气泡产生情况
分解
C 铁片上发生了吸 在一块除去铁锈的铁片上滴1滴含有酚酞的食盐水,静置2~3min,溶液边缘出现
氧腐蚀 红色
D
与 的 向 溶液中滴加 的 溶液振荡,再滴加1~2
反应是可逆反应
滴 溶液,观察现象
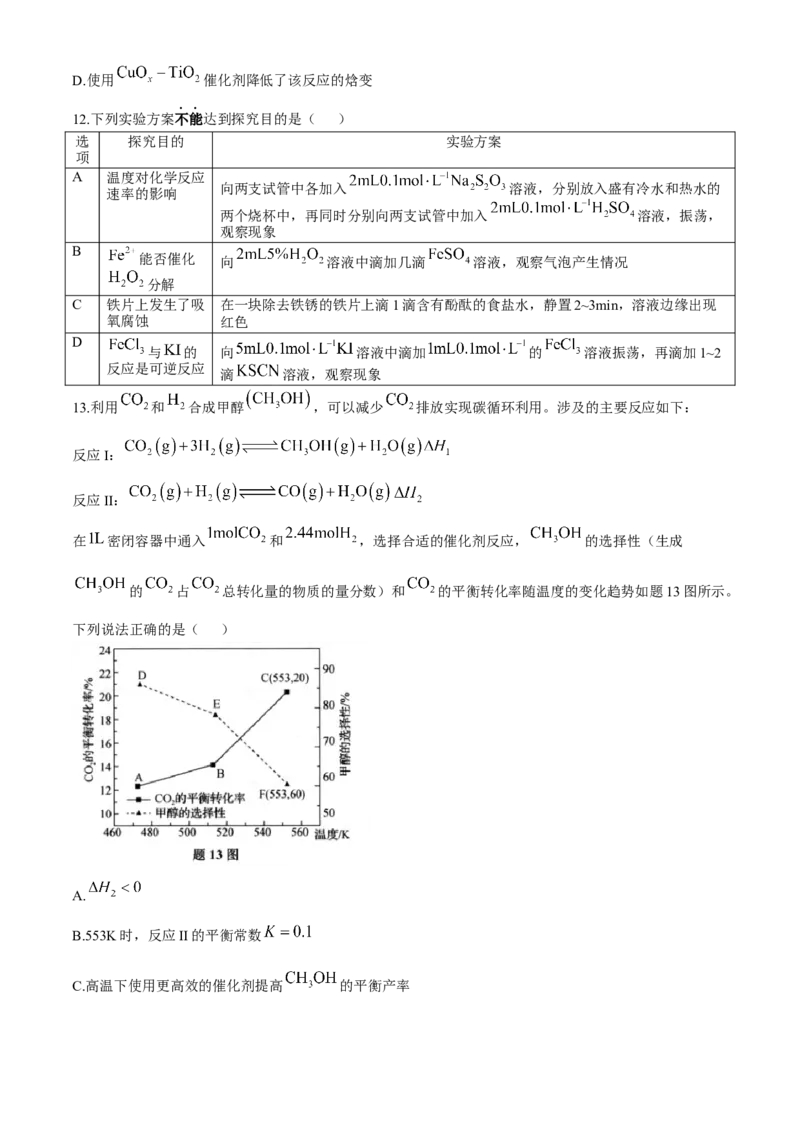
13.利用 和 合成甲醇 ,可以减少 排放实现碳循环利用。涉及的主要反应如下:
反应I:
反应II:
在 密闭容器中通入 和 ,选择合适的催化剂反应, 的选择性(生成
的 占 总转化量的物质的量分数)和 的平衡转化率随温度的变化趋势如题13图所示。
下列说法正确的是( )
A.
B.553K时,反应II的平衡常数
C.高温下使用更高效的催化剂提高 的平衡产率D.其他条件不变,增大压强可提高平衡时 的体积分数
二、非选择题:共4题,共61分。
14.(14分)铬铁合金作为添加料可用于生产具有优良性能的特种钢,这类特种钢中含有碳、硅、氧、氮、
磷等元素。
(1) 基态核外电子的排布式为__________。
(2)第一电离能N比O大的主要原因是__________。
(3) 的空间构型为__________。
(4) 中 键角______ 中键角。(填“>”“<”或“=”)
(5)有机铁肥 中不存在的化学键有______(填字母)。
A.离子键 B.金属键 C.配位键 D. 键
(6)向 溶液中加入 溶液变成红色,该反应是 与 以1:3个数比形成了配合物,该
配合物的化学式用 表示。若 与 以1:1个数比配合,则形成的配合物化学式可表示为
______。
15.(16分)硫酸工业中 氧化为 的反应为: ; 。下表列
出了一定比例的 和 在不同温度和压强下 的平衡转化率。
温度/℃
平衡转化率/%
0.1MPa 0.5MPa 1MPa 5MPa 10MPa
450 97.5 98.9 99.2 99.6 99.7
550 85.6 92.9 95 97.7 98.3
(1)①根据表中数据判断该反应 _____(填“>”“<”或“=”)。
②该反应平衡常数 __________ (填“>”“<”或“=”)。
(2)350℃时,向1L恒容密闭容器中加入 和 ,反应达到平衡时 的转化率为
20%。
①测得4s时 浓度为 , 内平均反应速率 __________。
②350℃时,反应 的平衡常数 ______。(保留2位小数)(3) 催化氧化 的反应过程分两步:第二步反应为 ,写出第一步反应
的化学方程式:__________。
(4)一般 氧化都在常压下进行,但部分工厂会在 (约10个大气压)下反应生产,高压生产优
点除了可以加快反应速率外,还有__________,高压生产的缺点是__________。
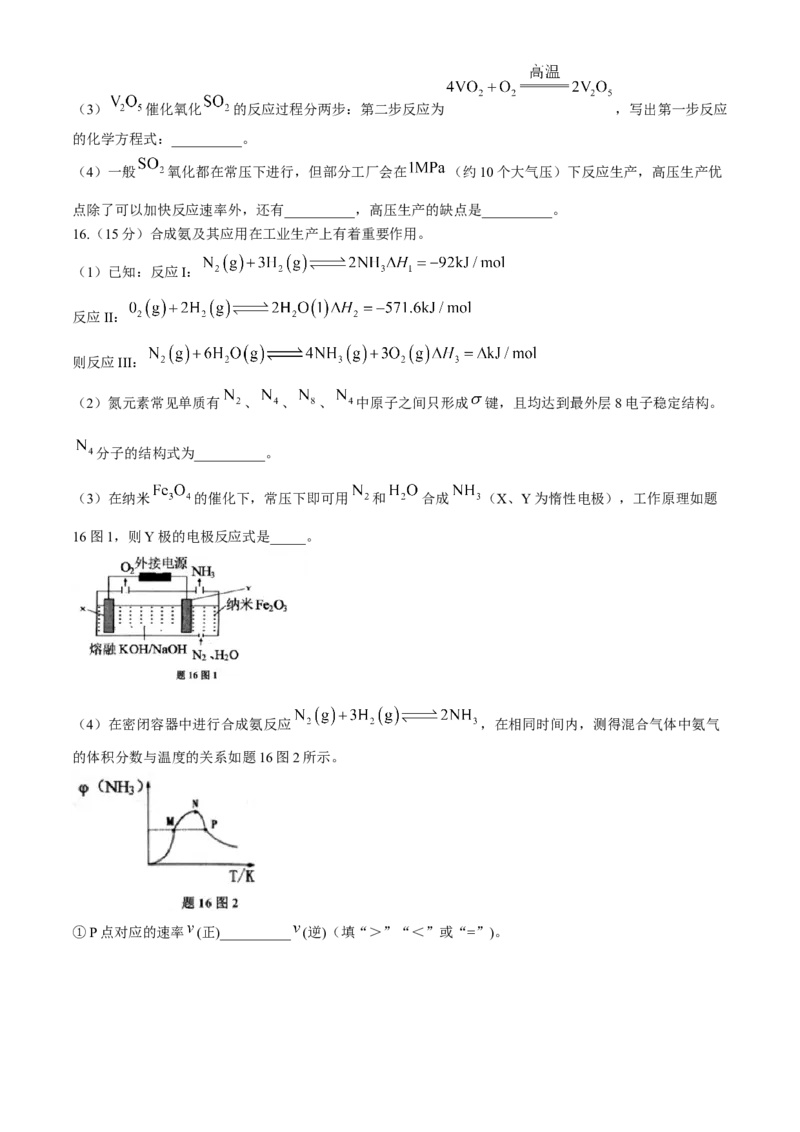
16.(15分)合成氨及其应用在工业生产上有着重要作用。
(1)已知:反应I:
反应II:
则反应III:
(2)氮元素常见单质有 、 、 、 中原子之间只形成 键,且均达到最外层8电子稳定结构。
分子的结构式为__________。
(3)在纳米 的催化下,常压下即可用 和 合成 (X、Y为惰性电极),工作原理如题
16图1,则Y极的电极反应式是_____。
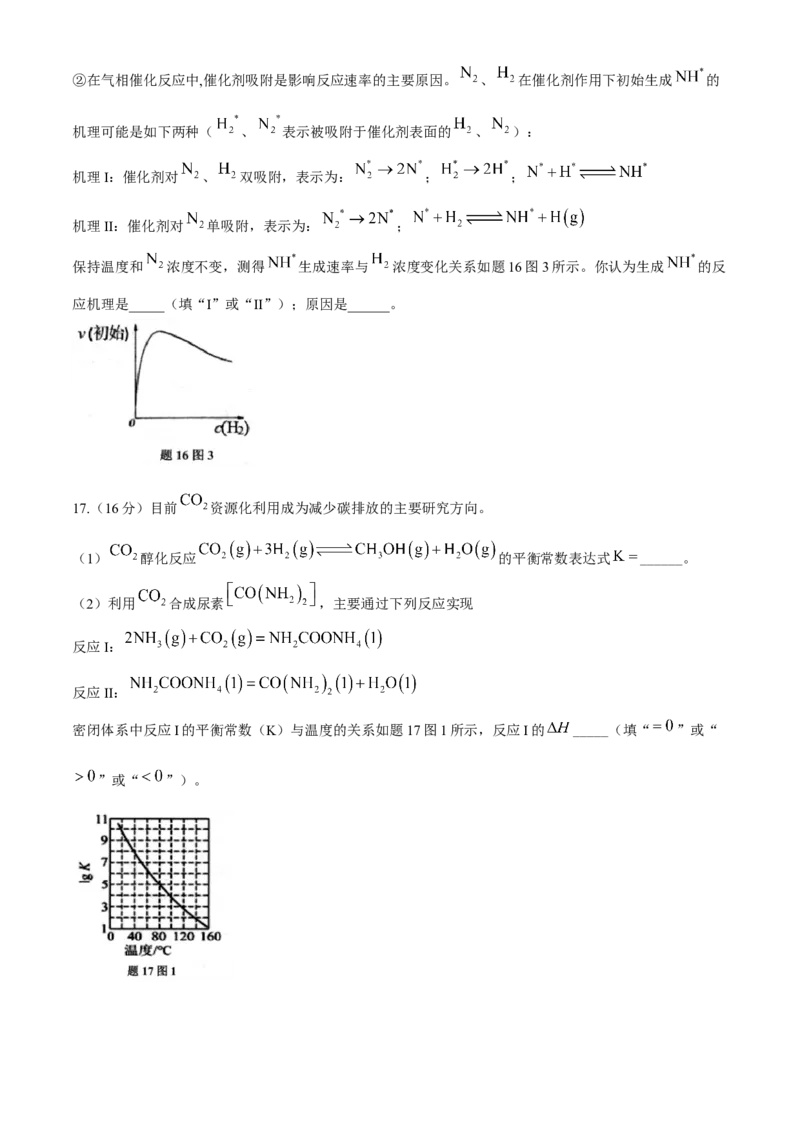
(4)在密闭容器中进行合成氨反应 ,在相同时间内,测得混合气体中氨气
的体积分数与温度的关系如题16图2所示。
①P点对应的速率 (正)__________ (逆)(填“>”“<”或“=”)。②在气相催化反应中,催化剂吸附是影响反应速率的主要原因。 、 在催化剂作用下初始生成 的
机理可能是如下两种( 、 表示被吸附于催化剂表面的 、 ):
机理I:催化剂对 、 双吸附,表示为: ; ;
机理II:催化剂对 单吸附,表示为: ;
保持温度和 浓度不变,测得 生成速率与 浓度变化关系如题16图3所示。你认为生成 的反
应机理是_____(填“I”或“II”);原因是______。
17.(16分)目前 资源化利用成为减少碳排放的主要研究方向。
(1) 醇化反应 的平衡常数表达式 ______。
(2)利用 合成尿素 ,主要通过下列反应实现
反应I:
反应II:
密闭体系中反应I的平衡常数(K)与温度的关系如题17图1所示,反应I的 _____(填“ ”或“
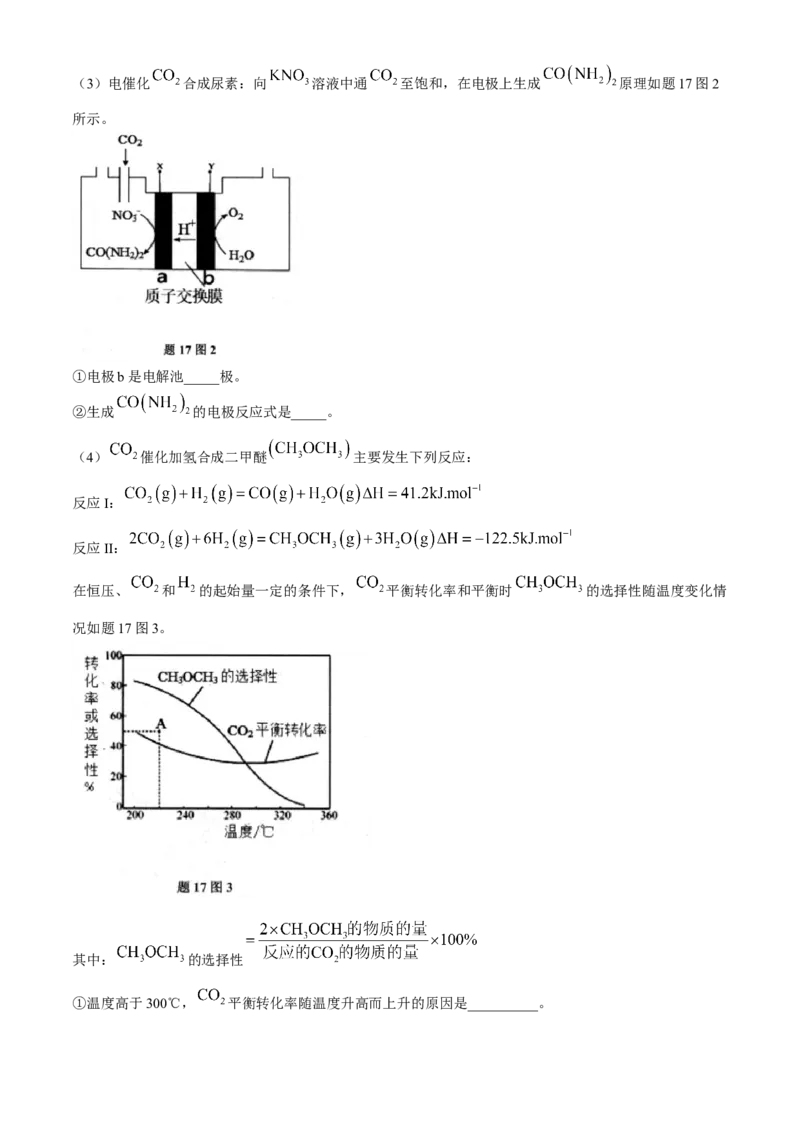
”或“ ”)。(3)电催化 合成尿素:向 溶液中通 至饱和,在电极上生成 原理如题17图2
所示。
①电极b是电解池_____极。
②生成 的电极反应式是_____。
(4) 催化加氢合成二甲醚 主要发生下列反应:
反应I:
反应II:
在恒压、 和 的起始量一定的条件下, 平衡转化率和平衡时 的选择性随温度变化情
况如题17图3。
其中: 的选择性
①温度高于300℃, 平衡转化率随温度升高而上升的原因是__________。②220℃时,在催化剂作用下 与 反应一段时间后,测得 的选择性为48%(图中A点)。
不改变反应时间和温度,一定能提高 选择性的措施是_____。