文档内容
射洪中学高 2024 级高二上期半期考试
化学试题
命题:苏凤丽 审核:代宽全 校对:郭锐
(考试时间:75分钟 满分:100分)
注意事项:
1.答卷前,考生务必将自己的班级、姓名、考号填写在答题卡上。
2.国答选择题时,选出每小题答案后,用 2B铅笔把答题卡上对应题目的答案标号涂
黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。写在本试卷上无效。
3.回答非选择题时,将答案写在答题卡对应题号的位置上。写在本试卷上无效。
4.考试结束后,将答题卡交回。
第 I 卷(选择题)
一、单选题(每题3分,共计45分)
1.化学反应速率的控制可以更好地造福人类。下列图示变化对应的化学反应速率的增大对
人类无益的是
C.淀粉水解生产
A.工业合成甲醇 B.金属桥梁腐蚀 D.药物合成
葡萄糖
A.A B.B C.C D.D
2.已知吸热反应 ,该反应高温自发,则有关该反应
的 、 判断正确的是
A. , B. ,
C. , D. ,
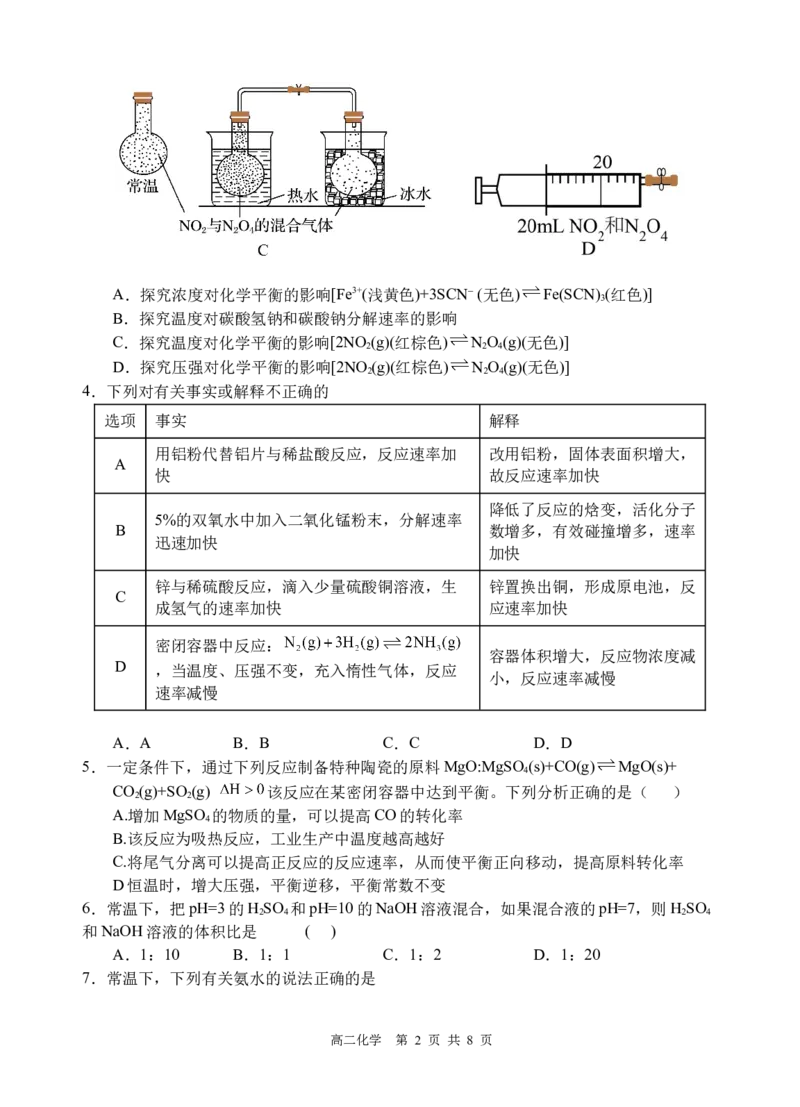
3.下列装置不能达到对应实验目的的是
高二化学 第 1 页 共 8 页A.探究浓度对化学平衡的影响[Fe3+(浅黄色)+3SCN⁻ (无色) Fe(SCN) (红色)]
3
B.探究温度对碳酸氢钠和碳酸钠分解速率的影响
C.探究温度对化学平衡的影响[2NO (g)(红棕色) N O (g)(无色)]
2 2 4
D.探究压强对化学平衡的影响[2NO (g)(红棕色) N O (g)(无色)]
2 2 4
4.下列对有关事实或解释不正确的
选项 事实 解释
用铝粉代替铝片与稀盐酸反应,反应速率加 改用铝粉,固体表面积增大,
A
快 故反应速率加快
降低了反应的焓变,活化分子
5%的双氧水中加入二氧化锰粉末,分解速率
B 数增多,有效碰撞增多,速率
迅速加快
加快
锌与稀硫酸反应,滴入少量硫酸铜溶液,生 锌置换出铜,形成原电池,反
C
成氢气的速率加快 应速率加快
密闭容器中反应:
容器体积增大,反应物浓度减
D ,当温度、压强不变,充入惰性气体,反应
小,反应速率减慢
速率减慢
A.A B.B C.C D.D
5.一定条件下,通过下列反应制备特种陶瓷的原料MgO:MgSO (s)+CO(g) MgO(s)+
4
CO (g)+SO (g) 该反应在某密闭容器中达到平衡。下列分析正确的是( )
2 2
A.增加MgSO 的物质的量,可以提高CO的转化率
4
B.该反应为吸热反应,工业生产中温度越高越好
C.将尾气分离可以提高正反应的反应速率,从而使平衡正向移动,提高原料转化率
D恒温时,增大压强,平衡逆移,平衡常数不变
6.常温下,把pH=3的H SO 和pH=10的NaOH溶液混合,如果混合液的pH=7,则H SO
2 4 2 4
和NaOH溶液的体积比是 ( )
A.1:10 B.1:1 C.1:2 D.1:20
7.常温下,下列有关氨水的说法正确的是
高二化学 第 2 页 共 8 页A.向氨水中不断加水稀释, 逐渐减小
B.向氨水中加入少量 固体, 减小
C.浓度不同的氨水中, 的 相同
D. 溶液的导电能力一定比氨水的导电能力强
8.下列说法错误的是
A.某温度下,0.02 mol·L-1 的Ba(OH) 与等浓度的NaHSO 等体积混合,混合后溶液的
2 4
pH=12
B.水是极弱的电解质,将少量Cl 通入水中,水的电离程度减小
2
C.将pH=3的CH COOH溶液稀释10倍后,若37,则MOH为弱碱
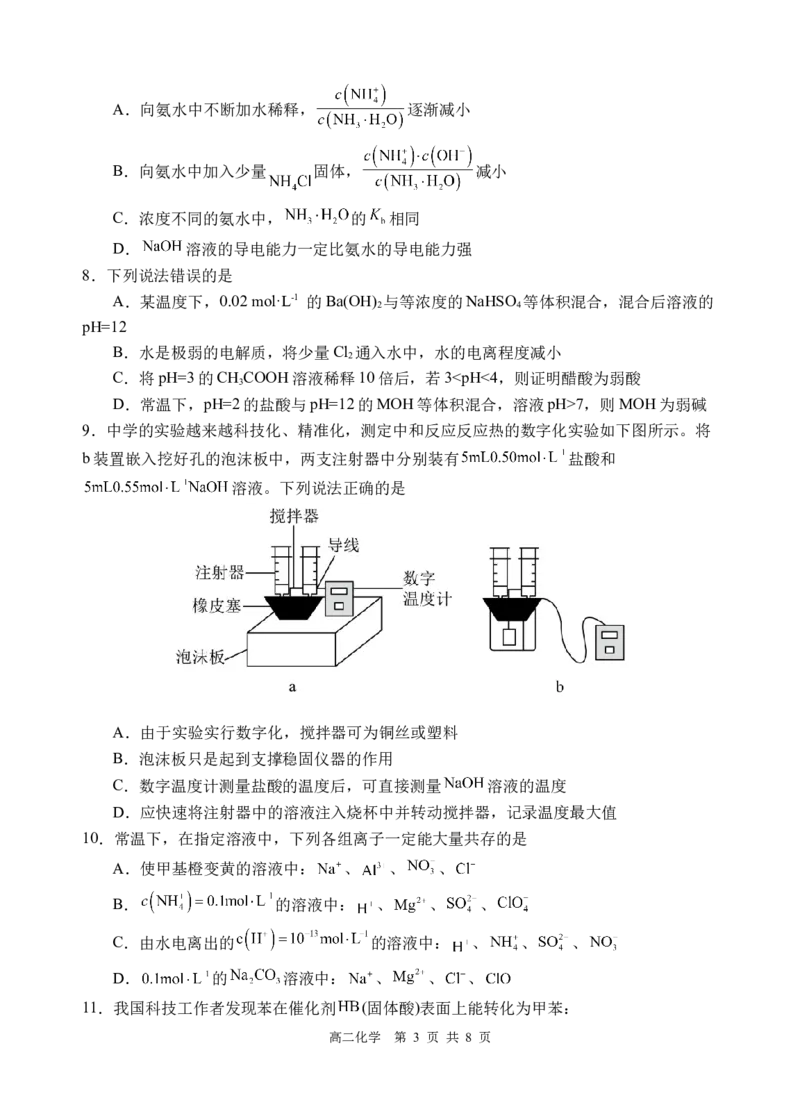
9.中学的实验越来越科技化、精准化,测定中和反应反应热的数字化实验如下图所示。将
b装置嵌入挖好孔的泡沫板中,两支注射器中分别装有 盐酸和
溶液。下列说法正确的是
A.由于实验实行数字化,搅拌器可为铜丝或塑料
B.泡沫板只是起到支撑稳固仪器的作用
C.数字温度计测量盐酸的温度后,可直接测量 溶液的温度
D.应快速将注射器中的溶液注入烧杯中并转动搅拌器,记录温度最大值
10.常温下,在指定溶液中,下列各组离子一定能大量共存的是
A.使甲基橙变黄的溶液中: 、 、 、
B. 的溶液中: 、 、 、
C.由水电离出的 的溶液中: 、 、 、
D. 的 溶液中: 、 、 、
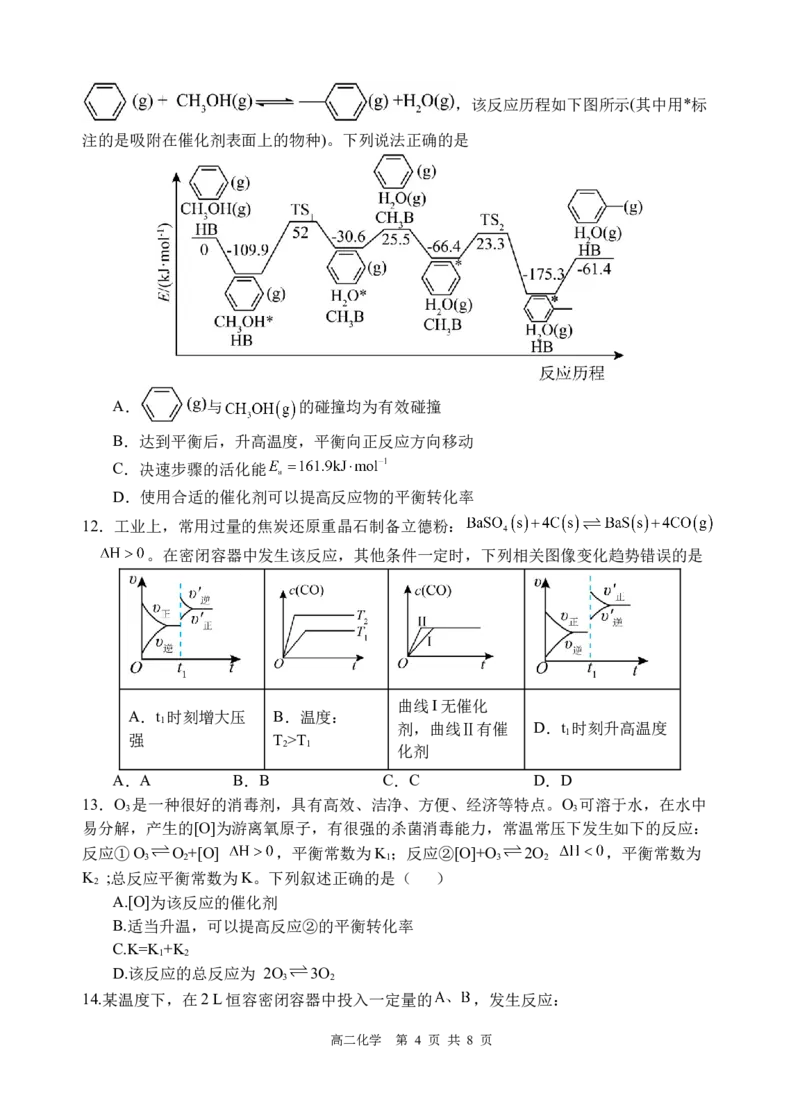
11.我国科技工作者发现苯在催化剂 (固体酸)表面上能转化为甲苯:
高二化学 第 3 页 共 8 页,该反应历程如下图所示(其中用*标
注的是吸附在催化剂表面上的物种)。下列说法正确的是
A. 与 的碰撞均为有效碰撞
B.达到平衡后,升高温度,平衡向正反应方向移动
C.决速步骤的活化能
D.使用合适的催化剂可以提高反应物的平衡转化率
12.工业上,常用过量的焦炭还原重晶石制备立德粉:
。在密闭容器中发生该反应,其他条件一定时,下列相关图像变化趋势错误的是
曲线I无催化
A.t 时刻增大压 B.温度:
1
剂,曲线Ⅱ有催 D.t 时刻升高温度
1
强 T >T
2 1
化剂
A.A B.B C.C D.D
13.O 是一种很好的消毒剂,具有高效、洁净、方便、经济等特点。O 可溶于水,在水中
3 3
易分解,产生的[O]为游离氧原子,有很强的杀菌消毒能力,常温常压下发生如下的反应:
反应①O O +[O] ,平衡常数为K ;反应②[O]+O 2O ,平衡常数为
3 2 1 3 2
K ;总反应平衡常数为K。下列叙述正确的是( )
2
A.[O]为该反应的催化剂
B.适当升温,可以提高反应②的平衡转化率
C.K=K +K
1 2
D.该反应的总反应为 2O 3O
3 2
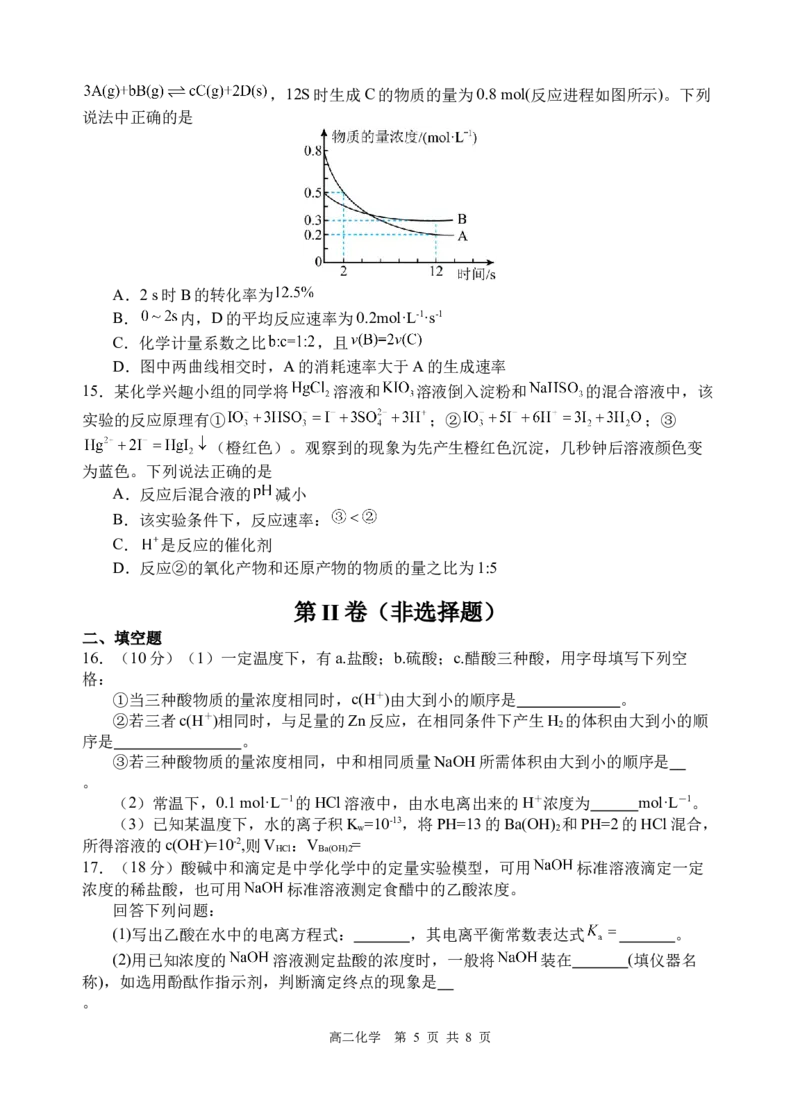
14.某温度下,在2 L恒容密闭容器中投入一定量的 ,发生反应:
高二化学 第 4 页 共 8 页,12S时生成C的物质的量为0.8 mol(反应进程如图所示)。下列
说法中正确的是
A.2 s时B的转化率为
B. 内,D的平均反应速率为0.2mol·L-1·s-1
C.化学计量系数之比 ,且
D.图中两曲线相交时,A的消耗速率大于A的生成速率
15.某化学兴趣小组的同学将 溶液和 溶液倒入淀粉和 的混合溶液中,该
实验的反应原理有① ;② ;③
(橙红色)。观察到的现象为先产生橙红色沉淀,几秒钟后溶液颜色变
为蓝色。下列说法正确的是
A.反应后混合液的 减小
B.该实验条件下,反应速率:
C. 是反应的催化剂
D.反应②的氧化产物和还原产物的物质的量之比为1:5
第 II 卷(非选择题)
二、填空题
16.(10分)(1)一定温度下,有a.盐酸;b.硫酸;c.醋酸三种酸,用字母填写下列空
格:
①当三种酸物质的量浓度相同时,c(H+)由大到小的顺序是 。
②若三者c(H+)相同时,与足量的Zn反应,在相同条件下产生H 的体积由大到小的顺
2
序是 。
③若三种酸物质的量浓度相同,中和相同质量NaOH所需体积由大到小的顺序是
。
(2)常温下,0.1 mol·L-1的HCl溶液中,由水电离出来的H+浓度为 mol·L-1。
(3)已知某温度下,水的离子积K =10-13,将PH=13的Ba(OH) 和PH=2的HCl混合,
w 2
所得溶液的c(OH-)=10-2,则V :V =
HCl Ba(OH)2
17.(18分)酸碱中和滴定是中学化学中的定量实验模型,可用 标准溶液滴定一定
浓度的稀盐酸,也可用 标准溶液测定食醋中的乙酸浓度。
回答下列问题:
(1)写出乙酸在水中的电离方程式: ,其电离平衡常数表达式 。
(2)用已知浓度的 溶液测定盐酸的浓度时,一般将 装在 (填仪器名
称),如选用酚酞作指示剂,判断滴定终点的现象是
。
高二化学 第 5 页 共 8 页(3)用 溶液测定盐酸的浓度的实验中,下列玻璃仪器中用不到的是 (填仪器
名称)。
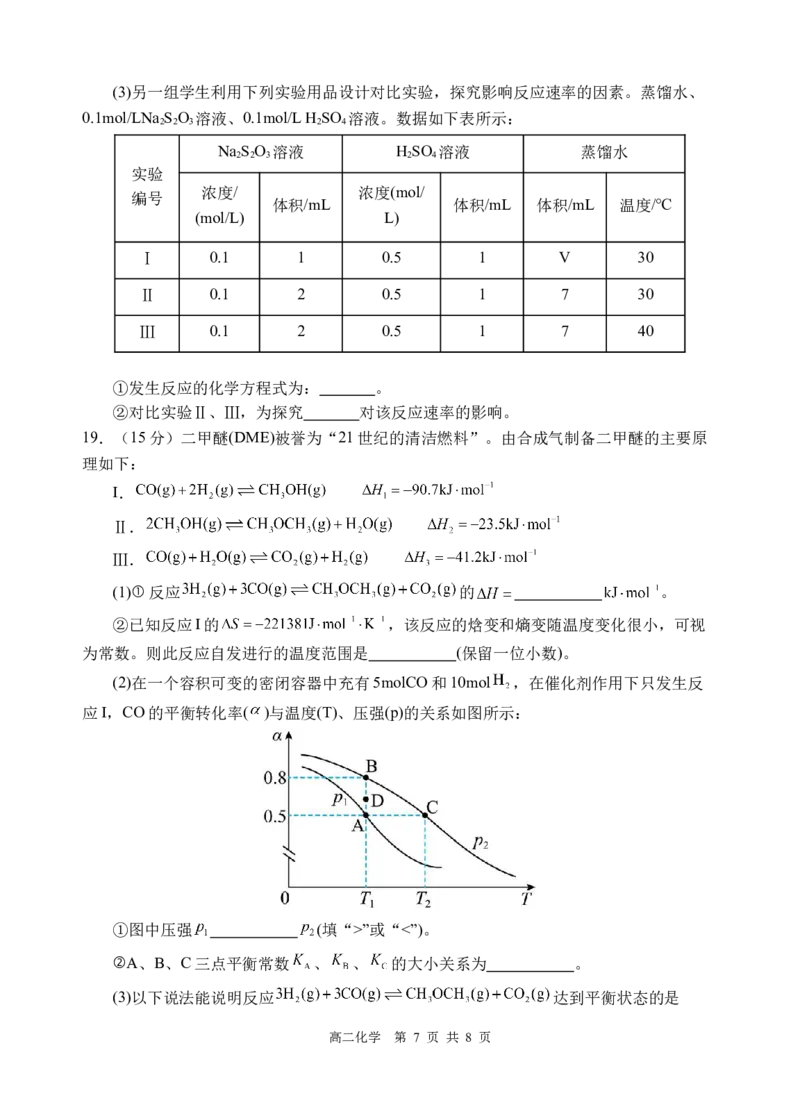
(4)取体积均为 的稀盐酸(浓度为 )和未知浓度的食醋,用
标准溶液分别进行滴定,得到甲、乙两个滴定曲线下图。
已知: 。
标准溶液滴定 盐酸的滴定曲线是 (填“甲”或“乙”);a点
溶液的 (不考虑溶液混合导致的体积变化);分析图像可知 1(填“=”
“>”或“<”)。
(5)测定食醋浓度的实验中,滴定终点读取滴定管数值时,仰视凹液面最低点,导致所
测食醋中乙酸浓度 (填“偏大”“不变”或“偏小”)。
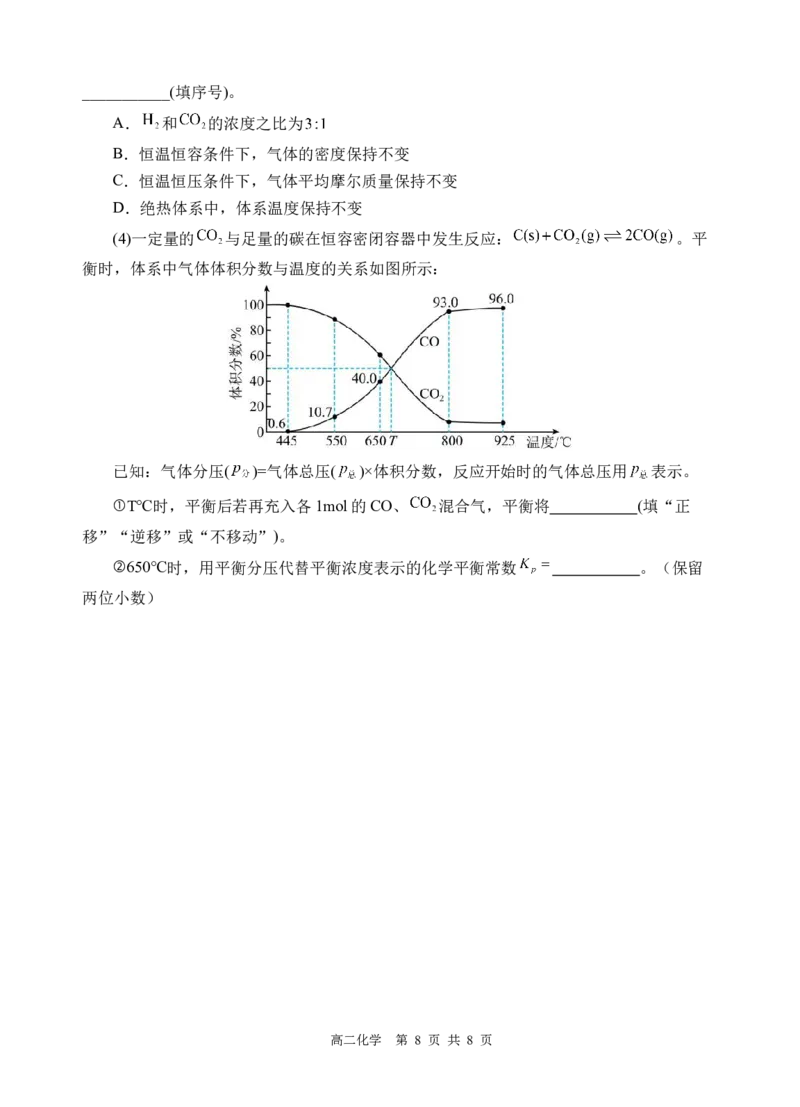
18.(12分)H O 作为氧化剂在反应时不产生污染物被称为绿色氧化剂,因而受到人们越
2 2
来越多的关注。但不稳定,易分解。为比较Fe3+和Cu2+对H O 分解的催化效果,某化学研
2 2
究小组的同学分别设计了如图甲、乙所示的实验。请回答下列问题:
(1)定性分析:图甲可通过观察 定性比较得出结论。有同学提出氯离子可能对实
验造成干扰,将FeCl 溶液改为 溶液更合理。
3
(2)定量分析:如图乙所示,实验时均以生成40 mL气体为准,其他可能影响实验的因
素均已忽略。检查全套装置气密性的方法是:关闭A的活塞,将注射器活塞向外拉出一段
后松手,过一段时间后看到 ,则气密性良好。实验中需要测量的数据是 。
高二化学 第 6 页 共 8 页(3)另一组学生利用下列实验用品设计对比实验,探究影响反应速率的因素。蒸馏水、
0.1mol/LNa S O 溶液、0.1mol/L H SO 溶液。数据如下表所示:
2 2 3 2 4
Na S O 溶液 H SO 溶液 蒸馏水
2 2 3 2 4
实验
浓度/ 浓度(mol/
编号
体积/mL 体积/mL 体积/mL 温度/℃
(mol/L) L)
Ⅰ 0.1 1 0.5 1 V 30
Ⅱ 0.1 2 0.5 1 7 30
Ⅲ 0.1 2 0.5 1 7 40
①发生反应的化学方程式为: 。
②对比实验Ⅱ、Ⅲ,为探究 对该反应速率的影响。
19.(15分)二甲醚(DME)被誉为“21世纪的清洁燃料”。由合成气制备二甲醚的主要原
理如下:
I.
Ⅱ.
Ⅲ.
(1)①反应 的 。
②已知反应I的 ,该反应的焓变和熵变随温度变化很小,可视
为常数。则此反应自发进行的温度范围是 (保留一位小数)。
(2)在一个容积可变的密闭容器中充有5molCO和10mol ,在催化剂作用下只发生反
应I,CO的平衡转化率( )与温度(T)、压强(p)的关系如图所示:
①图中压强 (填“>”或“<”)。
②A、B、C三点平衡常数 、 、 的大小关系为 。
(3)以下说法能说明反应 达到平衡状态的是
高二化学 第 7 页 共 8 页___________(填序号)。
A. 和 的浓度之比为
B.恒温恒容条件下,气体的密度保持不变
C.恒温恒压条件下,气体平均摩尔质量保持不变
D.绝热体系中,体系温度保持不变
(4)一定量的 与足量的碳在恒容密闭容器中发生反应: 。平
衡时,体系中气体体积分数与温度的关系如图所示:
已知:气体分压( )=气体总压( )×体积分数,反应开始时的气体总压用 表示。
①T℃时,平衡后若再充入各1mol的CO、 混合气,平衡将 (填“正
移”“逆移”或“不移动”)。
②650℃时,用平衡分压代替平衡浓度表示的化学平衡常数 。(保留
两位小数)
高二化学 第 8 页 共 8 页