文档内容
2025 届高三综合测试(二)
化 学
本试卷共 8 页,共 20 小题,满分 100 分。考试用时 75 分钟。
注意事项:
1.答卷前,考生务必用黑色字迹的钢笔或签字笔将自己的姓名、考生号、试室号和座位号填写在答题
卡上,用 2B 铅笔在答题卡相应位置上填涂考生号。
2.作答选择题时,选出每小题答案后,用 2B 铅笔把答题卡对应题目选项的答案信息点涂黑;如需改
动,用橡皮擦干净后,再选涂其他答案。答案不能答在试卷上。
3.非选择题必须用黑色字迹的钢笔或签字笔作答,答案必须写在答题卡各题目指定区域内相应位置上;
如需改动,先划掉原来的答案,然后再写上新答案;不准使用铅笔和涂改液。不按以上要求作答无效。
4.考生必须保持答题卡的整洁。考试结束后,将试卷和答题卡一并交回。
可能用到的相对原子质量:H1 Li7 C12 O16 Au197 Na23 Cl35.5
一、选择题:本大题共16小题,1~10每小题2分,11~16每小题4分,满分44分。在每小题列出的
四个选项中只有一项符合题目要求。
1.南粤之地人杰地灵,文化灿烂。下列广东博物院馆藏文物中,材料的主要成分为有机高分子的是
A.通雕蟹篓(木雕) B.南朝青铜盘 C.元白玉镂雕盖钮 D.南宋鎏金腰带
2.《厉害了,我的国》展示了中国科技举世瞩目的成就。下列说法不
.
正
.
确
.
的是
A.“祝融号”火星车利用正十一烷储能,正十一烷属于烃类
B.“华龙一号”核电海外投产,其反应堆中含有的235U与238U互为同素异形体
92 92
C.“天和核心舱”电推进系统采用了氮化硼陶瓷,其属于新型无机非金属材料
D.月球探测器带回的月壤样品中含磷酸盐晶体,其结构可用X射线衍射仪测定
3.化学与生产、生活密切相关,下列说法不
.
正
.
确
.
的是
A.人体中的蛋白质和核酸中都有氢键存在
B.碳酸钡可用于肠胃X射线造影检查
C.通过石油化工催化重整可得到芳香烃
D.煤的干馏、气化、液化均为化学变化
4.下列表示对应化学反应的离子方程式正确的是
A.硫酸酸化的淀粉碘化钾溶液久置后变蓝:4IO 4H 2I 2H O
2 2 2
B.Na与水的反应:2Na+2H+=2Na++H ↑
2
C.向NaHCO 溶液中加过量Ca(OH) 溶液:Ca22OH2HCO CaCO CO22H O
3 2 3 3 3 2
D.向Ca(ClO) 溶液中通入过量的SO :ClOSO H O HClOHSO
2 2 2 2 3
第1页,共8页
{#{QQABJYCAggioABJAAAgCAQ2ACAAQkgAAAYgGBBAMIAABSAFABAA=}#}5.电化学原理在生产生活中的用途十分广泛,下列说法正确的是
A.钢铁发生电化学腐蚀时,铁失去电子生成Fe3
B.铅蓄电池在放电时,正极与负极质量均增加
C.利用外加电流法保护闸门时,闸门与电源正极相连
D.氯碱工业中电解饱和食盐水,选用阴离子交换膜
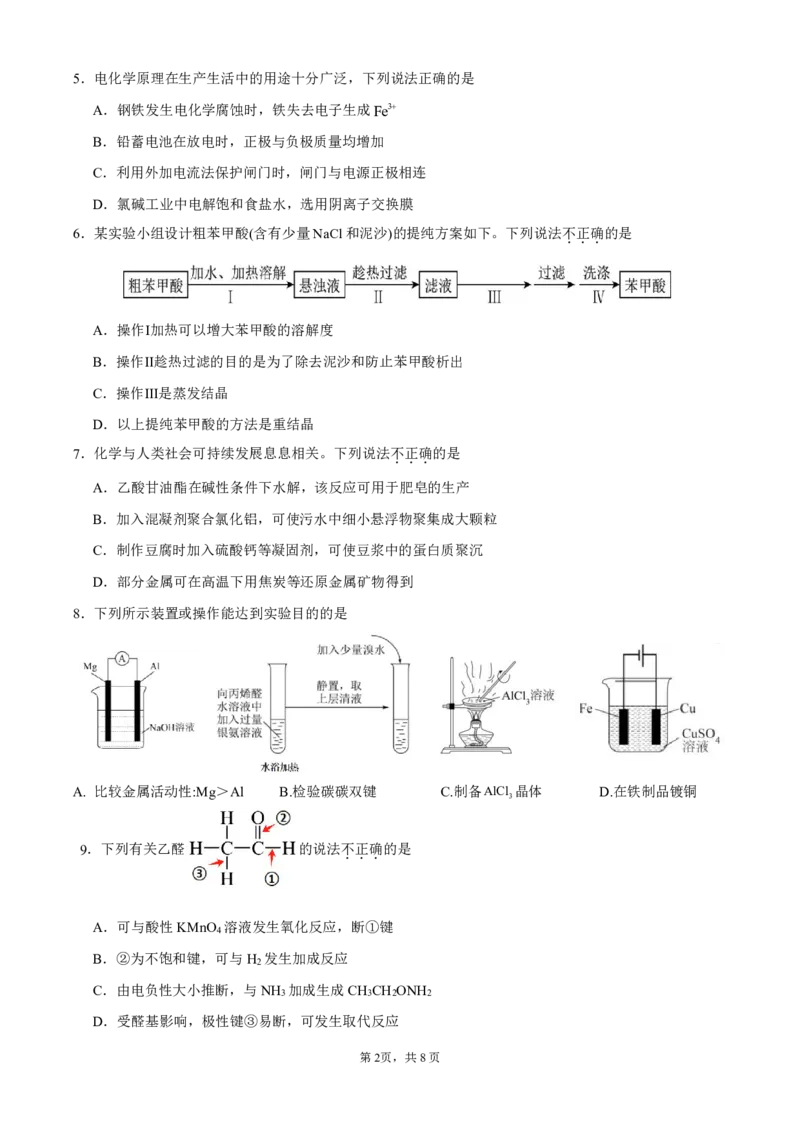
6.某实验小组设计粗苯甲酸(含有少量NaCl和泥沙)的提纯方案如下。下列说法不
.
正
.
确
.
的是
A.操作Ⅰ加热可以增大苯甲酸的溶解度
B.操作Ⅱ趁热过滤的目的是为了除去泥沙和防止苯甲酸析出
C.操作Ⅲ是蒸发结晶
D.以上提纯苯甲酸的方法是重结晶
7.化学与人类社会可持续发展息息相关。下列说法不
.
正
.
确
.
的是
A.乙酸甘油酯在碱性条件下水解,该反应可用于肥皂的生产
B.加入混凝剂聚合氯化铝,可使污水中细小悬浮物聚集成大颗粒
C.制作豆腐时加入硫酸钙等凝固剂,可使豆浆中的蛋白质聚沉
D.部分金属可在高温下用焦炭等还原金属矿物得到
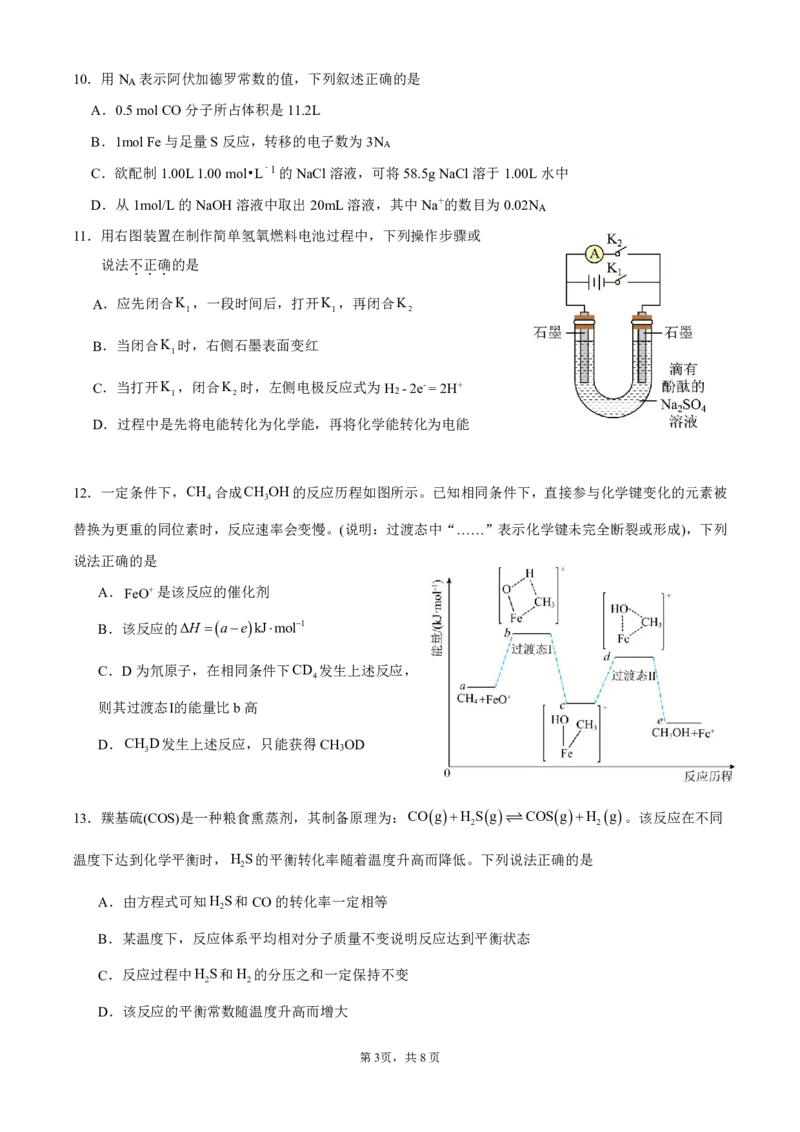
8.下列所示装置或操作能达到实验目的的是
A. 比较金属活动性:Mg>Al B.检验碳碳双键 C.制备AlCl 晶体 D.在铁制品镀铜
3
9.下列有关乙醛 的说法不
.
正
.
确
.
的是
A.可与酸性KMnO 溶液发生氧化反应,断①键
4
B.②为不饱和键,可与H 发生加成反应
2
C.由电负性大小推断,与NH 加成生成CH CH ONH
3 3 2 2
D.受醛基影响,极性键③易断,可发生取代反应
第2页,共8页
{#{QQABJYCAggioABJAAAgCAQ2ACAAQkgAAAYgGBBAMIAABSAFABAA=}#}10.用NA 表示阿伏加德罗常数的值,下列叙述正确的是
A.0.5molCO分子所占体积是11.2L
B.1molFe与足量S反应,转移的电子数为3N
A
C.欲配制1.00L1.00mol•L ﹣1的NaCl溶液,可将58.5gNaCl溶于1.00L水中
D.从1mol/L的NaOH溶液中取出20mL溶液,其中Na+的数目为0.02NA
11.用右图装置在制作简单氢氧燃料电池过程中,下列操作步骤或
说法不正确的是
...
A.应先闭合K ,一段时间后,打开K ,再闭合K
1 1 2
B.当闭合K 时,右侧石墨表面变红
1
C.当打开K ,闭合K 时,左侧电极反应式为H -2e-=2H+
1 2 2
D.过程中是先将电能转化为化学能,再将化学能转化为电能
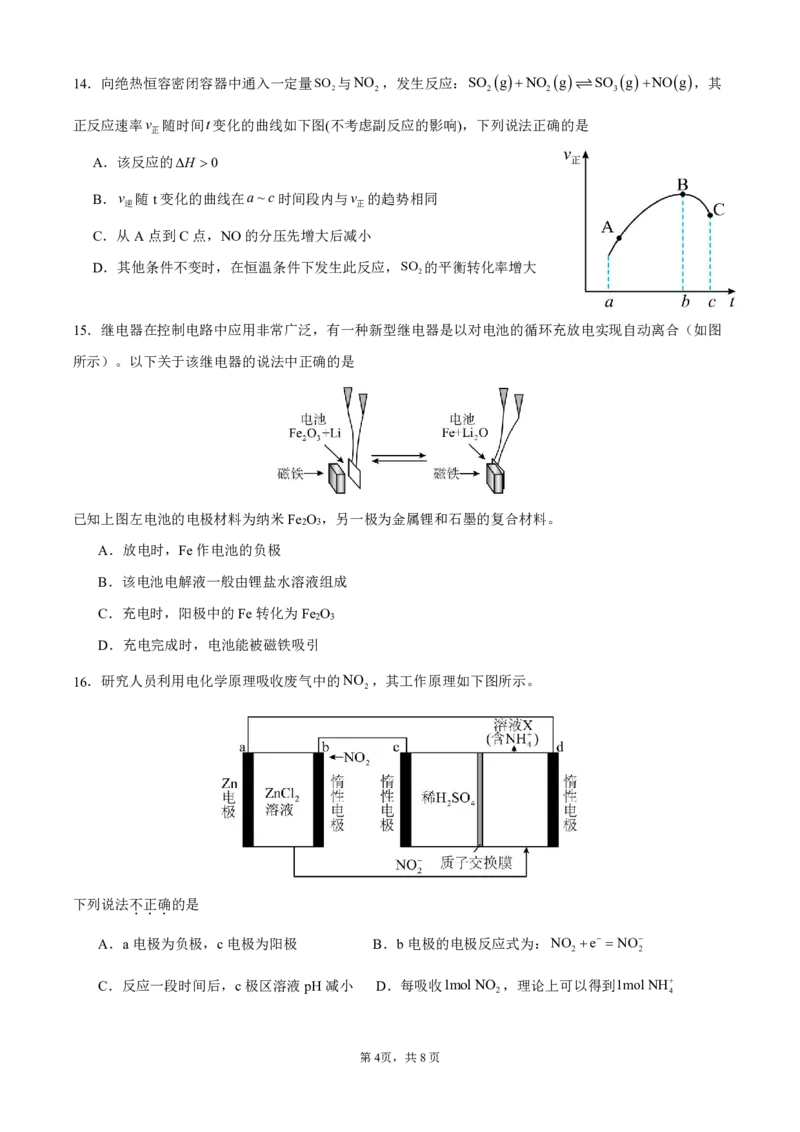
12.一定条件下,CH 合成CH OH的反应历程如图所示。已知相同条件下,直接参与化学键变化的元素被
4 3
替换为更重的同位素时,反应速率会变慢。(说明:过渡态中“……”表示化学键未完全断裂或形成),下列
说法正确的是
A.FeO是该反应的催化剂
B.该反应的ΔH aekJmol1
C.D为氘原子,在相同条件下CD 发生上述反应,
4
则其过渡态Ⅰ的能量比b高
D.CH D发生上述反应,只能获得CH OD
3 3
13.羰基硫(COS)是一种粮食熏蒸剂,其制备原理为:COgH Sg COSgH g。该反应在不同
2 2
温度下达到化学平衡时,H S的平衡转化率随着温度升高而降低。下列说法正确的是
2
A.由方程式可知H S和CO的转化率一定相等
2
B.某温度下,反应体系平均相对分子质量不变说明反应达到平衡状态
C.反应过程中H S和H 的分压之和一定保持不变
2 2
D.该反应的平衡常数随温度升高而增大
第3页,共8页
{#{QQABJYCAggioABJAAAgCAQ2ACAAQkgAAAYgGBBAMIAABSAFABAA=}#}14.向绝热恒容密闭容器中通入一定量SO 与NO ,发生反应:SO gNO g SO gNOg,其
2 2 2 2 3
正反应速率v 随时间t变化的曲线如下图(不考虑副反应的影响),下列说法正确的是
正
A.该反应的ΔH 0
B.v 随t变化的曲线在a~c时间段内与v 的趋势相同
逆 正
C.从A点到C点,NO的分压先增大后减小
D.其他条件不变时,在恒温条件下发生此反应,SO 的平衡转化率增大
2
15.继电器在控制电路中应用非常广泛,有一种新型继电器是以对电池的循环充放电实现自动离合(如图
所示)。以下关于该继电器的说法中正确的是
已知上图左电池的电极材料为纳米Fe O ,另一极为金属锂和石墨的复合材料。
2 3
A.放电时,Fe作电池的负极
B.该电池电解液一般由锂盐水溶液组成
C.充电时,阳极中的Fe转化为Fe O
2 3
D.充电完成时,电池能被磁铁吸引
16.研究人员利用电化学原理吸收废气中的NO ,其工作原理如下图所示。
2
下列说法不正确的是
...
A.a电极为负极,c电极为阳极 B.b电极的电极反应式为:NO e NO
2 2
C.反应一段时间后,c极区溶液pH减小 D.每吸收1molNO ,理论上可以得到1molNH
2 4
第4页,共8页
{#{QQABJYCAggioABJAAAgCAQ2ACAAQkgAAAYgGBBAMIAABSAFABAA=}#}二、非选择题:本大题共 4小题,共 56 分。
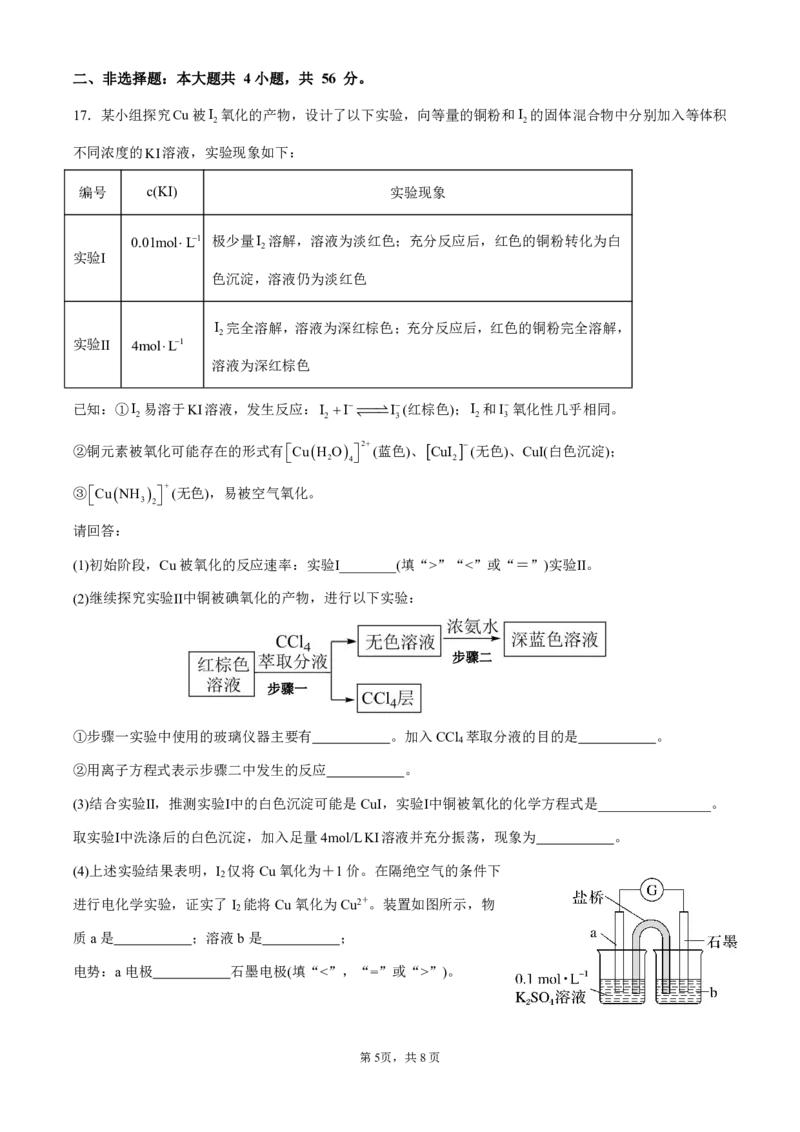
17.某小组探究Cu被I 氧化的产物,设计了以下实验,向等量的铜粉和I 的固体混合物中分别加入等体积
2 2
不同浓度的KI溶液,实验现象如下:
编号 c(KI) 实验现象
0.01molL1 极少量I 溶解,溶液为淡红色;充分反应后,红色的铜粉转化为白
2
实验Ⅰ
色沉淀,溶液仍为淡红色
I 完全溶解,溶液为深红棕色;充分反应后,红色的铜粉完全溶解,
2
实验Ⅱ 4molL1
溶液为深红棕色
已知:①I
2
易溶于KI溶液,发生反应:I
2
I I
3
(红棕色);I
2
和I
3
氧化性几乎相同。
②铜元素被氧化可能存在的形式有CuH O 2 (蓝色)、CuI (无色)、CuI(白色沉淀);
2 4 2
③CuNH (无色),易被空气氧化。
3 2
请回答:
(1)初始阶段,Cu被氧化的反应速率:实验Ⅰ________(填“>”“<”或“=”)实验Ⅱ。
(2)继续探究实验Ⅱ中铜被碘氧化的产物,进行以下实验:
步骤二
步骤一
①步骤一实验中使用的玻璃仪器主要有 。加入CCl 萃取分液的目的是 。
4
②用离子方程式表示步骤二中发生的反应 。
(3)结合实验Ⅱ,推测实验Ⅰ中的白色沉淀可能是CuI,实验Ⅰ中铜被氧化的化学方程式是________________。
取实验Ⅰ中洗涤后的白色沉淀,加入足量4mol/LKI溶液并充分振荡,现象为 。
(4)上述实验结果表明,I 仅将Cu氧化为+1价。在隔绝空气的条件下
2
进行电化学实验,证实了I 能将Cu氧化为Cu2+。装置如图所示,物
2
质a是 ;溶液b是 ;
电势:a电极 石墨电极(填“<”,“=”或“>”)。
第5页,共8页
{#{QQABJYCAggioABJAAAgCAQ2ACAAQkgAAAYgGBBAMIAABSAFABAA=}#}18.为充分利用资源,变废为宝,可从废旧CPU[含Au(金)、Ag、Cu和Pt(铂)]中回收Au,其化工流程如图,
回答下列问题:
(1)“酸浸氧化”中,为了提高反应速率,可以采取的措施是 (写出一种即可)。
(2)“酸浸氧化”中,若将稀HNO 改成稀H SO ,通入O 进行加热,也能浸出Cu2+,写出反应的离子方程
3 2 4 2
式 。
(3“) 酸溶”时,Pt、Au分别转化为H PtCl 和HAuCl ,同时有NO生成。Pt溶解的化学方程式是 。
2 6 4
(4)“萃取分液”后的“水层”中可回收的金属元素是 。
(5)从“还原分液”后的“有机层”中回收甲基异丁基甲酮,采用的方法是 。
(6)理论上消耗0.6mol草酸(H C O )可得到Au的物质的量为 mol。
2 2 4
(7)提取“滤液”中的Ag+会涉及反应AgCl(s)+2NH 3[Ag(NH
3
)
2
]++Cl-,则该反应的平衡常数K的值
为 。已知:①[Ag(NH
3
)
2
]+Ag++2NH
3
K
1
=6×10-8;②K
sp
(AgCl)=1.8×10-10。
第6页,共8页
{#{QQABJYCAggioABJAAAgCAQ2ACAAQkgAAAYgGBBAMIAABSAFABAA=}#}
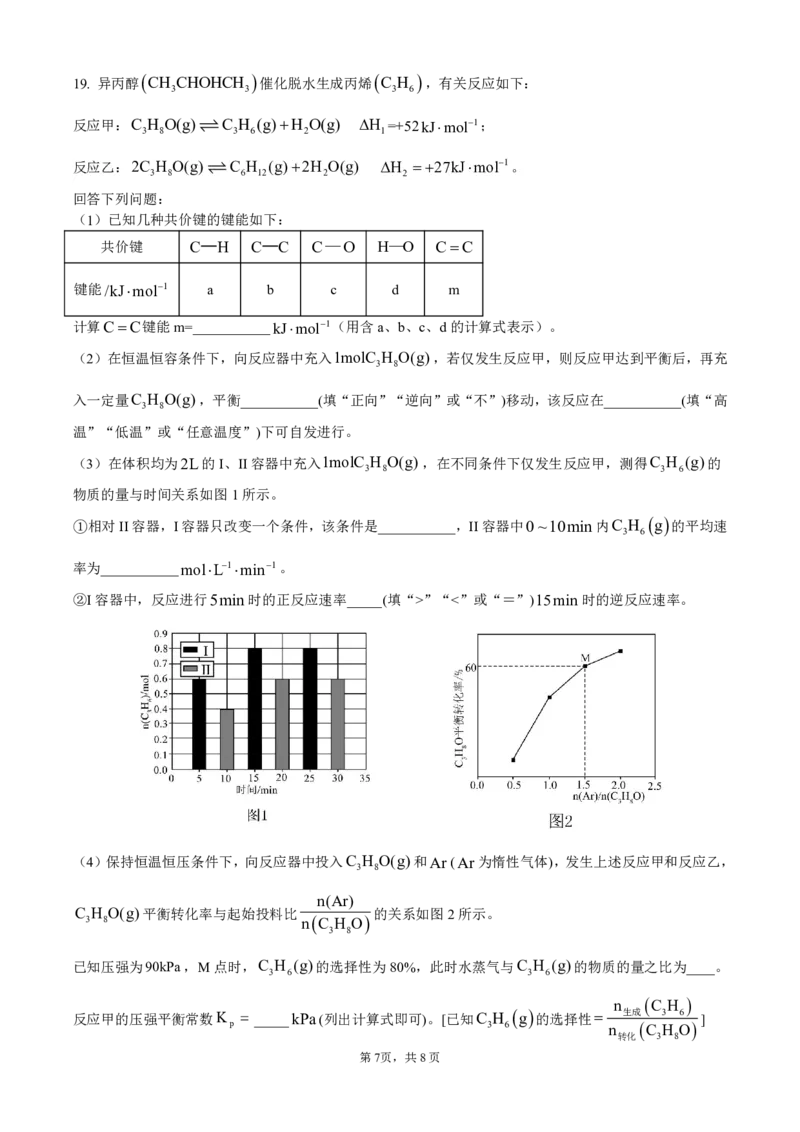
19. 异丙醇 CH CHOHCH 催化脱水生成丙烯 C H ,有关反应如下:
3 3 3 6
反应甲:C H O(g)C H (g)H O(g) H =+52kJmol1;
3 8 3 6 2 1
反应乙:2C H O(g) C H (g)2H O(g) H 27kJmol1。
3 8 6 12 2 2
回答下列问题:
(1)已知几种共价键的键能如下:
共价键 C—H C—C C—O H—O CC
键能/kJmol1 a b c d m
计算CC键能m=___________kJmol1(用含a、b、c、d的计算式表示)。
(2)在恒温恒容条件下,向反应器中充入1molC H O(g),若仅发生反应甲,则反应甲达到平衡后,再充
3 8
入一定量C H O(g),平衡___________(填“正向”“逆向”或“不”)移动,该反应在___________(填“高
3 8
温”“低温”或“任意温度”)下可自发进行。
(3)在体积均为2L的I、II容器中充入1molC H O(g),在不同条件下仅发生反应甲,测得C H (g)的
3 8 3 6
物质的量与时间关系如图1所示。
①相对II容器,I容器只改变一个条件,该条件是___________,II容器中0~10min内C H g 的平均速
3 6
率为___________molL1min1。
②I容器中,反应进行5min时的正反应速率_____(填“>”“<”或“=”)15min时的逆反应速率。
(4)保持恒温恒压条件下,向反应器中投入C H O(g)和Ar(Ar为惰性气体),发生上述反应甲和反应乙,
3 8
n(Ar)
C H O(g)平衡转化率与起始投料比 的关系如图2所示。
3 8 n C H O
3 8
已知压强为90kPa,M点时,C H (g)的选择性为80%,此时水蒸气与C H (g)的物质的量之比为____。
3 6 3 6
n C H
反应甲的压强平衡常数K _____kPa(列出计算式即可)。[已知C H g 的选择性 生成 3 6 ]
p 3 6 n C H O
转化 3 8
第7页,共8页
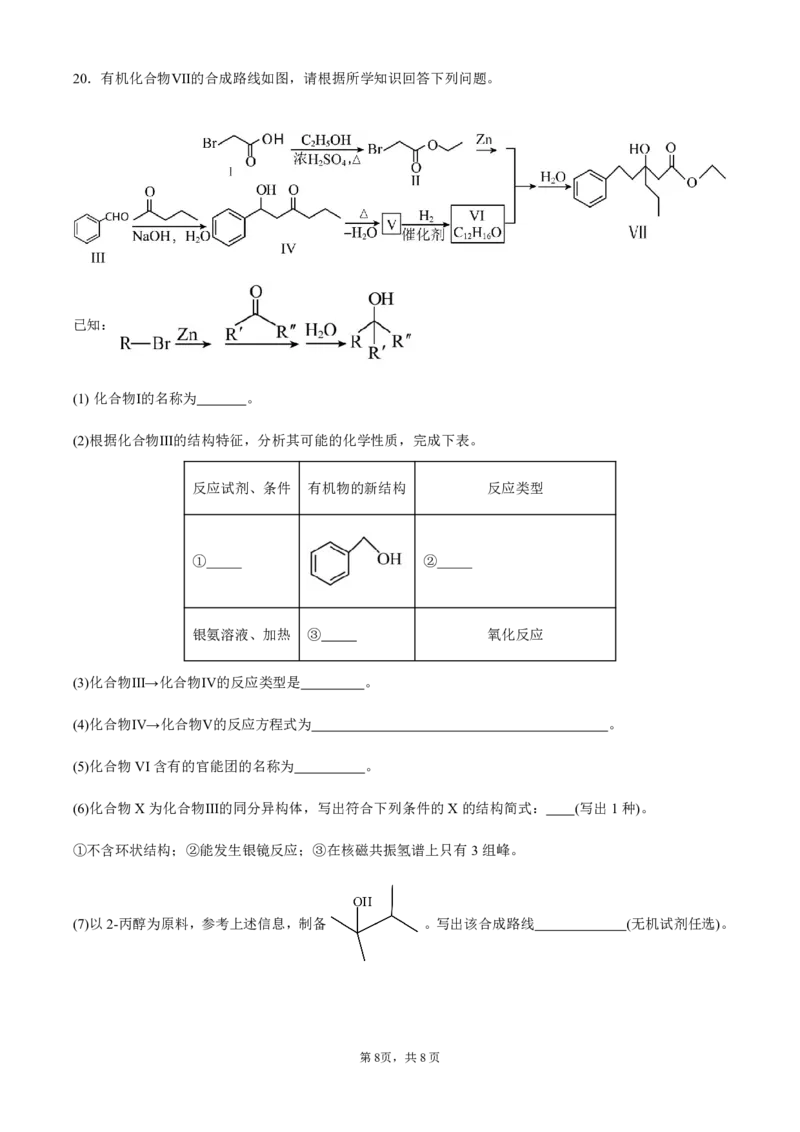
{#{QQABJYCAggioABJAAAgCAQ2ACAAQkgAAAYgGBBAMIAABSAFABAA=}#}20.有机化合物Ⅶ的合成路线如图,请根据所学知识回答下列问题。
已知:
(1) 化合物Ⅰ的名称为 。
(2)根据化合物Ⅲ的结构特征,分析其可能的化学性质,完成下表。
反应试剂、条件 有机物的新结构 反应类型
① ②
银氨溶液、加热 ③ 氧化反应
(3)化合物Ⅲ→化合物Ⅳ的反应类型是 。
(4)化合物Ⅳ→化合物Ⅴ的反应方程式为 。
(5)化合物VI含有的官能团的名称为 。
(6)化合物X为化合物Ⅲ的同分异构体,写出符合下列条件的X的结构简式: (写出1种)。
①不含环状结构;②能发生银镜反应;③在核磁共振氢谱上只有3组峰。
(7)以2-丙醇为原料,参考上述信息,制备 。写出该合成路线 (无机试剂任选)。
第8页,共8页
{#{QQABJYCAggioABJAAAgCAQ2ACAAQkgAAAYgGBBAMIAABSAFABAA=}#}2025 届高三综合测试(二)
化学参考答案
一、选择题(1~10每小题2分,11~16每小题4分;共44分)
题号 1 2 3 4 5 6 7 8 9 10
答案 A B B A B C A D C D
题号 11 12 13 14 15 16
答案 C C C D C D
二、非选择题(共56分)
17.共14分,除备注外每空2分
(1) < 1分
(2) ① (梨形)分液漏斗、烧杯 除去I(或I-),防止干扰后续实验
2 3
② 4CuI 16NH H OO 4CuNH 2 14H O8I4OH 或分开写
2 3 2 2 3 4 2
CuI 2NH H O Cu NH 2H O2I
2 3 2 3 2 2
4CuNH O 8NH H O4CuNH 2 4OH6H O
3 2 2 3 2 3 4 2
(3) 2Cu+I ===2CuI(或2Cu+KI ===2CuI+KI) 白色沉淀完全溶解,形成无色溶液
2 3
(4) 铜 I 与KI溶液混合液 < 各1分
2
18.共14分,每空2分。
(1)将废旧CPU粉碎或适当增大稀硝酸的浓度、升温、搅拌
(2)2Cu+O +4H+=2Cu2++2H O
2 2
(3)3Pt+18HCl+4HNO =3H PtCl +4NO↑+8H O
3 2 6 2
(4)Pt (5)蒸馏 (6)0.4 (7)0.003
{#{QQABJYCAggioABJAAAgCAQ2ACAAQkgAAAYgGBBAMIAABSAFABAA=}#}19.共14分,前4空每空1分,其余每空2分
(1)a+b+c-d-52
(2) 正向 高温
(3) ①升温 0.02 ② >
0.48 0.6
90 90
3.04 3.04
(4) 1.25
0.4
90
3.04
20.共14分。
(1)一溴乙酸(或2-溴乙酸)
(2) H、催化剂、加热 加成反应(或还原反应) 或 各1分
2
(3) 加成反应 1分
(4) 2分
(5)羰基 1分
(6) CH -CH -C C-C C-CHO 、CH -CC-CC-CH -CHO 、CH -CC-CH -CC-CHO 、
3 2 3 2 3 2
(7) 3分
{#{QQABJYCAggioABJAAAgCAQ2ACAAQkgAAAYgGBBAMIAABSAFABAA=}#}