文档内容
2021 年苏州市初中毕业暨升学考试试卷
化学
注意事项:
1.本试奏分选择题和非选择题,选择题第1页至第3页,非选择题第4页至第8页;共28题,满分100分;
考试用时100分钟
2.答题前,考生务必将自己的姓名、考点名称、考场号、座位号用0.5毫米黑色墨水签字笔填写在答题卡相对
应的位置上,并认真核对条形码上的准考号、姓名是否与本人的相符合。
3.答选择题必须用2B铅笔把答题卡相对应题目的答案标号涂黑,如需改动,请用橡皮擦干净后,再选涂其他
答案;答非选择题必须用0.5毫米黑色墨水签字笔写在答题卡指定的位置上,不在答题区城内的答案一律无
效,不得用其他笔答题。
可能用到的相对原子质量:H-1 C-12 O-16 Na-23 C1-35.5
选择题(共 40 分)
单项选择题(包括20小题,每题2分,共40分。每题只有一个选项符合题意。)
1.2021年6月5日是第50个“世界环境日”。下列做法不利于保护环境的是
A.生活垃圾分类处理 B.工业废水直接排放
C.农药化肥合理施用 D.清洁能源推广使用
2.下列物质属于氧化物的是
A H O B.O C.Na SO D. H CO
2 2 2 4 2 3
3.下列物质由离子构成的是
A.铜 B.二氧化碳 C.氯化钠 D.金刚石
4.保鲜膜的主要成分是聚乙烯(化学式为[ ])。聚乙烯属于
A.金属材料 B.合成材料 C.无机非金属材料 D.复合材料
5.下列化学用语表达正确的是
A.2个氢原子:H B.锌元素:ZN
2
C.钠原子结构示意图: D.氧化镁中镁元素的化合价:
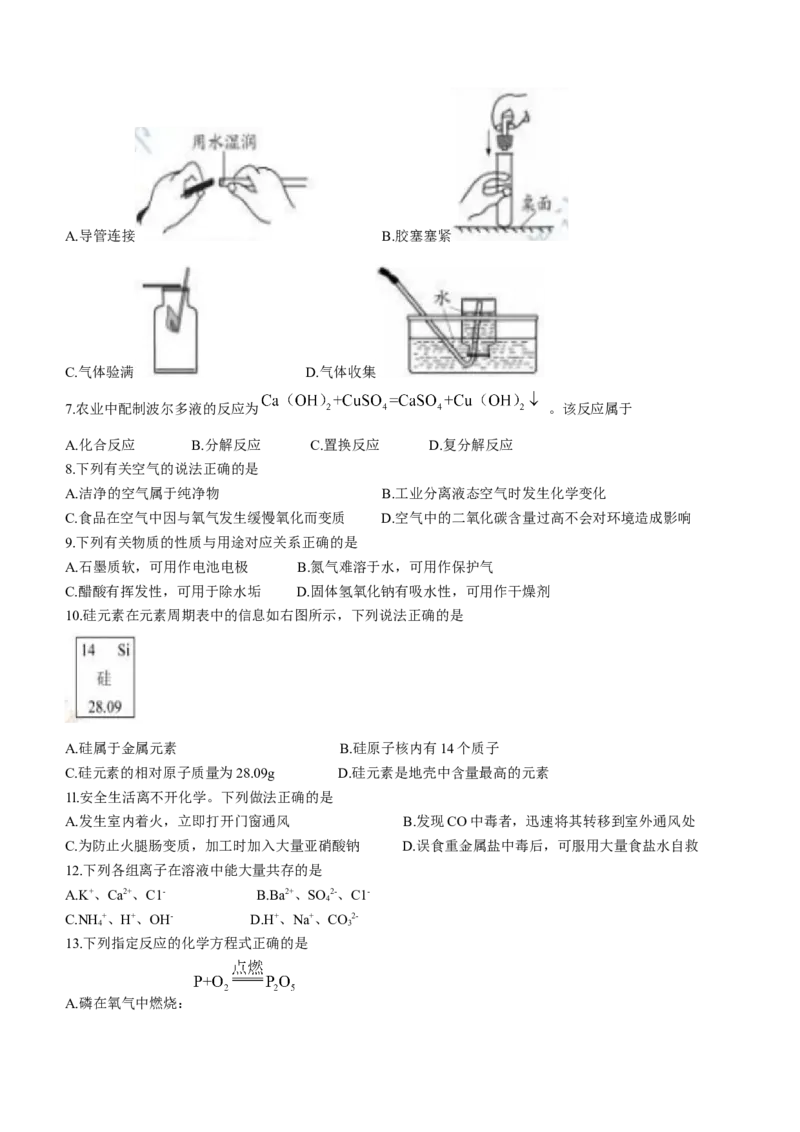
6.下列有关实验室制取二氧化碳气体的操作图示正确的是A.导管连接 B.胶塞塞紧
C.气体验满 D.气体收集
7.农业中配制波尔多液的反应为 。该反应属于
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
8.下列有关空气的说法正确的是
A.洁净的空气属于纯净物 B.工业分离液态空气时发生化学变化
C.食品在空气中因与氧气发生缓慢氧化而变质 D.空气中的二氧化碳含量过高不会对环境造成影响
9.下列有关物质的性质与用途对应关系正确的是
A.石墨质软,可用作电池电极 B.氮气难溶于水,可用作保护气
C.醋酸有挥发性,可用于除水垢 D.固体氢氧化钠有吸水性,可用作干燥剂
10.硅元素在元素周期表中的信息如右图所示,下列说法正确的是
A.硅属于金属元素 B.硅原子核内有14个质子
C.硅元素的相对原子质量为28.09g D.硅元素是地壳中含量最高的元素
1l.安全生活离不开化学。下列做法正确的是
A.发生室内着火,立即打开门窗通风 B.发现CO中毒者,迅速将其转移到室外通风处
C.为防止火腿肠变质,加工时加入大量亚硝酸钠 D.误食重金属盐中毒后,可服用大量食盐水自救
12.下列各组离子在溶液中能大量共存的是
A.K+、Ca2+、C1- B.Ba2+、SO 2-、C1-
4
C.NH+、H+、OH- D.H+、Na+、CO2-
4 3
13.下列指定反应的化学方程式正确的是
A.磷在氧气中燃烧:B.铜丝插入硝酸银溶液中:
C.高锰酸钾受热分解:
D.绿色植物的光合作用:
14.下列有关溶液的说法正确的是
A.均一、稳定的液体都是溶液 B.少量泥土与水混合能形成溶液
C.氢氧化钠溶液的导电性比水强 D.浓硫酸与水混合会吸收大量热
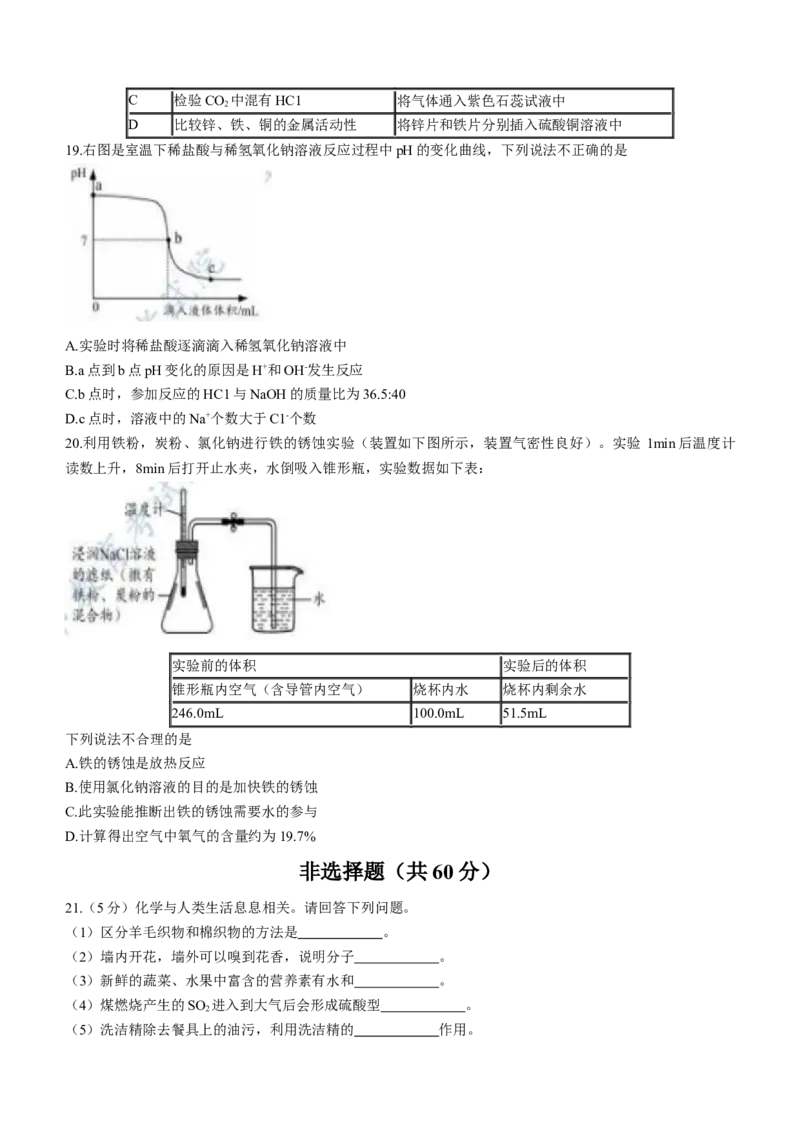
15.NaCl和KNO 的溶解度曲线如右图所示。下列说法正确的是
3
A. KNO 的溶解度一定大于NaCl
3
B.NaCl的溶解度受温度影响的程度比KNO 大
3
C.40℃时,KNO 饱和溶液的溶质质量分数为63.9%
3
D.将60℃时210g KNO 饱和溶液降温至20℃,析出KNO 晶体78.4g
3 3
16.下列有关金属的说法正确的是
A.所有金属都呈银白色 B.常温下所有的金属都是固体
C.合金的硬度一般比各成分金属小 D.铝制品耐腐蚀是因为表面生成致密氧化膜
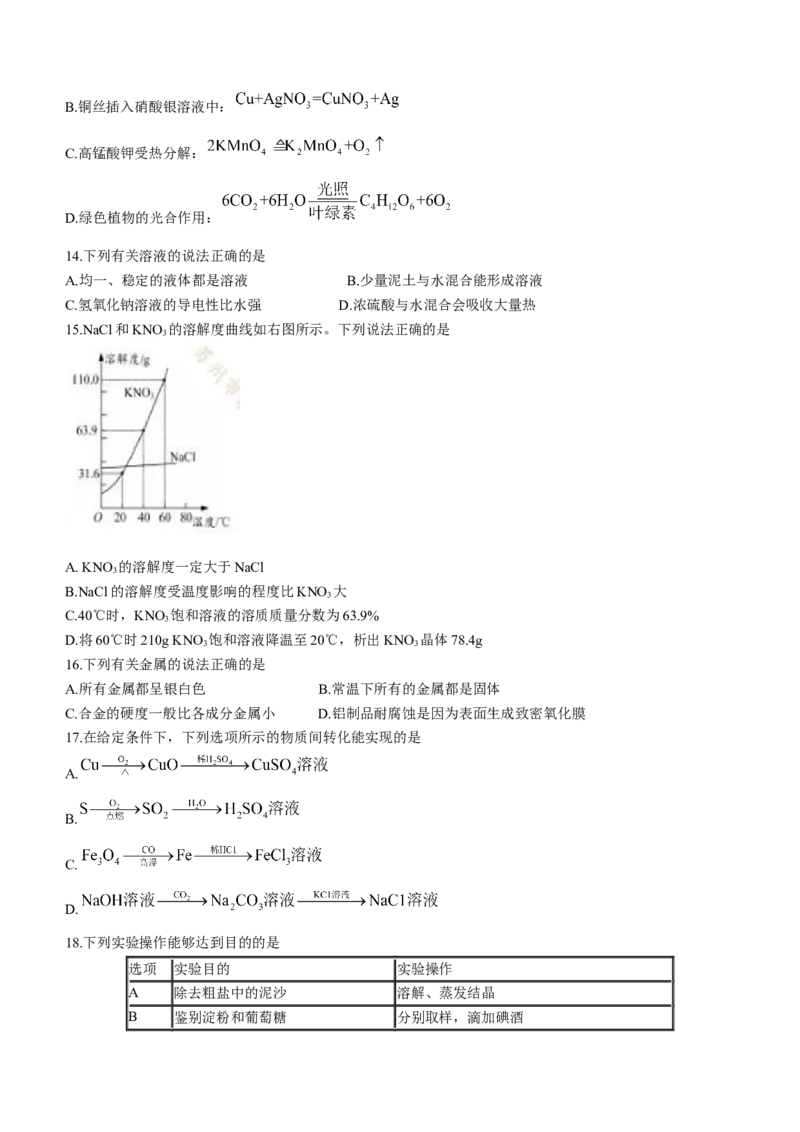
17.在给定条件下,下列选项所示的物质间转化能实现的是
A.
B.
C.
D.
18.下列实验操作能够达到目的的是
选项 实验目的 实验操作
A 除去粗盐中的泥沙 溶解、蒸发结晶
B 鉴别淀粉和葡萄糖 分别取样,滴加碘酒C 检验CO 中混有HC1 将气体通入紫色石蕊试液中
2
D 比较锌、铁、铜的金属活动性 将锌片和铁片分别插入硫酸铜溶液中
19.右图是室温下稀盐酸与稀氢氧化钠溶液反应过程中pH的变化曲线,下列说法不正确的是
A.实验时将稀盐酸逐滴滴入稀氢氧化钠溶液中
B.a点到b点pH变化的原因是H+和OH-发生反应
C.b点时,参加反应的HC1与NaOH的质量比为36.5:40
D.c点时,溶液中的Na+个数大于C1-个数
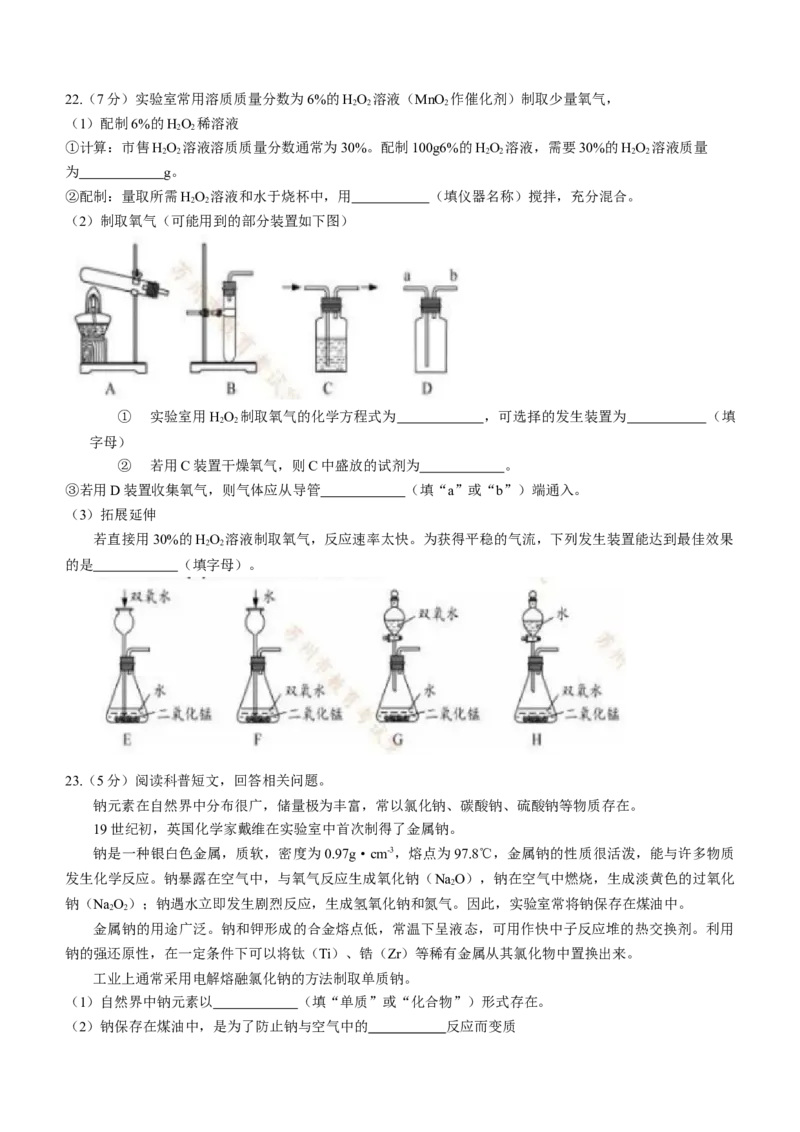
20.利用铁粉,炭粉、氯化钠进行铁的锈蚀实验(装置如下图所示,装置气密性良好)。实验 1min后温度计
读数上升,8min后打开止水夹,水倒吸入锥形瓶,实验数据如下表:
实验前的体积 实验后的体积
锥形瓶内空气(含导管内空气) 烧杯内水 烧杯内剩余水
246.0mL 100.0mL 51.5mL
下列说法不合理的是
A.铁的锈蚀是放热反应
B.使用氯化钠溶液的目的是加快铁的锈蚀
C.此实验能推断出铁的锈蚀需要水的参与
D.计算得出空气中氧气的含量约为19.7%
非选择题(共 60 分)
21.(5分)化学与人类生活息息相关。请回答下列问题。
(1)区分羊毛织物和棉织物的方法是 。
(2)墙内开花,墙外可以嗅到花香,说明分子 。
(3)新鲜的蔬菜、水果中富含的营养素有水和 。
(4)煤燃烧产生的SO 进入到大气后会形成硫酸型 。
2
(5)洗洁精除去餐具上的油污,利用洗洁精的 作用。22.(7分)实验室常用溶质质量分数为6%的HO 溶液(MnO 作催化剂)制取少量氧气,
2 2 2
(1)配制6%的HO 稀溶液
2 2
①计算:市售HO 溶液溶质质量分数通常为30%。配制100g6%的HO 溶液,需要30%的HO 溶液质量
2 2 2 2 2 2
为 g。
②配制:量取所需HO 溶液和水于烧杯中,用 (填仪器名称)搅拌,充分混合。
2 2
(2)制取氧气(可能用到的部分装置如下图)
① 实验室用HO 制取氧气的化学方程式为 ,可选择的发生装置为 (填
2 2
字母)
② 若用C装置干燥氧气,则C中盛放的试剂为 。
③若用D装置收集氧气,则气体应从导管 (填“a”或“b”)端通入。
(3)拓展延伸
若直接用30%的HO 溶液制取氧气,反应速率太快。为获得平稳的气流,下列发生装置能达到最佳效果
2 2
的是 (填字母)。
23.(5分)阅读科普短文,回答相关问题。
钠元素在自然界中分布很广,储量极为丰富,常以氯化钠、碳酸钠、硫酸钠等物质存在。
19世纪初,英国化学家戴维在实验室中首次制得了金属钠。
钠是一种银白色金属,质软,密度为0.97g·cm-3,熔点为97.8℃,金属钠的性质很活泼,能与许多物质
发生化学反应。钠暴露在空气中,与氧气反应生成氧化钠(NaO),钠在空气中燃烧,生成淡黄色的过氧化
2
钠(NaO);钠遇水立即发生剧烈反应,生成氢氧化钠和氮气。因此,实验室常将钠保存在煤油中。
2 2
金属钠的用途广泛。钠和钾形成的合金熔点低,常温下呈液态,可用作快中子反应堆的热交换剂。利用
钠的强还原性,在一定条件下可以将钛(Ti)、锆(Zr)等稀有金属从其氯化物中置换出来。
工业上通常采用电解熔融氯化钠的方法制取单质钠。
(1)自然界中钠元素以 (填“单质”或“化合物”)形式存在。
(2)钠保存在煤油中,是为了防止钠与空气中的 反应而变质(3)过氧化钠中的阴离子为O2-,1个O2-离子含有的电子数为 。
2 2
(4)钠钾合金用作快中子反应堆的热交换剂,利用钠钾合金良好的 (填字母)。
a.导电性 b.导热性 c.延展性
(5)写出高温下钠与四氯化钛反应的化学方程式: 。
24.(7分)天然气广泛应用于生产生活,其主要成分是甲烷(CH)。
4
Ⅰ.天然气是重要的能源
(1)天然气属于 (填”可再生”或“不可再生”)能源。
(2)室温下,充分燃烧1g天然气和1g煤,产生的CO 及热量的对比如题24图所示。据图分析,与煤相比,
2
用天然气作燃料的优点有 。
(3)甲烷可直接应用于燃料电池,电池工作时的能量转化方式为 。
Ⅱ.天然气是重要的化工原料
(4)甲烷和二氧化碳在高温下催化重整(Ni 作催化剂)可制得 CO 和 H 。该反应的化学方程式为
2
。
(5)甲烷无氧催化重整可获得碳氢化合物X,X的相对分子质量为106,且碳、氢元素的质量比为48:5,则
X的化学式为 。
25.(6分)水是生命之源,是人类宝贵的自然资源。
Ⅰ.节約用水
(1)下列图标是我国“国家节水标志”的是 (填字母)。
Ⅱ.水的净化
天然水净化为自来水的主要流程如下:
(2)“沉降池”中可用明矾作混凝剂,其化学式为KA1(SO )·12H O,n的值为 。
4 n 2(3)“吸附池”中常用 (填物质名称)吸附色素和异味。
(4)“消毒池”中常用液氢作消毒剂,发生了反应: ,若用自来水直接配制硝酸
银溶液会产生氯化银白色沉淀。写出盐酸与硝酸银溶液反应的化学方程式: 。
Ⅲ.废水处理
(5)废水中氨氮(以NH 形式存在)含量过高,直接排放会导致水体富营养化。次氯酸(HC1O)可除去废
3
水中的NH ,发生的反应为: 。X的化学式为 ,若废水碱性
3
过强(pH>10),NH 的去除率会显著降低,原因是 。
3
26.(8分)碳酸氢铵是一种常用的化学肥料。工业生产碳酸氢铵的一种流程如下:
已知:“合成”步骤中发生的反应为 ,
(1)碳酸氢铵属于化肥中的 。肥
(2)“造气”步骤中为加快反应速率,可采取的具体措施有 。(写一条即可)
(3)“碳酸化”步骤的化学方程式为 。该步骤在较低温度下进行的原因是 。
(4)“碳酸化”步骤的作用是制取碳酸氢铵和 。
(5)“循环”的目的是 。
27.(10分)硫酸亚铁是一种重要的补铁剂。实验室以废铁屑(含少量Fe O )为原料制备硫酸:亚铁晶体的流
2 3
程如下:
已知:铁与硫酸铁反应的化学方程式为 。
(1)“碱洗”是为了洗去铁屑表面的油污,用热的碳酸钠溶液浸泡,过滤,再用蒸馏水洗涤2-3次。取最后
一次洗涤液,测其pH,若pH= ,说明洗涤液中无碳酸钠。
(2)“酸溶”是向“碱洗”过的铁屑中加入过量稀硫酸。
①写出铁与稀硫酸反应的化学方程式: 。
②所用硫酸溶液浓度不能太稀,原因是 。
③废铁屑中的少量Fe O 不需要进行除杂处理,原因是 。
2 3
(3)“结晶”的相关操作依次为:蒸发浓缩、降温结晶。蒸发浓缩的自的是 ,便于结晶。(4)含量测定:准确称取制得的硫酸亚铁样品2.82g于锥形瓶中,加蒸馏水完全溶解,加入稀硫酸,滴加溶
质质量分数为1.58%的高锰酸钾溶液,当恰好完全反应时,消耗高锰酸钾溶液的体积为 20.00mL(该高锰酸
钾溶液密度近似为1g·mL-1)。列式计算该样品中硫酸亚铁的含量(结果用百分数表示,保留一位小数)。
已知:高锰酸钾与硫酸亚铁反应的化学方程式为
(相对分子质量;FeSO -152,KMnO -158)
4 4
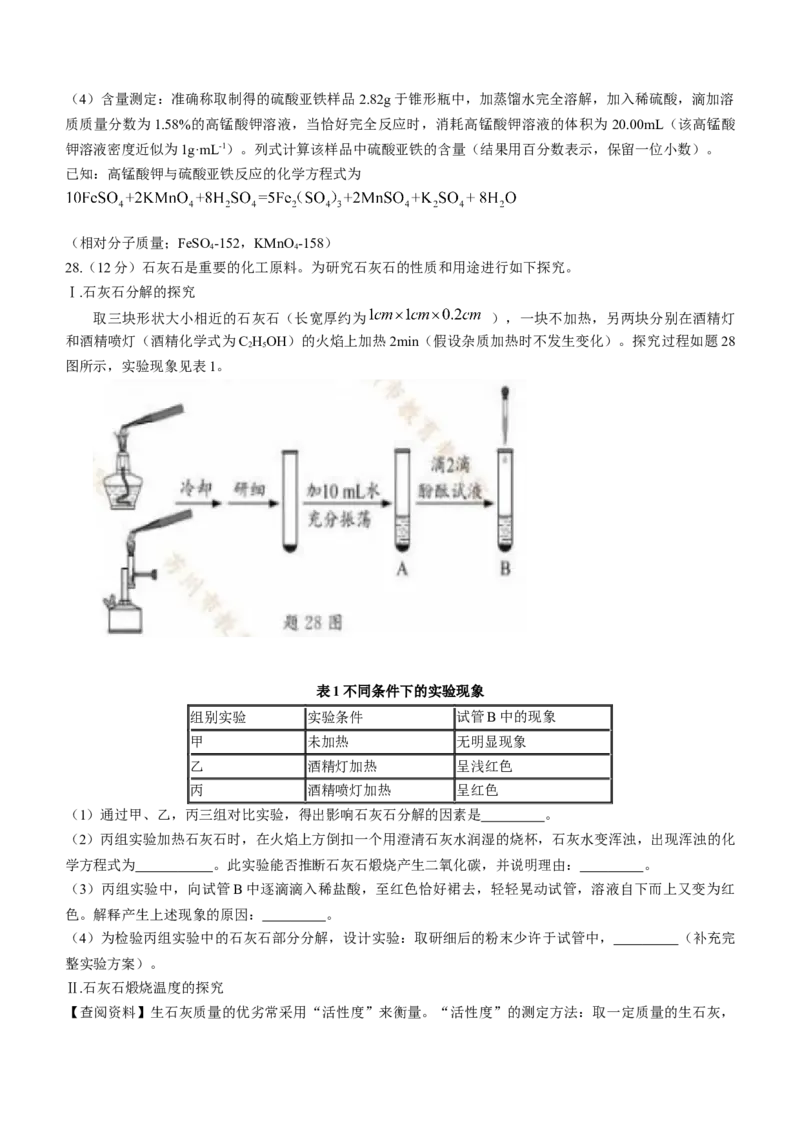
28.(12分)石灰石是重要的化工原料。为研究石灰石的性质和用途进行如下探究。
Ⅰ.石灰石分解的探究
取三块形状大小相近的石灰石(长宽厚约为 ),一块不加热,另两块分别在酒精灯
和酒精喷灯(酒精化学式为C HOH)的火焰上加热2min(假设杂质加热时不发生变化)。探究过程如题28
2 5
图所示,实验现象见表1。
表1不同条件下的实验现象
组别实验 实验条件 试管B中的现象
甲 未加热 无明显现象
乙 酒精灯加热 呈浅红色
丙 酒精喷灯加热 呈红色
(1)通过甲、乙,丙三组对比实验,得出影响石灰石分解的因素是 。
(2)丙组实验加热石灰石时,在火焰上方倒扣一个用澄清石灰水润湿的烧杯,石灰水变浑浊,出现浑浊的化
学方程式为 。此实验能否推断石灰石煅烧产生二氧化碳,并说明理由: 。
(3)丙组实验中,向试管B中逐滴滴入稀盐酸,至红色恰好裙去,轻轻晃动试管,溶液自下而上又变为红
色。解释产生上述现象的原因: 。
(4)为检验丙组实验中的石灰石部分分解,设计实验:取研细后的粉末少许于试管中, (补充完
整实验方案)。
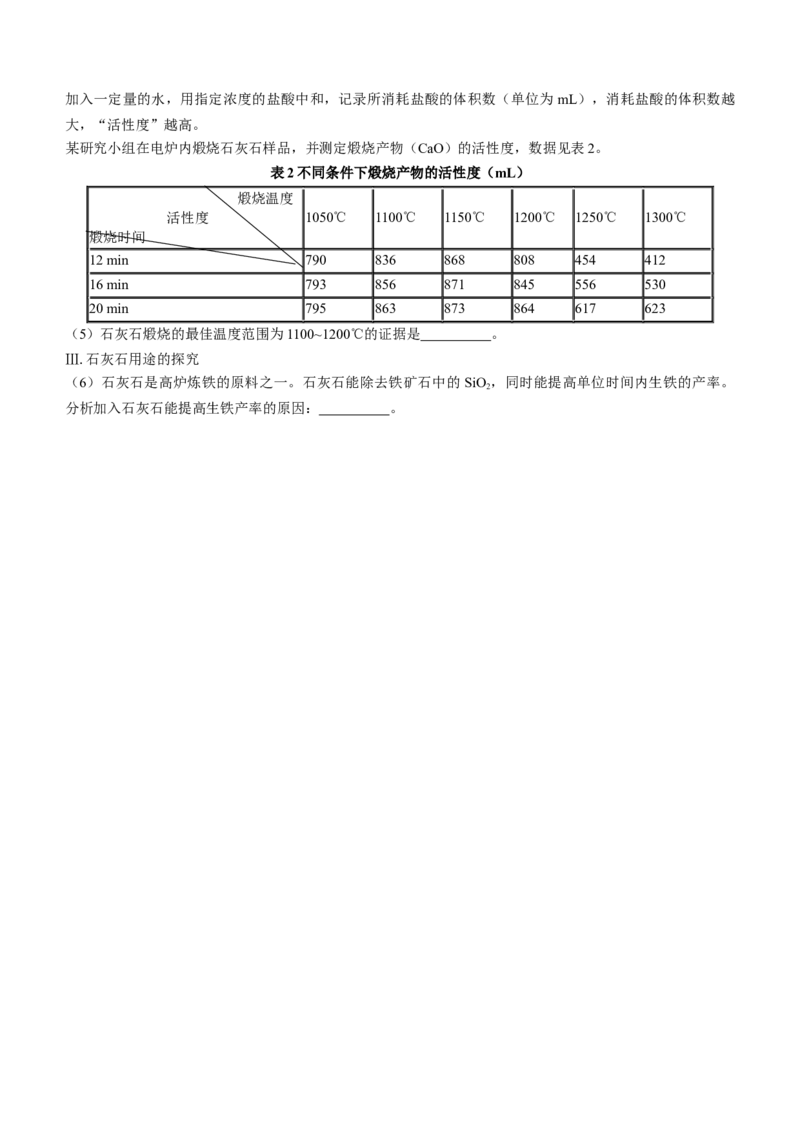
Ⅱ.石灰石煅烧温度的探究
【查阅资料】生石灰质量的优劣常采用“活性度”来衡量。“活性度”的测定方法:取一定质量的生石灰,加入一定量的水,用指定浓度的盐酸中和,记录所消耗盐酸的体积数(单位为mL),消耗盐酸的体积数越
大,“活性度”越高。
某研究小组在电炉内煅烧石灰石样品,并测定煅烧产物(CaO)的活性度,数据见表2。
表2不同条件下煅烧产物的活性度(mL)
煅烧温度
活性度 1050℃ 1100℃ 1150℃ 1200℃ 1250℃ 1300℃
煅烧时间
12 min 790 836 868 808 454 412
16 min 793 856 871 845 556 530
20 min 795 863 873 864 617 623
(5)石灰石煅烧的最佳温度范围为1100~1200℃的证据是 。
Ⅲ.石灰石用途的探究
(6)石灰石是高炉炼铁的原料之一。石灰石能除去铁矿石中的 SiO ,同时能提高单位时间内生铁的产率。
2
分析加入石灰石能提高生铁产率的原因: 。化学试题参考答案
选择题(共40分)
1.B 2.A 3.C 4.B 5.C 6.A 7.D 8.C 9.D 10.B l1. B 12.A 13.D 14.C 15.D 16.D 17.A
18.B 19.D 20.C
非选择题(共60分)
21.(5分)
(1)灼烧后闻气味 (2)在不断运动 (3)维生素 (4)酸雨 (5)乳化
22.(7分)
(1)①20 ②玻璃棒 (2)① B ②浓硫酸 ③a (3)G
23.(5分
(1)化合物 (2)O 和 HO (3)18 (4)b (5)
2 2
24.(7分)
(1)不可再生 (2)等质量的甲烷燃烧产生的CO 少,产生的热量高
2
(3)化学能转化为电能 (4) (5)C H
8 10
25.(6分)
(1)B (2)2 (3)活性炭 (4)
(5)N 碱性过强会消耗HC1O,使HC1O浓度降低,导致氨的去除率降低
2
26.(8分)
(1)氮 (2)将煤粉碎或升高温度或使用催化剂
(3) 防止碳酸氢铵分解,减少氨水的挥发
(4)吸收CO,分离出N 和H (5)提高N、H 的利用率,节约资源
2 2 2 2 2
27.(10分)
(1)7 (2)① ②反应速率太慢,结晶步骤能耗过多
③氧化铁与硫酸反应生成硫酸铁,硫酸铁与铁反应生成硫酸亚铁 (3)形成热的饱和溶液 (4)53.9%
28.(12分)
(1)温度 (2)
否,酒精燃烧也会生成二氧化碳,使澄清石灰水变浑浊
(3)氢氧化钙与盐酸反应,酚酞红色褪去:氢氧化钙微溶于水,晃动时氢氧化钙继续溶解,溶液呈碱性,使
酚酞变红 (4)滴入稀盐酸,有无色气体产生(5)煅烧不同的时间,在1100~1200℃范围内生成的生石灰活性度均高
(6)石灰石高温分解产生的CO 与焦炭反应生成CO,可还原生成更多铁
2