APP基因“刹车”失灵?警惕阿尔茨海默病背后的记忆窃贼
阿尔茨海默病(AD)是老年期痴呆最常见的类型,占比超60%,以进行性记忆减退、认知障碍为核心,目前尚无根治方法,早期识别干预是关键。APP基因是AD致病核心基因,而其甲基化异常作为表观遗传因素,也在AD发病中扮演重要角色~

一、基础认知:什么是阿尔茨海默病?
✅ 核心特征:起病隐匿、进行性发展,最终导致患者丧失独立生活能力,大脑神经细胞不可逆损伤、脑体积萎缩。
✅ 患病人群:多为65岁以上老年人(散发性AD);40-65岁早发性病例多与基因突变相关。
✅ 与APP基因关联:APP基因编码的淀粉样前体蛋白(APP),正常酶解无毒性;基因突变会导致酶解异常,产生大量β-淀粉样蛋白(Aβ),形成AD特征性“老年斑”。
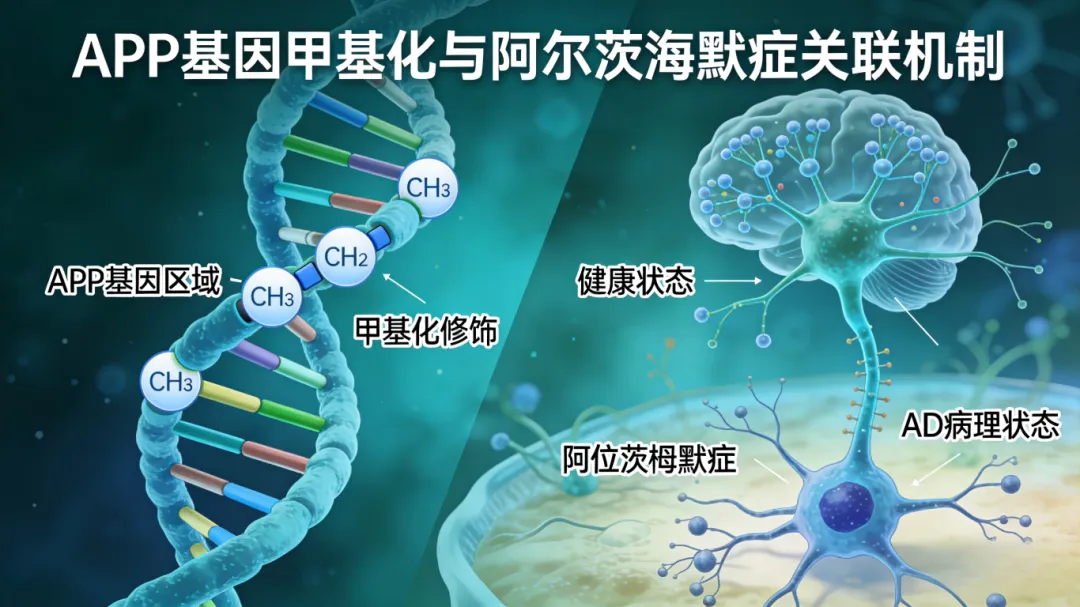

二、核心机制:APP基因及甲基化如何影响AD?
目前最认可的是“β-淀粉样蛋白级联假说”,APP基因及其甲基化状态是关键:
1. APP基因的正常与异常
– 正常:APP蛋白被α-分泌酶切割为无害片段,助力神经细胞生长修复。
– 异常:基因突变导致α-分泌酶切割位点受损,转而被β、γ-分泌酶切割,产生大量易聚集的Aβ40、Aβ42,诱发tau蛋白异常,破坏神经突触,最终导致认知障碍。
2. APP基因甲基化的核心影响
甲基化是调控基因表达的表观遗传修饰,不改变基因序列,主要分两种异常状态:
– 低甲基化(最常见):解除基因抑制,APP蛋白过量表达,加速Aβ聚集和老年斑形成,加重认知衰退,与AD病情严重程度正相关。
– 高甲基化(罕见):过度抑制APP蛋白表达,虽可能减少Aβ产生,但会影响神经突触功能,仅可能导致轻微记忆力下降,对AD影响极小。
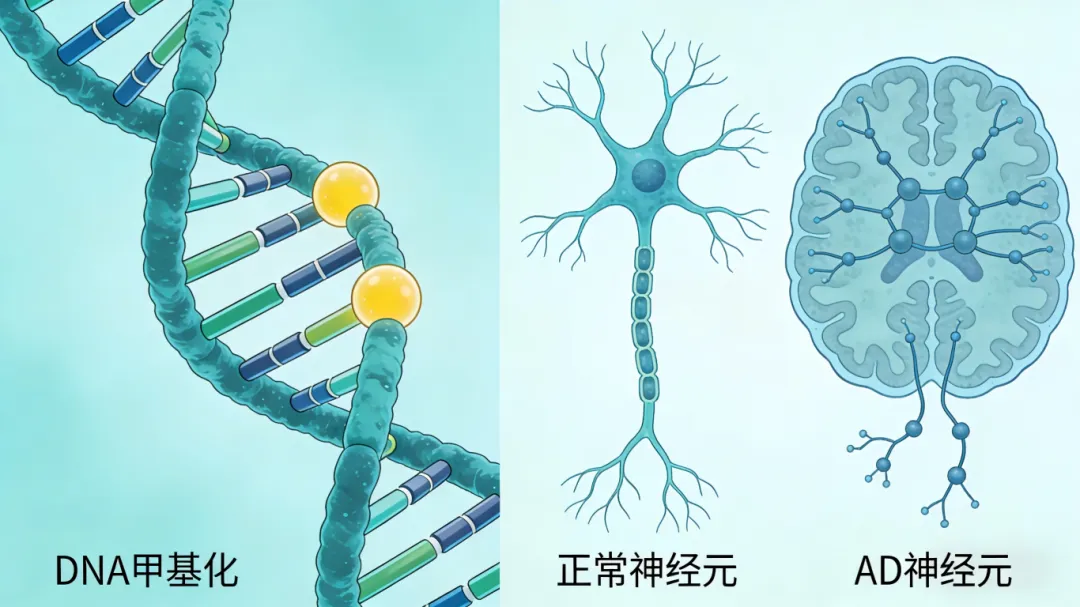

三、典型症状:分3阶段,早识别不忽视
重点区分:正常老年健忘是“记不清”,AD是“记不住”且无法回忆,症状进行性加重:
🔸 早期(1-3年):近事记忆障碍(忘事、忘带东西),操作生疏、情绪轻微异常,是干预黄金期。
🔸 中期(3-10年):近远期记忆全丧失,不会计算、认人、辨方向,行为异常,需家人协助生活。
🔸 晚期(10年以上):完全丧失认知和语言能力,卧床、大小便失禁,易合并肺炎等并发症。

四、筛查诊断:重点人群+关键手段
1. 重点筛查人群
65岁以上老人、AD家族史者、APP等基因异常/甲基化异常者、长期记忆减退者、合并“三高”/脑卒中/抑郁症者。
2. 核心筛查手段
– 临床评估:通过MMSE、MoCA量表快速判断认知受损程度。
– 影像学:头颅CT/MRI看脑萎缩(尤其海马体),PET-CT检测Aβ沉积。
– 实验室:脑脊液检测Aβ、tau蛋白;基因检测排查突变;甲基化检测辅助早期预警。
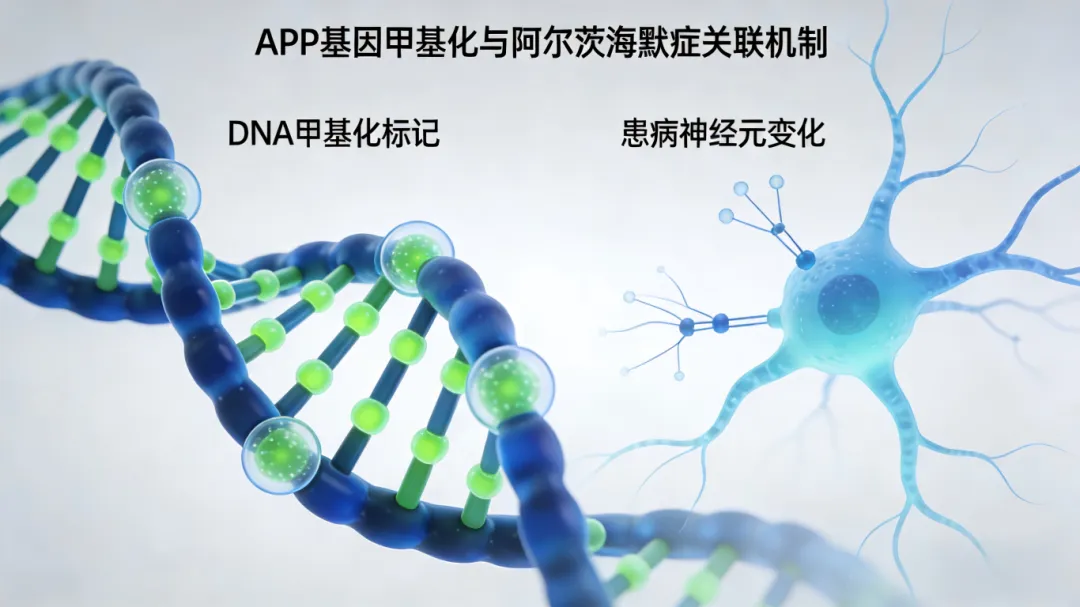

五、干预管理:延缓进展是核心
目前无根治方法,核心是延缓病情、减轻照护负担,分3类干预:
1. 药物干预(遵医嘱)
– 改善认知:轻中度用胆碱酯酶抑制剂,中重度用美金刚。
– 改善精神行为:小剂量使用抗抑郁、抗精神病药。
– 潜在靶向药:Aβ单克隆抗体(部分获批)、甲基化靶向编辑技术(研发中)。
2. 非药物干预(全程适用)
认知训练(拼图、读报)、规律运动、戒烟限酒、充足睡眠、均衡饮食(地中海饮食)、多社交少独处。
3. 照护管理(中晚期重点)
做好安全防护(防迷路、防误服)、协助生活起居、预防压疮和呛咳,同时关注照护者心理健康。

六、甲基化对身体的核心影响
1. 核心影响(大脑):低甲基化加重认知衰退,高甲基化仅可能轻微影响记忆。
2. 病理基础:低甲基化导致Aβ过量,损伤神经细胞;高甲基化仅轻微影响神经功能。
3. 潜在关联:可能与冠心病相关(研究初步发现),对肝肾等系统影响轻微。
4. 关键提醒:甲基化异常可后天调控(健康生活方式可改善),具有可逆性。
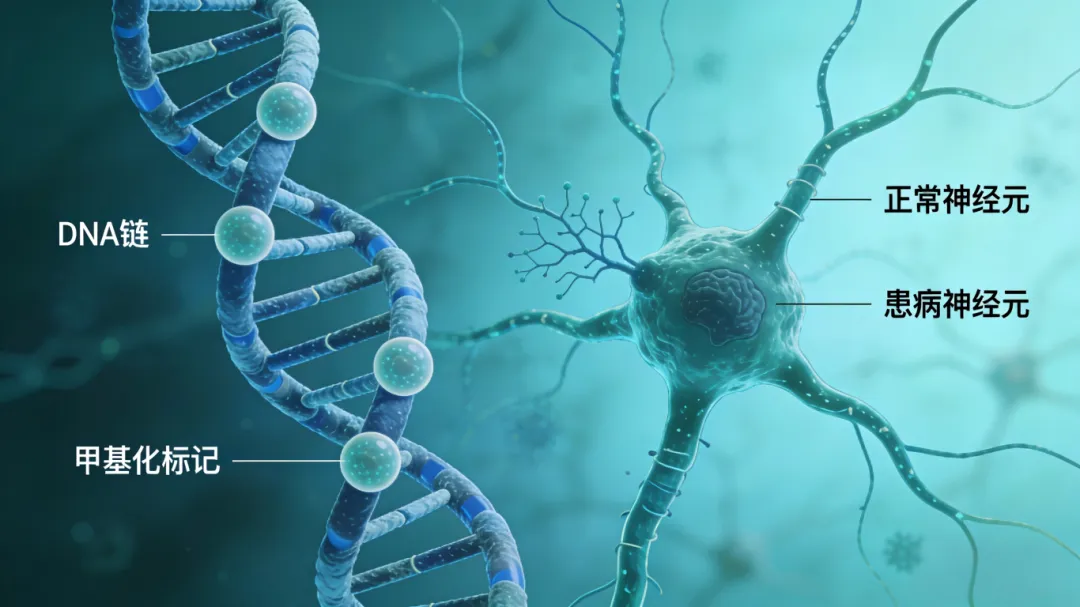

七、常见误区澄清
❌ 老糊涂=AD:错!正常健忘不影响生活,AD是进行性病理改变。
❌ AD只影响老人:错!早发性AD与基因突变相关,中年也需警惕。
❌ 甲基化异常=必患AD:错!仅增加风险,需结合其他因素。
❌ 甲基化异常无法改:错!健康生活方式可维持正常状态,具有可逆性。

八、预防要点(从年轻开始)
-
终身学习、多社交,保持大脑活跃;
-
控制“三高”,积极治疗基础病;
-
规律运动、均衡饮食、充足睡眠;
-
高危人群定期筛查(认知+甲基化);
-
减少长期精神压力。
✨ 总结:AD不可怕,早识别、早干预,结合基因与甲基化筛查,能最大程度延缓病情,守护老年认知健康~
参考文献
Liu Z, Zhang S, et al. Single-cell multiregion epigenomic rewiring in Alzheimer’s disease progression and cognitive resilience. Cell. 2025 Sep;188(18):1-20. doi: 10.1016/j.cell.2025.07.033
Perinatal-choline supplementation reverses APP-KI-induced DNA methylation aberrations and amyloid-associated phenotypes. Nature Communications. 2025 Oct;16:7459. doi: 10.1038/s41467-025-41321-x
Biospective Technical White-paper. 5xFAD vs APP/PS1 murine models of amyloid-β pathology: relevance to familial AD gene–methylation interplay. 2025 Nov.

 夜雨聆风
夜雨聆风





