应用分享 | Stunner极速解析ADC光谱以测定DAR值
通过UV/Vis吸光度表征ADC (抗体偶联药物) 是确定抗体浓度与药物-抗体比(DAR)快捷且简单的方法。此法特别适合需要在多个实验室间标准化的方法,或在筛选大量样品(早期发现与工艺开发阶段)时使用。然而,当您面对那些对抗体、药物或连接子光谱并非了然于胸的样品时,分析道路上往往会出现不少坑洼。传统的UV/Vis DAR值判定通常依赖于已知的药物-连接子吸收光谱与精确的摩尔消光系数,方法才能真正成熟可用,而许多ADC的药物与抗体吸收光谱太过相似,令经典的双波长法变得棘手——无论是方法开发还是分析读数都会更难把控。
Stunner配备了足够的脑力、速度与灵活性,能胜任各种ADC、偶联的片段抗体(fAb) 或其他蛋白偶联体的DAR值分析 (见图1)。借助先进的光谱拆分算法,Stunner可以将高度重叠的ADC光谱解卷积,提取出蛋白与药物-连接子两部分的吸收贡献——即便事先没有任何光谱信息也能搞定。这一策略使得即便对高度重叠的光谱或缺乏药物-连接子先验光谱的样品,也能实现分析。

图1: Stunner是一款为生物制剂打造的基于板式的动态光散射和紫外/可见光分析工具
如果您偏好更传统的做法,Stunner的双波长应用 (ADC Dual Wvl) 支持经典的双波长DAR值分析;而当已知药物-连接子光谱时,ADC Quant应用可将完整光谱信息用于DAR值分析,相较仅依赖两波长可提升稳健性并减少误差。
鉴于聚集是ADC开发中的常见难题,每一个基于UV/Vis的ADC应用都可与动态光散射 (DLS) 联用,在同一次测量中同时筛查粒径并检测聚集体。
本应用说明演示了Stunner如何将ADC表征变得更简单:只需2 µL样品、每次检测不到1分钟、并以96孔板自动化友好的形式快速、精确地给出抗体浓度、DAR值、粒径与聚集信息。
用于本工作的试剂包括:曲妥珠单抗 (Trastuzumab, HY-P9907)、曲妥珠单抗-emtansine (HY-P9921)、曲妥珠单抗-deruxtecan (HY-138298A)、曲妥珠单抗-vedotin (HY-164992)、纳拉图珠单抗 (HY-P99374)、纳拉图珠单抗-emtansine (HY-132260)、吉妥珠单抗 (HY-P9997)、吉妥珠单抗-ozogamicin (HY-109539),均购自MedChemExpress。
本研究使用了Stunner (型号:900-2003)、Stunner板 (型号:701-2125) 以及Stunner客户端和分析软件v10.1 (图2)。实验设置和分析中使用了ADC Quant、ADC Dual Wvl和ADC Decode应用程序。
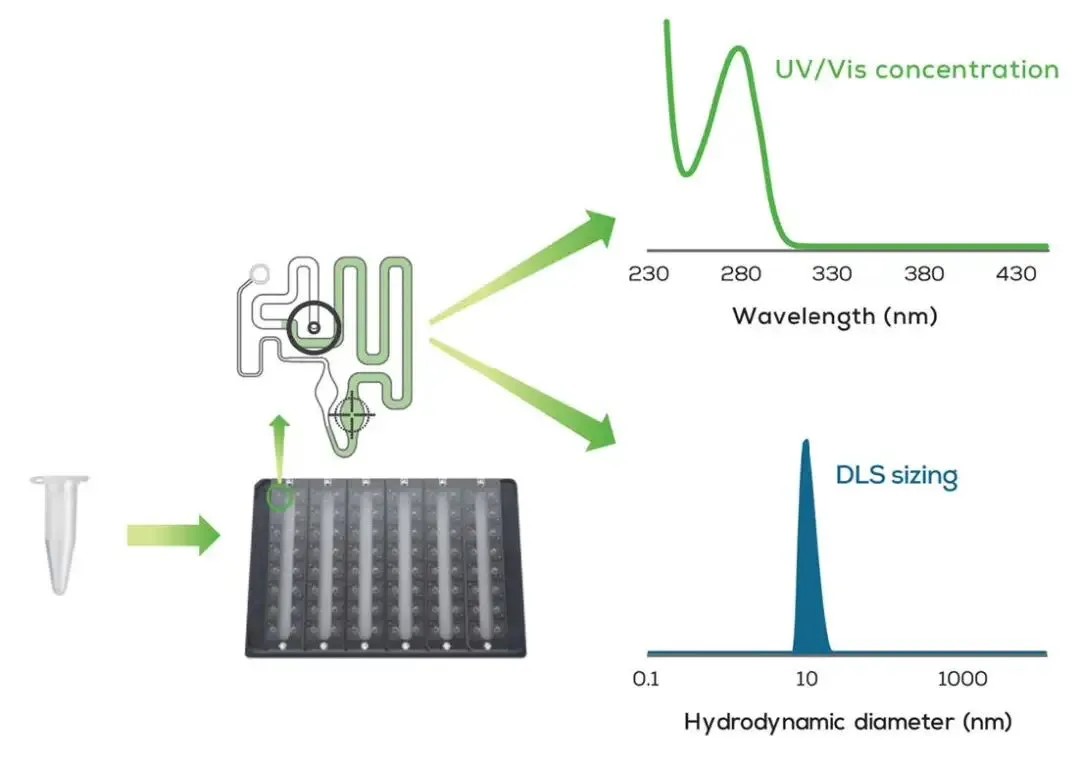
图2: 在支持自动化的96孔Stunner板中的微流控回路可以从2 µL样品中收集紫外/可见光浓度、粒径和多分散指数 (PDI) 测量数据
量化抗体浓度、药物-连接子浓度与DAR值的基础方法仍依赖对两种分子在UV/Vis吸收行为的充分认知。若已知抗体与药物在两波长处的单位摩尔消光系数 (L·mol⁻¹)·cm⁻¹,即可通过解线性方程组计算出DAR值与两项浓度值。Stunner的Dual Wvl应用可自动执行这些计算,支持手动输入消光系数,或直接调用已在Stunner软件中保存的Analytes值。
图3展示了ADC Dual Wvl在测定三种以曲妥珠单抗为母体的ADC (曲妥珠单抗-emtansine、-deruxtecan、-vedotin) 时,对抗体浓度、药物浓度与DAR值的一致性。若文献中可得摩尔消光系数,则可直接采用。样品以1:2稀释系列测量,覆盖8倍浓度范围 (起始抗体浓度分别为4.8、5.0与2.9 mg/mL)。测得的药物与mAb浓度比在各样品与稀释步骤间保持1.89–2.17;DAR值在稀释间稳定分布于0.98–1.04,展现出极佳的线性与精密度。
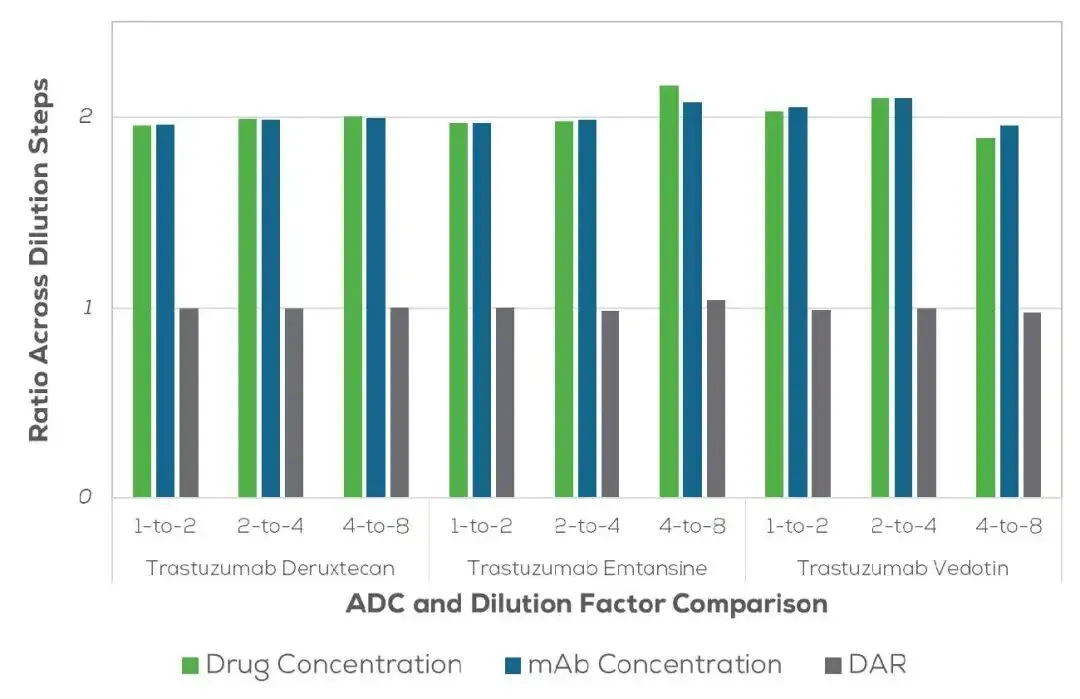
图3: 在1:2稀释系列中,抗体浓度和药物浓度均按2倍递减,而DAR保持不变。样品通过ADC Dual Wvl应用进行测量
但在大批样品或对尚未充分表征的分子进行分析时,确定正确的摩尔消光系数往往很困难。溶剂间 (如有机溶剂vs水相) 消光系数不可直接互换,且药物与抗体间显著的光谱重叠会使得确定消光系数变得不切实际。此类情况下,需要一种更灵活、更智能的分析策略。
当摩尔消光系数与光谱未知时,Stunner的ADC Decode应用可直接读取ADC的吸收光谱,并利用强大的Unmix算法拟合出合适的蛋白光谱成分,同时可视化出潜在的药物-连接子吸收光谱。
在用ADC Decode测量ADC吸光度时,Stunner通常会从其analyte库里调用一个蛋白 (通常是抗体) 光谱作为参照。如果样品中抗体浓度本身未知,其可能取值区间由ADC的总体吸光度上限至0 (见图4)。ADC Decode利用280–300nm区域与色氨酸相关的吸收特征来确定最佳拟合与最优抗体浓度。
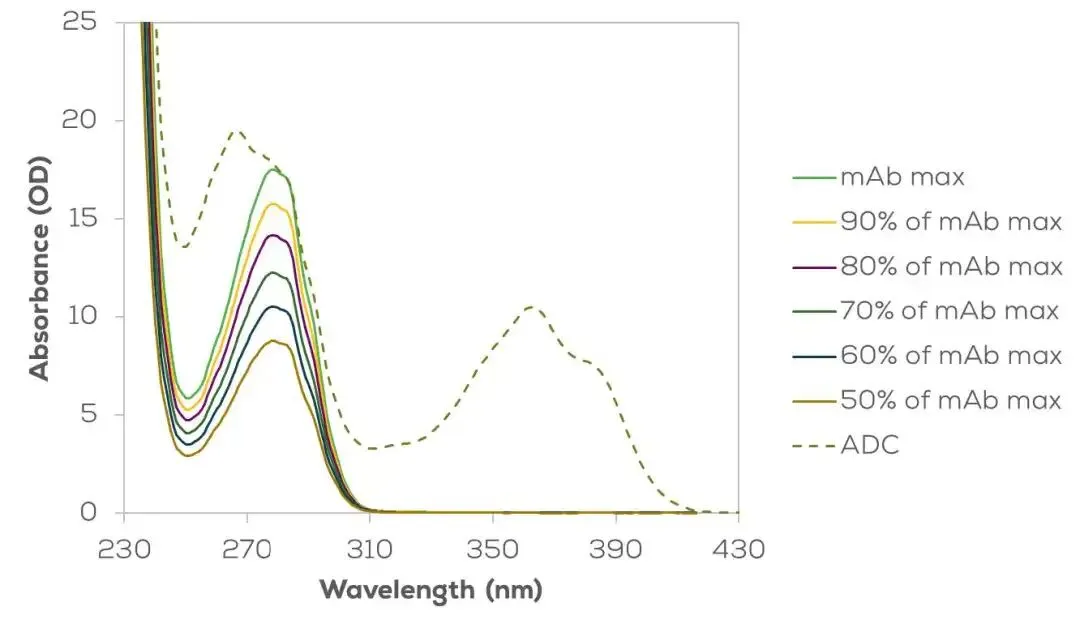
图4: 可以从ADC (虚线,曲妥珠单抗-deruxtecan) 吸光光谱中提取的蛋白质 (单抗) 光谱范围。每条线表示不同的蛋白质浓度可能,并对应不同的互补药物-连接子光谱(未显示)
基于所测得的ADC光谱,ADC Decode算法可寻找理想匹配解并确定抗体浓度及相应的药物-连接子吸收谱。图5展示了对曲妥珠单抗-emtansine、-deruxtecan、-vedotin进行解码后得到的谱线;右侧附图显示药物成分光谱在所有三重复中叠合得很精准。进行四重复分析时,药物吸光度的变异系数 (CV) 分别为0.6%、0.5%与0.6%;测得DAR值的CV则分别为0.5%、0.2%与0.5%,说明了测定的高精密度。
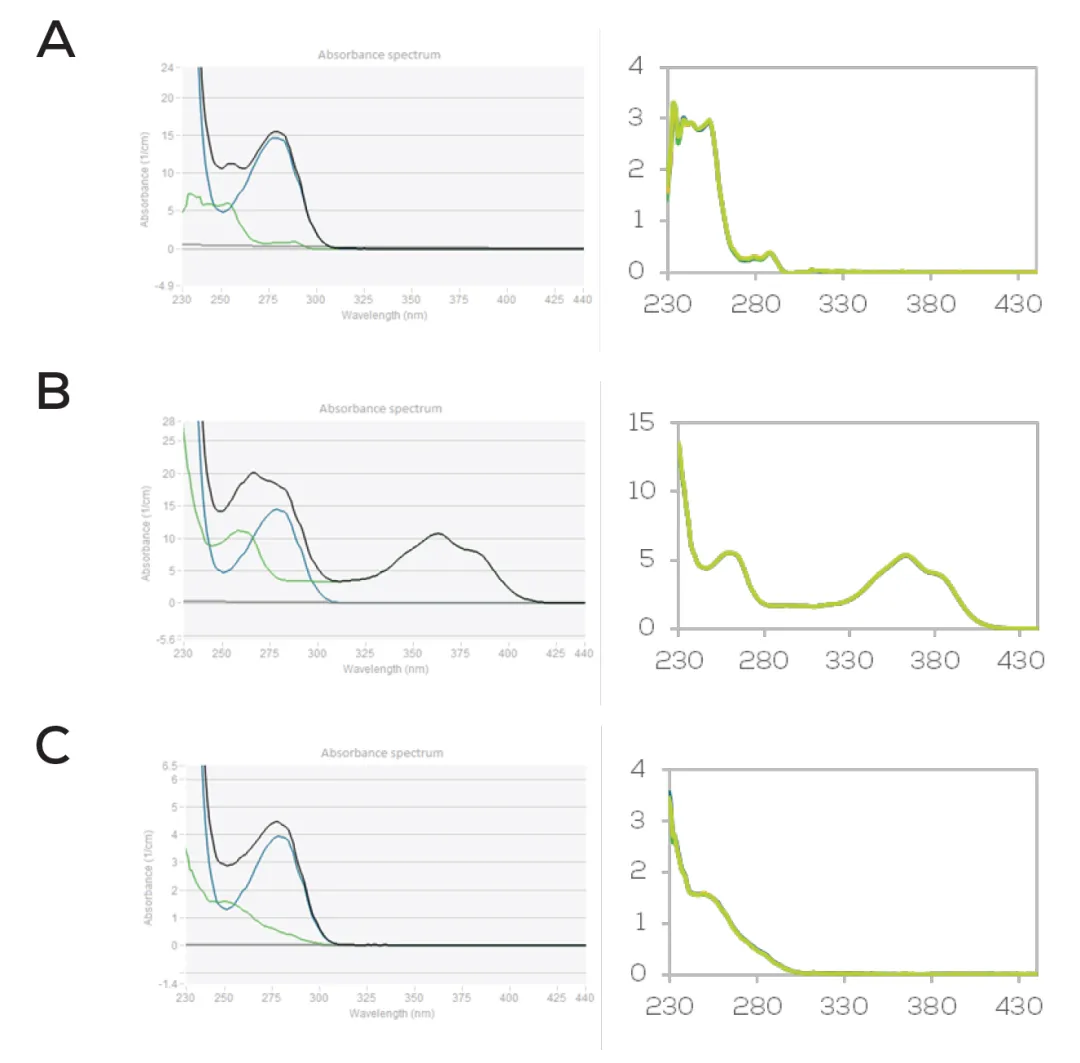
图5: 使用ADC解码分析曲妥珠单抗-emtansine (A)、曲妥珠单抗-deruxtecan (B) 和曲妥珠单抗-vedotin (C)时得到的光谱 (左)。附图 (右) 显示了药物成分光谱在所有三重复样中的精确叠加
鉴于早期化合物常缺乏摩尔消光系数,Stunner的ADC应用也支持仅基于吸光度信息进行相对比较。例如上述实例中,曲妥珠单抗-emtansine在疏水相互作用色谱 (HIC) 测得DAR值为3.6,而Stunner测得为3.3;如果无法获得消光系数,亦可采用药物谱与蛋白谱吸光度之比 (A252nm/A280nm=0.48) 来比较工艺步骤、偶联条件或批次差异。
上文所述的三种曲妥珠单抗系ADC的1:2稀释系列已在ADC Decode与ADC Dual Wvl应用下并行分析 (见图6)。未偶联曲妥珠单抗的抗体浓度测量CV为0.2% (未列示);而曲妥珠单抗-emtansine、-deruxtecan、-vedotin的抗体浓度CV分别为0.4%、0.3%与0.4%。DAR值测量也表现精确:最高浓度样品的CV在0.5–1.4%之间,最低浓度样品在0.8–4.3%之间。
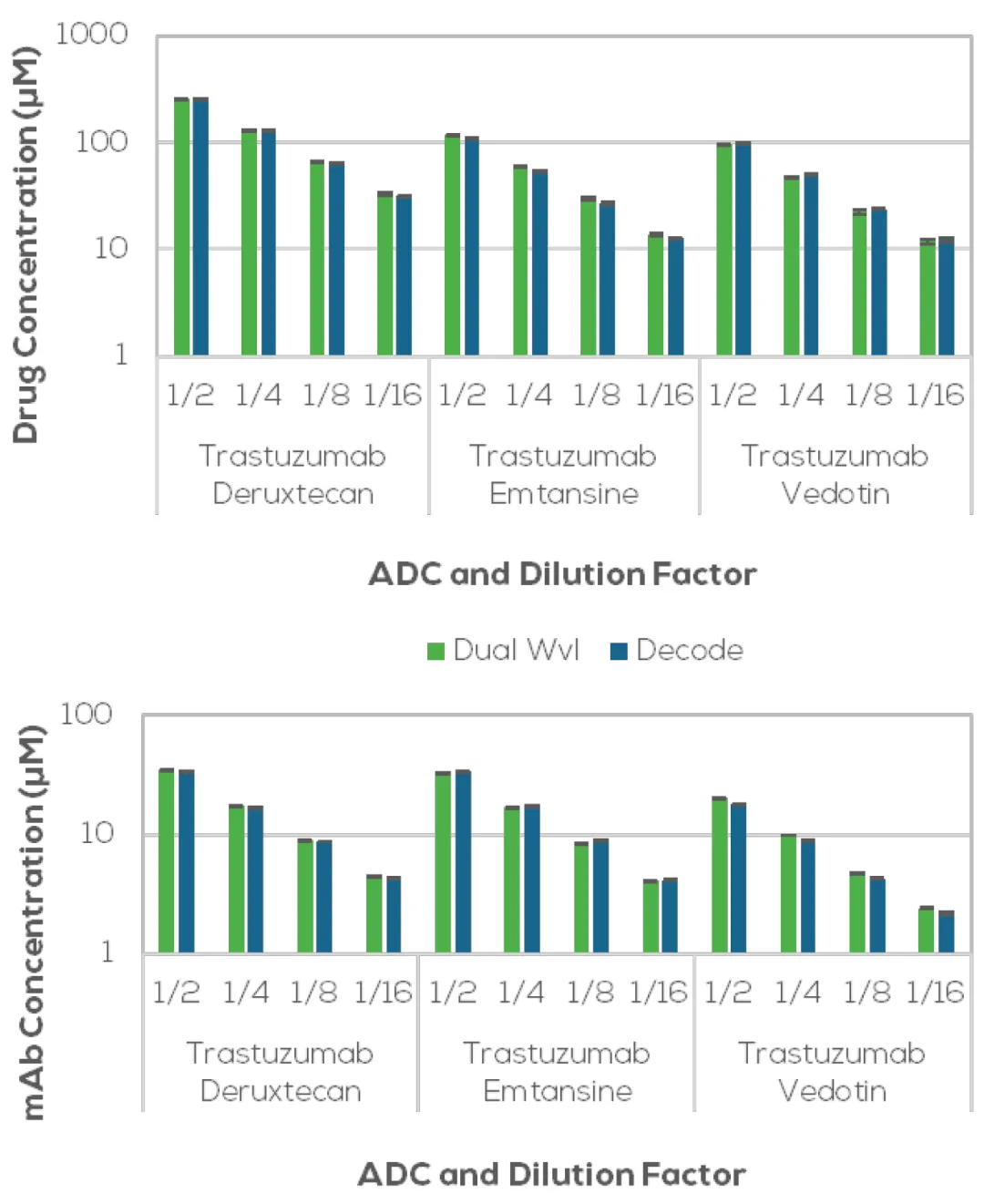
图6: 在1:2稀释系列中,对于三种曲妥珠单抗衍生的ADC,当通过ADC Decode和ADC Dual Wvl应用测量时,抗体浓度和药物浓度呈线性下降。y轴采用对数刻度,以便在低浓度下更清晰地显示
使用ADC Decode + Sizing应用,可同时用DLS评估三种ADC的原始浓度下的粒径与聚集情况 (图7)。测得平均水合动力学直径:曲妥珠单抗-emtansine为11.8±0.4nm、曲妥珠单抗-deruxtecan为14.3±0.5nm、曲妥珠单抗-vedotin为10.2±0.8nm。质量分布的重叠与可重复性表明样品主体质量在粒径上是一致的;但较大的deruxtecan粒径提示可能存在聚集,值得进一步调查。这类快速的聚集筛查有助于识别导致聚集的工艺或配方条件。
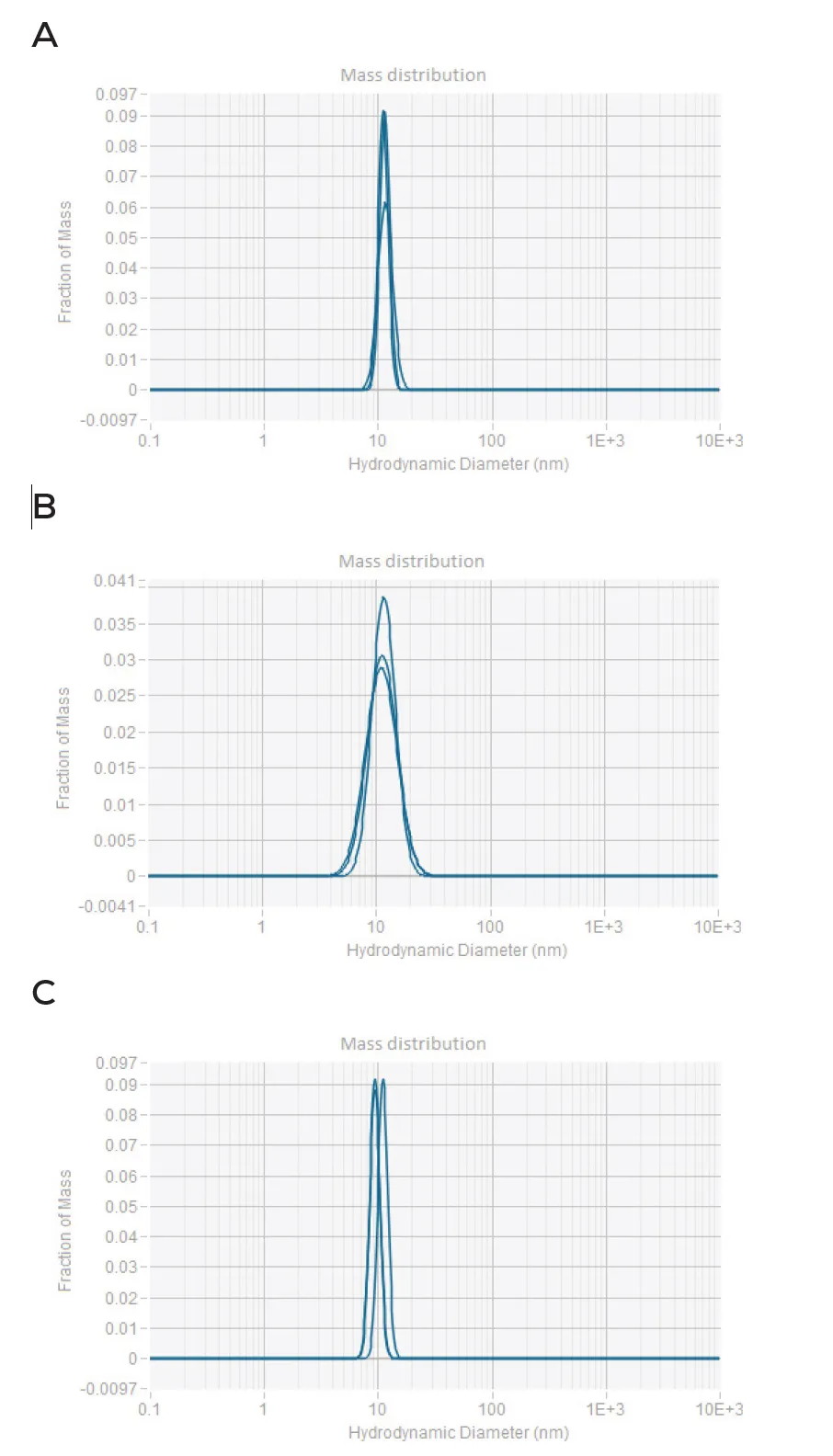
图7: 通过DLS分析获得的曲妥珠单抗-emtansine (A)、曲妥珠单抗-deruxtecan (B) 和曲妥珠单抗-vedotin (C) 的质量分布,每个样品均使用ADC Decode + Sizing应用程序进行三次测量
Stunner的最终ADC工具是ADC Quant (如含DLS则为ADC + Sizing)。ADC Quant能将先前实验中保存到Stunner数据库的抗体与药物光谱调入测量,基于这些已知谱进行更准确的谱解卷积与抗体/药物谱确定。与双波长法相比,使用完整的药物与抗体光谱来评估浓度通常被视为ADC Quant方法的一大优势。
Stunner将稳健的UV/Vis分析与敏感的DLS粒径测量合并在一次仅需2µL的测定中,大幅提升了ADC表征的可能性。无论是用ADC Decode解开重叠光谱、用ADC Dual Wvl或ADC Quant应用套用已知光谱数据,还是通过增加DLS做聚集筛查,Stunner在ADC开发流程中始终提供准确与精密的结果。凭借极小的样品用量、超简便的工作流程与快速的数据采集,Stunner为ADC表征带来了全新的视角。
-
Chen, Y. Drug-to-Antibody Ratio (DAR) by UV/Vis Spectroscopy. In Antibody–Drug Conjugates; Ducry, L., Ed.; Humana Press: Totowa, NJ, 2013; pp 267–273.
-
McKertish, C.; Kaysar, A. Novel Dual-Payload ADC for the Treatment of HER2+ Breast and Colon Cancer. Pharmaceutics 2023, 15(8), 2020.
-
Pozniak, A.; et al. The cytotoxic conjugate of highly internalizing tetravalent antibody for targeting FGFR1-overproducing cancer cells. Molecular Medicine 2021, 27(46).
-
Kim, M. T.; et al. Statistical Modeling of the Drug Load Distribution on Trastuzumab Emtansine (Kadcyla), a Lysine-Linked Antibody Drug Conjugate. Bioconjugate Chemistry 2014, 25(7), 1223–1232.
-
Nakatsuji, M.; et al. Human Lipocalin-Type Prostaglandin D Synthase–Based Drug Delivery System for Poorly Water-Soluble Anti-Cancer Drug SN-38. PLOS ONE 2015, 10(11), e0142206.




 夜雨聆风
夜雨聆风





