临床试验文档管理的两难:一边减少文件,一边却让人应接不暇
在我的日常工作中,有一个令人发笑的矛盾,那就是临床试验主文档(Trial Master File,TMF)的一个目的是减少文档,但实际上,进入TMF的文件数量却常常令人不堪重负。
什么是临床试验主文档(TMF)?
从概念上来说,TMF非常简单——它不过是临床试验的必要文件的集合。然而,从操作层面来看,TMF却相当复杂,需要投入大量的时间去建立和维护。
TMF管理困难的一个重要因素就是文档量巨大。在DIA参考模型中,共有250种文档(称为文物)。假设每种文档平均有两个版本,每个版本平均有十页,那么TMF就会有5000页——这比托尔斯泰的《战争与和平》还要多四本!而这已经是非常保守的估计,大多数TMF的规模远不止于此。
为什么需要TMF?
美国食品药品监督管理局(FDA)要求临床试验必须符合国际人用药品注册技术协调会议(ICH)制定的《药物临床试验管理规范》(GCP)指南。GCP指南第八章明确规定了TMF的最低要求,并清楚地阐述了TMF存在的原因,TMF用于:
-
评估试验的执行情况;
-
确认试验实施的有效性和收集数据的完整性;
-
证明符合所有适用的法规要求。
TMF是什么样子的?
TMF只是一个经过良好组织的文档和文件的集合。TMF可以是纸质的,也可以是电子版的,或者两者结合。例如,纸质TMF可以是一个或多个装订的文件夹,分为三个层次,用标签隔开。而电子TMF(eTMF)系统则类似于计算机上的文件结构。在DIA参考模型中,一级是大类(称为区域),二级是章节,三级是具体的文档(称为文物)。共有11个区域,48个章节和250个文物。
文物可以是文档或文件,例如PDF文档、SAS程序文件或视频录制的mp4文件。这并不意味着每个TMF一定要包含250个文件。每个文物可能对应多个文件。例如,一项临床试验可能有两个文件对应于文物11.01.01,即《统计分析计划》第一版和第二版。此外,并非所有文物都适用于每个试验。例如,文物11.02.01《随机化计划》就不适用于开放标签、非随机化的研究。
谁是药品信息协会(DIA)?
药品信息协会(DIA)文件和记录管理社区管理TMF参考模型。该模型提供了标准化的分类和元数据,并概述了TMF内容的参考定义。DIA参考模型及其相关资料已通过行业协作努力开发,并发布在公共领域,供任何人出于任何目的自由使用。
为什么要标准化?
虽然根据GCP第八章的要求,所有临床试验必须维护TMF,但并非每项研究都必须使用DIA的TMF参考模型。然而,我个人建议采用该模型。标准化有助于提高效率。就像美国联邦公路管理局对公路建设的标准化一样,这确保了卡车不会频繁撞上天桥。
同样,DIA在标准化TMF内容、结构和命名方面取得了重大进展。这种标准化带来了诸多好处,包括使TMF的维护更容易、文档查找更方便、审计更高效以及更好地与外部实体合作。
黄金法则是什么?
“临床试验研究的黄金法则是:如果没有记录,那就相当于没有发生。”
我在研究生毕业后的第一份工作是在人力资源部门。我们每天工作的指导原则之一就是“如果没有记录,那就等于没有发生”。无论是给员工提供停车申请表,还是讨论不当工作行为,如果我没有在员工管理数据库中记录这些交流,那就相当于什么都没发生。
临床试验同样遵循这一黄金法则:如果没有写下来,就相当于没有发生。而这些关键文档就保存在TMF中!PROMETRIKA的质量保证主管用一个比喻让我深有共鸣,他将审计人员比作考古学家。如果考古学家发现了一处完好保存的遗迹,他们就能重现当时的情景。同样,想象一下,50年后你是一名审计人员,正在审查你当前的临床试验TMF,你应该能够通过TMF完整地重现这项临床试验。因此,当你在工作中犹豫是否需要记录某些内容或是否应将某些内容归档到TMF时,请以50年后审计人员的需求为导向。
思考要点
在管理临床试验的TMF时,这里有一些关键考虑:
-
TMF的三个支柱是“完整性、及时性和质量”。
-
TMF必须实时维护,而不是事后的补救措施。
-
如果将TMF外包,请仔细选择供应商,因为最终责任仍在于赞助方。
-
制定标准操作程序(SOP)来规定TMF的处理方式。
-
确保员工经过适当培训,具备维护TMF的能力。
-
如果使用电子TMF,必须使用经过验证的系统。
-
自我测试,进行TMF的模拟检查,及时发现问题,以免被FDA检查时发现。
-
考虑雇佣TMF运营专家,或者如果你有兴趣,可以将其作为职业发展方向!
当你看着满架的TMF文件夹和海量的电子文件时,请记住,TMF只收集最终版本的必要文件,别无其他。

福利一:凡是购买课程的学员讲师将全程在线解答学员课程相关及实际工作和学习中遇到的问题
福利二:凡是购买整套课程的学员,如有需要,本平台可推荐工作机会
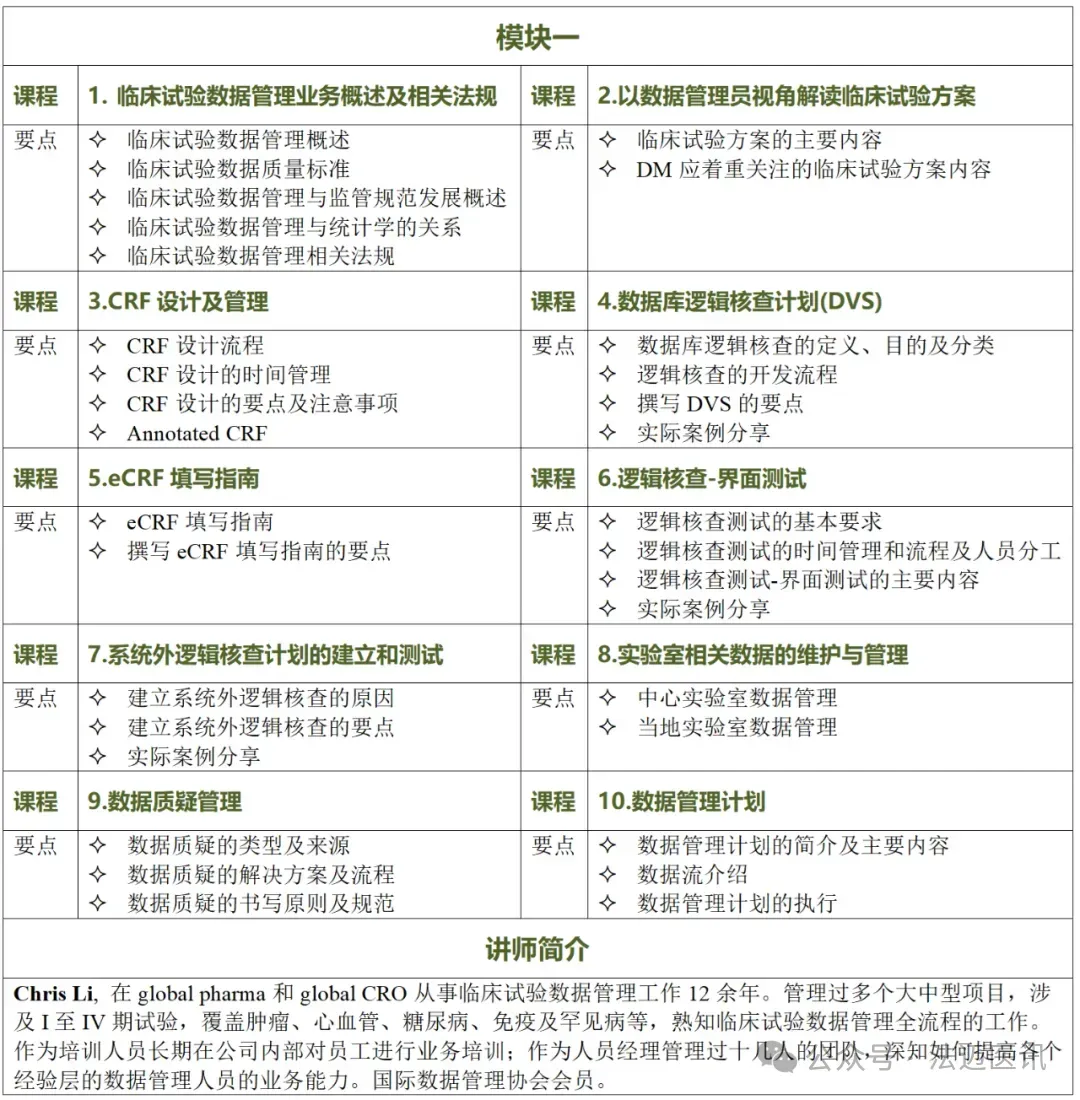
模块一:课程试听
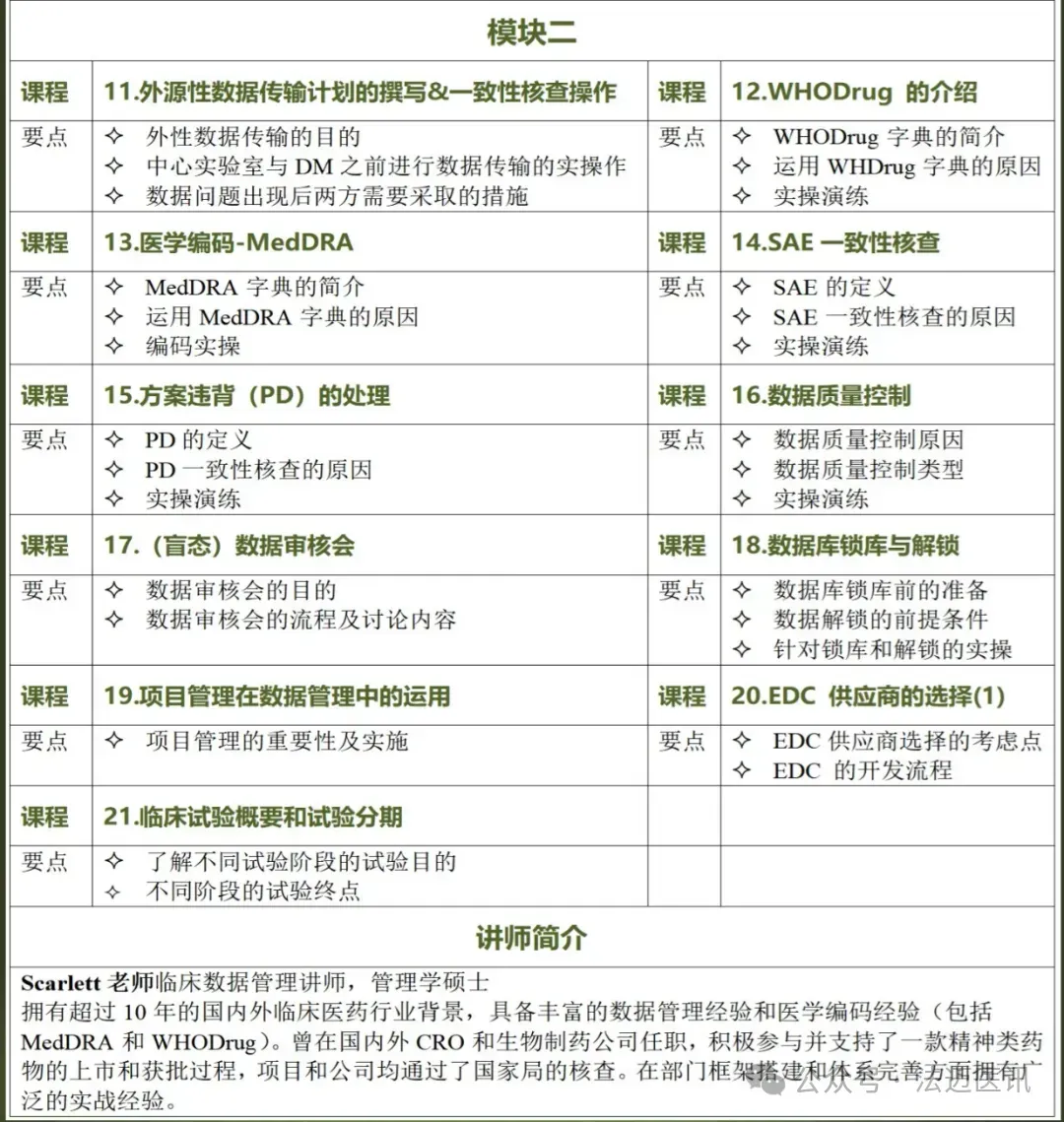 模块二:课程试听
模块二:课程试听
录播课程+讲师全程在线答疑+专属学习群
请扫描二维码添加小草老师微信备注 “ DM课程”

欢迎加入1411+人的中国临床试验千人通讯录
精品课程推荐
《AI赋能Protocol撰写Workshop》训练AI按要求帮你完成专业的protocol撰写,附课程试听!
统计师必看:从实际案例系统学习临床试验前沿设计方法 生翼计划:临床SAS程序员实战项目训练营开营啦!真实临床试验项目数据练手,模拟工作环境,体验工作日常!
药物警戒体系全套SOPs:符合国家局核查标准!符合B证现场检查!
精品资料包推荐
真实世界研究全套资料包! 临床试验贝叶斯设计资料包:17本书籍+14篇文献干货满满! FDA药物警戒资料包 领取|临床研究统计方法必看的15本知名书籍! 领取| 临床SAS编程和数据管理全套干货资料包! 药物警戒全套精华资料包 收藏|知名书籍:临床试验的贝叶斯自适应方法 法规|ICH-GCP中英文对照(最完整版) 收藏|E9:临床试验统计原则(另附中英文对照词汇表) 免费公开课|21节SAS Base初级编程系列课程 限时领取|杜克临床研究所的临床试验手册 汇总|临床试验十七个相关知识点 免费领取|临床研究几本经典书籍 ! 最全汇总:Define-XML 2.1指导原则讲解视频 分享|专属生物统计师的几本经典书籍 汇总|电子版CDISC-SDTM基本理论及实践系列文章 限时领取|8.72G临床试验精华资料包(共180个文件)送给临研人的福利! 限时领取|符合国际标准的全套临床SOP资料包,651个文件供你参考学习! 汇总帖:CDISC标准干货文章和资料精选 汇总帖:生物统计系列干货文章和资料精选 汇总帖:SDTM干货文章和资料精选 免费领取|ADC(抗体药物偶联物)知名书籍:研发,临床,注册及市场发展 领取|生物等效性试验(BE试验)比较全面的知名书籍! 汇总|CDE ICH指导原则全系列培训视频 必看|学习生物制药CMC必看的23本书籍! 限时免费|书籍: 临床数据管理实用指南第三版 收藏|抗肿瘤药物创新研发必看16本书籍! 福利|专属CRC的全套资料包免费领取 收藏|547页CDASHIG v2.3 FINAL 领取知名书籍:新临床试验人员的基本概念&药物开发中的定量决策 汇总|生物统计系列十五篇干货文章! 收藏|临床研究设计与方案撰写资料包!! 汇总|生物统计系列十五篇干货文章! 汇总|生物统计学常用统计分析方法系列文章 汇总|SAS编程应用及相关知识分享系列文章 收藏|药物临床试验必备文件及相关管理要求 限时领取|CRA应看的5本知名书籍! >>>> 公众号推荐
欢迎关注法迈新媒体
更多,更及时的干货内容,请加我们的微信公众号:法迈医讯,诚邀业内人士及机构向我们投稿。投稿邮箱:bellama@pharmanews.cn 【免责声明】文章为网络整理,不代表“法迈医讯”立场。如因作品内容、版权等存在问题,请于本文刊发30日内联系法迈医讯进行删除或洽谈版权使用事宜。
法迈医讯作为法迈新媒体微信公众号矩阵之一, 法迈新媒体是国内一家面向制药行业供应链综合服务平台,致力于服务全球制药行业从业人员。以创新的互网+模式服务于行业用户,形成以“资源整合,知识共享”为核心,微信公众号矩阵、社群矩阵为分支的新媒体模式,力争打造国内活跃和具影响力的专业化平台 !
 夜雨聆风
夜雨聆风