氢键的深度理解(WORD下载)


致各位读者:因为公众号平台改变了推送规则,如果想正常看到“化学之窗”的推送,需要大家在阅读后,在文末右下角点一下“在看”或者将公众号设为“星标”,我们每次的新文章才会第一时间出现在您的订阅列表里,人海茫茫,不想和大家错过,感谢您一如既往的支持!
化学时代——高中化学领军公众号


本课程由4位名师历时3个月,按照“新教材、新课标、新理念”精心设计、精心打造而成。课件、讲义、课时作业采用统一模板,精美别致。视频讲解细致深刻,不失为化学教师学习的经典案例。
本课程按照人教版新教材高中化学必修(第二册)的内容,结合课程标准,整合了苏教版、鲁科版的相关内容,共设计了37讲(37课时),其中包括学生必做的化学实验2讲和每章的整理提升(复习)。非常适合高一化学教师使用。

化学高考直通车与您如约而至,2024年的第一天,来自全国各地的一线名师,在《中国高考评价体系》指引下,潜心研究2023高考化学命题特点,展望2024年命题趋势,以2024高考为目标,结合近年高考经典试题,按照“知识+题型”的思路,精心设置27个专题。精彩讲座,为您奉上!

氢键
氢原子与电负性大、半径小的原子X(氟、氧、氮等)以共价键结合,若与电负性大的原子Y(与X相同的也可以)接近,在X与Y之间以氢为媒介,生成X-H…Y形式的一种特殊的分子间或分子内相互作用,称为氢键。[X与Y可以是同一种类分子,如水分子之间的氢键;也可以是不同种类分子,如一水合氨分子(NH3·H2O)之间的氢键]
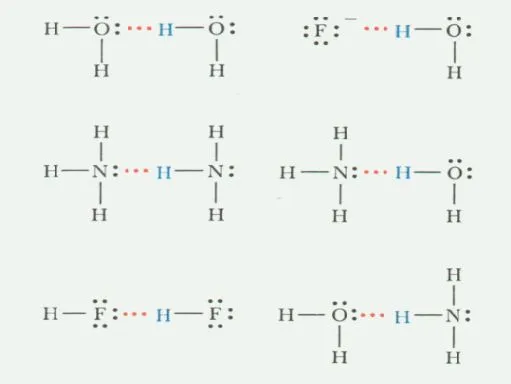
形成条件
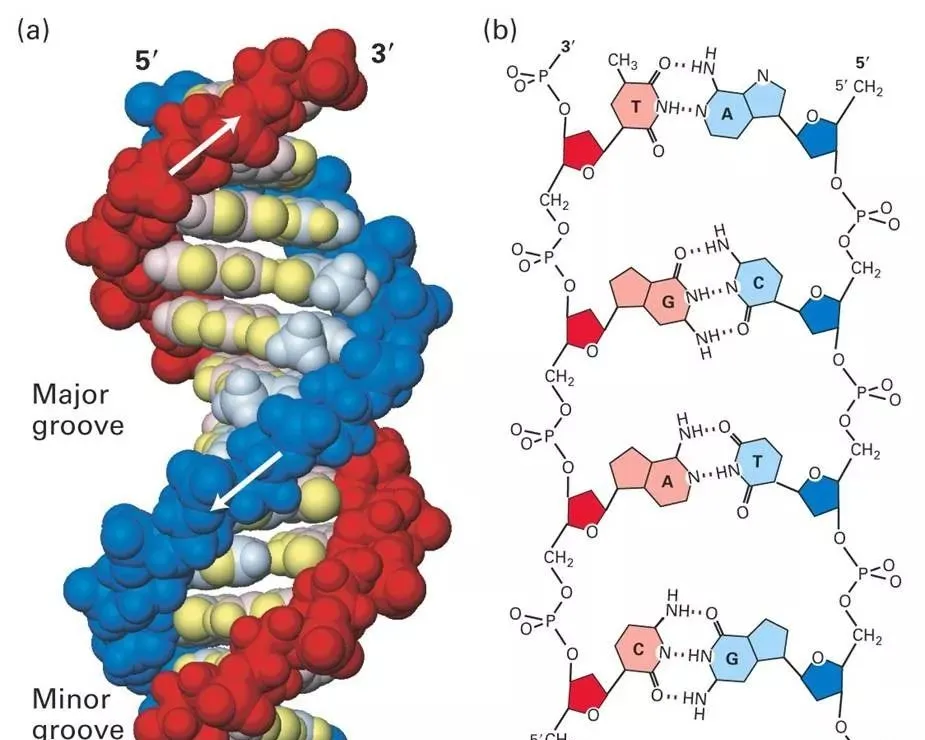
在蛋白质的a-螺旋的情况下是N-H…O型的氢键,DNA的双螺旋情况下是N-H…O,N-H…N型的氢键,因为这样的氢键很多,因此这些结构是稳定的。此外,水和其他溶媒是异质的,也由于在水分子间生成O-H-…O型氢键。
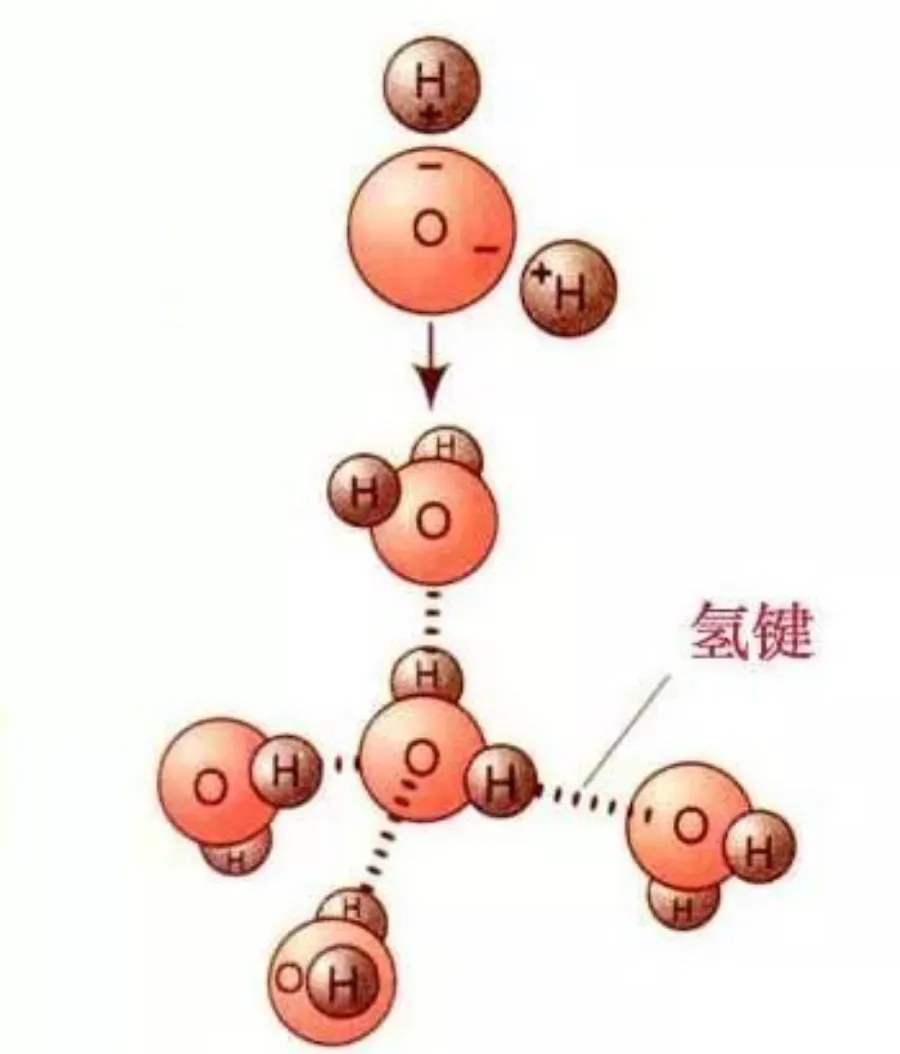
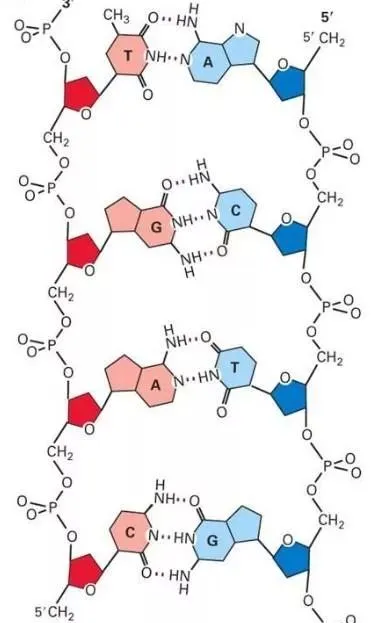
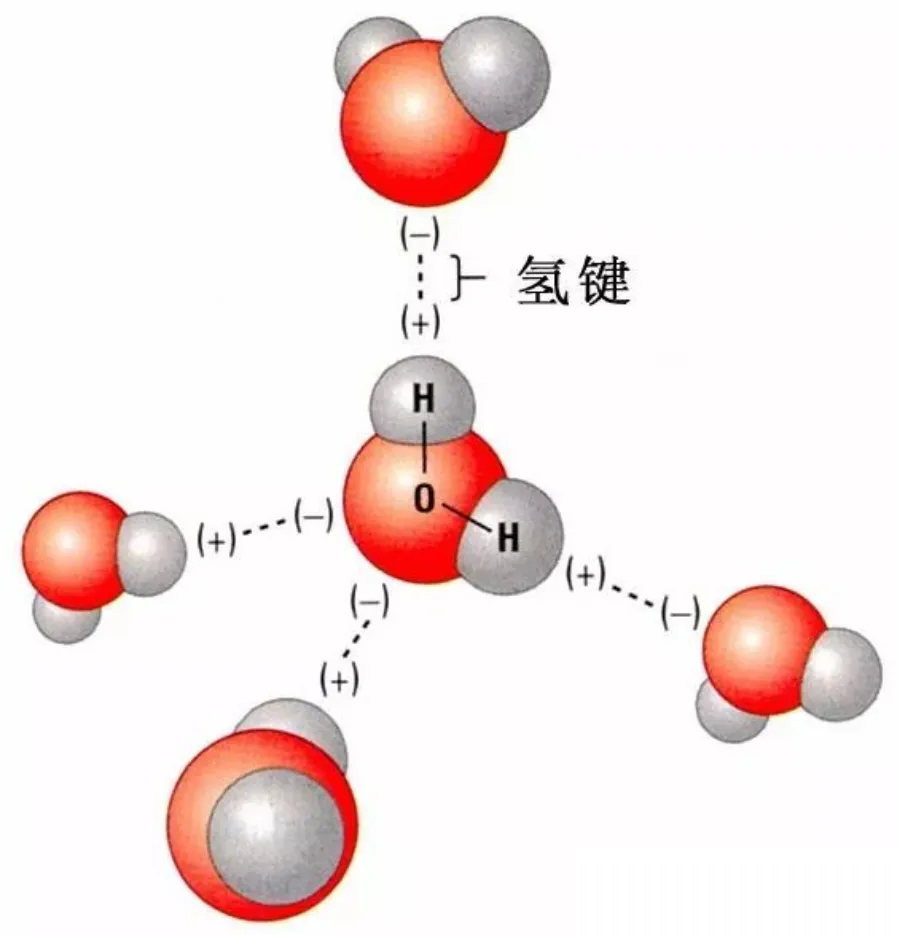
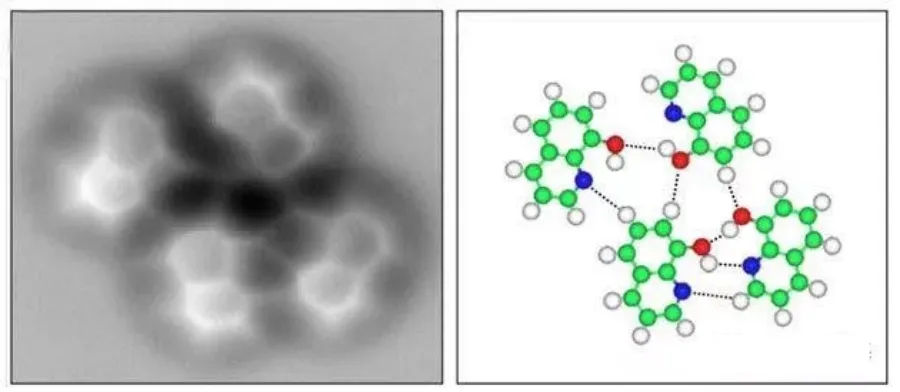
成键
氢键通常可用X-H…Y来表示。其中X以共价键(或离子键)与氢相连,具有较高的电负性,可以稳定负电荷,因此氢易解离,具有酸性(质子给予体)。而Y则具有较高的电子密度,一般是含有孤对电子的原子,容易吸引氢质子,从而与X和H原子形成三中心四电子键。
成键原子
典型的氢键中,X和Y是电负性很强的F、N和O原子。但C、S、Cl、P甚至Br和I原子在某些情况下也能形成氢键,但通常键能较低。碳在与数个电负性强的原子相连时也有可能产生氢键。例如在氯仿CHCl3中,碳原子直接与三个氯原子相连,氯原子周围电子云密度较大,因而碳原子周围即带有部分正电荷,碳也因此参与了氢键的形成,扮演了质子供体的角色。此外,芳环上的碳也有相对强的吸电子能力,因此形成Ar-H … :O型的弱氢键(此处Ar表示芳环)。
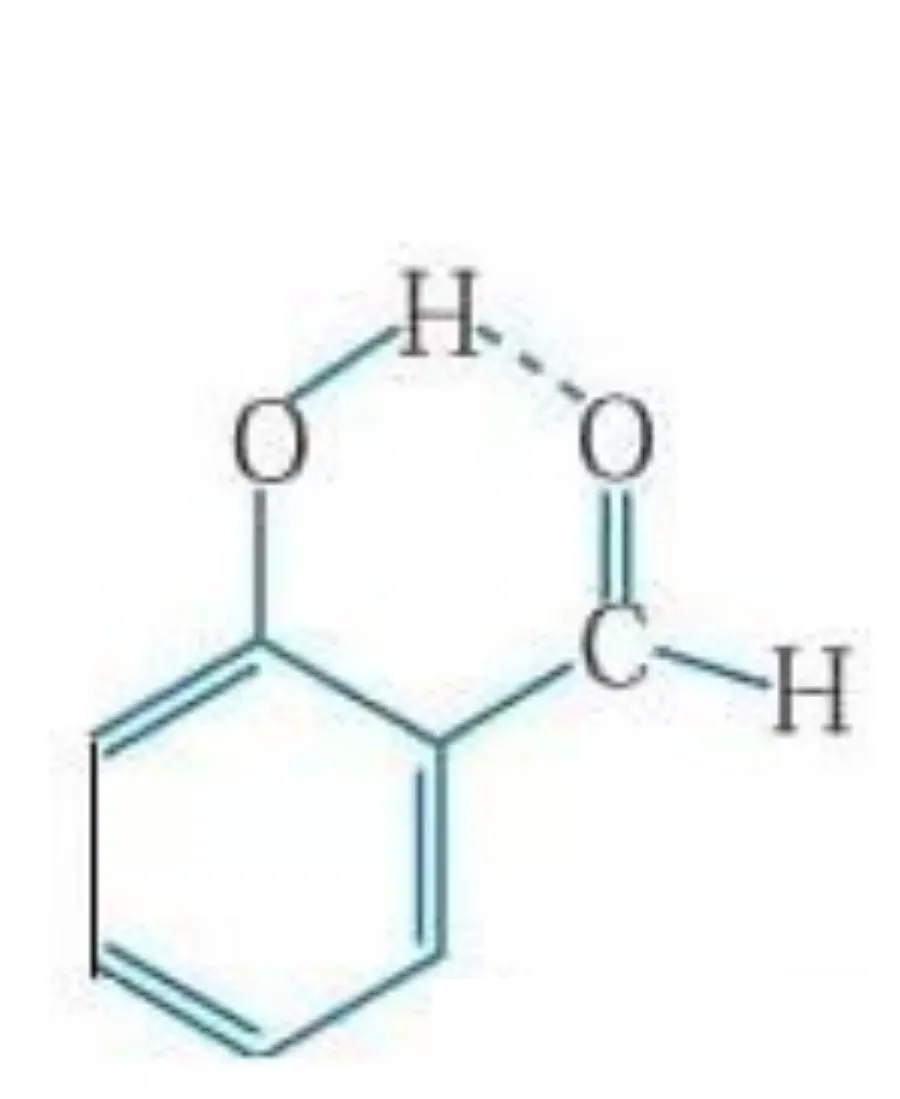
芳香环、碳碳叁键或双键在某些情况下都可作为电子供体,与强极性的X-H(如-O-H)形成氢键。
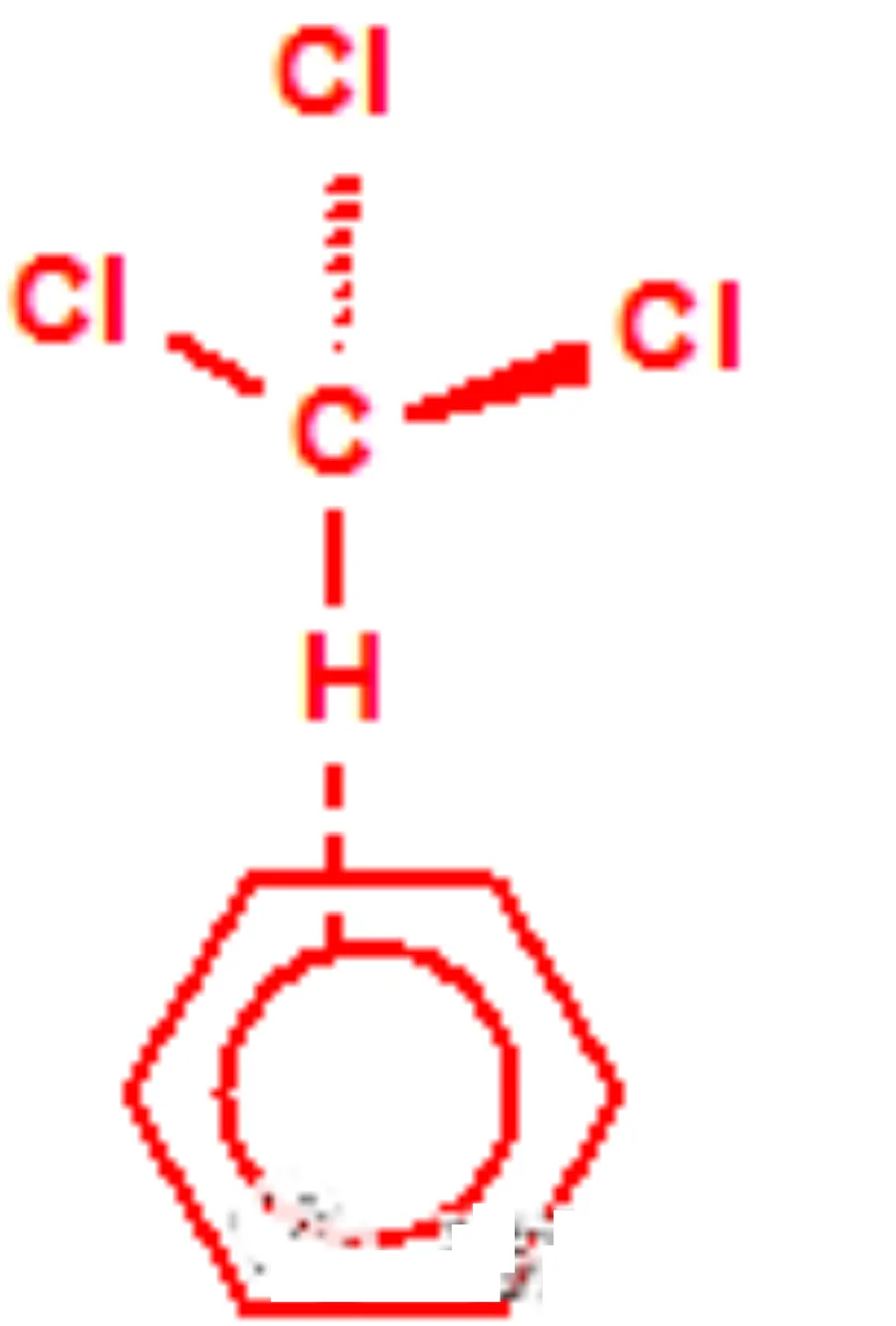
分类
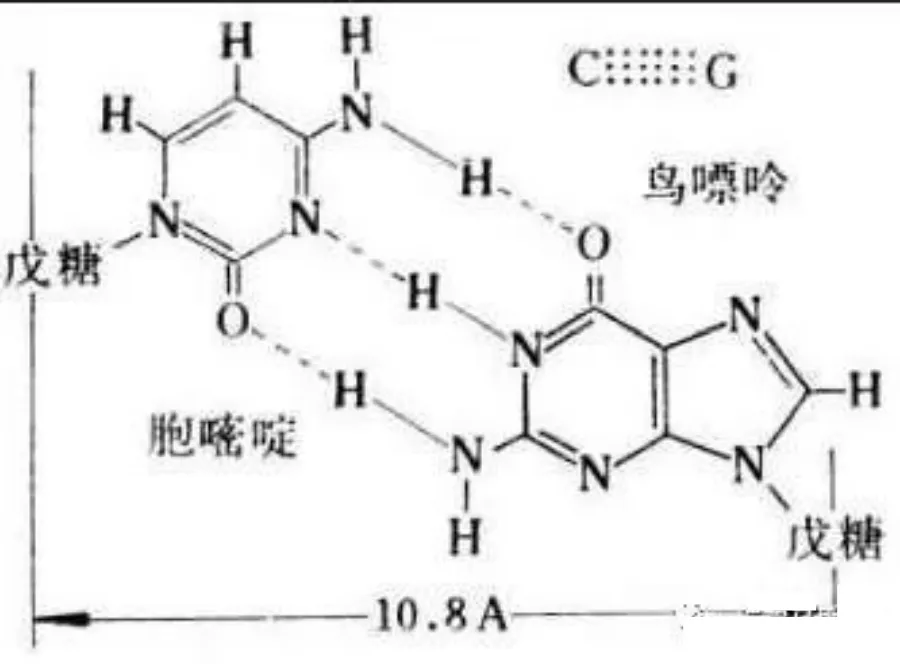
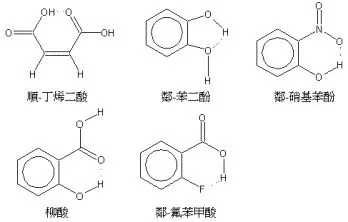
键能
氢键的结合能是2-8千卡(Kcal)。氢键是一种比分子间作用力(范德华力)稍强,比共价键和离子键弱很多的相互作用。其稳定性弱于共价键和离子键。
氢键键能大多在25-40kJ/mol之间。一般认为键能<25kJ/mol的氢键属于较弱氢键,键能在25-40kJ/mol的属于中等强度氢键,而键能>40kJ/mol的氢键则是较强氢键。曾经有一度认为最强的氢键是[HF2]中的FH…F键,计算出的键能大约为169kJ/mol。而事实上,用相同方法计算甲酸和氟离子间的[HCO2H…F]氢键键能,结果要比HF2的高出大约30kJ/mol。
常见氢键的平均键能数据为:
F-H … :F (155kJ/mol 或 40 kcal/mol)O-H … :N (29 kJ/mol 或 6.9 kcal/mol)O-H … :O (21 kJ/mol 或 5.0 kcal/mol)N-H … :N (13 kJ/mol 或 3.1 kcal/mol)N-H … :O (8 kJ/mol 或 1.9 kcal/mol)HO-H … :OH3(18 kJ/mol或 4.3 kcal/mol)
特性
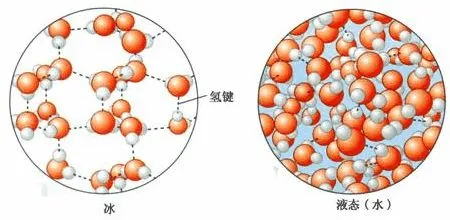
氢键通常是物质在液态时形成的,但形成后有时也能继续存在于某些晶态甚至气态物质之中。例如在气态、液态和固态的HF中都有氢键存在。能够形成氢键的物质是很多的,如水、水合物、氨合物、无机酸和某些有机化合物。氢键的存在,影响到物质的某些性质。
熔沸点
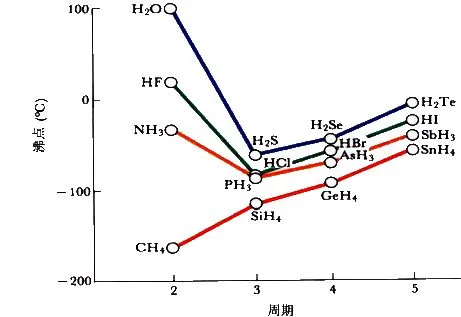
分子间有氢键的物质熔化或气化时,除了要克服纯粹的分子间力外,还必须提高温度,额外地供应一份能量来破坏分子间的氢键,所以这些物质的熔点、沸点比同系列氢化物的熔点、沸点高。
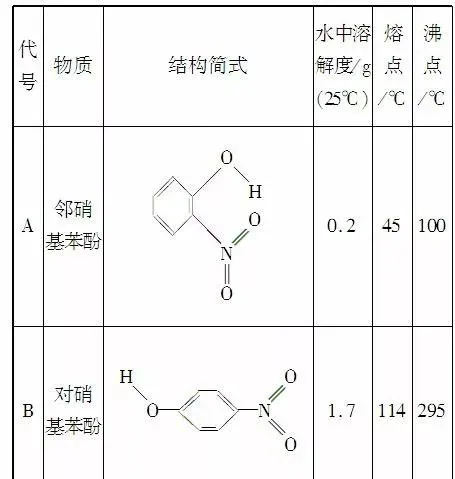
溶解度
在极性溶剂中,如果溶质分子与溶剂分子之间可以形成氢键,则溶质的溶解度增大。HF和NH3在水中的溶解度比较大,就是这个缘故。
粘度
分子间有氢键的液体,一般粘度较大。例如甘油、磷酸、浓硫酸等多羟基化合物,由于分子间可形成众多的氢键,这些物质通常为粘稠状液体。
密度
液体分子间若形成氢键,有可能发生缔合现象,例如液态HF,在通常条件下,除了正常简HF分子外,还有通过氢键联系在一起的复杂分子(HF)n。 nHF(HF)n 。其中n可以是2,3,4…这种由若干个简单分子联成复杂分子而又不会改变原物质化学性质的现象,称为分子缔合。分子缔合的结果会影响液体的密度。
影响
氢键对化合物熔点和沸点的影响
分子间形成氢键时,化合物的熔点、沸点显著升高。HF,H20和NH3等第二周期元素的氢化物,由于分子间氢键的存在,要使其固体熔化或液体气化,必须给予额外的能量破坏分子间的氢键,所以它们的熔点、沸点均高于各自同族的氢化物。
分子间作用力
氢键与分子间作用力概念辨析
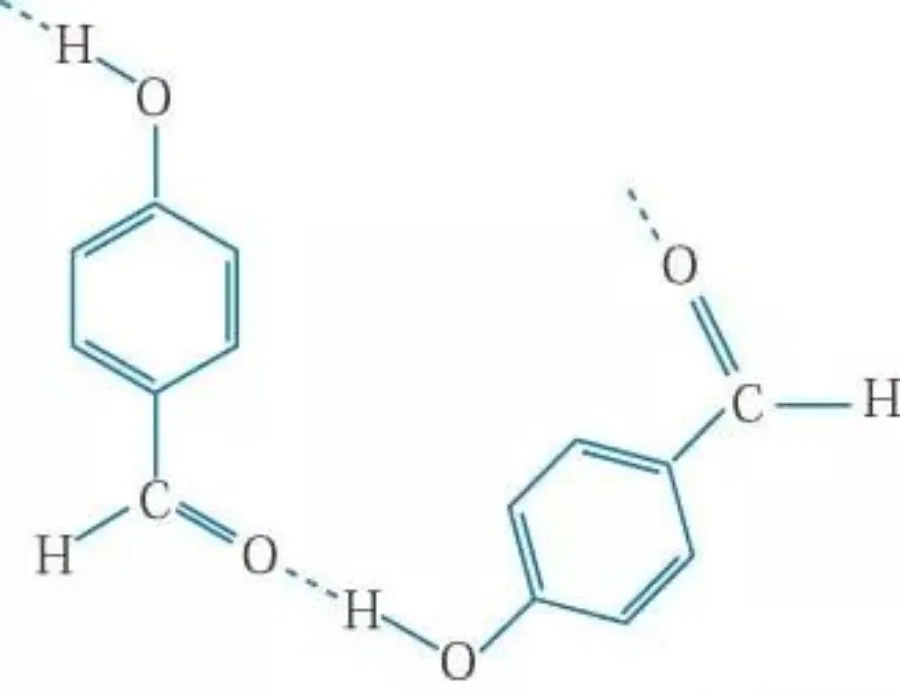
我们可以参见2011IUPAC对氢键的重新定义来看。
氢键是比我们以为的要更加模糊的实体。IUPAC的成员之一、印度科技大学的高塔姆·丹瑟拉朱表示:”它同明显的边界之间没有相互关系。“
丹瑟拉朱表示,这不仅仅与语义学有关。一个新的定义将对抗化学家们普遍接受的一种有关氢键什么时候、在什么地方出现的误解,并且鼓励他们思考氢键在新的环境—比如考虑到形成有机分子并采用一种以前认为不可能的反应方式下的影响。探索这条道路可能有助于我们研发出更加便宜的、更加环保的有机物,远离目前对有毒的、昂贵且包含了珍贵金属元素的催化剂的依赖。
重新定义
前面给出的定义是传统鲍林定义,2011年IUPAC给出了重新定义。
氢键就是键合于一个分子或分子碎片X-H上的氢原子与另外一个原子或原子团之间形成的吸引力,有分子间氢键和分子内氢键之分,其X的电负性比氢原子强。可表示为X-H……Y-Z 。“……”是氢键。 X-H是氢键供体,Y是氢键受体,Y可以是分子、离子以及分子片段。受体Y必须是富电子的,可以是含孤对电子的Y原子也可以是含π键的Y分子,X,Y相同原子时形成对称氢键。
IUPAC给出的氢键六准则:
规则1指出,氢键源于静电作用,色散相互作用不再认为是氢键,而规则6是为弱氢键提供能量判断的底线。IUPAC规则指出,氢键形成可以看做质子迁移反应杯部分激活的先兆。氢键网状结构表现出来的协同现象,导致氢键性质不具备按队相加性。氢键在成键方向的最优选择影响晶体的结构堆积模式。氢键电荷迁移估算表明氢键相互作用能与供体和受体间电荷迁移程度密切相关。通过对氢键体系电荷密度拓扑分析,X,Y原子间会显示一条连接X、Y以及键临界点的键径。
下载方法:
化学高考直通车精品课程
点击海报图片,识别二维码了解详情,付费后即可下载配套资料。
1.教材同步讲座系列课程(备课资源包)
| 必修1-2021版 |
必修1-2023版 |
 |
 |
| 必修2-2021版 | 必修2-2024版 |
 |
|
| 化学反应原理 | 有机化学基础 |
 |
 |
 |
2.化学教学疑难问题解析系列讲座
| 物质结构疑难解析 专题18讲 |
化学反应原理疑难 解析专题12讲 |
 |
 |
3.一轮复习系列课程
高考一轮复习专用,基于主题教学的2023高考化学专题复习80讲,经典中的经典,全网极具优势的课程资源。化学高考直通车,打造精品教学案例!
一直被模仿,从未被超越。

4.高中化学二轮复习系列讲座
| 2021新高考化学 专题20讲 |
2022新高考二轮 重点专题30讲 |
 |
 |

5.高考化学试题评析及教学启示系列讲座

| 2020年 |
2021年 |
 |
 |
| 2022年 |
2022年 |
 |
 |
 |
 |
 |
 |
7.考前最后一课、开学第一课
| 2021年 |
2022年 |
 |
 |
| 2023高考最后一课 | 2023开学第一课 |
 |
 |
8.突破高考压轴题系列
 |
 |
 |
 |
| 有机化学基础专题突破 |
 |
 |
 |
 |
 |
 |
一轮二轮三轮精品Word版
 |
 |
 |
 |
 |
 |
化学之窗——高中化学领军公众号
后台回复关键字:
✔回复“hxzc01”:查看必修1、必修2的微课视频;
✔回复“hxzc02”:查看原理、结构、有机的微课视频;
✔回复“hxzc03”:一轮复习、二轮复习的微课视频;
✔回复“hxzc04”:收看精彩科普视频,教学好素材;
✔回复“hxzc05”:高清实验视频+动画模拟1000个;
✔回复“大礼包”:获得化学之窗粉丝特供资料大礼包,大礼包包括:高中化学电子版教材,学案,配套练习,配套课件,配套高清化学实验,一轮、二轮复习课件,配套练习,各种图书Word版,各类优质课、说课的说课稿,视频,历年高考试题等。
大礼包会不定期更新,欢迎大家经常惠顾。
点击文末的“阅读原文”,获得精品课程视频和课程资料。
如果您是一位优秀的高中学生,请加入全国高中生化学大联盟:(QQ群1:208255867;QQ群2:1032125244)。加群请注明“高中化学新天地”二字。

(分享、点赞、在看)

 更多精品内容,欢迎点击【阅读原文】
更多精品内容,欢迎点击【阅读原文】
 夜雨聆风
夜雨聆风






