【热点提升】水解常数是如何确定的(可下载word版)

对于资料下载,敬请点击:
【友情提示】本公众号使用说明书
热点精讲
1.水解常数的概念
在一定温度下,能水解的盐(强碱弱酸盐、强酸弱碱盐或弱酸弱碱盐)在水溶液中达到水解平衡时,生成的弱酸(或弱碱)浓度和氢氧根离子(或氢离子)浓度之积与溶液中未水解的弱酸根阴离子(或弱碱的阳离子)浓度之比是一个常数,该常数就叫水解平衡常数。
2.水解常数(Kh)与电离常数的定量关系(以CH3COONa为例)
CH3COONa溶液中存在如下水解平衡:
CH3COO-+H2O CH3COOH+OH-
CH3COOH+OH-

因而Ka(或Kh)与Kw的定量关系为:
(1)Ka·Kh=Kw或Kb·Kh=Kw
(2)Na2CO3的水解常数Kh=KwKa2
(3)NaHCO3的水解常数Kh=KwKa1
3.水解平衡常数是描述能水解的盐水解平衡的主要参数。它只受温度的影响,因水解过程是吸热过程,故它随温度的升高而增大。
关于该知识点的更详尽讲解,敬请点击:
热点精练
1.已知25 ℃时,NH3·H2O的电离平衡常数Kb=1.8×10-5 mol·L-1,该温度下1 mol·L-1的NH4Cl溶液中[H+]=________ mol·L-1。(已知5.56≈2.36)
【答案】 2.36×10-5
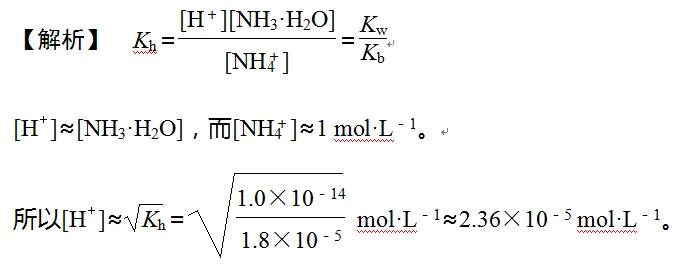
2.已知某温度时,Na2CO3溶液的水解常数Kh=2×10-4,则当溶液中[HCO-3]∶[CO2-3]=2∶1时,试求该溶液的pH=________。
【答案】 10
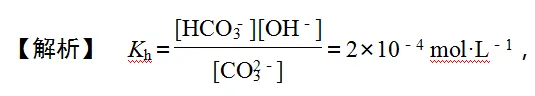
又[HCO3-]∶[CO32-]=2∶1,则[OH-]=10-4 mol·L-1,结合Kw=1.0×10-14 mol2·L-2,可得[H+]=10-10 mol·L-1。
3.已知常温下,K(HCN)=6.2×10-10 mol·L-1。
(1)常温下,含等物质的量浓度的HCN与NaCN的混合溶液显___(填“酸”“碱”或“中”)性,[CN-]________(填“>”“<”或“=”)[HCN]。该溶液中各离子浓度由大到小的顺序为____________。
(2)常温下,若将c mol·L-1盐酸与0.62 mol·L-1 KCN溶液等体积混合后恰好得到中性溶液,则c=__________(小数点后保留4位数字)。
【答案】 (1)碱 < [Na+]>[CN-]>[OH-]>[H+]
(2)0.616 2

4.磷酸是三元弱酸,常温下三级电离常数分别是
Ka1=7.1×10-3 mol·L-1,Ka2=6.2×10-8 mol·L-1,Ka3=4.5×10-13 mol·L-1,解答下列问题:
(1)常温下同浓度①Na3PO4、②Na2HPO4、③NaH2PO4的pH由小到大的顺序是________________(填序号)。
(2)常温下,NaH2PO4的水溶液pH________(填“>”“<”或“=”)7。
(3)常温下,Na2HPO4的水溶液呈________(填“酸”“碱”或“中”)性,用Ka与Kh的相对大小,说明判断理由:____________________________。

2NH3↑。
为便于友友们阅读,现将各个合集的代表作展示如下,欢迎赐教:
(1)《氧化还原反应》合集:热点梳理:有关氧化还原反应的热考点
(2)《物质的量》合集:雾点警示:你知道摩尔命题有哪些魔坑吗
(3)《物质结构、元素周期律》合集:【克难秘技】巧解晶体投影、妙定粒子坐标
(4)《电化学》合集:“四步曲”搞定新情境下原电池电极反应式的书写
(5)《化学平衡、化学反应速率》合集:【同步教辅】《化学反应原理》专题复习之《化学平衡综合应用》
(6)《电解质溶液》合集:重点明示:有关弱电解质的三大考点
(7)《化学实验》合集:热点提升:常见两类实验,破解设计方案
(8)《有机化学》合集:热点专攻:如何巧解有机合成综合题
(9)《我的育人理念》合集:考后寄语:高考,人生的跳板而已
(10)《我的文学作品》合集:周末驿站:那个中午,我收到了3封情书
(11)《诗歌》合集:教师节抒怀诗词两首
特别提示:点击“合集”(操作方法见精选文章《本公众号使用说明书》)可以得到某合集所有考点的word版。


百度网盘:【热点提升】水解常数是如何确定的(可下载word版).docx
链接: https://pan.baidu.com/s/18rGSyIEGQw-TUwVC9eM9Hw
提取码: 6658
 夜雨聆风
夜雨聆风





