医疗器械风险管理文档模板
1 产品描述
1.1预期用途
×××××。(与随机文件保持一致)
1.2 产品的组成
×××××由×××××组成。(与产品技术要求、随机文件保持一致)
1.3产品使用方法
×××××。(安装和拆卸、基本功能的实现,不能与随机文件冲突)
1.4预期使用寿命
×××××。(与铭牌保持一致)
1.5产品基本性能
1.5.1 基本性能×××××。
1.5.2 基本性能(从风险分析角度出发进行分析后)确认的依据(理由)或分析过程。
(注:1、应在技术要求中体现。基本性能及相应的试验方法可以是技术要求中的性能指标参数,也可以在技术要求中单独明确。但须遵循GB 9706.1-2020中3.27 的定义:与基本安全不相关的临床功能的性能,其丧失或降低到超过制造商规定的限值会导致不可接受的风险。2、此处只需体现基本性能要求,不需要体现试验方法。)
1.6 应用部分及按应用部分管理的部分
1.6.1 应用部分
×××××部分为××型应用部分。
1.6.2 不属于应用部分但需符合应用部分要求的部分
×××××。
1.7可触及部件的材料及接触时间(11章要求的内容)
1、列出可触及部分
2、给出各部分的接触概率/接触时间/材质。
3、超过41℃的部分按标准要求的内容写
表1 ME设备可能被触及部件容许的最高温度
|
ME设备及其部件 |
|||
|
可能接触的时间 |
|||
|
材质 |
|||
|
最高容许温度(℃) |
表2 与皮肤接触的ME设备的应用部分容许的最高温度
|
应用部分 |
|||
|
与患者接触的时间 |
|||
|
材质 |
|||
|
最高容许温度(℃) |
|||
|
临床影响 (应用部分表面温度超过41℃时) |
应确定体表、患者发育程度、药物治疗或表面压力这些特征的临床影响 |
1.8多次清洗/消毒的影响
制造商应评估ME设备,ME系统及其部件和附件在预期使用寿命期间内多次按使用说明书规定的清洗/消毒的影响,并确保这些过程不会导致基本安全或基本性能的丧失。
对ME设备,ME系统及其部件和附件进行清洗或消毒会影响符合本部分的那些地方,根据规定的方法,包括任何一个冷却或干燥周期,对其进行一次消毒,这些程序之后,ME设备、ME设备部件或附件不出现会导致不可接受风险的劣化迹象(目视检验);随后进行适当的电介质强度和漏电流试验。检查风险管理文档以核实制造商已经评估多次清洗的影响。有证据的提供证据(如测试报告)。
2.风险管理计划
(企业自行按照GB/T 42062-2022的要求填写该部分内容)
2.1 风险可接受性准则(以下内容仅供参考,但必须要有相关内容)
根据GB/T 42062-2022《医疗器械风险管理对医疗器械的应用》附录,对风险严重度和概率级别按以下进行划分,并确定风险可接受准则。
2.1.1严重度和概率级别划分
1)风险的严重度水平
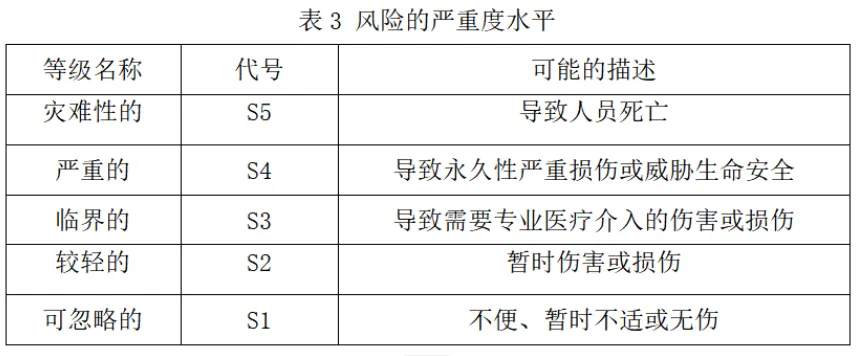
2)风险的概率等级
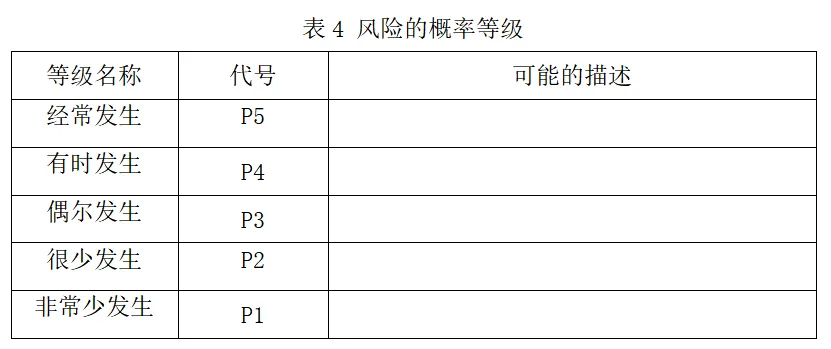
2.1.2风险可接受性准则
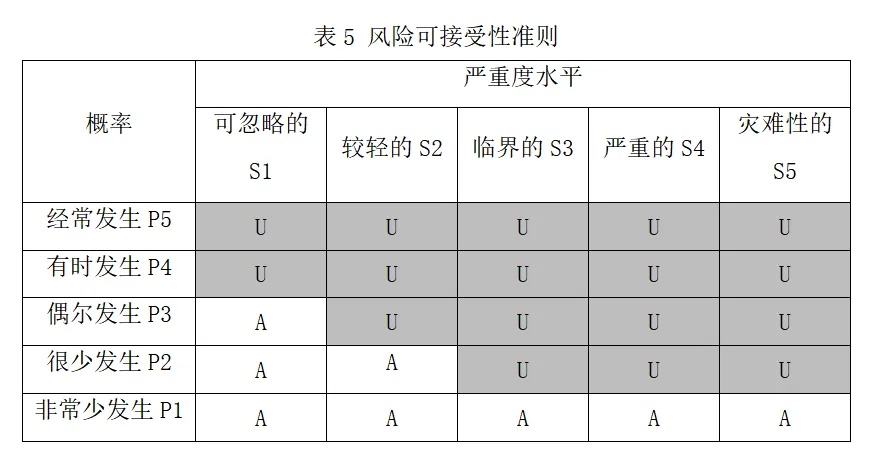
不可接受的风险 U
可接受的风险 A
(备注:也可分为不可接受风险、合理可行降低风险、可接受风险模块。)
3.风险分析
(企业自行按照GB/T 42062-2022的要求填写该部分内容)
4.2 风险评价
(企业自行按照GB/T 42062-2022的要求填写该部分内容)
4.3 剩余风险分析
5.风险控制
(企业自行按照GB/T 42062-2022的要求填写该部分内容)
6.综合剩余风险可接受评价
(企业自行按照GB/T 42062-2022的要求填写该部分内容)
本公众号每周更新医疗器械注册的最新法规和注册实务,NMPA、CE、FDA等国内外注册,欢迎关注!

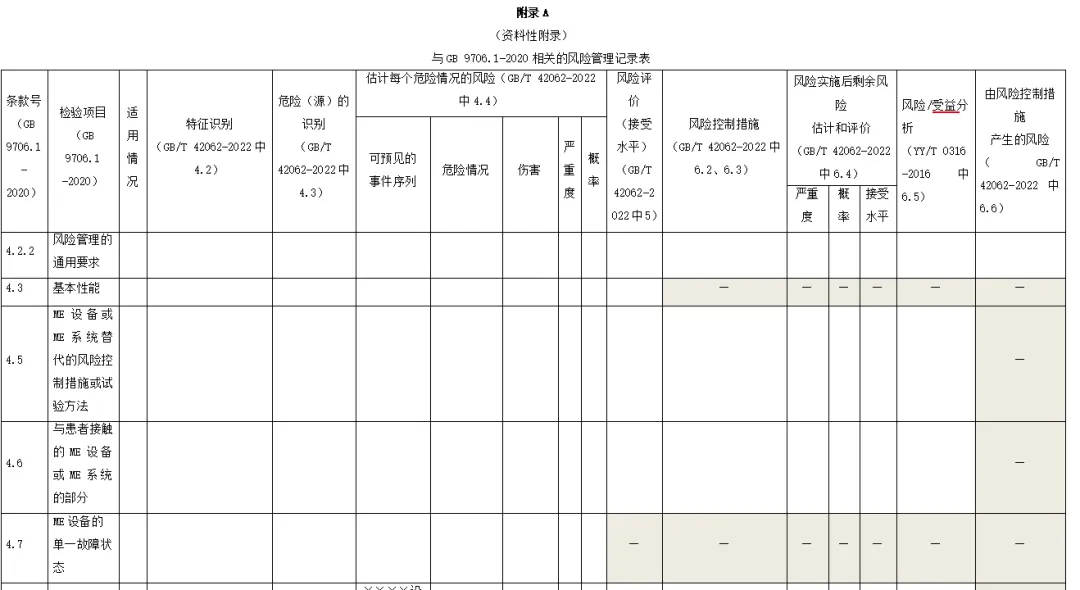
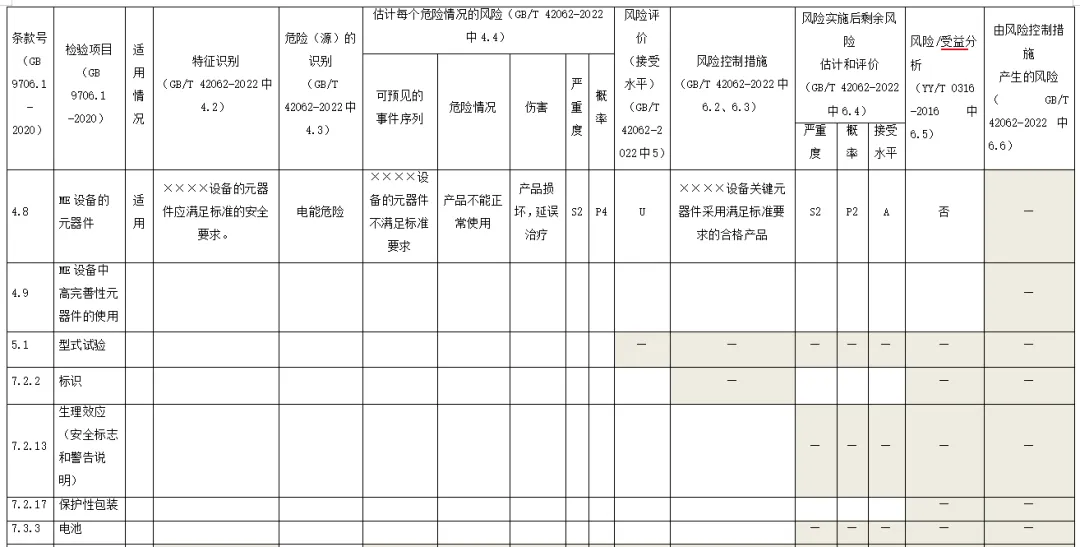
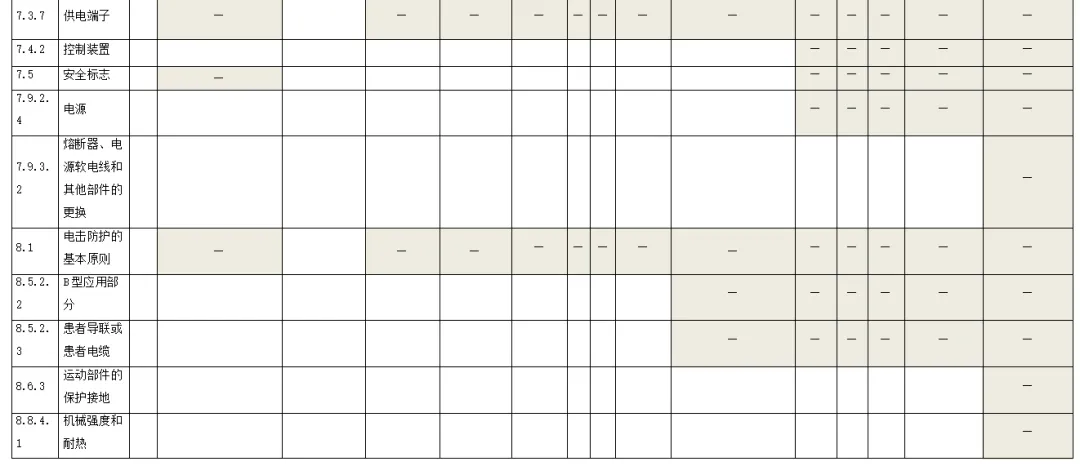
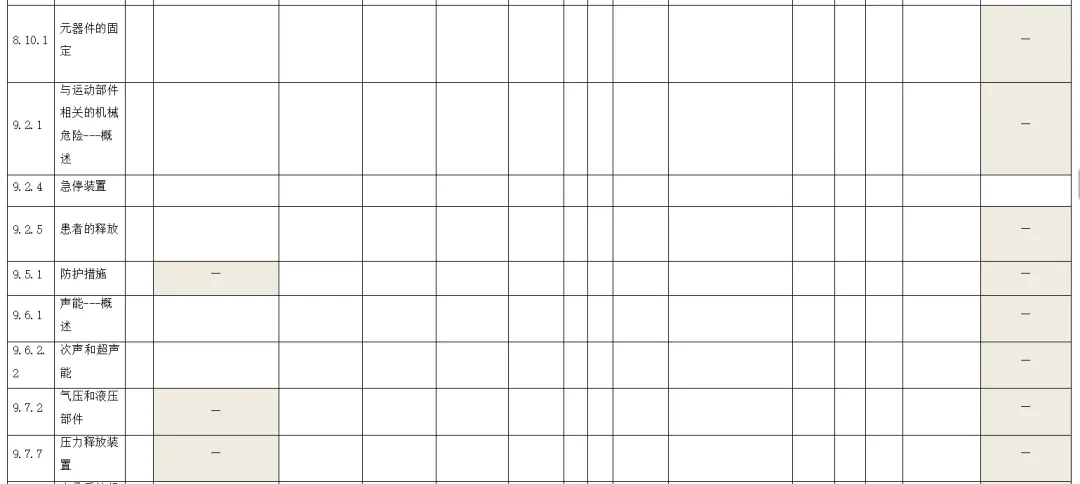
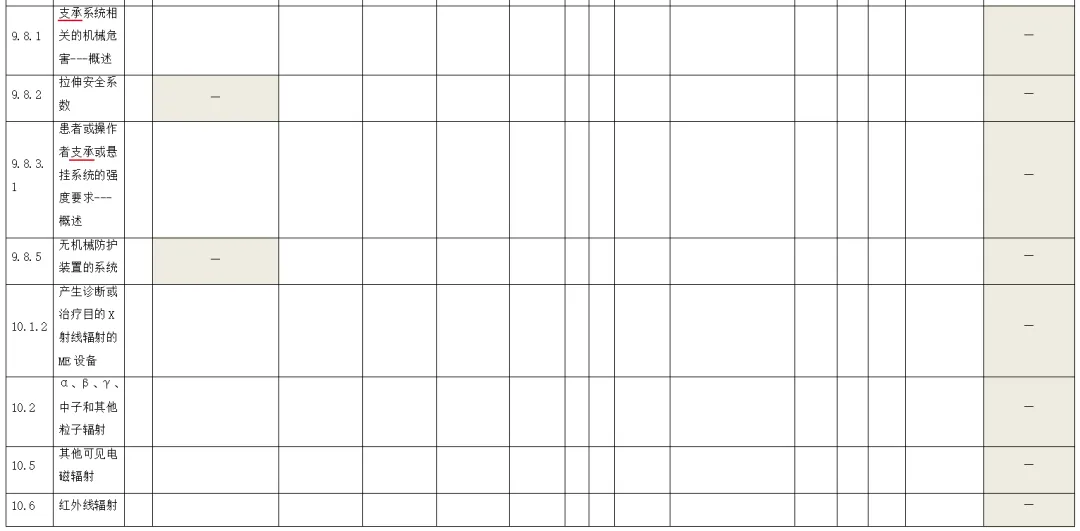
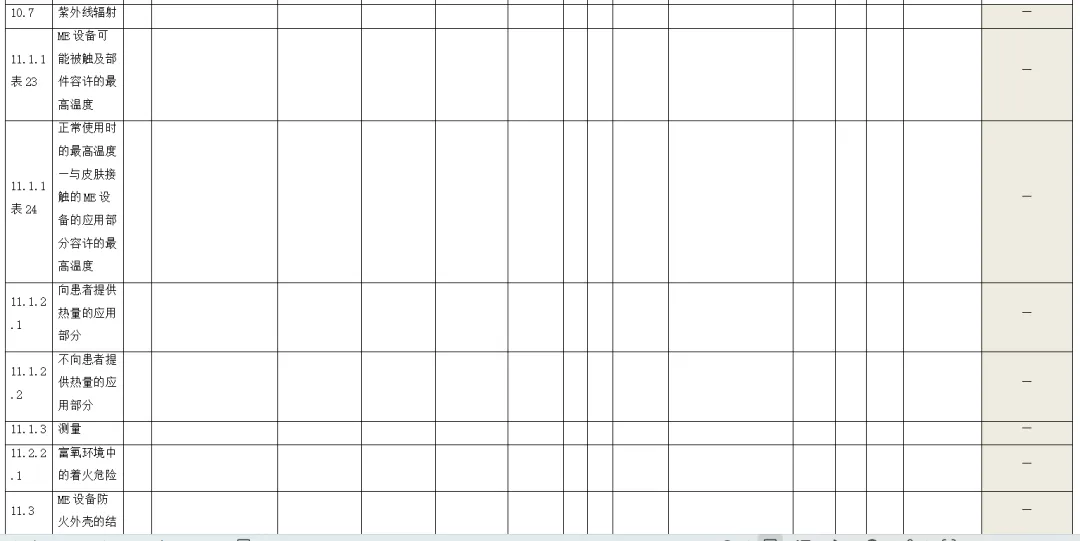
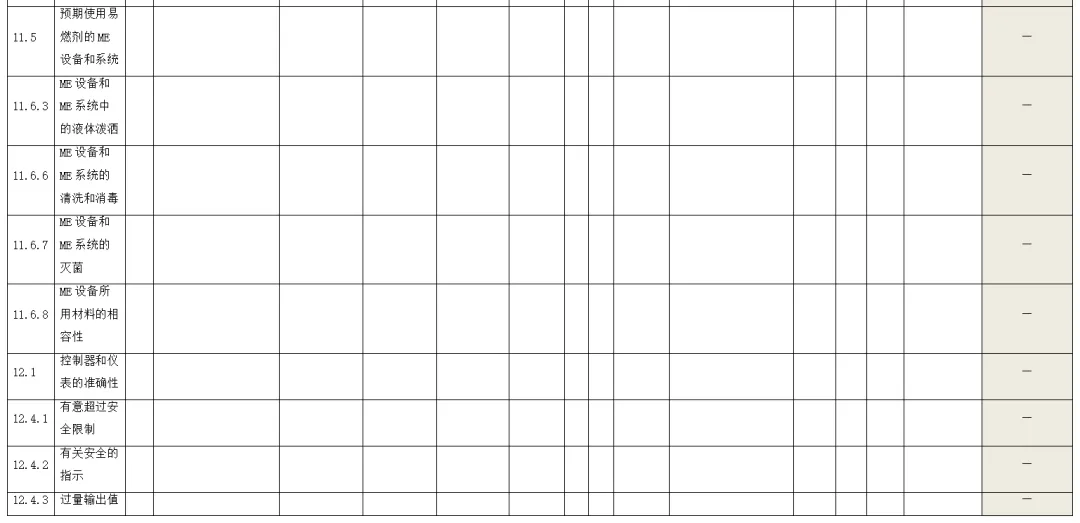
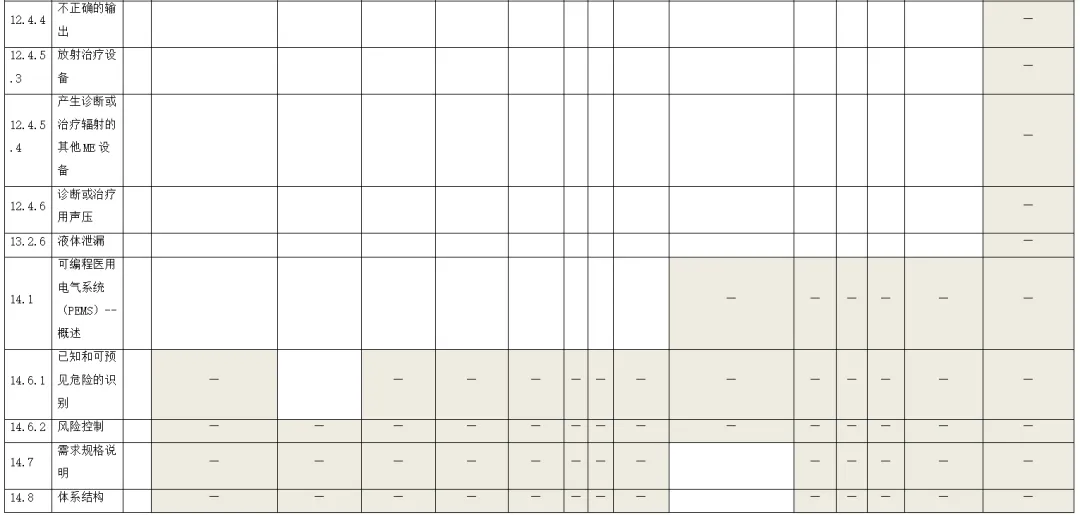
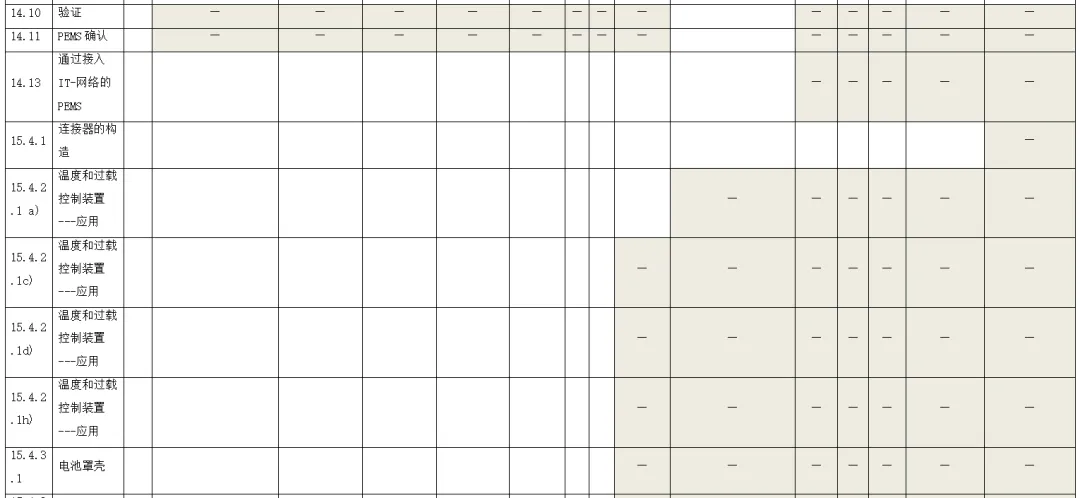
附录:与GB 9706.1-2020相关的风险管理记录表。
(备注:根据具体医疗器械,填写适用的条款)
 夜雨聆风
夜雨聆风





