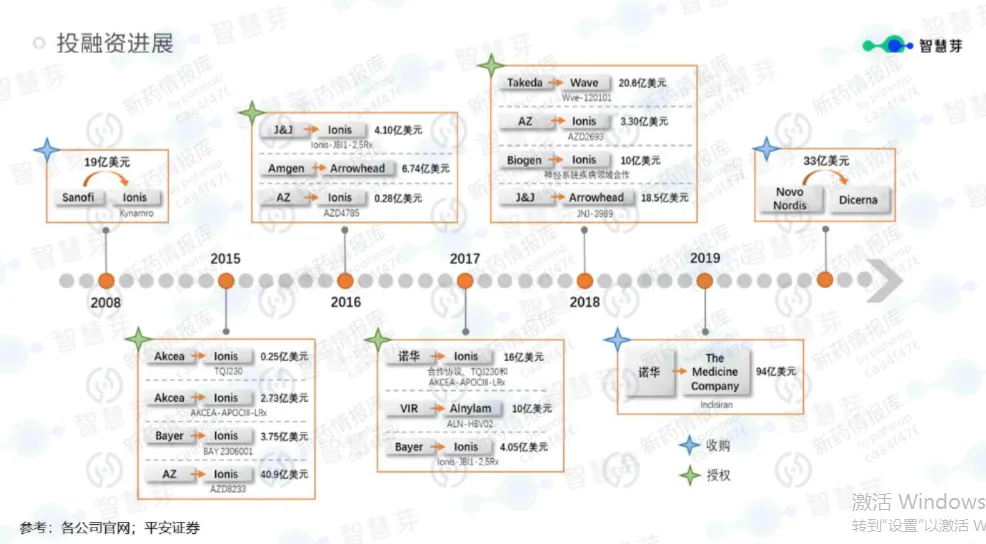
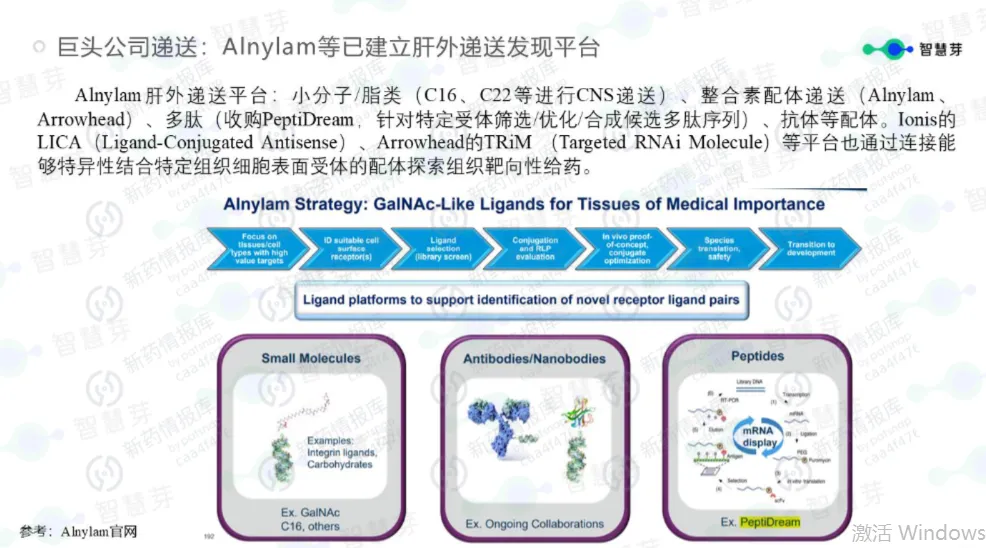
一场瞄准基因“源代码”的革命与回归的小核酸药物研发史
当我们谈论下一代药物革命时,基因疗法、细胞疗法无疑是聚光灯下的焦点。然而,一条在过去几十年间历经沉寂与爆发、更精准、更具“编程”属性的技术路径——小核酸药物,正悄然从罕见病的边缘地带,迈向心血管、乙肝、肥胖等亿万患者的主流战场。今天,我们就来梳理这段跌宕起伏的研发历程,读懂这场瞄准基因“源代码”的医学变革。
一、概念的曙光与第一次探索(1970s-1990s)
故事的起点,源于科学家们一个大胆的设想:若能直接干预“生命蓝图”(基因)的表达指令,是否能从根本上治愈疾病?这一设想,为小核酸药物的诞生埋下了种子。
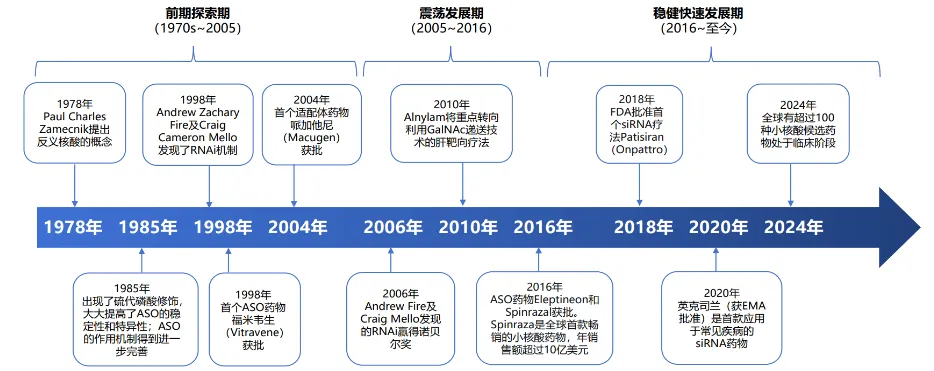
1978年,哈佛大学科学家首次提出反义核酸(ASO)概念——设计一段短链核酸,使其像“精准粘扣”一样,特异性结合并阻断致病基因的“信使”(mRNA),从而阻止异常蛋白的产生,从源头切断疾病发生的链条。
1998年,成为小核酸药物发展的第一个里程碑。这一年,首款ASO药物福米韦生(Vitravene)获批上市,用于治疗艾滋病患者的巨细胞病毒视网膜炎。尽管后来因适应症人群变化最终退市,但它首次以临床实绩证明,小核酸可以作为药物应用于人体,为整个领域注入了信心。
同年,另一项基础研究震惊学界:Fire和Mello在线虫中揭示了RNA干扰(RNAi)机制——双链小RNA能高效、特异地“沉默”目标基因,让致病基因无法发挥作用。这项突破性发现于2006年荣获诺贝尔生理学或医学奖,为后续siRNA药物的研发点燃了理论火种,也奠定了小核酸药物的核心技术基础。
二、震荡与寒冬:理想撞上现实的壁垒(2000s-2010s初)
诺奖的光环催生了小核酸领域的第一波投资与研发狂热,默沙东、罗氏等制药巨头纷纷重金入局,初创企业也如雨后春笋般涌现。然而,狂热之下,科学家们很快遭遇了两道难以逾越的技术壁垒,理想与现实发生激烈碰撞。
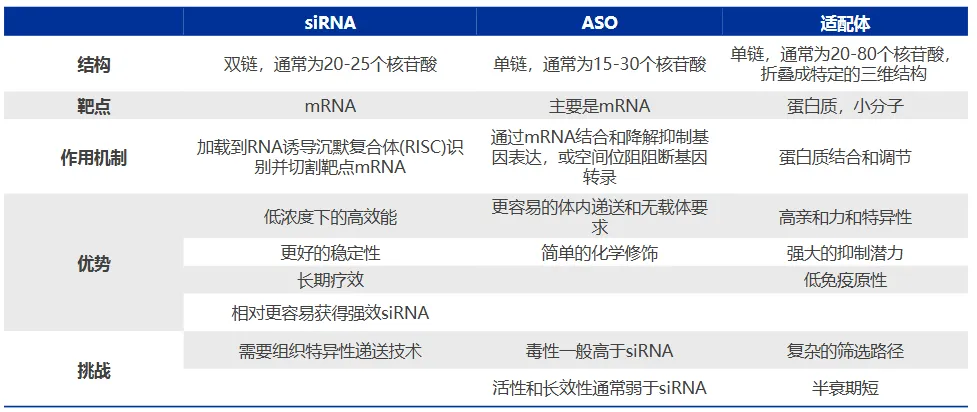
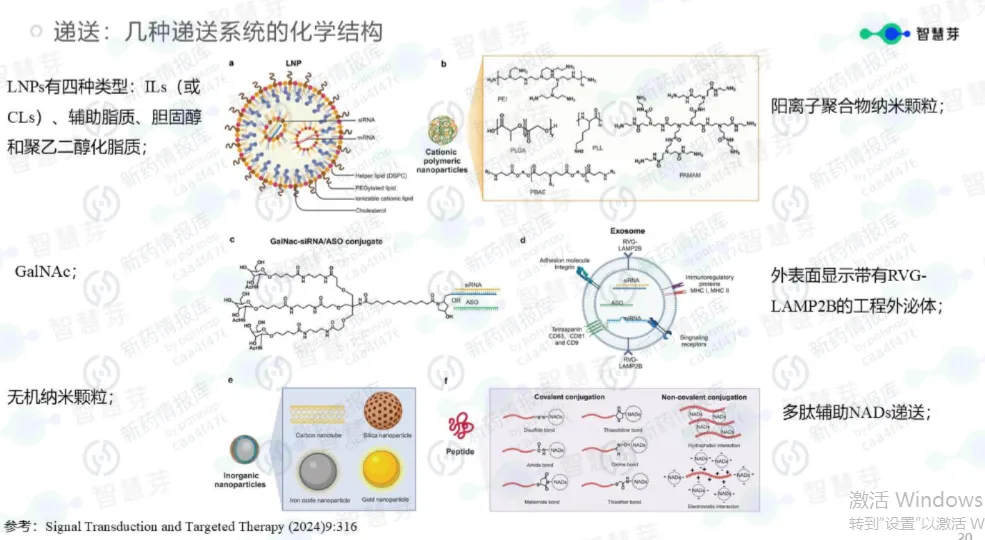
第一道壁垒是递送难题:外源小核酸作为异物,难以突破细胞的重重防线,既无法精准抵达目标组织和细胞,还容易被体内的核酸酶降解,导致药物无法发挥作用。第二道壁垒是安全性与稳定性:早期药物在临床试验中相继暴露出毒副作用、免疫原性等问题,让研发陷入困境。
2010年前后,多项关键临床试验接连失败,各大药企纷纷收缩布局、撤离赛道,行业投资急剧锐减,整个小核酸领域陷入“至暗时刻”。人们开始质疑,这项被寄予厚望的技术,究竟是划时代的治愈疗法,还是一场美丽的科学泡沫?
三、技术破冰,王者归来(2014年-至今)
行业的转机,始于一次关键的技术突破——递送系统的革新,这也成为小核酸药物“王者归来”的核心底气。
2014年左右,以Alnylam公司为代表的研发团队,在递送技术上取得革命性进展:他们开发出GalNAc(N-乙酰半乳糖胺)偶联技术,相当于给siRNA装上了一把“特洛伊木马”式的专属钥匙,能让药物高效、特异地被肝细胞识别并“吞入”。这一突破,彻底解决了肝脏靶向递送的核心难题,为小核酸药物的临床转化打通了关键堵点。
2016年,行业迎来全面回暖:Ionis公司的诺西那生钠(Spinraza,ASO)获批上市,成为脊髓性肌萎缩症(SMA)的救命药。这款药物不仅改写了SMA患者的生存命运,更创下年销售额超20亿美元的奇迹,充分展现了小核酸药物在罕见病领域的巨大临床价值与市场潜力。
2018年,小核酸领域迎来又一里程碑:首款siRNA药物帕替西兰(Onpattro)获批,用于治疗遗传性转甲状腺素蛋白淀粉样变性(hATTR)。这款药物的上市,正式拉开了siRNA药物商业化的大幕,也标志着小核酸药物从基础研究真正走向规模化临床应用。
自此,“化学修饰+靶向递送”的双轮驱动模式,让小核酸药物研发进入高速车道。自2018年起,几乎每年都有小核酸新药获批上市,曾经沉寂的赛道,彻底焕发新生。
四、新篇章:从“罕见”到“常见”的破界之旅
如果说,过去的小核酸药物是“为少数人定制的精工利器”,聚焦于罕见病治疗;那么现在,它正突破边界,开启为大众健康服务的通用平台新篇章。其核心逻辑简单而有力:既然能精准“关闭”肝脏中导致罕见病的坏基因,那也能针对性“关闭”导致高血脂、高血压、乙肝等常见病的致病基因,从源头攻克慢病难题。
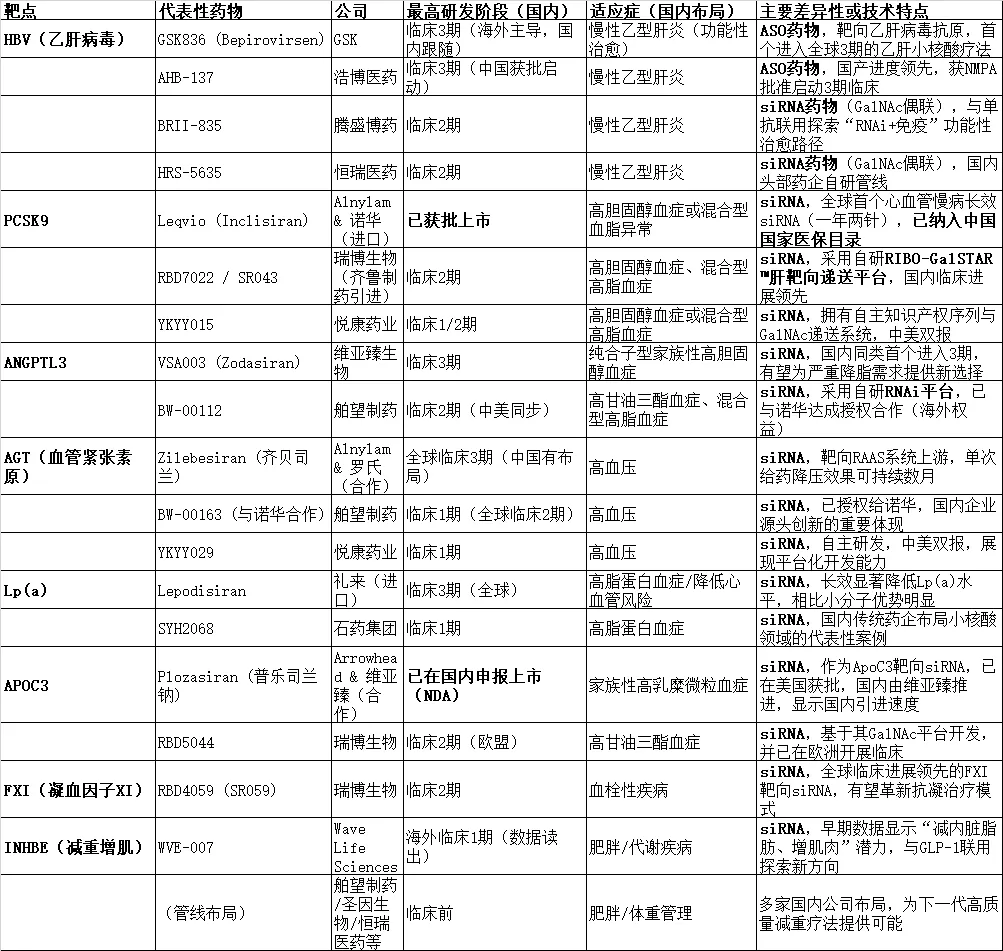
慢病领域的标杆性突破,来自2020年获批的siRNA药物英克司兰(Inclisiran)。这款药物靶向PCSK9基因,用于治疗高胆固醇血症。与传统降脂药每日服药的模式不同,英克司兰实现了一年仅需注射两次的超级长效优势,彻底颠覆了慢病治疗的给药逻辑,也展现出其在超大患者群体中的商业化潜力——2025年前三季度,其全球销售额已超8.6亿美元。
在国内,小核酸药物的布局呈现出鲜明的“中国特色”:与海外从罕见病起家的路径不同,中国药企凭借对国内庞大慢病市场的深刻洞察,选择直接切入心血管、乙肝、代谢性疾病等主流战场,实现“弯道超车”。目前,恒瑞医药、石药集团、舶望制药、悦康药业等企业纷纷加码布局,多款自研siRNA药物已进入临床II期,研发进度逐步追赶国际水平。
2024年,舶望制药与诺华达成总额可能高达50亿美元的重磅授权合作,创下国内非肿瘤领域BD交易纪录。这一合作不仅彰显了中国小核酸药物的研发实力,更标志着中国力量已获得国际顶级药企的认可,正式跻身全球小核酸研发的第一梯队。
五、未来已来:下一站,星辰大海
如今,小核酸药物的研发前沿正朝着两个核心维度急速拓展,不断打破技术边界,解锁更多治疗可能。
第一个维度是突破肝脏靶向,向“肝外”组织进发。目前,GalNAc偶联技术主要聚焦于肝脏递送,而新的递送技术——如抗体偶联(AOC)、多肽纳米颗粒等,正致力于将小核酸药物精准送达肌肉、中枢神经、肾脏、脂肪等肝外组织。这一突破至关重要,将为阿尔茨海默病、肌营养不良、肥胖症等疾病的治疗带来新希望——其中,已有靶向INHBE的siRNA药物展示出“减脂增肌”的潜力,有望改写肥胖症的治疗格局。
第二个维度是靶点的无限扩展。小核酸药物的核心优势的在于“可编程性”:理论上,只要明确致病基因的序列,就能设计出对应的小核酸药物,实现对致病基因的精准沉默。这一特性,使其成为攻克传统“不可成药”靶点的利器,让曾经无法治疗的疾病,拥有了治愈的可能。
结语
小核酸药物的研发史,是一部人类执着于从生命最底层逻辑——基因表达层面——干预疾病的壮阔史诗。它历经概念萌发的曙光、技术受挫的寒冬、突破瓶颈的重生,如今正迎来边界不断拓宽的爆发期,完成了从“小众探索”到“主流赛道”的蜕变与回归。
它不仅仅是一类新药,更是一种高度平台化、可编程的药物治疗新范式。当GalNAc偶联技术将我们带入肝靶向时代,我们已然站在肝外递送时代的前夜。未来,随着递送技术的持续解锁和研发经验的不断积累,小核酸药物有望在更广阔的疾病领域,带来更多“一针管半年”甚至更久的治疗革命,真正实现从“治标”到“治本”的跨越。
这场瞄准基因“源代码”的精准医学革命,正在加速驶向未来。而中国力量,已然成为其中不可忽视的强劲引擎,在全球小核酸药物的发展浪潮中,书写着属于中国的研发传奇。
说明:本文基于公开行业研究报告与资料梳理,旨在科普产业发展脉络,不构成任何投资建议。