利用 ibidi 细胞划痕插件建立神经元功能的模块化模型
前言
突触连接是神经元功能的基本构建模块,它使得神经活动能够从一个神经回路传播到另一个神经回路。然而,传统的体外神经元模型仅包含单个神经回路,而动物模型则因成本过高且操作复杂,难以用于研究突触传播。在此,我们描述了一种简单且在体外研究两个不同神经回路之间突触传播的实验方法的发展和特性。我们使用 2 孔细胞划痕插件(购自 ibidi GmbH 公司)在 6 孔微电极阵列(MEA)板的每个孔中分别接种空间上分离的啮齿动物皮层神经元群体。在移除细胞划痕插件并待细胞培养成熟后,这两个神经元群体之间形成了功能性的突触连接,从而允许两个群体之间产生协调一致的神经活动爆发。其中一个神经元群体被转导了 ChR2(一种去极化光遗传通道),并用蓝光刺激以诱发神经活动,而另一个神经元群体则作为「指标」群体,用于量化突触传播。我们在培养孔中加入了突触阻断剂混合物,这突显了该实验方法在解析突触传播变化方面的能力。

2 孔细胞划痕插件
实验材料
1)细胞
鼠皮层神经元(RNC)细胞(购自 Thermo Scientific 公司)。
2)培养基
Neurobasal™ Plus培养基(Thermo Scientific,A3582901),加有 50× B-27™ Plus 补充剂(Thermo Scientific,A3582801)以及 1% 青霉素-链霉素混合液(Gibco,15140122)
3)多孔板耗材与仪器设备
将 2 孔细胞划痕插件(ibidi,80209)粘贴在 Axion CytoView MEA 6 孔板上。Axion CytoView MEA 6 孔板中每个孔的培养表面上均已嵌入 64 个记录电极。
实验步骤
1)CytoView MEA 6 孔板制备
-
将 ibidi 2 孔细胞划痕插件从包装中取出,放置在 CytoView MEA 6 孔板的每个孔的微电极阵列(MEA)表面上,确保插件的中心线位于微电极阵列的中间位置; -
在细胞划痕插件的每个孔中各加入 50 μL 0.01% 多聚-D-赖氨酸氢溴酸盐(PDL)溶液; -
用 diH₂O 洗涤插件各孔 4 次并晾干。
2)细胞培养
-
按照供应商提供的相关指引,将大鼠皮层神经元(RNCs)解冻并进行培养,并使用血细胞计数器确定细胞密度及存活率; -
将细胞悬液转移至 15 mL 锥形管中,100xg离心 1 min 后弃上清,注意不要扰动细胞沉淀; -
将神经元重悬至浓度为10,000,000 neurons/ml并将悬液分成两管,用于后续的转导步骤; -
在细胞划痕插件两侧的记录电极上方各滴加 5 μL 上述神经元悬液,37°C、5% CO₂ 孵育 1 h; -
在细胞划痕插件的每个孔中加入 100 μL 培养基,孵育 48 h 后移除插件; -
将多孔板每孔中的培养基补至 500 μL,随后每 2~3 d 更换 50% 培养基以维持细胞生长。
3)神经元的光遗传转导
利用 AAV-9 病毒载体以及 CAG 启动子(rAAV9/CAG-ChR2-GFP,4.1×10^13viral molecules/mL)对细胞划痕拆建一侧的神经元进行转导,以诱导表达蓝光敏感的光敏蛋白——通道视紫红质(ChR2)。在将细胞悬液接种至培养板中前,先将病毒载体(3 μL 病毒原液)加入到其中一个细胞悬液管中。
4)光学刺激
用 LUMOS 96 光学刺激设备进行光学刺激,并通过 AxIS Navigator Stimulation Studio 软件进行操作。Lumos设备以最大功率的 2% 发射蓝光脉冲,频率为 0.5 Hz,持续 2 min。
实验结果
1)2 孔细胞划痕插件促进不同神经元网络之间的功能连接
将 2 孔细胞划痕插件粘贴到 CytoView 多电极阵列(MEA)6 孔板的每个孔中。将皮层神经元接种至每个插件孔中并培养 2 d。在体外培养 2 d 后,移除 2 孔细胞划痕插件,使轴突投射能够跨越无细胞间隙(即划痕),在两个不同的皮层网络之间建立功能连接。

图 1:A)2 孔细胞划痕插件置于 CytoView 多电极阵列(MEA)6 孔板的一个孔中。B)移除插件后 10 d 内,轴突投射跨越了无细胞间隙。C)活动图展示两个空间上分离的网络之间的同步活动。
图 1 展示了培养板上单个孔的一个示例。如图 1-A 所示,2 孔细胞划痕插件将孔在阵列上方分隔成了两个隔室。该孔的光学图像证实,在移除 2 孔细胞划痕插件后的 10 d 内,轴突投射已跨越了无细胞间隙(图 1-B),活动图则表明两个网络之间存在同步活动(图 1-C)。
2)突触传递的诱发实验
神经网络最初的空间分离使得每个网络能够独立进行基因修饰。在培养约 17 d 后,转导的细胞群体能够对光刺激产生响应,并且功能性突触连接将诱发的活动传递到了另一个网络。图 2 提供了从诱发实验中收集到的一个数据示例。
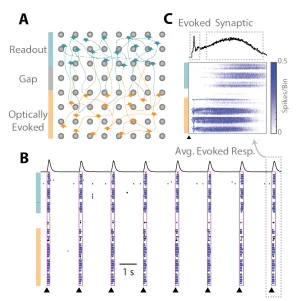
图 2-A 中的示意图描绘了两个空间上相互分离的网络:光学「诱发」网络(橙色)以及「响应」网络(蓝绿色)。每一束光脉冲(黑色三角形)在培养孔中引发了两个网络间的一阵活动爆发(图 2-B)。图 2-C 中的刺激前后栅格图显示,活动首先在「诱发」网络中开始,随后在经过一段延迟后,传递至「响应」网络。因此,培养孔分隔装置与光遗传学刺激手段共同构成了一个实验测定平台,可用于探究两个皮层网络之间突触传递的药物调控机制。
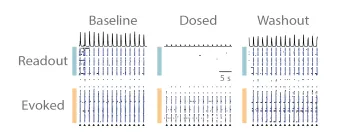
(A)在药物处理之前,「诱发(Evoked)」网络与「响应(Readout)」网络之间的突触活动强劲且同步;(B)药物处理导致「诱发」网络在刺激后的活动略有下降,并切断了从「诱发」网络到「响应」网络的突触传递;(C)药物洗脱后,两个皮层网络内部及之间的突触通信得到恢复。
3)突触传递的药物调控
重组皮层神经元(RCN)培养物中既包含兴奋性神经元,也包含抑制性神经元,因此本实验联合使用了 NMDA、GABA 和 AMPA 受体拮抗剂。将 APV(50 μM)、Bicuculline(20 μM)和 CNQX(20 μM)作为混合剂一起加入培养孔中。按照图 2 所描述的方法,在溶剂对照和混合剂处理条件下,于基线、给药和洗脱阶段进行了诱发测定。从一个示例孔的栅格图可以直观地看出,加入混合剂后,诱发的输入信号无法传递至「响应」网络,但在洗脱后传递得以恢复(图 3)。
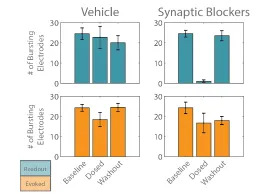
随后,分别对「诱发」网络和「响应」网络的活动进行分析,以说明突触阻断剂混合剂的作用效果。记录爆发电极的数量可追踪每个网络受刺激影响的程度。在加入混合剂之前,大多数电极都检测到了每个网络的爆发活动(图 4)。给药后,「诱发」网络的爆发电极数量略有下降,但与溶剂对照组相比并无显著差异。相比之下,「响应」网络在给药混合剂后,爆发电极的数量显著减少,因为突触传递被完全阻断。洗脱混合剂后,恢复了从「诱发」网络到「响应」网络的活动传递,这从「响应」网络爆发电极数量恢复到基线水平即可看出。
上述分析是根据培养孔内两个网络的空间分离情况进行的。当考虑诱发响应的潜伏期时,也能得到类似的结果。在此,我们将两个网络的活动放在一起分析,但将其分为早期响应(0~40 ms)和晚期响应(40~100 ms)两个阶段,其中早期响应是由光遗传学刺激直接诱发的,而晚期响应则是由突触传递介导的。
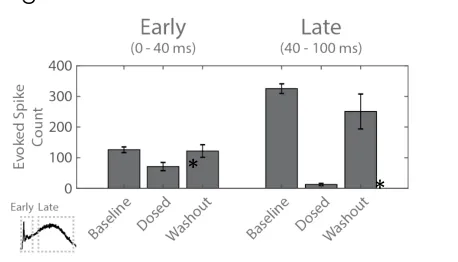
图 5:利用诱发尖峰计数来量化光遗传学刺激所引发的早期「诱发」响应(左)和晚期「突触」响应(右)。与基线相比的统计显著性用(*)标注。
利用诱发尖峰计数来量化响应各阶段的反应情况。加入混合阻断剂后,由直接诱发活动产生的早期响应确实有所下降,这表明存在短潜伏期的突触活动(图 5)。图 2-C 中的刺激前后栅格图显示,大部分这种短潜伏期的突触活动都发生在「诱发」网络内部。代表突触传递的晚期响应,在给予突触阻断剂混合物后显著减少。值得注意的是,晚期突触响应中活动的近乎完全消失,表明网络内和网络间的突触均被阻断。
结论
Maestro 多电极阵列(MEA)与 ibidi 2 孔细胞划痕插件的联合应用构建了一个多功能实验测定平台,适用于体外研究两个神经网络之间的连接特性。该平台在细胞接种类型选择、分隔装置移除时间设定以及分析参数配置等方面均展现出高度的灵活性,从而能够满足多样化的研究需求。例如,本研究所提出的突触测定技术框架,为神经肌肉接头功能研究以及模拟突触活动异常相关的神经退行性疾病提供了新的研究手段。
广州科适特科学仪器有限公司是德国ibidi公司在中国区合作伙伴
如果你感兴趣请和我们联系
电话:020-38102730
服务QQ:501747125
邮箱:info@kosterscience.com
地址:广州市天河区体育西路骏汇大厦北塔110 D房
关注微信公众号及时获取最新资讯

 夜雨聆风
夜雨聆风





