文档内容
重庆市 2025 年普通高等学校招生统一考试
化学试题注意事项:
1.答卷前,考生务必将自己的姓名、准考证号等填写在答题卡和试卷指定位置
上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号
涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,
将答案写在答题卡上。写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
4.可能用到的相对原子质量:Se-79 Ag-108 Cl-35.5 I-127 O-16 Na-23
一、选择题:本大题共14小题,每小题3分,共42分,每题给出的四个选项
中,只有一项符合题目要求。
1.抗日战争时期,我国军民同仇敌忾,利用简易装置制作了许多武器,下列制
造过程中涉及氧化还原反应的是
A.用研磨法代替粉碎机碾碎硝化棉 B.在陶缸中使用硫磺制作硫酸
C.用蒸馏法将白酒制取工业酒精 D.用水解法将植物油与熟石灰制备甘
油
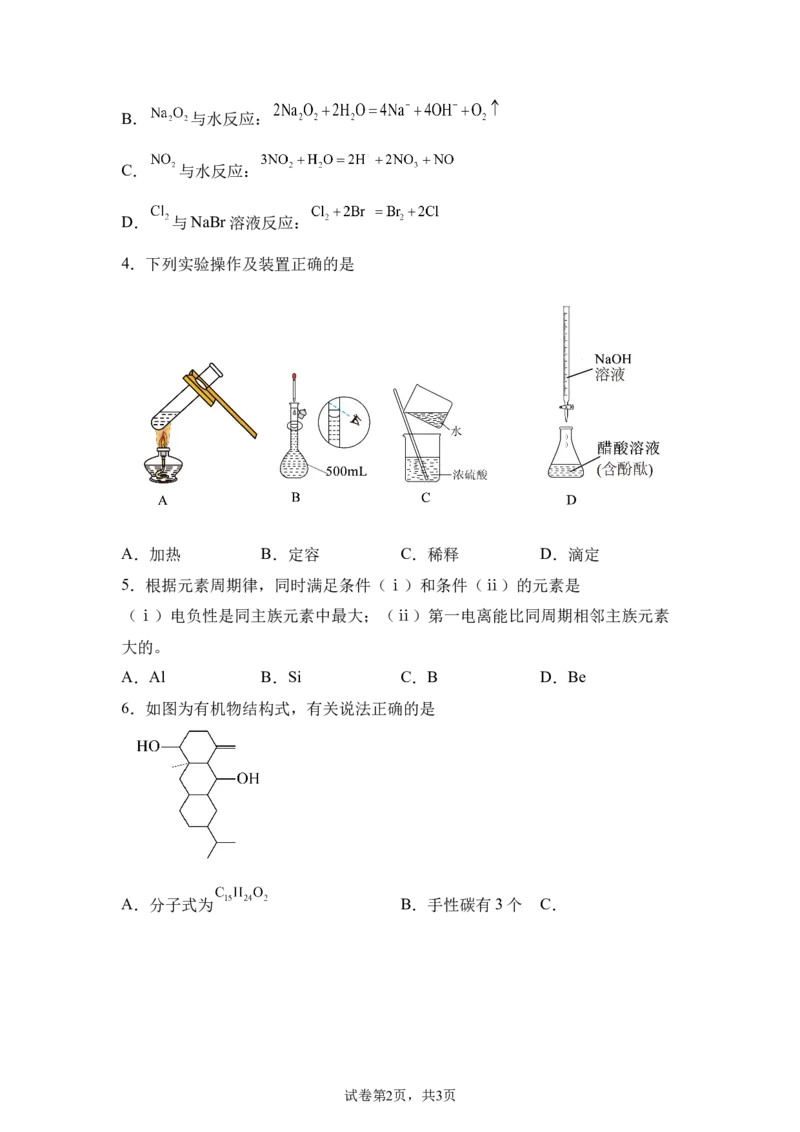
2.下列实验对应物质性质、现象都正确的是
选
性质 现象
项
A 焰色反应 Na、K火焰都是紫色
B 漂白性 、 都可以使物质永久漂白
C 蛋白质变性 醋酸铅和甲醛都能让蛋白质变性
腐蚀印刷电 用氯化铁和浓硫酸在常温下都可以刻
D
路 画电路板
A.A B.B C.C D.D
3.下列有关离子反应错误的是
A.亚硫酸氢钠与石灰水反应:
试卷第1页,共3页B. 与水反应:
C. 与水反应:
D. 与NaBr溶液反应:
4.下列实验操作及装置正确的是
A.加热 B.定容 C.稀释 D.滴定
5.根据元素周期律,同时满足条件(ⅰ)和条件(ⅱ)的元素是
(ⅰ)电负性是同主族元素中最大;(ⅱ)第一电离能比同周期相邻主族元素
大的。
A.Al B.Si C.B D.Be
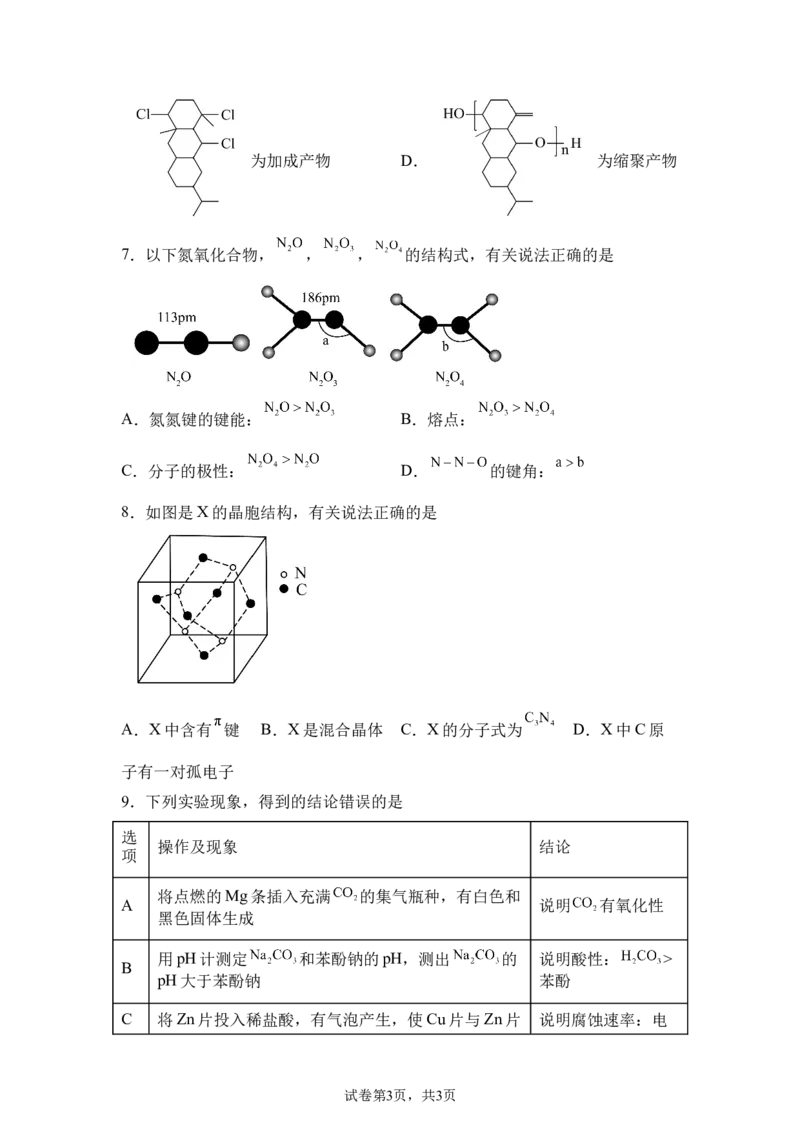
6.如图为有机物结构式,有关说法正确的是
A.分子式为 B.手性碳有3个 C.
试卷第2页,共3页为加成产物 D. 为缩聚产物
7.以下氮氧化合物, , , 的结构式,有关说法正确的是
A.氮氮键的键能: B.熔点:
C.分子的极性: D. 的键角:
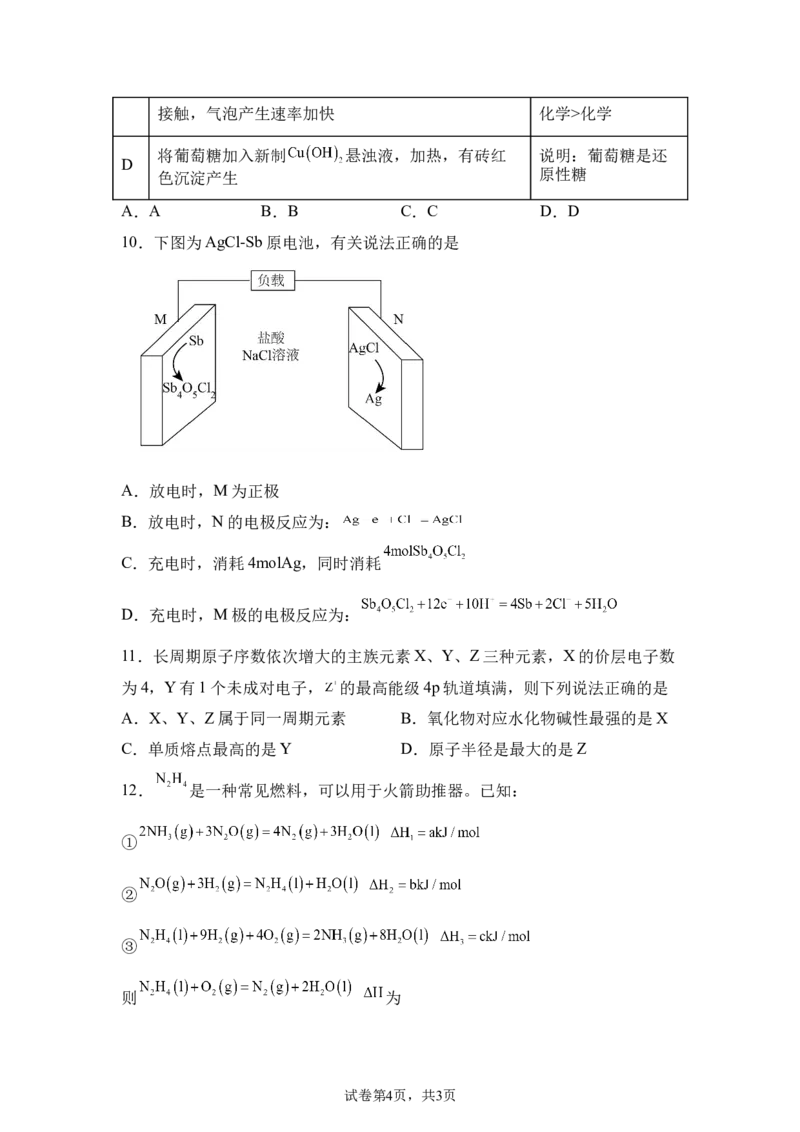
8.如图是X的晶胞结构,有关说法正确的是
A.X中含有 键 B.X是混合晶体 C.X的分子式为 D.X中C原
子有一对孤电子
9.下列实验现象,得到的结论错误的是
选
操作及现象 结论
项
将点燃的Mg条插入充满 的集气瓶种,有白色和
A 说明 有氧化性
黑色固体生成
用pH计测定 和苯酚钠的pH,测出 的 说明酸性: >
B
pH大于苯酚钠 苯酚
C 将Zn片投入稀盐酸,有气泡产生,使Cu片与Zn片 说明腐蚀速率:电
试卷第3页,共3页接触,气泡产生速率加快 化学>化学
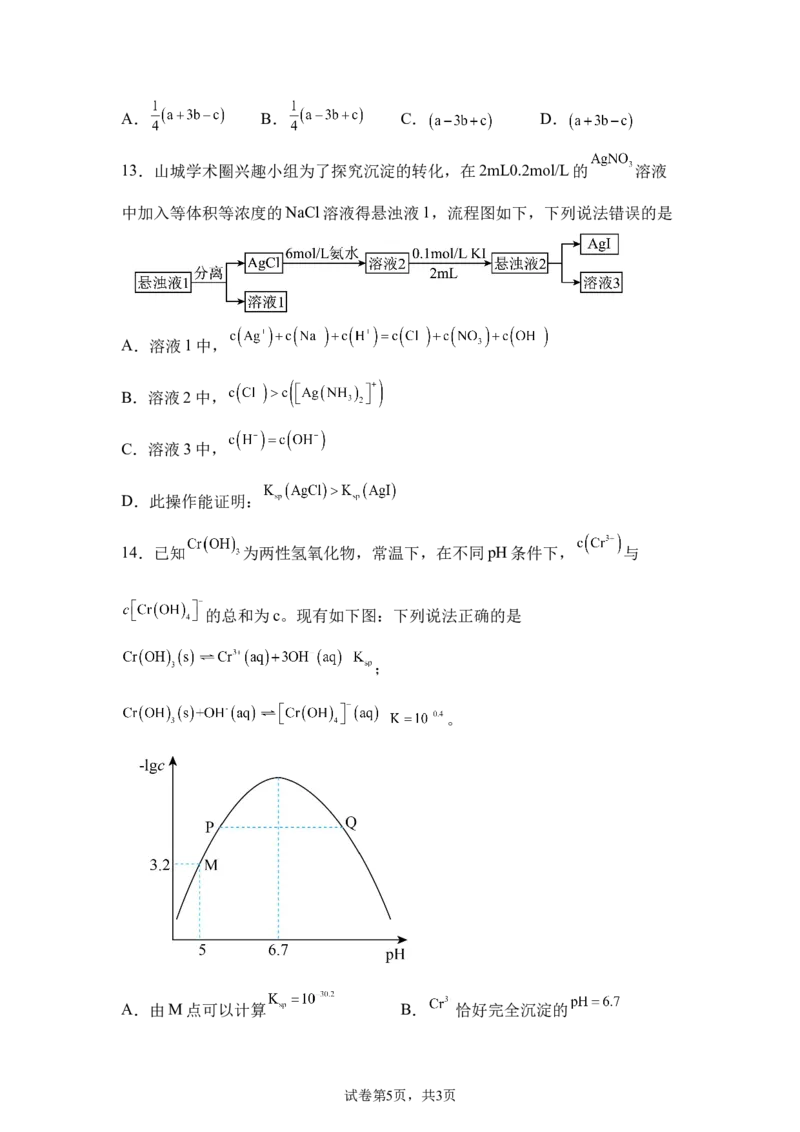
将葡萄糖加入新制 悬浊液,加热,有砖红 说明:葡萄糖是还
D
色沉淀产生 原性糖
A.A B.B C.C D.D
10.下图为AgCl-Sb原电池,有关说法正确的是
A.放电时,M为正极
B.放电时,N的电极反应为:
C.充电时,消耗4molAg,同时消耗
D.充电时,M极的电极反应为:
11.长周期原子序数依次增大的主族元素X、Y、Z三种元素,X的价层电子数
为4,Y有1个未成对电子, 的最高能级4p轨道填满,则下列说法正确的是
A.X、Y、Z属于同一周期元素 B.氧化物对应水化物碱性最强的是X
C.单质熔点最高的是Y D.原子半径是最大的是Z
12. 是一种常见燃料,可以用于火箭助推器。已知:
①
②
③
则 为
试卷第4页,共3页A. B. C. D.
13.山城学术圈兴趣小组为了探究沉淀的转化,在2mL0.2mol/L的 溶液
中加入等体积等浓度的NaCl溶液得悬浊液1,流程图如下,下列说法错误的是
A.溶液1中,
B.溶液2中,
C.溶液3中,
D.此操作能证明:
14.已知 为两性氢氧化物,常温下,在不同pH条件下, 与
的总和为c。现有如下图:下列说法正确的是
;
。
A.由M点可以计算 B. 恰好完全沉淀的
试卷第5页,共3页C.P点溶液质量小于Q点溶液质量 D.随着pH的增大溶液中
比值先增大后减小
二、非选择题:共58分。
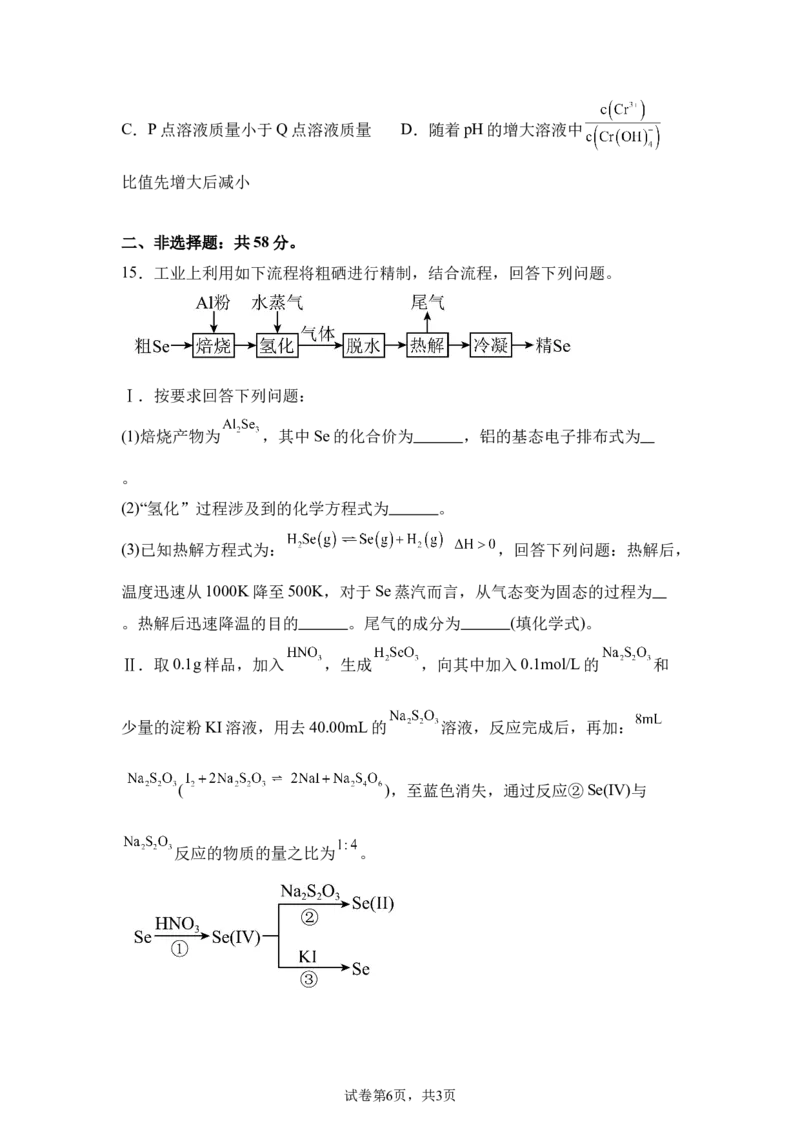
15.工业上利用如下流程将粗硒进行精制,结合流程,回答下列问题。
Ⅰ.按要求回答下列问题:
(1)焙烧产物为 ,其中Se的化合价为 ,铝的基态电子排布式为
。
(2)“氢化”过程涉及到的化学方程式为 。
(3)已知热解方程式为: ,回答下列问题:热解后,
温度迅速从1000K降至500K,对于Se蒸汽而言,从气态变为固态的过程为
。热解后迅速降温的目的 。尾气的成分为 (填化学式)。
Ⅱ.取0.1g样品,加入 ,生成 ,向其中加入0.1mol/L的 和
少量的淀粉KI溶液,用去40.00mL的 溶液,反应完成后,再加:
( ),至蓝色消失,通过反应②Se(IV)与
反应的物质的量之比为 。
试卷第6页,共3页(4)反应③的离子方程式为 。
(5)样品中Se的含量 。
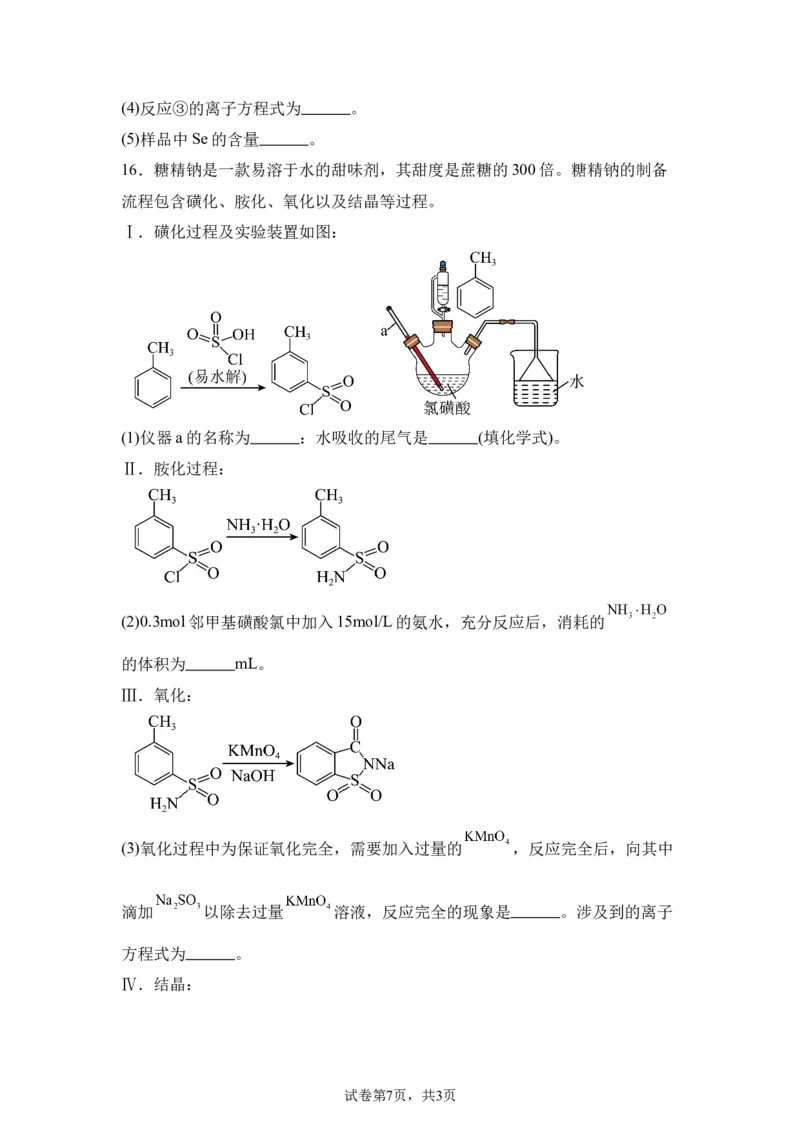
16.糖精钠是一款易溶于水的甜味剂,其甜度是蔗糖的300倍。糖精钠的制备
流程包含磺化、胺化、氧化以及结晶等过程。
Ⅰ.磺化过程及实验装置如图:
(1)仪器a的名称为 :水吸收的尾气是 (填化学式)。
Ⅱ.胺化过程:
(2)0.3mol邻甲基磺酸氯中加入15mol/L的氨水,充分反应后,消耗的
的体积为 mL。
Ⅲ.氧化:
(3)氧化过程中为保证氧化完全,需要加入过量的 ,反应完全后,向其中
滴加 以除去过量 溶液,反应完全的现象是 。涉及到的离子
方程式为 。
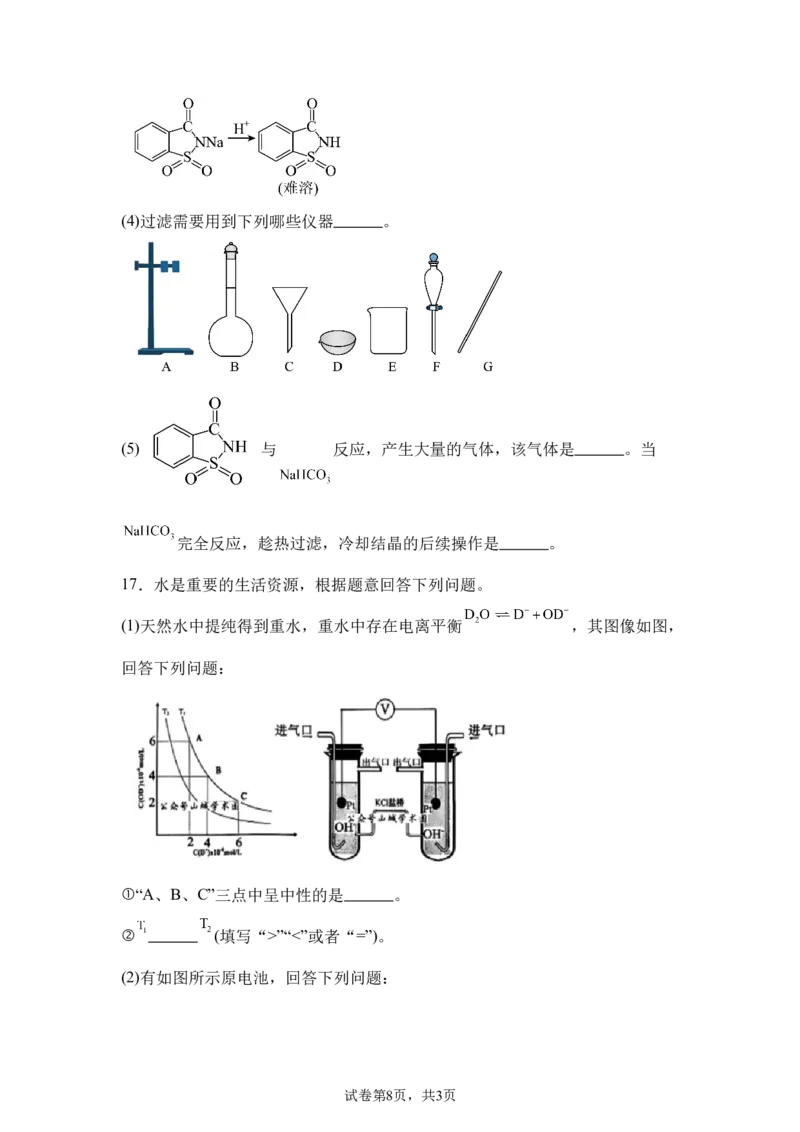
Ⅳ.结晶:
试卷第7页,共3页(4)过滤需要用到下列哪些仪器 。
(5) 与 反应,产生大量的气体,该气体是 。当
完全反应,趁热过滤,冷却结晶的后续操作是 。
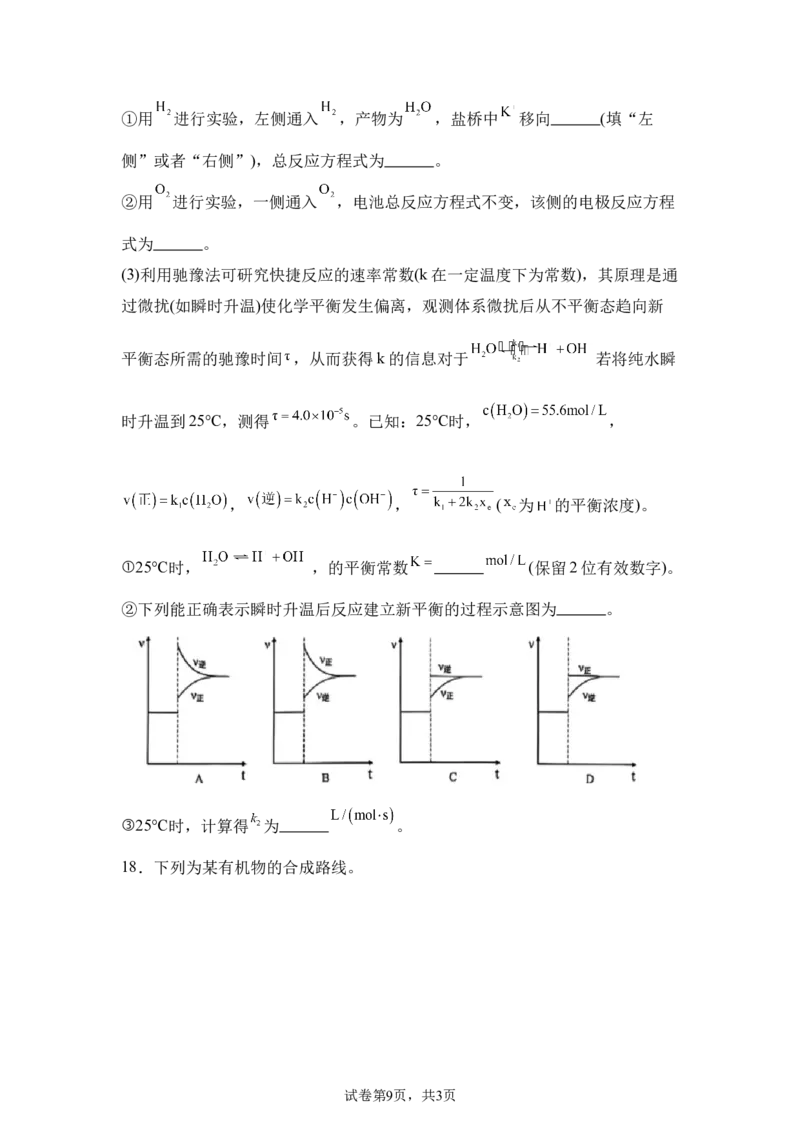
17.水是重要的生活资源,根据题意回答下列问题。
(1)天然水中提纯得到重水,重水中存在电离平衡 ,其图像如图,
回答下列问题:
①“A、B、C”三点中呈中性的是 。
② (填写“>”“<”或者“=”)。
(2)有如图所示原电池,回答下列问题:
试卷第8页,共3页①用 进行实验,左侧通入 ,产物为 ,盐桥中 移向 (填“左
侧”或者“右侧”),总反应方程式为 。
②用 进行实验,一侧通入 ,电池总反应方程式不变,该侧的电极反应方程
式为 。
(3)利用驰豫法可研究快捷反应的速率常数(k在一定温度下为常数),其原理是通
过微扰(如瞬时升温)使化学平衡发生偏离,观测体系微扰后从不平衡态趋向新
平衡态所需的驰豫时间 ,从而获得k的信息对于 若将纯水瞬
时升温到25℃,测得 。已知:25℃时, ,
, , ( 为 的平衡浓度)。
①25℃时, ,的平衡常数 (保留2位有效数字)。
②下列能正确表示瞬时升温后反应建立新平衡的过程示意图为 。
③25℃时,计算得 为 。
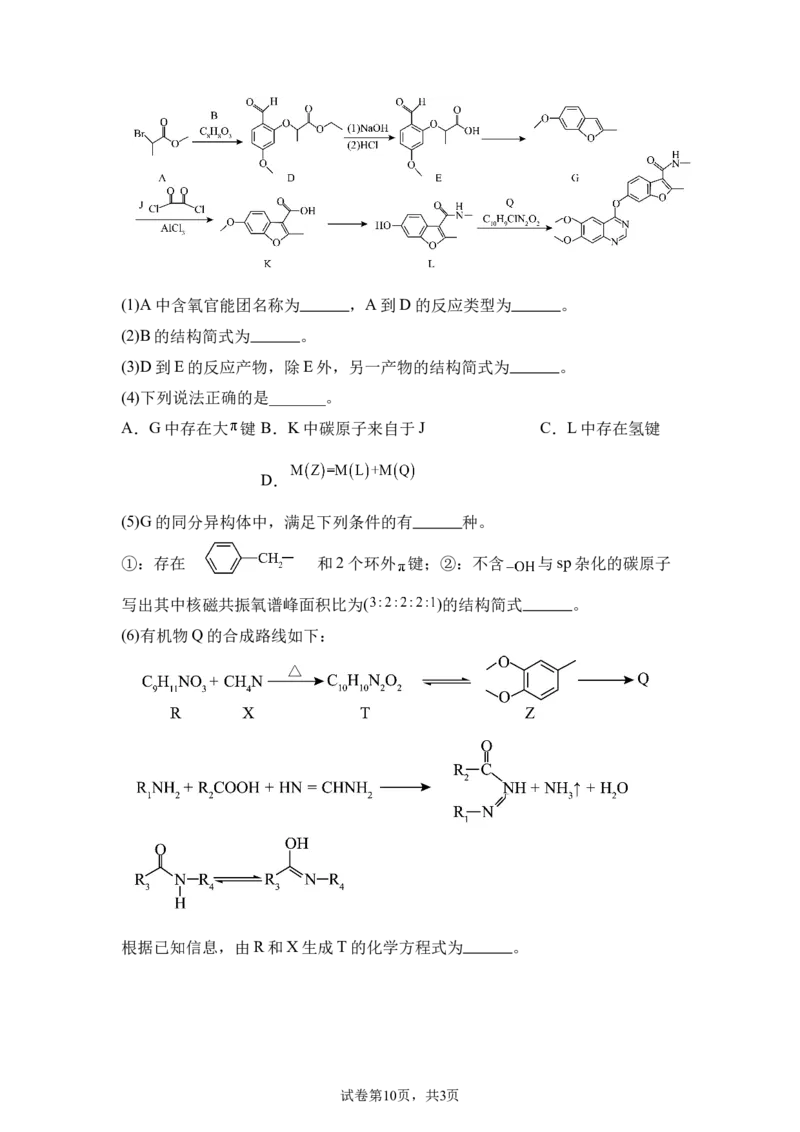
18.下列为某有机物的合成路线。
试卷第9页,共3页(1)A中含氧官能团名称为 ,A到D的反应类型为 。
(2)B的结构简式为 。
(3)D到E的反应产物,除E外,另一产物的结构简式为 。
(4)下列说法正确的是_______。
A.G中存在大 键 B.K中碳原子来自于J C.L中存在氢键
D.
(5)G的同分异构体中,满足下列条件的有 种。
①:存在 和2个环外 键;②:不含 与sp杂化的碳原子
写出其中核磁共振氧谱峰面积比为( )的结构简式 。
(6)有机物Q的合成路线如下:
根据已知信息,由R和X生成T的化学方程式为 。
试卷第10页,共3页1.B
【详解】A.研磨硝化棉是物理粉碎过程,无化合价变化,不涉及氧化还原反应,A错误;
B.硫磺(S)转化为硫酸(HSO )时,硫的化合价从0升至+6,发生氧化反应,涉及氧
2 4
化还原反应,B正确;
C.蒸馏法分离酒精是物理过程,无新物质生成,不涉及氧化还原反应,C错误;
D.植物油水解生成甘油和脂肪酸盐,属于水解反应,无化合价变化,不涉及氧化还原反
应,D错误;
故选B。
2.C
【详解】A.钠的焰色反应为黄色,钾需透过蓝色钴玻璃观察呈紫色,现象描述错误,A
错误;
B. 的漂白是暂时性, 需生成HClO才有漂白性且为永久性,但 本身不直接漂白,
B错误;
C.醋酸铅(重金属盐)和甲醛均能使蛋白质不可逆变性,性质与现象正确,C正确;
D.铜在常温浓硫酸中表现出惰性,加热才能反应,故浓硫酸无法腐蚀铜电路板,而
溶液可以,D错误;
故选C。
3.A
【详解】A.亚硫酸氢钠(NaHSO)与石灰水反应时,HSO 不能拆开,先与OH-中和生
3
成SO ,再与Ca2+结合生成CaSO 沉淀,正确的方程式为:
3
,A方程式错误;
B.NaO 与水反应的离子方程式为2NaO+2H O=4Na++4OH-+O ↑,符合反应实际(生成
2 2 2 2 2 2
NaOH和O),B离子方程式正确;
2
C.NO 与水反应的离子方程式为3NO +H O=2H++2NO-+NO,与化学方程式
2 2 2 3
3NO +H O=2HNO + NO一致,C方程式正确;
2 2 3
D.Cl 与NaBr溶液反应的离子方程式Cl+2Br-=Br +2Cl-,符合氧化还原反应规律(Cl 氧
2 2 2 2
化Br-为Br ),D方程式正确;
2
答案第1页,共2页故选A。
4.A
【详解】A.给试管中的物质加热时,液体体积不能超过试管容积的 ,且用酒精灯外焰
加热,操作合理,A正确;
B.定容时,视线应与刻度线保持水平,操作错误,B错误;
C.稀释浓硫酸应遵循“酸入水”的原则,操作错误,C错误;
D.氢氧化钠溶液呈碱性,应放在碱式滴定管中进行滴定,装置使用错误,D错误;
故选A。
5.D
【详解】A.Al是第ⅢA族元素,同主族中电负性最大的是B,因此Al不满足条件
(i),A错误;
B.Si是第ⅣA族元素,同主族中电负性最大的是C,因此Si不满足条件(i),B错误;
C.B是第ⅢA族元素,电负性在同主族中最大,满足条件(i)。B是ⅢA族元素,同周
期电离能从左往右逐渐增加,但Be是第ⅡA族元素,2p为全空,比较稳定,电离能大于
B,所以B的第一电离能比相邻的Be和C都小,不满足条件(ii),C错误;
D.Be是第ⅡA族元素,电负性在同主族中最大,满足条件(i);Be是第ⅡA族元素,
2p为全空,比较稳定,电离能大于B和Li,所以Be的第一电离能大于同周期相邻主族元
素,满足条件(ii),D正确;
故选D。
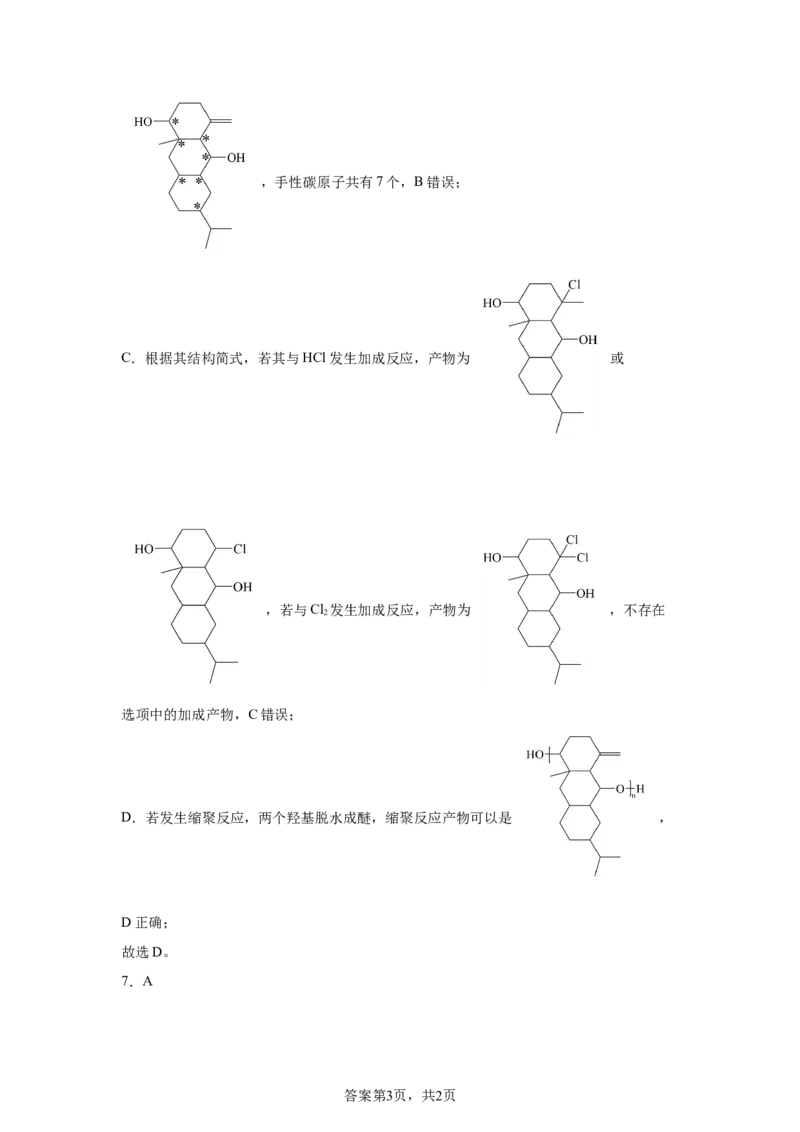
6.D
【详解】A.分子不饱和度为4,碳原子数为19,则氢原子个数为 ,化
学式: ,A错误;
B.连接四个互不相同的原子或原子团的碳原子是手性碳原子,根据该分子结构
答案第2页,共2页,手性碳原子共有7个,B错误;
C.根据其结构简式,若其与HCl发生加成反应,产物为 或
,若与Cl 发生加成反应,产物为 ,不存在
2
选项中的加成产物,C错误;
D.若发生缩聚反应,两个羟基脱水成醚,缩聚反应产物可以是 ,
D正确;
故选D。
7.A
答案第3页,共2页【详解】A.由图中数据可知,氮氮键的键长: ,则氮氮键的键能:
,A正确;
B.二者均为分子构成的物质,分子间作用力: ,熔点: ,B错
误;
C. 为对称的平面结构,极性较弱,而 结构不对称,正负电荷中心不能重合,属
于典型的极性分子,故分子极性:: ,C错误;
D. 结构为 ,中心原子N存在 对孤对电子,中心原子N
为 杂化,受孤对电子影响,键角略小于120°;而 中心原子N的孤对电子为
,价电子数为3,也是 杂化,没有孤对电子的影响,故键角 ,D
错误;
故选A。
8.C
【分析】由图可知,晶胞中C原子的个数是 ,N位于晶胞内部,个数为4,则晶胞
化学式为 ;
【详解】A.C、N均以单键连接,晶胞中不含π键,A错误;
B.晶胞内只存在共价键,不是混合型晶体,B错误;
C.由分析可知,晶胞化学式为 ,C正确;
D.位于面心的C原子,与周围4个氮原子(位于两个晶胞内)相连,其配位数为4,不存在
孤独电子,D错误;
故选C。
9.B
答案第4页,共2页【详解】A.镁与CO 反应中,生成氧化镁和碳单质,CO 提供氧,而且化合价降低,所以
2 2
二氧化碳体现氧化性,A结论正确;
B.用pH计测定等浓度的 和苯酚钠的pH,根据水解原理,碳酸氢根的酸性比苯酚
弱,则碳酸根的水解程度较大,溶液的碱性较强,pH大,所以由现象可得出结论是酸性:
<苯酚,不能直接比较碳酸和苯酚的酸性,而且选项中没有强调碳酸钠和苯酚钠的
浓度是否相等,B结论错误;
C.铜,锌和稀盐酸可形成原电池,加快了反应,所以电化学腐蚀速率更快,C结论正确;
D.葡萄糖与新制的氢氧化铜反应,生成的砖红色沉淀为Cu O,说明氢氧化铜做氧化剂,
2
葡萄糖作还原剂,证明葡萄糖具有还原性,D结论正确;
故选B。
10.D
【分析】由图可知,放电时,N电极上 发生得电子的还原反应,为正极,电极
反应为: ,M电极为负极,电极反应为
,充电时,N为阳极,M为阴极,电极反应与原电
池相反,据此解答。
【详解】A.由分析可知,放电时,M电极为负极,A错误;
B.由分析可知,放电时,N电极反应为: ,B错误;
C.由分析可知,建立电子转移关系式: ,由此可知,消耗
4molAg,同时消耗 ,C错误;
D.充电时,M极为阴极,电极反应与原电池相反:
,D正确;
故选D。
11.D
答案第5页,共2页【分析】X、Y、Z的原子序数依次增大且均为长周期主族元素。X的价层电子数为4
(ⅣA族),Y有1个未成对电子(可能为IA族或ⅦA族), 的4p轨道填满,说明Z
的原子序数为37,即Rb,根据原子序数依次增大,可确定X为Ge,Y为Br,据此解答。
【详解】A.分析可知,X为Ge,Y为Br,Z为Rb,不属于同一周期,A错误;
B.X为Ge,Y为Br,Z为Rb,金属性最强的元素为Rb,所以最高价氧化物对应水化物
碱性最强的是Z,B错误;
C.X为Ge,单质为金属晶体;Y为Br,单质为分子晶体;Z为Rb,单质为金属晶体;Ge
原子半径较小,而且价电子数多,金属键较强,熔点较高,所以单质熔点最高的是X,C
错误;
D.电子层数越多的,原子半径越大,X,Y为第四周期,Z为第五周期,所Z的原子半径
最大,D正确;
故选D。
12.B
【分析】根据目标方程式与原方程式的特点可知,将原方程式进行 (①-3×②+③)变换,
可得目标方程式,所以,ΔH应为 ,据此解答。
【详解】A.选项A的表达式为 ,但根据推导结果,ΔH应为 ,
与A不符,A错误;
B.推导过程中,通过组合反应①、③及反转的反应②×3,得到总ΔH为 ,再除以
4得 ,与选项B一致,B正确;
C.选项C未除以4,直接取 ,不符合目标反应的系数比例,C错误;
D.选项D的表达式为 ,符号和系数均与推导结果不符,D错误;
故选B。
13.C
【分析】在2mL0.2mol/L的 溶液中加入等体积等浓度的NaCl溶液得悬浊液1,经分
离后,向 中滴加6mol/L的氨水,发生反应 ,
答案第6页,共2页加入0.1mol/LKI溶液2mL,发生反应: ,得到
沉淀,由物质的量关系可知, 不能完全反应,溶液3中可能还存在剩
余的氨水以及 ;
【详解】A.溶液1中主要溶质是 ,同时由于存在溶解平衡:
,还存在极少量的 ,选项中满足电荷守恒关系,A
正确;
B.根据元素守恒可知,若 不水解,则 ,但 会水解生成其
他含银的微粒,故 ,B正确;
C.溶液3中可能存在氨水过量的情况,不能得出 的结论,C错误;
D.由实验操作可知,存在转化 ,由此说明AgI更难溶,
故可得出结论 ,D正确;
故选C。
14.A
【分析】 与 的总和为c,随着pH增大,发生反应:
,含铬微粒总浓度下降,随着pH继续增大,发生反应
: 含铬微粒总浓度上升,据此解答。
【详解】A.M点时, , ,
答案第7页,共2页,几乎可以忽略不计,含Cr微粒主要为 ,
,A正确;
B. 恰好完全沉淀时, ,由 数据计算可知,
, 恰好完全沉淀pH最小值5.6,B错误;
C.P和Q点溶液中含Cr微粒总和相等,生成的 质量相等,则P点溶液质量等
于Q点溶液质量,C错误;
D.随着pH的增大, 减小,而 增大, 比值减小,D错误;
故选A。
15.(1)
(2)
(3) 凝华 减少 生成,提高Se产率 ,
(4)
(5)94.8%
【分析】粗Se加入铝粉焙烧得到 ,通入水蒸气氢化得到 ,脱水后热解发生反
应: ,冷凝后得到精Se;
【详解】(1)Al是IIIA族元素,化合价为+3价,则Se化合价为-2价;铝的基态电子排布
式为 ;
答案第8页,共2页(2)“氢化”过程是 与水蒸气反应生成 ,化学方程式为
;
(3)从气态变为固态的过程为凝华;已知热解正向是吸热反应,降温时,为避免平衡逆向
移动,需要迅速冷凝Se蒸汽,故目的是减少 生成,提高Se产率;尾气种含有 以
及少量的 ;
(4)反应③是 被KI还原为Se的过程,离子方程式为:
;
(5)第一次加入40.00mL的 溶液和KI溶液,二者同时做还原剂,将 还原
为Se,第二次再加入同浓度的 滴定上一步生成的碘单质,整个过程相当于48mL
0.1mol/L的 溶液与 反应,根据已知条件Se(IV)与 反应的物质的量
之比为 ,则 ,样品中Se的含量:
。
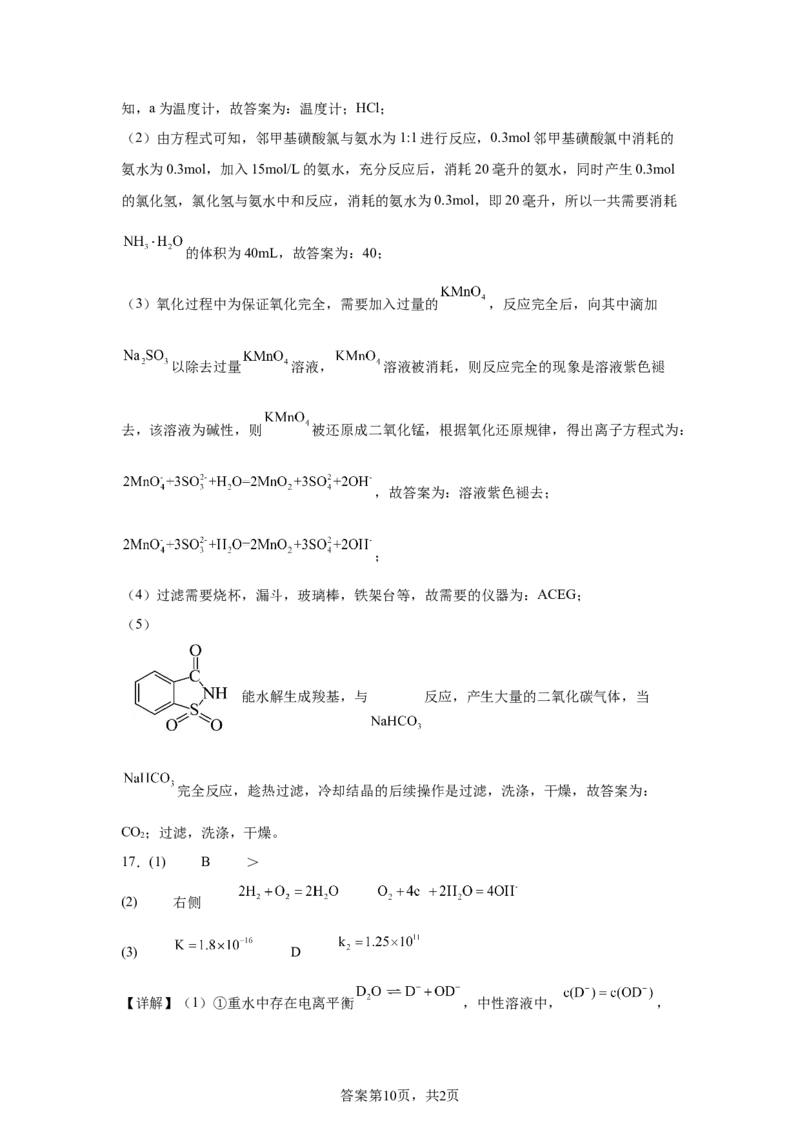
16.(1) 温度计 HCl
(2)40
(3) 溶液紫色褪去
(4)ACEG
(5) 过滤、洗涤、干燥
【详解】(1)由方程式可知,磺化过程中还生成了氯化氢,所以用水来吸收,由装置图可
答案第9页,共2页知,a为温度计,故答案为:温度计;HCl;
(2)由方程式可知,邻甲基磺酸氯与氨水为1:1进行反应,0.3mol邻甲基磺酸氯中消耗的
氨水为0.3mol,加入15mol/L的氨水,充分反应后,消耗20毫升的氨水,同时产生0.3mol
的氯化氢,氯化氢与氨水中和反应,消耗的氨水为0.3mol,即20毫升,所以一共需要消耗
的体积为40mL,故答案为:40;
(3)氧化过程中为保证氧化完全,需要加入过量的 ,反应完全后,向其中滴加
以除去过量 溶液, 溶液被消耗,则反应完全的现象是溶液紫色褪
去,该溶液为碱性,则 被还原成二氧化锰,根据氧化还原规律,得出离子方程式为:
,故答案为:溶液紫色褪去;
;
(4)过滤需要烧杯,漏斗,玻璃棒,铁架台等,故需要的仪器为:ACEG;
(5)
能水解生成羧基,与 反应,产生大量的二氧化碳气体,当
完全反应,趁热过滤,冷却结晶的后续操作是过滤,洗涤,干燥,故答案为:
CO;过滤,洗涤,干燥。
2
17.(1) B >
(2) 右侧
(3) D
【详解】(1)①重水中存在电离平衡 ,中性溶液中, ,
答案第10页,共2页只有B点符合,所以“A、B、C”三点中呈中性的是B点,故答案为:B;
②水的电离平衡为吸热过程,温度升高,电离程度增大, , 均增大,Kw也
增大,由图可知,T 时离子浓度更高,Kw更大,所以 > ,故答案为:>;
1
(2)①用 进行实验,左侧通入 ,产物为 ,电极方程式为: ,
左侧为负极,右侧为正极,电极方程式为 ,在原电池中,正电荷向
正极移动,所以盐桥中 移向正极,即右侧,该电池为燃料电池,原料为氢气和氧气,总
反应方程式为 ,故答案为:右侧; ;
②用 进行实验,一侧通入 ,电池总反应方程式不变,则该电池为氢气和氧气组成的
燃料电池,该侧的电极反应方程式为 ,故答案为:
;
(3)①25℃时,由题意可知, ,达到平衡时 = ,即
= , ,又因为 ,联立方程,
得出 的平衡常数 ,故答案为: ;
②瞬时升温后,逆反应速率增大,但水的浓度是恒定的,正反应速率不变,所以建立新平
衡的过程示意图为D,
③由①联立方程,得出 ,故答案为: 。
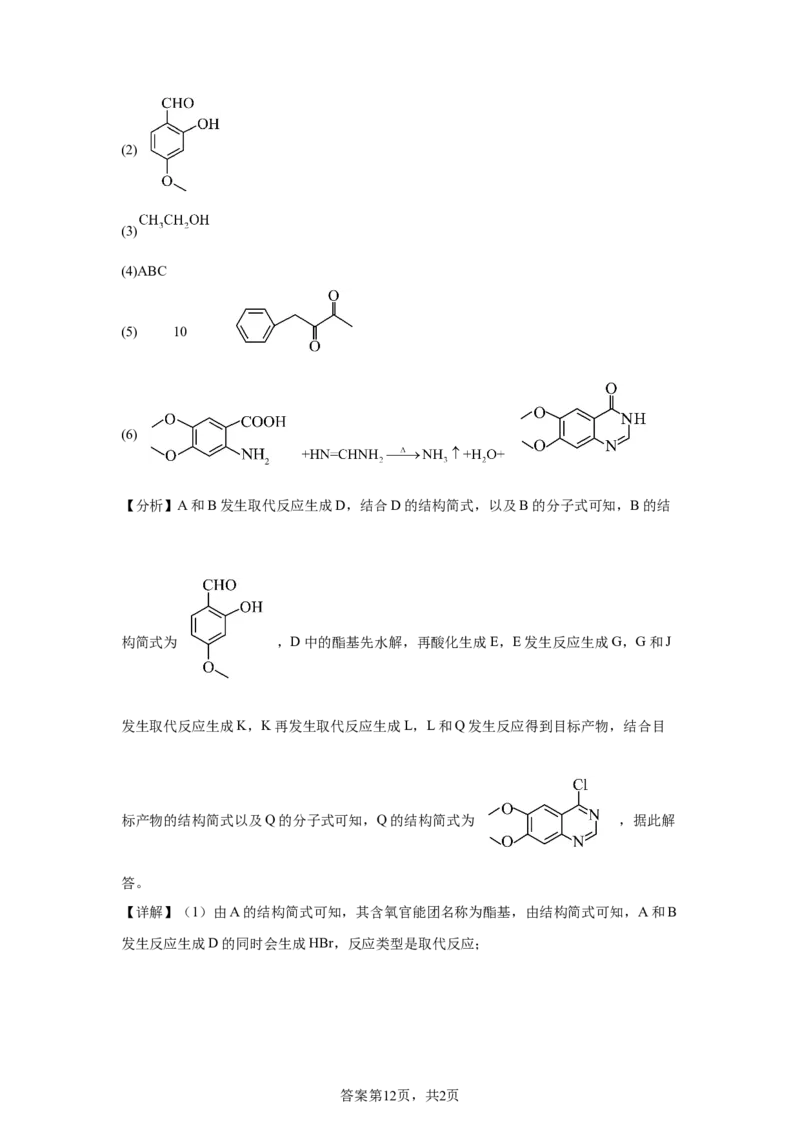
18.(1) 酯基 取代反应
答案第11页,共2页(2)
(3)
(4)ABC
(5) 10
(6)
【分析】A和B发生取代反应生成D,结合D的结构简式,以及B的分子式可知,B的结
构简式为 ,D中的酯基先水解,再酸化生成E,E发生反应生成G,G和J
发生取代反应生成K,K再发生取代反应生成L,L和Q发生反应得到目标产物,结合目
标产物的结构简式以及Q的分子式可知,Q的结构简式为 ,据此解
答。
【详解】(1)由A的结构简式可知,其含氧官能团名称为酯基,由结构简式可知,A和B
发生反应生成D的同时会生成HBr,反应类型是取代反应;
答案第12页,共2页(2)由分析可知,B的结构简式为 ;
(3)D到E先发生酯基的水解以及酸碱中和反应,再酸化生成羧基,另一种产物是乙醇,
结构简式为 ;
(4)A.G中含有苯环,存在大 键,A正确;
B.由G和K的结构简式可知,K中有1个碳原子来自于J,B正确;
C.L中含有羟基和酰胺基,能形成氢键,C正确;
D.L与Q生成Z的反应中,发生的是取代反应,会生成小分子的HCl,因此
,D错误
故选ABC;
(5)G的分子式为 ,不饱和度为6,存在 和2个环外 键,
说明分子中除了苯环外还存在2个双键结构,不含 与sp杂化的碳原子,说明不含有羟
基、羧基、碳碳三键,则苯环的支链可以为:
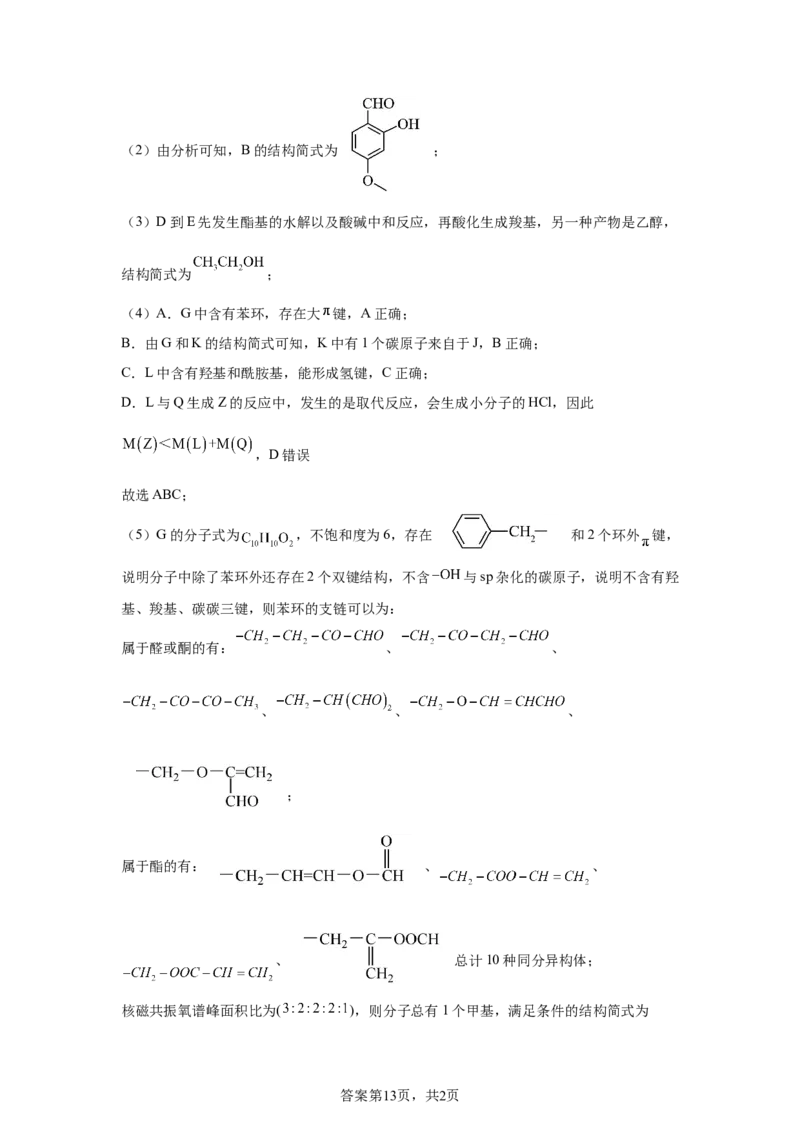
属于醛或酮的有: 、 、
、 、 、
;
属于酯的有: 、 、
、 总计10种同分异构体;
核磁共振氧谱峰面积比为( ),则分子总有1个甲基,满足条件的结构简式为
答案第13页,共2页;
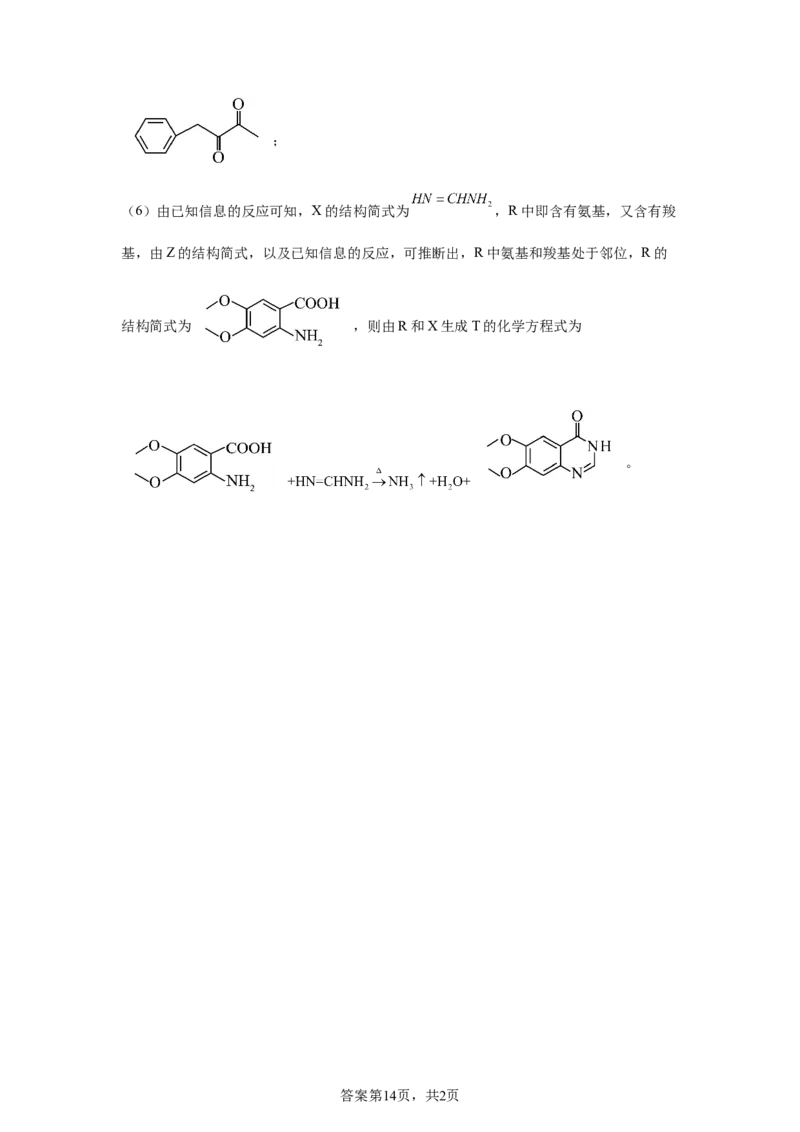
(6)由已知信息的反应可知,X的结构简式为 ,R中即含有氨基,又含有羧
基,由Z的结构简式,以及已知信息的反应,可推断出,R中氨基和羧基处于邻位,R的
结构简式为 ,则由R和X生成T的化学方程式为
。
答案第14页,共2页