文档内容
扬州市 2020 年初中毕业、升学统一考试化学试题
说明:
1.本试卷共6页,包含选择题(第1题一第20题,共20题)、非选择题(第21题一第25题,
共5题)两部分,本卷满分100分,考试时间为100分钟,考试结束后,请将本试卷和答题
卡一并交回。
2.答题前,考生务必将本人的姓名、准考证号填写在答题卡相应的位置上,同时务必在试卷
的装订线内将本人的姓名、准考证号、毕业学校填写好,在试卷第一面的右下角填写好座位
号。
3.所有的试题都必须在专用的“答题卡”上作答,选择题用2B铅笔作答、非选择题在指定位置
用0.5毫米黑色墨水签字笔作答,在试卷成草稿纸上答题无效。
可能用到的相对原子质量:H1 C12 N14 O16 S32 Cl35.5 Fe56 Ca64
选择题
单项选择题:本题包括15小题,每小题2分,共计30分。每小题只有一个选项符合题意。
的
1.糖类又称碳水化合物,是人体所需 重要营养物质,葡萄糖中不含有的元素是
A. 氢 B. 碳 C. 氮 D. 氧
2.扬州拥有众多非物质文化遗产项目,下列过程涉及化学变化的是
A. 玉石雕刻
B. 纸张裁剪
C. 木料打磨
D. 腐乳发酵
3.NaOH可用于造纸和印染工业,NaOH属于A. 单质 B. 酸 C. 碱 D. 盐
4.下列物质由离子构成的是
A. 氢气 B. 氯化钾 C. 金刚石 D. 二氧化碳
5.不同的物质溶于水后会形成酸碱性不同的溶液,下列溶液显酸性的是
A. 食醋 B. 氨水 C. NaCl溶液 D. NaCO 溶液
2 3
6.氧气是空气的主要成分之一。下列说法不正确的是
A. 通常状况下,O 是无色气体
2
B. 相同条件下,O 的密度大于CO 的
2 2
.
C 分离液态空气可获得O
2
D. O 能够支持可燃物的燃烧
2
7.对反应进行分类有助于认识与研究,下列反应属于化合反应的是
A.
B.
C.
D.
8.潜艇供氧的一种反应原理为 ,其中X的化学式是( )
A. Na B. NaO C. NaO D. NaOH
2 2 2
9.培养垃圾分类的好习惯,为改善生活环境作努力,空的塑料矿泉水瓶应投入的垃圾箱上所印标识是
A.
B.C.
D.
10.扬州被誉为“中国运河第一城”,保护水资源是每个公民的责任。下列说法正确的是
A. 河水属于纯净物
B. 明矾可用于自来水的杀菌消毒
C. 生活污水可直接排放入运河
D. 自然界水循环的主要途径是水的三态转化
11.硫酸是一种重要的工业原料,下列说法不正确的是
A. 浓硫酸可用于干燥O
2
B. 浓硫酸可使纸张炭化
C. 实验室可用块状石灰石与稀硫酸制备CO
2
D. 稀硫酸可用于金属表面除锈
12.粗盐提纯实验包含称量,溶解、过滤和蒸发,下列装置和操作能达到实验目的的是
A. 量取10mL水 B. 溶解粗盐
C. 过滤悬浊液 D. 蒸发滤液13.甘油(C HO)具有保湿作用。下列关于甘油的说法不正确的是
3 8 3
A. 由3种元素组成
B. 相对分子质量为( )
C. 碳、氢、氧3种原子的个数比为3:8:3
D. 碳元素的质量分数为
14.根据下列实验操作和现象所得到的结论正确的是
选项 实验操作和现象 结论
A 将铁钉放CuSO 溶液中,铁钉表面析出红色物质 Fe的金属活动性比Cu强
4
B 将燃着的木条伸入集气瓶中,木条熄灭 瓶中气体为CO
2
C 将某布料置于酒精灯火焰上灼烧,闻到烧焦羽毛的气味 该布料中不含蛋白质
D 向某水样中加入适量皂水,振荡,产生白色的垢状物 该水样为软水
A. A B. B C. C D. D
15.某反应前后分子变化的微观示意图如下,下列说法正确的是( )
A. 反应后原子的数目增加
B. 反应后原子的种类增加
C. 反应前后分子的数目不变
D. 反应前后物质的总质量不变
不定项选择题:本题包括5小题,每小题2分,共计10分。每小题只有一个或两个选项符合
题意。若正确答案只有一个选项,多选时,该小题得0分;若正确答案包括两个选项,只选
一个且正确的得1分,选两个且都正确的得满分,但只要选错一个,该小题就得0分。
16.研究金属的冶炼和腐蚀对于合理生产和使用金属有着重要意义。下列说法不正确的是( )
A. 炼铁是将铁的化合物转化为铁单质的过程
B. 炼铁时,固体原料从高炉下方加入,空气从上方通入
C. 铁被腐蚀时发生了铁单质转化为铁的化合物的反应D. 洗净铁制品表面 的油膜能有效防止其腐蚀
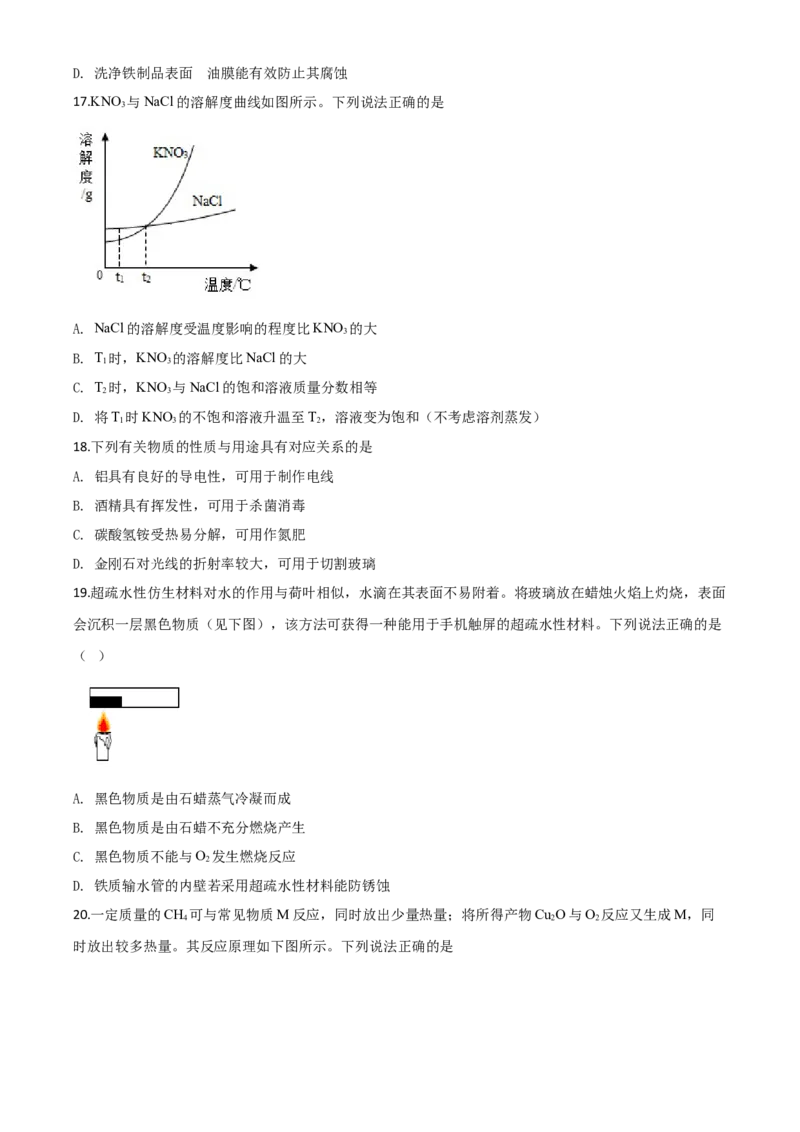
17.KNO 与NaCl的溶解度曲线如图所示。下列说法正确的是
3
A. NaCl的溶解度受温度影响的程度比KNO 的大
3
B. T 时,KNO 的溶解度比NaCl的大
1 3
C. T 时,KNO 与NaCl的饱和溶液质量分数相等
2 3
D. 将T 时KNO 的不饱和溶液升温至T,溶液变为饱和(不考虑溶剂蒸发)
1 3 2
18.下列有关物质的性质与用途具有对应关系的是
A. 铝具有良好的导电性,可用于制作电线
B. 酒精具有挥发性,可用于杀菌消毒
C. 碳酸氢铵受热易分解,可用作氮肥
D. 金刚石对光线的折射率较大,可用于切割玻璃
19.超疏水性仿生材料对水的作用与荷叶相似,水滴在其表面不易附着。将玻璃放在蜡烛火焰上灼烧,表面
会沉积一层黑色物质(见下图),该方法可获得一种能用于手机触屏的超疏水性材料。下列说法正确的是
( )
A. 黑色物质是由石蜡蒸气冷凝而成
B. 黑色物质是由石蜡不充分燃烧产生
C. 黑色物质不能与O 发生燃烧反应
2
D. 铁质输水管的内壁若采用超疏水性材料能防锈蚀
20.一定质量的CH 可与常见物质M反应,同时放出少量热量;将所得产物Cu O与O 反应又生成M,同
4 2 2
时放出较多热量。其反应原理如下图所示。下列说法正确的是A. M中铜元素的质量分数比Cu O中的高
2
B. 理论上反应每生成44gCO,同时生成18gHO
2 2
C. 理论上每16gCH 参与反应,最终消耗64gO
4 2
D. 过程①可将CH 中的部分能量储存于Cu O中
4 2
非选择题
21.扬州既是世界美食之都,更是一座拥有两千多年历史的文化旅游名城。
(1)扬州早点是一张靓丽的城市名片。
①扬州包子面皮如雪。面皮的主要成分为淀粉,淀粉属于_____(填字母)。
A 糖类
B 油脂
C 蛋白质
②大煮干丝富含蛋白质。蛋白质在人体内转化为能被吸收的小分子化合物,这类化合物称为______。
③翡翠烧卖色泽翠润,所用天然色素来自新鲜绿色蔬菜。获取天然色素时,将菜渣与菜汁分离开可采用
_______的方法。
(2)青砖黛瓦诉说着扬州的历史。
①《天工开物》中介组了烧制青砖的方法,其中载有“灌水其上”“水火既济”。相关反应为水蒸气与灼热的
碳生成CO和一种气体单质,其化学方程式为________。
②古代建筑工匠常用糯米灰浆粘合墙砖,糯米灰浆由糯米汁、熟石灰和砂土等混合制成。糯米灰浆属于
_________(填“复合材料”或“金属材料”),熟石灰的化学式为_____,在空气中熟石灰最终转化为_______(填化学式)。
③“帘外芭蕉惹骤雨,门环惹铜绿。”铜绿是铜发生一系列复杂反应的产物,空气中参与该反应过程的物质
有________(填化学式)。
22.空气质量意味着生活质量。
(1)下表为某同学测量的呼吸前后气体组成的实验数据(通常状况).
物质 吸入空气(体积分数/%) 呼出气体(体积分数/%)
氮气 78 75
氧气 21 16
二氧化碳 0.03 4
水蒸气 a b
①氮气的化学性质比较_________(填“稳定”或“活泼”),在呼吸前后没有发生变化,实验中呼出气体的总
体积_________吸入空气的总体积(填“>”“=”或“<”)。
②呼吸时消耗O 产生CO,该过程______能量(填“吸收”或“释放”)。呼吸前后气体中水蒸气含量变化较
2 2
大,实验中其体积分数b_________a(填“>”“=”或“<”)。
(2)汽车多以汽油为燃料,辛烷(C H )是汽油中的一种成分。
8 18
①每114gC H 完全燃烧,需要消耗400gO,生成mgCO 和162gHO,则m=_______g。
8 18 2 2 2
②与完全燃烧相比,等质量的C H 不完全燃烧时会产生CO,消耗O 的质量_______(填“偏大”“相等”或
8 18 2
“偏小”),除污染环境外,燃料不完全燃烧还会产生的问题是_______(写出一种)。
(3)“远在高空是地球卫士,近在身边是健康杀手。”臭氧(O)对环境的作用需辩证地认识。
3
①高空中臭氧层能吸收紫外线,有学者认为,致冷剂氟利昂进入高空大气后会产生氯原子(C1),引发以
下反应: Ⅰ
Ⅱ
Cl加快了上述转化过程总反应的速率,但自身的质量和化学性质在总反应前后没有发生变化,其作用是
_________,该转化过程总反应的化学方程式为__________。
②地面附近的臭氧是一种空气污染物,臭氧属于________(填“单质”或“化合物”),O 可表示一个
3
___________(填“原子”“分子”或“离子”)。
(4)有人提出:你吸入的空气中的某个氧原子可能自于若干年前恐龙的身体。该说法表达的观点是_____
(填字母)。
A 分子聚集形成物质,分子在不停地运动B 在化学变化中原子既不会产生,也不会消失
C 原子内部结构复杂,原子不是构成物质的最小微粒
23.实验室可利用Zn与稀硫酸的反应制取H。
2
(1)用浓硫酸配制稀硫酸的操作为________(填字母),用玻璃棒引流,并不断搅拌。
A 将浓硫酸缓缓注入盛有水的烧杯中
B 水缓缓注入盛有浓硫酸的烧杯中
(2)Zn与稀硫酸反应的化学方程式为___________。
(3)图-1所示的仪器B、D的名称为__________、________,组装制取H 的发生装置应选用的仪器为
2
_________(填字母)。
(4)为收集并准确测量H 的体积,在装入药品前,需检查装置的_______。
2
(5)相同条件下H 密度比空气小,利用该性质可以通过_________法收集H,若用图-2所示装置测量生
2 2
成H 的体积,H 应从____________(填“甲”或“乙”)管通入。
2 2
(6)为探究影响Zn与稀硫酸反应快慢的因素,进行以下三组实验,室温下,取颗粒大小相同的锌粒与足
量的稀硫酸反应,测量产生10mLH(通常状况)所需的时间,下表为实验数据:
2
硫酸的体积/
实验编号 硫酸的质量分数/% 锌粒的质量/g 时间/s
mL
1 10 10 1 78
2 10 10 2 57
3 40 10 1 9
①比较实验1、2的数据,可以得出的结论是________。
②由实验数据可知,该实验中对Zn与稀硫酸反应快慢影响较大的因素是________。
③比较不同条件下锌粒与稀硫酸反应的快慢有不同的方法,除测量产生相同体积的H 所需的时间,还可采
2
用的测量方法是___________(写出一种)。
24.CO 的捕集与资源化利用是化学研究的热点。
2
(1)控制CO 的排放,是为了减缓_________效应,加压水洗法可捕集CO,是因为压强增大时CO 在水
2 2 2中的溶解度_______(填“增大”“不变”或“减小”)。
的
(2)石灰石循环法可用于捕集烟气中 CO,该方法以CaO捕集CO,将所得产物在高温下煅烧可重新获
2 2
得CaO,高温煅烧时反应的化学方程式为_______,生成的CaO疏松多孔,结构与活性炭相似,其在捕集
过程中对CO 具有良好的_________性。
2
(3)对CO 气体加压,降温,可获得干冰,从构成物质的微粒视角分析,该过程主要改变的是_______。
2
干冰能用于人工降雨,是因为______。
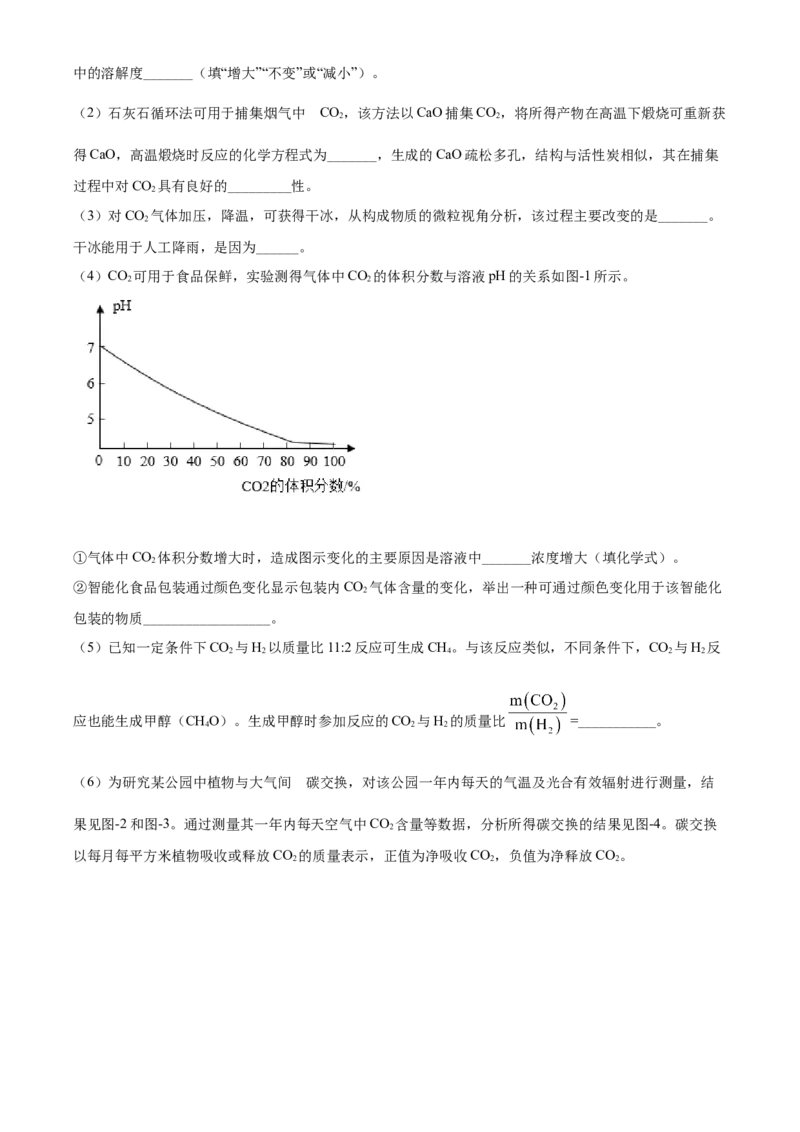
(4)CO 可用于食品保鲜,实验测得气体中CO 的体积分数与溶液pH的关系如图-1所示。
2 2
①气体中CO 体积分数增大时,造成图示变化的主要原因是溶液中_______浓度增大(填化学式)。
2
②智能化食品包装通过颜色变化显示包装内CO 气体含量的变化,举出一种可通过颜色变化用于该智能化
2
包装的物质__________________。
(5)已知一定条件下CO 与H 以质量比11:2反应可生成CH。与该反应类似,不同条件下,CO 与H 反
2 2 4 2 2
应也能生成甲醇(CHO)。生成甲醇时参加反应的CO 与H 的质量比 =___________。
4 2 2
的
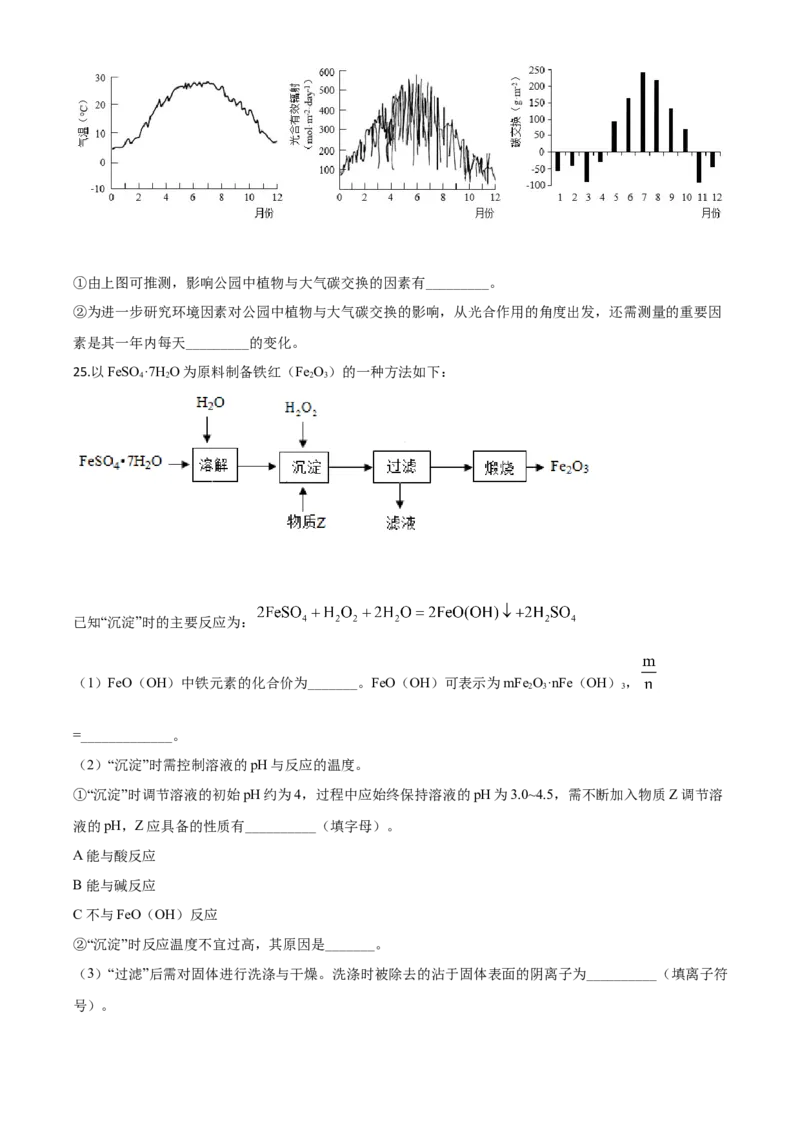
(6)为研究某公园中植物与大气间 碳交换,对该公园一年内每天的气温及光合有效辐射进行测量,结
果见图-2和图-3。通过测量其一年内每天空气中CO 含量等数据,分析所得碳交换的结果见图-4。碳交换
2
以每月每平方米植物吸收或释放CO 的质量表示,正值为净吸收CO,负值为净释放CO。
2 2 2①由上图可推测,影响公园中植物与大气碳交换的因素有_________。
②为进一步研究环境因素对公园中植物与大气碳交换的影响,从光合作用的角度出发,还需测量的重要因
素是其一年内每天_________的变化。
25.以FeSO ·7H O为原料制备铁红(Fe O)的一种方法如下:
4 2 2 3
已知“沉淀”时的主要反应为:
(1)FeO(OH)中铁元素的化合价为_______。FeO(OH)可表示为mFe O·nFe(OH),
2 3 3
=_____________。
(2)“沉淀”时需控制溶液的pH与反应的温度。
①“沉淀”时调节溶液的初始pH约为4,过程中应始终保持溶液的pH为3.0~4.5,需不断加入物质Z调节溶
液的pH,Z应具备的性质有__________(填字母)。
A 能与酸反应
B 能与碱反应
C 不与FeO(OH)反应
②“沉淀”时反应温度不宜过高,其原因是_______。
(3)“过滤”后需对固体进行洗涤与干燥。洗涤时被除去的沾于固体表面的阴离子为__________(填离子符
号)。(4)“煅烧”时反应的化学方程式为________。
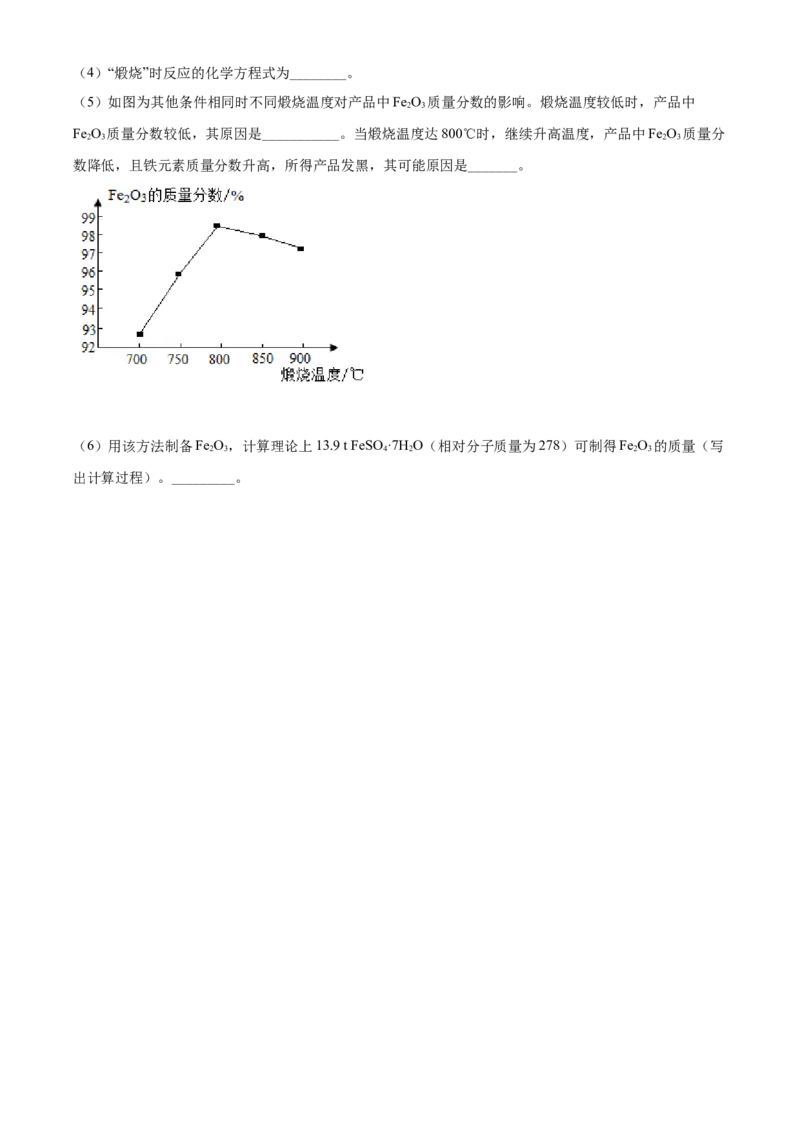
(5)如图为其他条件相同时不同煅烧温度对产品中Fe O 质量分数的影响。煅烧温度较低时,产品中
2 3
Fe O 质量分数较低,其原因是___________。当煅烧温度达800℃时,继续升高温度,产品中Fe O 质量分
2 3 2 3
数降低,且铁元素质量分数升高,所得产品发黑,其可能原因是_______。
(6)用该方法制备Fe O,计算理论上13.9 t FeSO ·7H O(相对分子质量为278)可制得Fe O 的质量(写
2 3 4 2 2 3
出计算过程)。_________。本试卷的题干、答案和解析均由组卷网(http://zujuan.xkw.com)专业教师团队编校出品。
登录组卷网可对本试卷进行单题组卷、细目表分析、布置作业、举一反三等操作。
试卷地址:在组卷网浏览本卷
组卷网是学科网旗下的在线题库平台,覆盖小初高全学段全学科、超过900万精品解析试题。
关注组卷网服务号,可使用移动教学助手功能(布置作业、线上考试、加入错题本、错题训练)。
学科网长期征集全国最新统考试卷、名校试卷、原创题,赢取丰厚稿酬,欢迎合作。
钱老师 QQ:537008204 曹老师 QQ:713000635