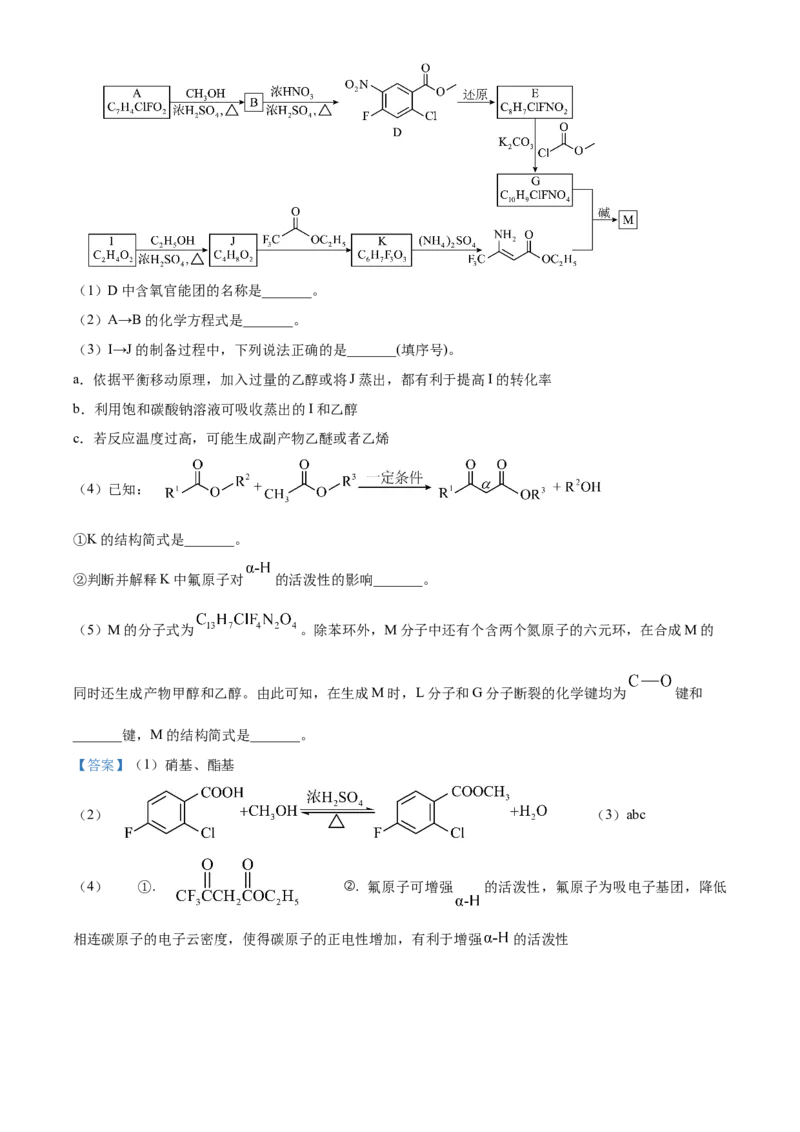
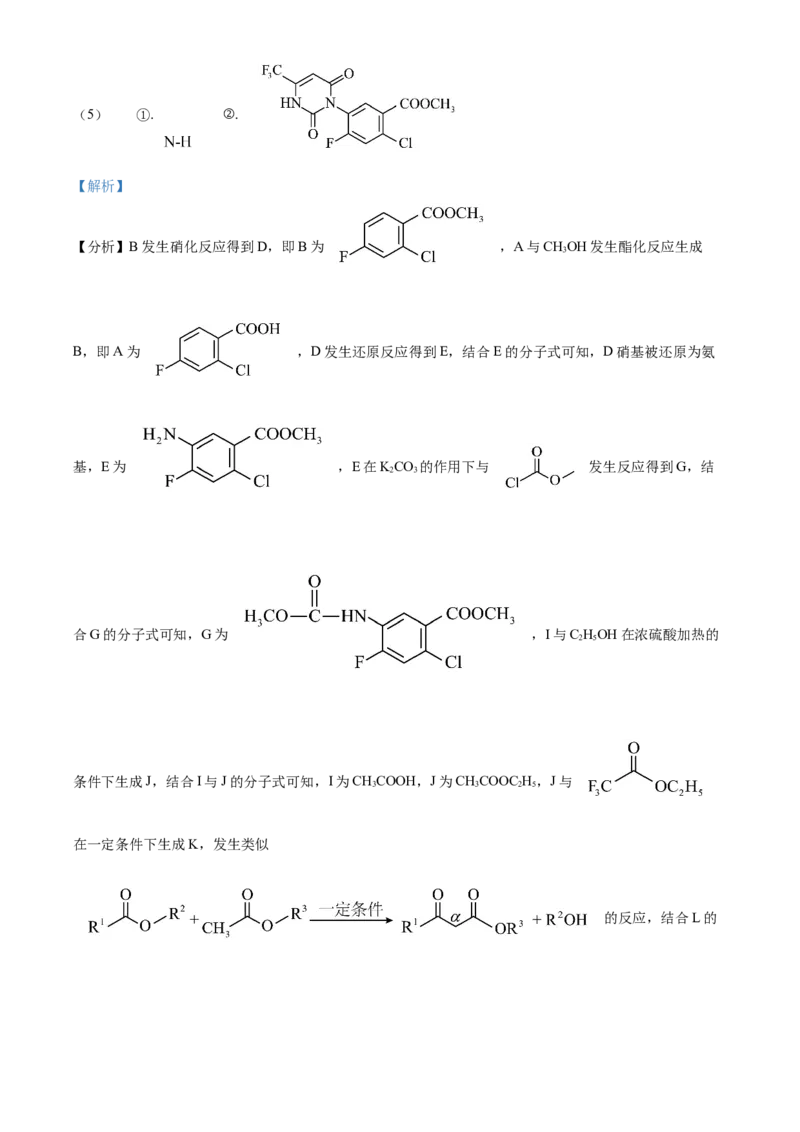
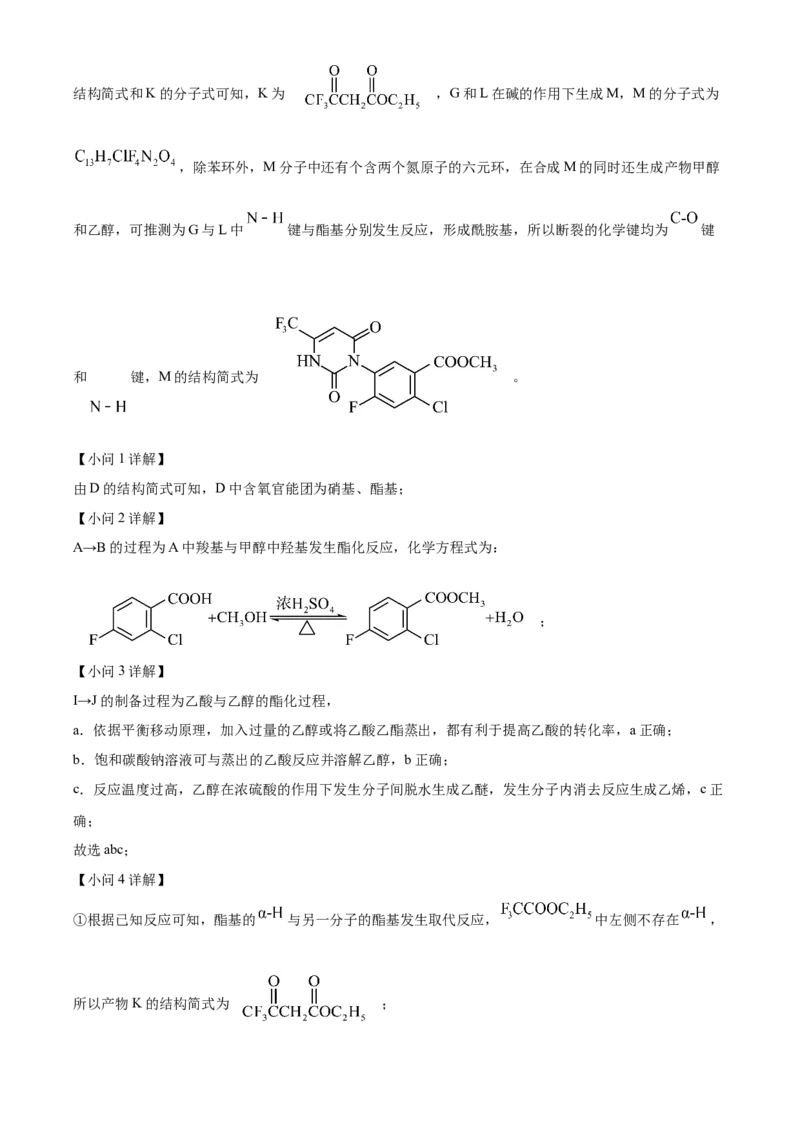
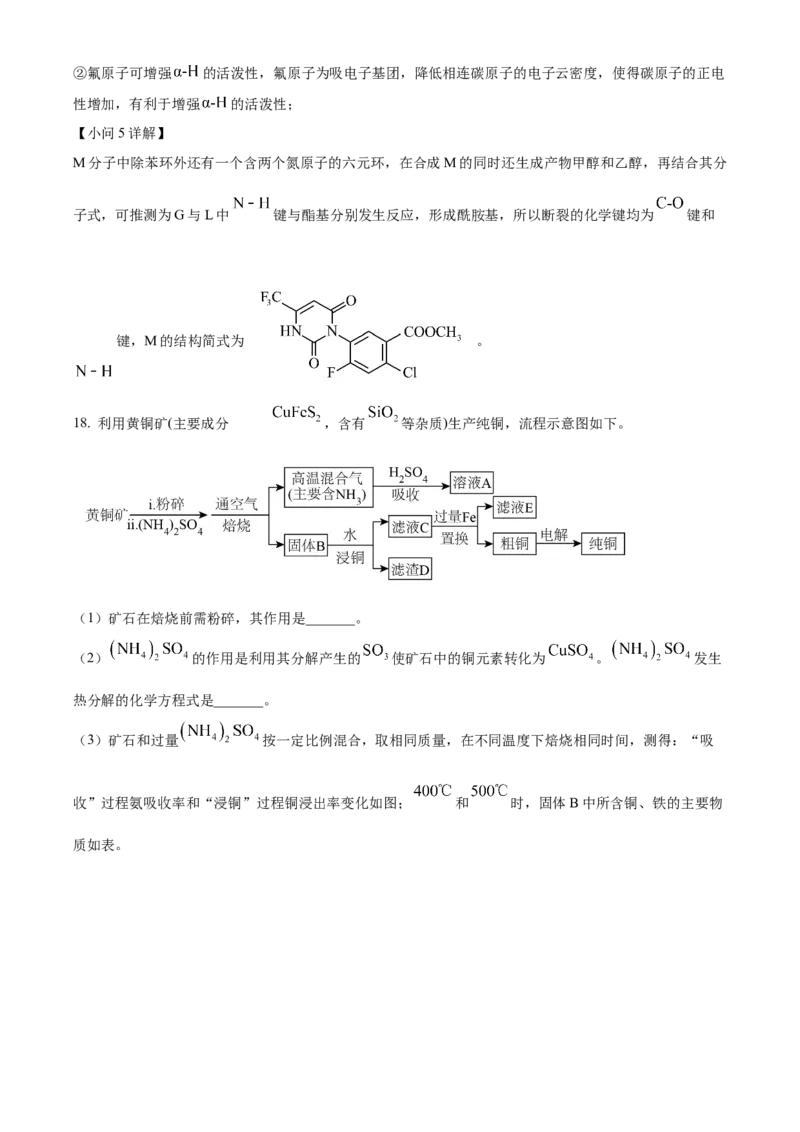
文档内容
2024 年普通高中学业水平等级性考试(北京卷)
化学
本试卷满分100分,考试时间90分钟。
可能用到的相对原子质量:
第一部分
本部分共14题,每题3分,共42分。在每题列出的四个选项中,选出最符合题目要求的一
项。
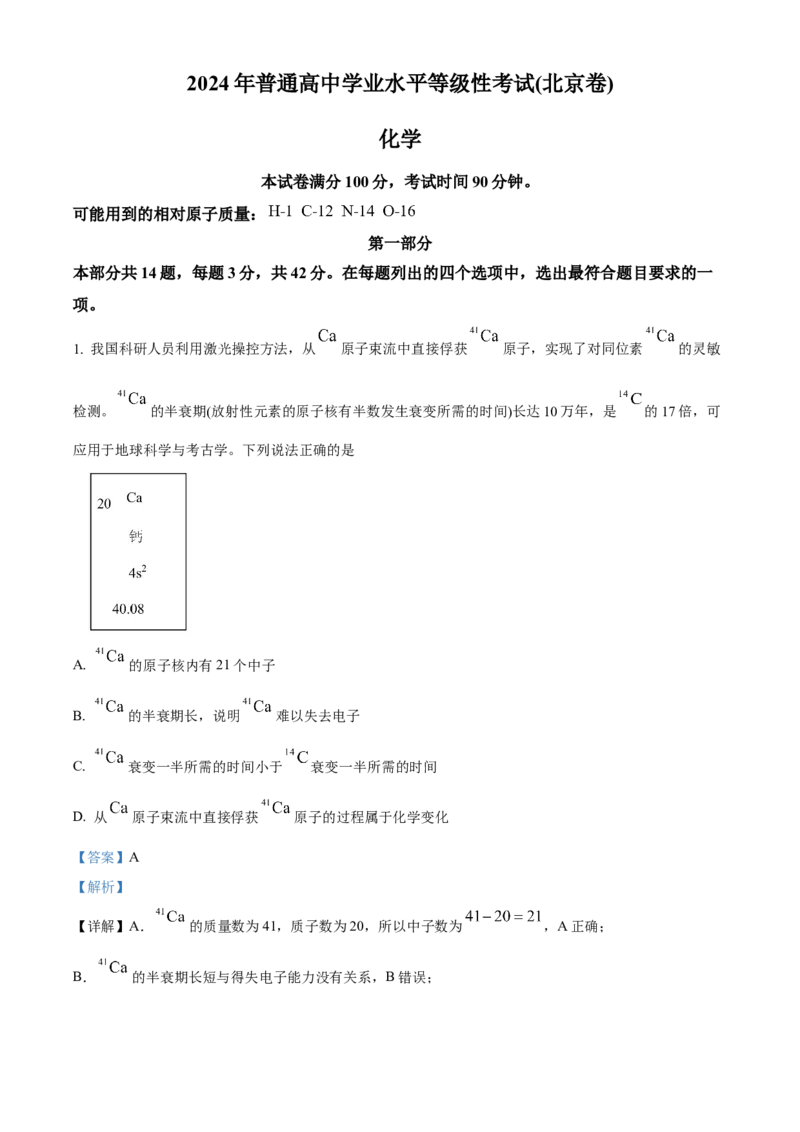
1. 我国科研人员利用激光操控方法,从 原子束流中直接俘获 原子,实现了对同位素 的灵敏
检测。 的半衰期(放射性元素的原子核有半数发生衰变所需的时间)长达10万年,是 的17倍,可
应用于地球科学与考古学。下列说法正确的是
A. 的原子核内有21个中子
B. 的半衰期长,说明 难以失去电子
C. 衰变一半所需的时间小于 衰变一半所需的时间
D. 从 原子束流中直接俘获 原子的过程属于化学变化
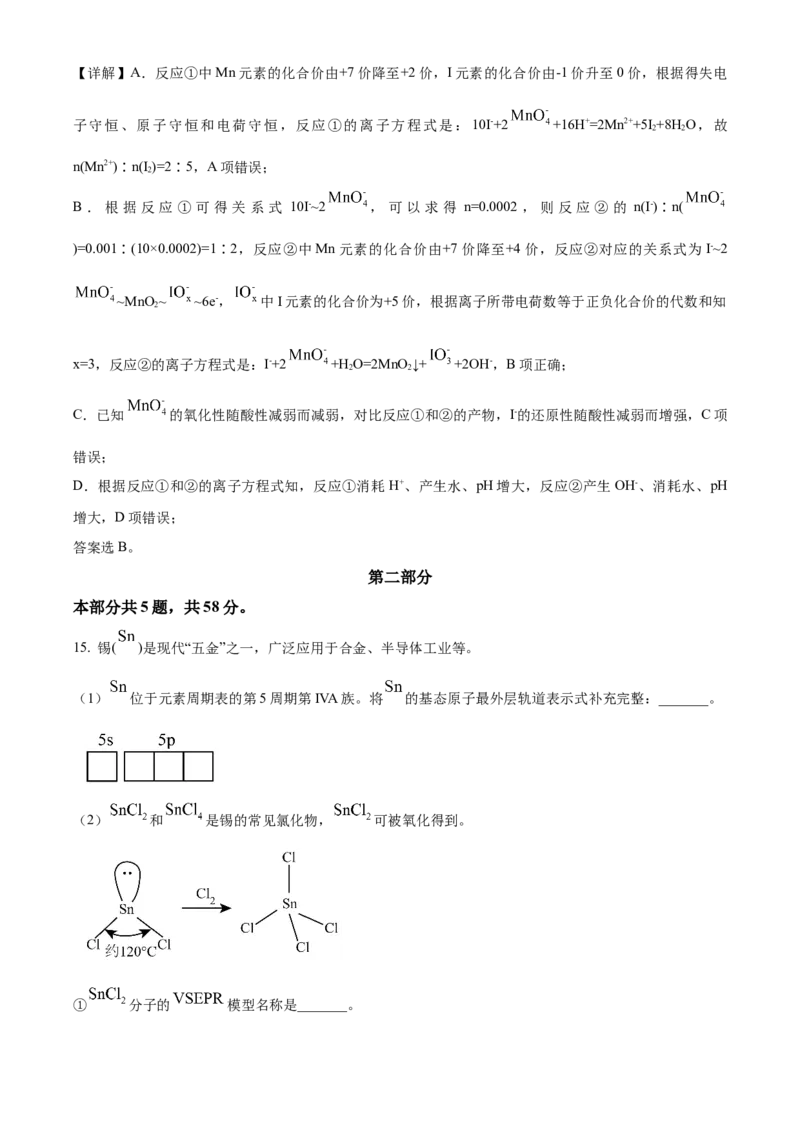
【答案】A
【解析】
【详解】A. 的质量数为41,质子数为20,所以中子数为 ,A正确;
B. 的半衰期长短与得失电子能力没有关系,B错误;C.根据题意 衰变一半所需的时间要大于 衰变半所需的时间,C错误;
D.从 原子束流中直接俘获 原子的过程没有新物质产生,不属于化学变化,D错误;
本题选A。
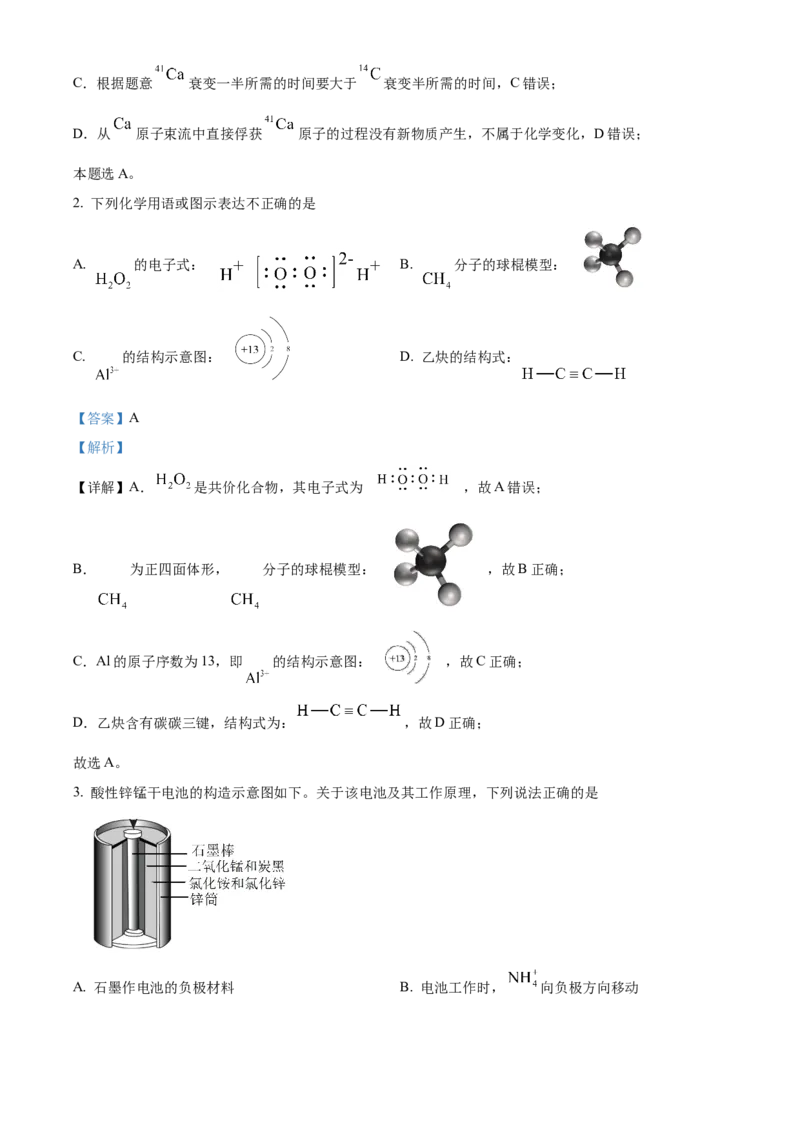
2. 下列化学用语或图示表达不正确的是
A. 的电子式: B. 分子的球棍模型:
C. 的结构示意图: D. 乙炔的结构式:
【答案】A
【解析】
【详解】A. 是共价化合物,其电子式为 ,故A错误;
B. 为正四面体形, 分子的球棍模型: ,故B正确;
C.Al的原子序数为13,即 的结构示意图: ,故C正确;
D.乙炔含有碳碳三键,结构式为: ,故D正确;
故选A。
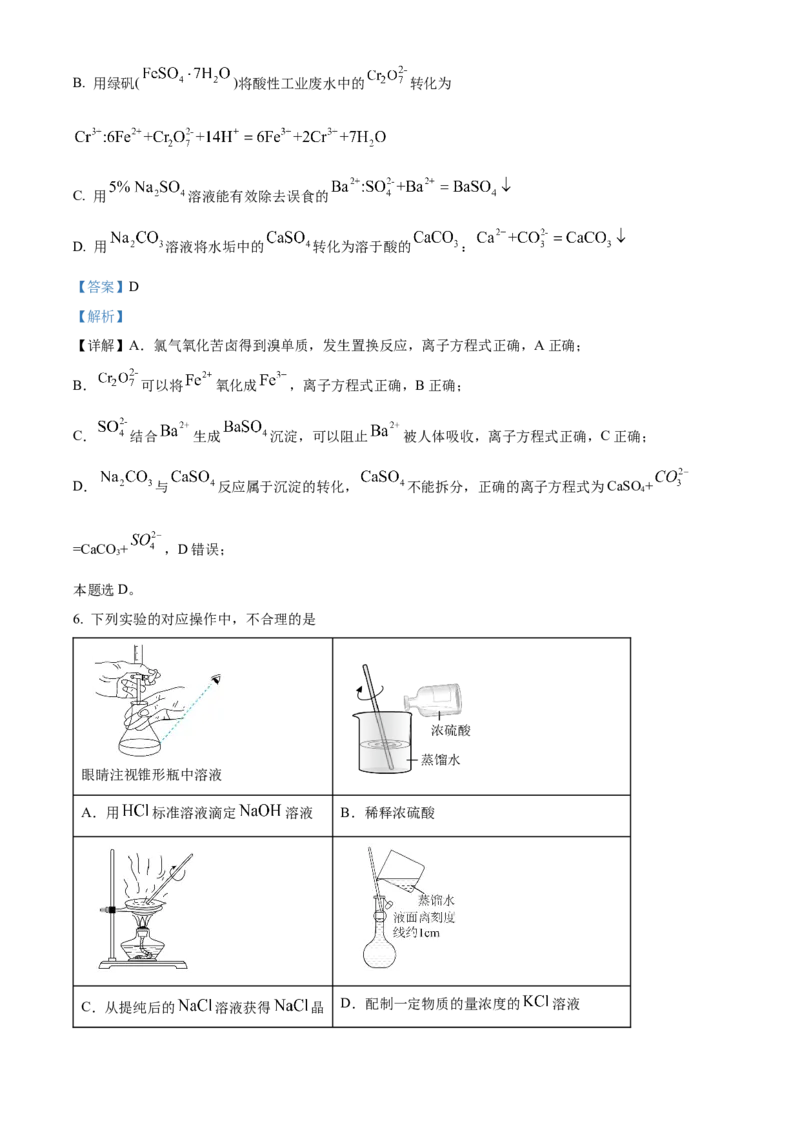
3. 酸性锌锰干电池的构造示意图如下。关于该电池及其工作原理,下列说法正确的是
A. 石墨作电池的负极材料 B. 电池工作时, 向负极方向移动C. 发生氧化反应 D. 锌筒发生的电极反应为
【答案】D
【解析】
【详解】A.酸性锌锰干电池,锌筒为负极,石墨电极为正极,故A错误;
B.原电池工作时,阳离子向正极(石墨电极)方向移动,故B错误;
C. 发生得电子的还原反应,故C错误;
D.锌筒为负极,负极发生失电子的氧化反应 ,故D正确;
故选D。
4. 下列说法不正确的是
A. 葡萄糖氧化生成 和 的反应是放热反应
B. 核酸可看作磷酸、戊糖和碱基通过一定方式结合而成的生物大分子
C. 由氨基乙酸形成的二肽中存在两个氨基和两个羧基
D. 向饱和的 溶液中加入少量鸡蛋清溶液会发生盐析
【答案】C
【解析】
【详解】A.葡萄糖氧化生成CO 和HO是放热反应,在人体内葡萄糖缓慢氧化成CO 和HO为人体提供
2 2 2 2
能量,A项正确;
B.核酸是一种生物大分子,分析核酸水解的产物可知,核酸是由许多核苷酸单体形成的聚合物,核苷酸
进一步水解得到磷酸和核苷,核苷进一步水解得到戊糖和碱基,故核酸可看作磷酸、戊糖和碱基通过一定
方式结合而成的生物大分子,B项正确;
C.氨基乙酸的结构简式为HNCH COOH,形成的二肽的结构简式为HNCH CONHCH COOH,该二肽中
2 2 2 2 2
含1个氨基、1个羧基和1个肽键,C项错误;
D.鸡蛋清溶液为蛋白质溶液,NaCl溶液属于轻金属盐溶液,向饱和NaCl溶液中加入少量鸡蛋清溶液,
蛋白质发生盐析,D项正确;
答案选C。
的
5. 下列方程式与所给事实不相符 是
A. 海水提溴过程中,用氯气氧化苦卤得到溴单质:B. 用绿矾( )将酸性工业废水中的 转化为
C. 用 溶液能有效除去误食的
D. 用 溶液将水垢中的 转化为溶于酸的 :
【答案】D
【解析】
【详解】A.氯气氧化苦卤得到溴单质,发生置换反应,离子方程式正确,A正确;
B. 可以将 氧化成 ,离子方程式正确,B正确;
C. 结合 生成 沉淀,可以阻止 被人体吸收,离子方程式正确,C正确;
D. 与 反应属于沉淀的转化, 不能拆分,正确的离子方程式为CaSO+
4
=CaCO + ,D错误;
3
本题选D。
6. 下列实验的对应操作中,不合理的是
眼睛注视锥形瓶中溶液
A.用 标准溶液滴定 溶液 B.稀释浓硫酸
C.从提纯后的 溶液获得 晶 D.配制一定物质的量浓度的 溶液体
A. A B. B C. C D. D
【答案】D
【解析】
【详解】A.用HCl标准溶液滴定NaOH溶液时,眼睛应注视锥形瓶中溶液,以便观察溶液颜色的变化从
而判断滴定终点,A项合理;
B.浓硫酸的密度比水的密度大,浓硫酸溶于水放热,故稀释浓硫酸时应将浓硫酸沿烧杯内壁缓慢倒入盛
水的烧杯中,并用玻璃棒不断搅拌,B项合理;
C.NaCl的溶解度随温度升高变化不明显,从NaCl溶液中获得NaCl晶体采用蒸发结晶的方法,C项合理;
D.配制一定物质的量浓度的溶液时,玻璃棒引流低端应该在容量瓶刻度线以下;定容阶段,当液面在刻
度线以下约1cm时,应改用胶头滴管滴加蒸馏水,D项不合理;
答案选D。
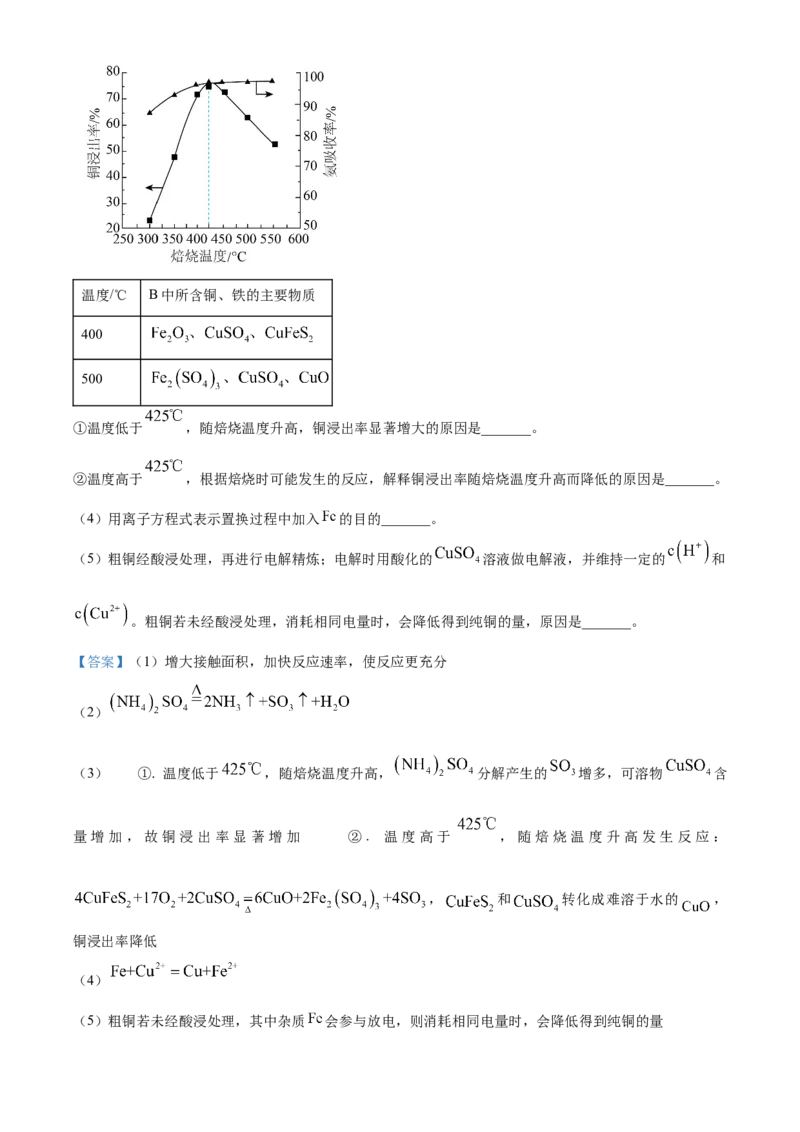
7. 硫酸是重要化工原料,工业生产制取硫酸的原理示意图如下。
下列说法不正确的是
A. I的化学方程式:
B. Ⅱ中的反应条件都是为了提高 平衡转化率
C. 将黄铁矿换成硫黄可以减少废渣的产生
D. 生产过程中产生的尾气可用碱液吸收
【答案】B
【解析】
【分析】黄铁矿和空气中的O 在加热条件下发生反应,生成SO 和Fe O,SO 和空气中的O 在
2 2 3 4 2 2
400~500℃、常压、催化剂的作用下发生反应得到SO ,用98.3%的浓硫酸吸收SO ,得到HSO 。
3 3 2 4
【详解】A.反应I是黄铁矿和空气中的O 在加热条件下发生反应,生成SO 和Fe O,化学方程式:
2 2 3 4
,故A正确;
B.反应Ⅱ条件要兼顾平衡转化率和反应速率,还要考虑生产成本,如Ⅱ中“常压、催化剂”不是为了提高平衡转化率,故B错误;
C.将黄铁矿换成硫黄,则不再产生 ,即可以减少废渣产生,故C正确;
D.硫酸工业产生的尾气为 、 ,可以用碱液吸收,故D正确;
故选B。
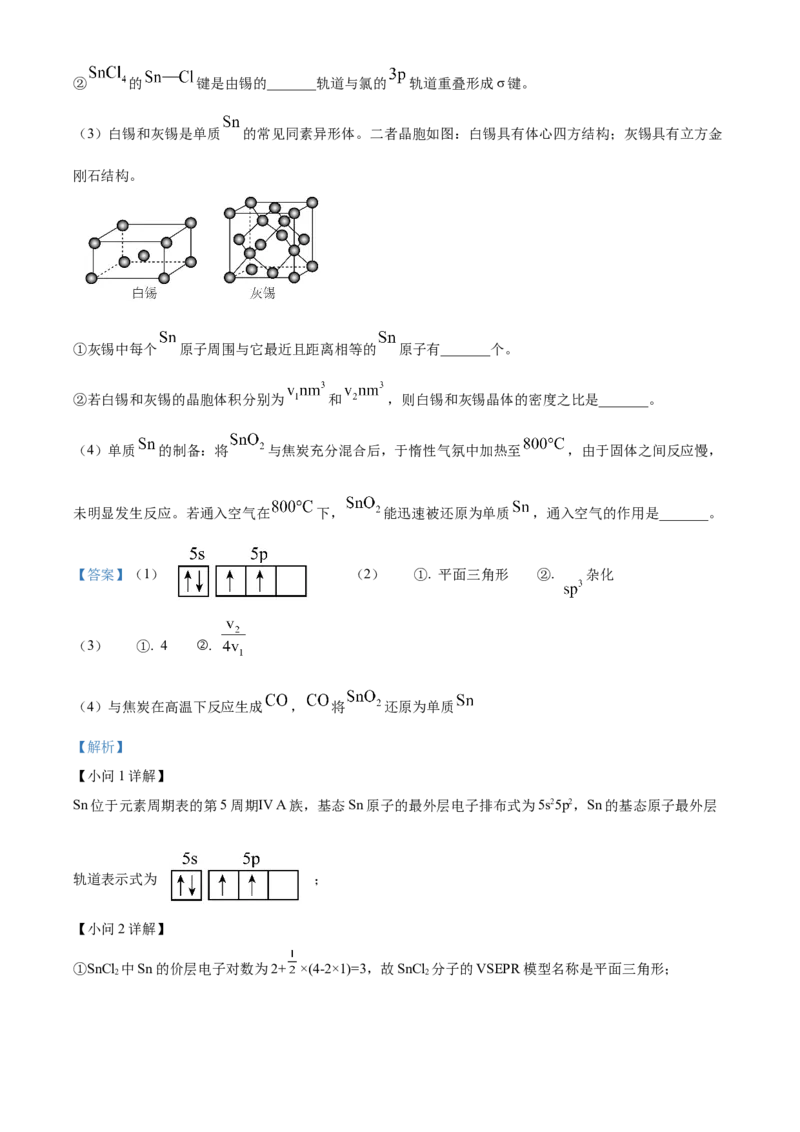
8. 关于 和 的下列说法中,不正确的是
A. 两种物质的溶液中,所含微粒的种类相同
B. 可用 溶液使 转化为
C. 利用二者热稳定性差异,可从它们的固体混合物中除去
D. 室温下,二者饱和溶液的 差约为4,主要是由于它们的溶解度差异
【答案】D
【解析】
【详解】A. 和 的溶液中均存在 、 、 、 、 、 、 ,
A正确;
B. 加入 溶液会发生反应: ,B正确;
C. 受热易分解,可转化为 ,而 热稳定性较强,利用二者热稳定性差异,可从
它们的固体混合物中除去NaHCO ,C正确;
3
D.室温下 和 饱和溶液 相差较大的主要原因是 的水解程度远大于 ,D
错误;
故选D。
9. 氘代氨( )可用于反应机理研究。下列两种方法均可得到 :① 与 的水解反应;②
与 反应。下列说法不正确的是
A. 和 可用质谱法区分B. 和 均为极性分子
的
C. 方法① 化学方程式是
D. 方法②得到的产品纯度比方法①的高
【答案】D
【解析】
的
【详解】A. 和 相对分子质量不同,可以用质谱法区分,A正确;
B. 和 的H原子不同,但空间构型均为三角锥形,是极性分子,B正确;
C.MgN 与DO发生水解生成Mg(OD) 和ND ,反应方法①的化学方程式书写正确,C正确;
3 2 2 2 3
D.方法②是通过 中D原子代替 中H原子的方式得到 ,代换的个数不同,产物会不同,纯
度低,D错误;
故选D。
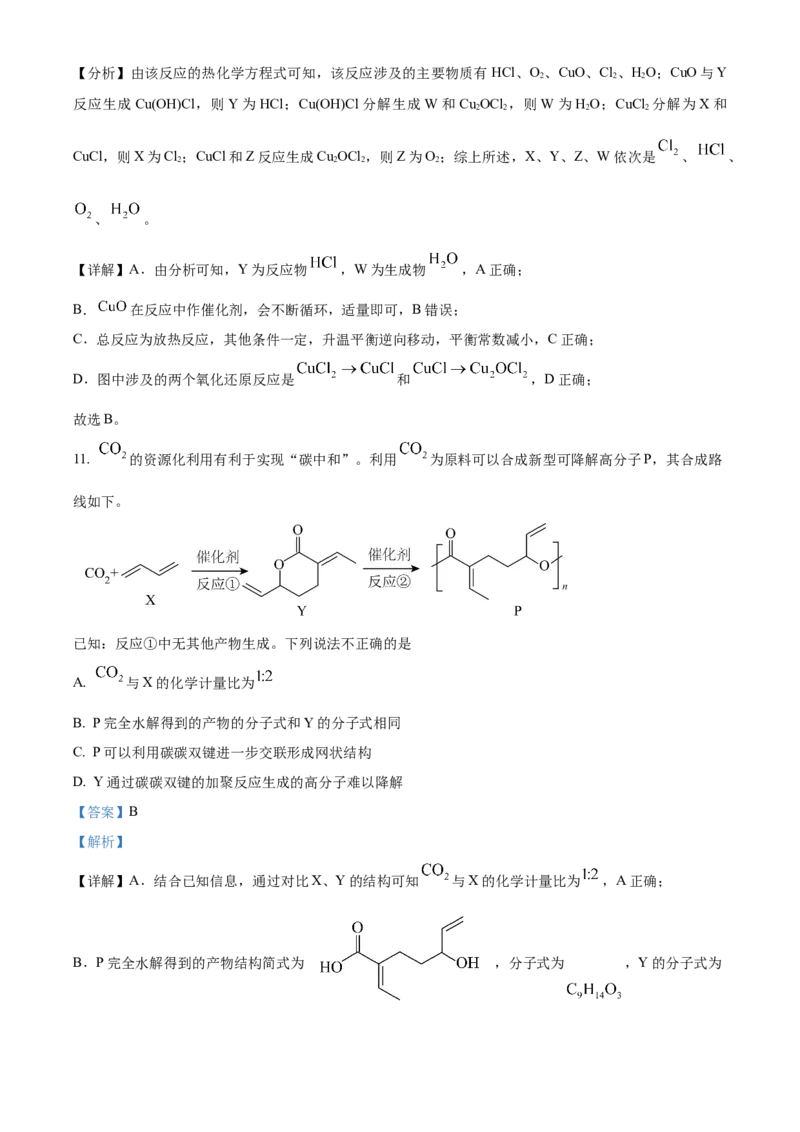
10. 可采用 催化氧化法将工业副产物 制成 ,实现氯资源的再利用。反应的热化学方程式:
。下图所示为该法的一种催化机理。
下列说法不正确的是
A. Y为反应物 ,W为生成物
B. 反应制得 ,须投入
C. 升高反应温度, 被 氧化制 的反应平衡常数减小
D. 图中转化涉及的反应中有两个属于氧化还原反应
【答案】B
【解析】【分析】由该反应的热化学方程式可知,该反应涉及的主要物质有HCl、O 、CuO、Cl 、HO;CuO与Y
2 2 2
反应生成Cu(OH)Cl,则Y为HCl;Cu(OH)Cl分解生成W和Cu OCl ,则W为HO;CuCl 分解为X和
2 2 2 2
CuCl,则X为Cl ;CuCl和Z反应生成Cu OCl ,则Z为O ;综上所述,X、Y、Z、W依次是 、 、
2 2 2 2
、 。
【详解】A.由分析可知,Y为反应物 ,W为生成物 ,A正确;
B. 在反应中作催化剂,会不断循环,适量即可,B错误;
C.总反应为放热反应,其他条件一定,升温平衡逆向移动,平衡常数减小,C正确;
D.图中涉及的两个氧化还原反应是 和 ,D正确;
故选B。
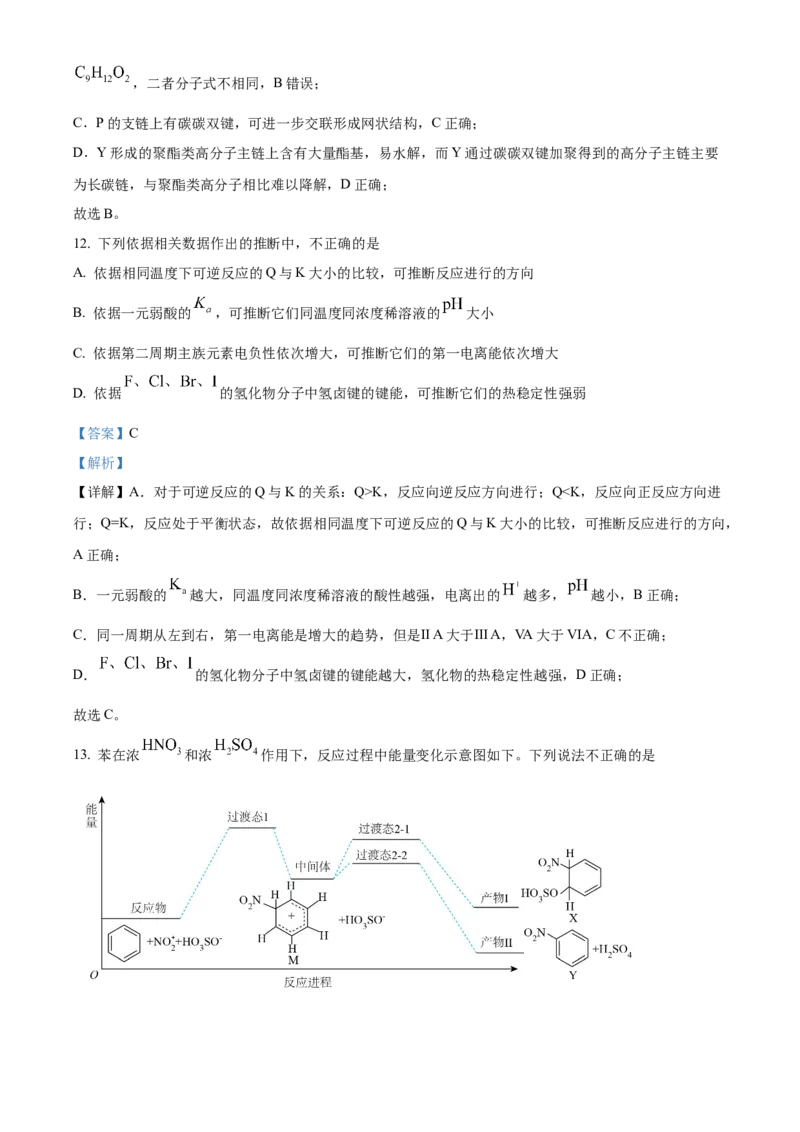
11. 的资源化利用有利于实现“碳中和”。利用 为原料可以合成新型可降解高分子P,其合成路
线如下。
已知:反应①中无其他产物生成。下列说法不正确的是
A. 与X的化学计量比为
B. P完全水解得到的产物的分子式和Y的分子式相同
C. P可以利用碳碳双键进一步交联形成网状结构
D. Y通过碳碳双键的加聚反应生成的高分子难以降解
【答案】B
【解析】
【详解】A.结合已知信息,通过对比X、Y的结构可知 与X的化学计量比为 ,A正确;
B.P完全水解得到的产物结构简式为 ,分子式为 ,Y的分子式为,二者分子式不相同,B错误;
C.P的支链上有碳碳双键,可进一步交联形成网状结构,C正确;
D.Y形成的聚酯类高分子主链上含有大量酯基,易水解,而Y通过碳碳双键加聚得到的高分子主链主要
为长碳链,与聚酯类高分子相比难以降解,D正确;
故选B。
12. 下列依据相关数据作出的推断中,不正确的是
A. 依据相同温度下可逆反应的Q与K大小的比较,可推断反应进行的方向
B. 依据一元弱酸的 ,可推断它们同温度同浓度稀溶液的 大小
C. 依据第二周期主族元素电负性依次增大,可推断它们的第一电离能依次增大
D. 依据 的氢化物分子中氢卤键的键能,可推断它们的热稳定性强弱
【答案】C
【解析】
【详解】A.对于可逆反应的Q与K的关系:Q>K,反应向逆反应方向进行;Q