文档内容
化学试题
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Cl 35.5 Cu 64
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一
项是符合题目要求的。
1. 近年来,我国新能源产业得到了蓬勃发展,下列说法错误的是
A. 理想的新能源应具有资源丰富、可再生、对环境无污染等特点
B. 氢氧燃料电池具有能量转化率高、清洁等优点
C. 锂离子电池放电时锂离子从负极脱嵌,充电时锂离子从正极脱嵌
D. 太阳能电池是一种将化学能转化为电能的装置
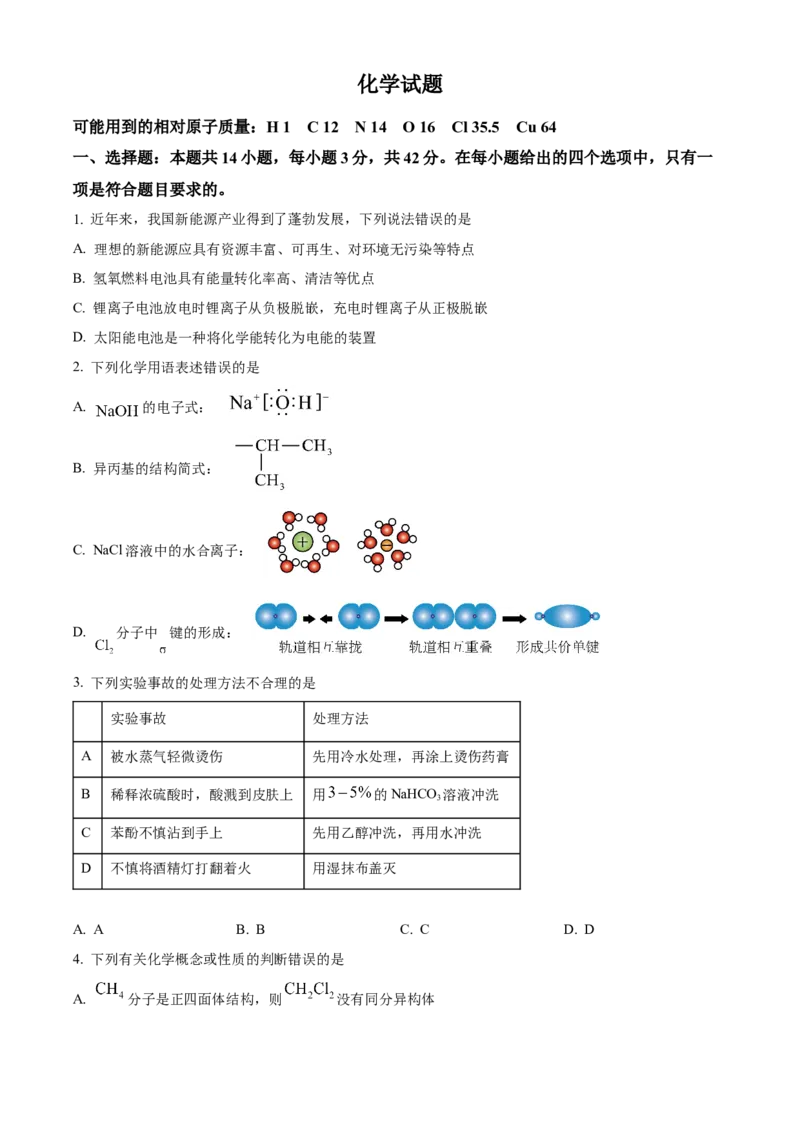
2. 下列化学用语表述错误的是
A. 的电子式:
B. 异丙基的结构简式:
C. NaCl溶液中的水合离子:
D. 分子中 键的形成:
3. 下列实验事故的处理方法不合理的是
实验事故 处理方法
A 被水蒸气轻微烫伤 先用冷水处理,再涂上烫伤药膏
B 稀释浓硫酸时,酸溅到皮肤上 用 的NaHCO 溶液冲洗
3
C 苯酚不慎沾到手上 先用乙醇冲洗,再用水冲洗
D 不慎将酒精灯打翻着火 用湿抹布盖灭
A. A B. B C. C D. D
4. 下列有关化学概念或性质的判断错误的是
A. 分子是正四面体结构,则 没有同分异构体B. 环己烷与苯分子中 键的键能相等
C. 甲苯的质谱图中,质荷比为92的峰归属于
D. 由 与 组成的离子液体常温下呈液态,与其离子的体积较大有关
5. 组成核酸的基本单元是核苷酸,下图是核酸的某一结构片段,下列说法错误的是
A. 脱氧核糖核酸(DNA)和核糖核酸(RNA)结构中的碱基相同,戊糖不同
B. 碱基与戊糖缩合形成核苷,核苷与磷酸缩合形成核苷酸,核苷酸缩合聚合得到核酸
C. 核苷酸在一定条件下,既可以与酸反应,又可以与碱反应
D. 核酸分子中碱基通过氢键实现互补配对
6. 下列过程中,对应的反应方程式错误的是
A 《天工开物》记载用炉甘石( )火法炼锌
B 用作野外生氢剂
C 饱和 溶液浸泡锅炉水垢
D 绿矾( )处理酸性工业废水中 的
A. A B. B C. C D. D
7. 某学生按图示方法进行实验,观察到以下实验现象:①铜丝表面缓慢放出气泡,锥形瓶内气体呈红棕色;
②铜丝表面气泡释放速度逐渐加快,气体颜色逐渐变深;
③一段时间后气体颜色逐渐变浅,至几乎无色;
④锥形瓶中液面下降,长颈漏斗中液面上升,最终铜丝与液面脱离接触,反应停止。
下列说法正确 的是
A. 开始阶段铜丝表面气泡释放速度缓慢,原因是铜丝在稀HNO 中表面钝化
3
B. 锥形瓶内出现了红棕色气体,表明铜和稀HNO 反应生成了NO
3 2
C. 红棕色逐渐变浅的主要原因是
D. 铜丝与液面脱离接触,反应停止,原因是硝酸消耗完全
8. 为达到下列实验目的,操作方法合理的是
实验目的 操作方法
A 从含有 的NaCl固体中提取 用CCl 溶解、萃取、分液
4
依次用 溶液洗涤、水洗、分
B 提纯实验室制备的乙酸乙酯
液、干燥
用 标准溶液滴定未知浓度
C 用甲基橙作指示剂进行滴定
的 溶液
D 从明矾过饱和溶液中快速析出晶体 用玻璃棒摩擦烧杯内壁
A. A B. B C. C D. D
9. 通过理论计算方法优化了P和Q的分子结构,P和Q呈平面六元并环结构,原子的连接方式如图所示,
下列说法错误的是A. P为非极性分子,Q为极性分子 B. 第一电离能:
为
C. 和 所含电子数目相等 D. P和Q分子中C、B和N均 杂化
10. 在 水溶液中,电化学方法合成高能物质 时,伴随少量 生成,电解原理如图所示,
下列说法正确的是
A. 电解时, 向Ni电极移动
B. 生成 的电极反应:
C. 电解一段时间后,溶液pH升高
D. 每生成 的同时,生成
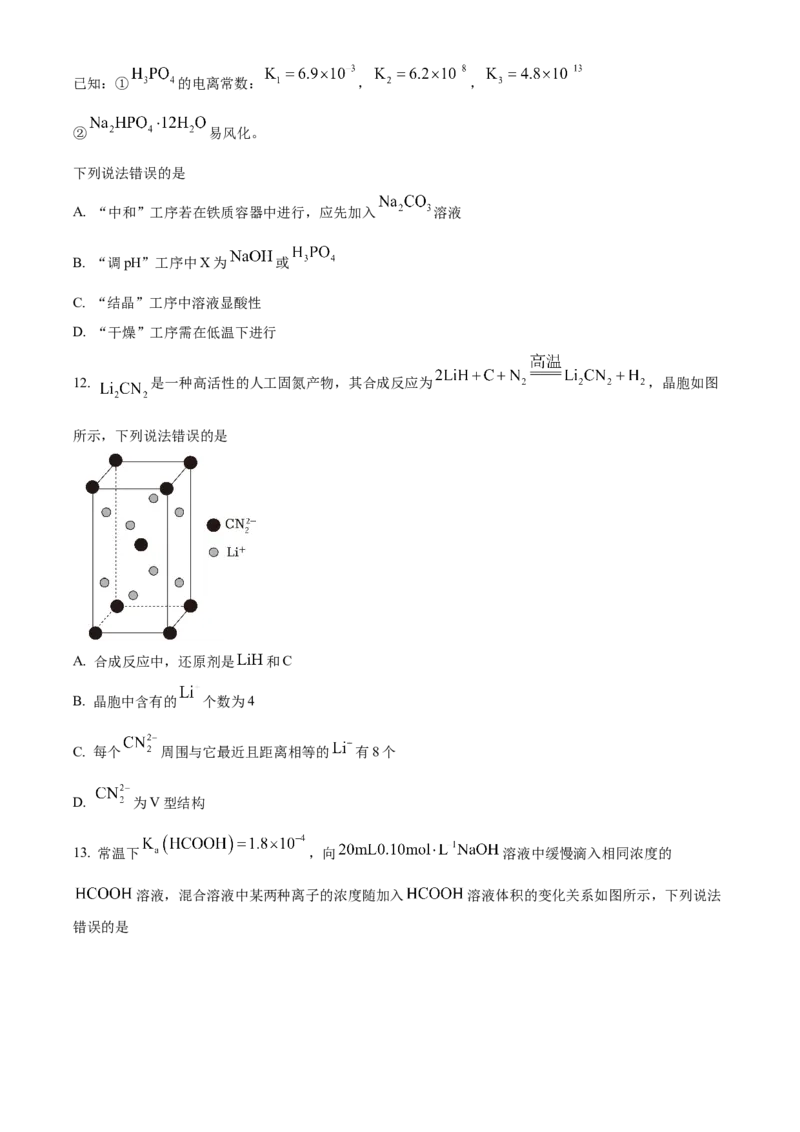
11. 中和法生产 的工艺流程如下:已知:① 的电离常数: , ,
② 易风化。
下列说法错误的是
A. “中和”工序若在铁质容器中进行,应先加入 溶液
B. “调pH”工序中X为 或
C. “结晶”工序中溶液显酸性
D. “干燥”工序需在低温下进行
12. 是一种高活性的人工固氮产物,其合成反应为 ,晶胞如图
所示,下列说法错误的是
A. 合成反应中,还原剂是 和C
B. 晶胞中含有的 个数为4
C. 每个 周围与它最近且距离相等的 有8个
D. 为V型结构
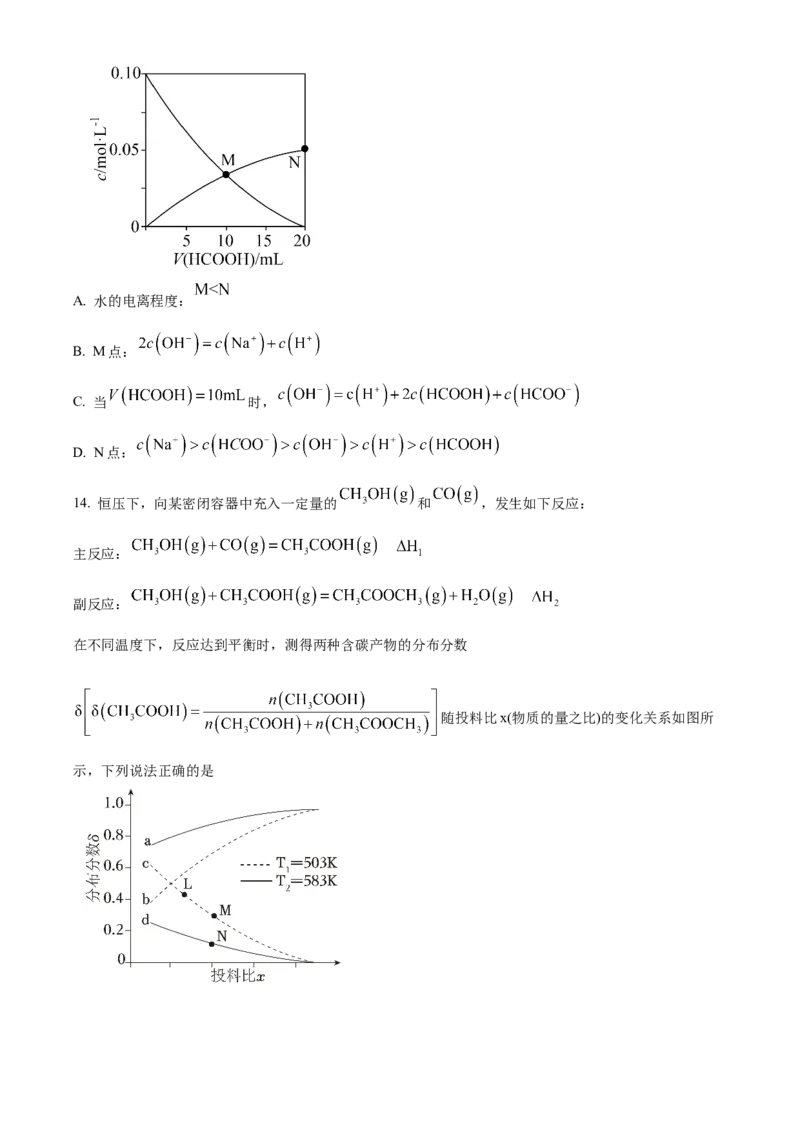
13. 常温下 ,向 溶液中缓慢滴入相同浓度的
溶液,混合溶液中某两种离子的浓度随加入 溶液体积的变化关系如图所示,下列说法
错误的是A. 水的电离程度:
B. M点:
C. 当 时,
D. N点:
14. 恒压下,向某密闭容器中充入一定量的 和 ,发生如下反应:
主反应:
副反应:
在不同温度下,反应达到平衡时,测得两种含碳产物的分布分数
随投料比x(物质的量之比)的变化关系如图所
示,下列说法正确的是A. 投料比x代表
B. 曲线c代表乙酸的分布分数
C. ,
D. L、M、N三点的平衡常数:
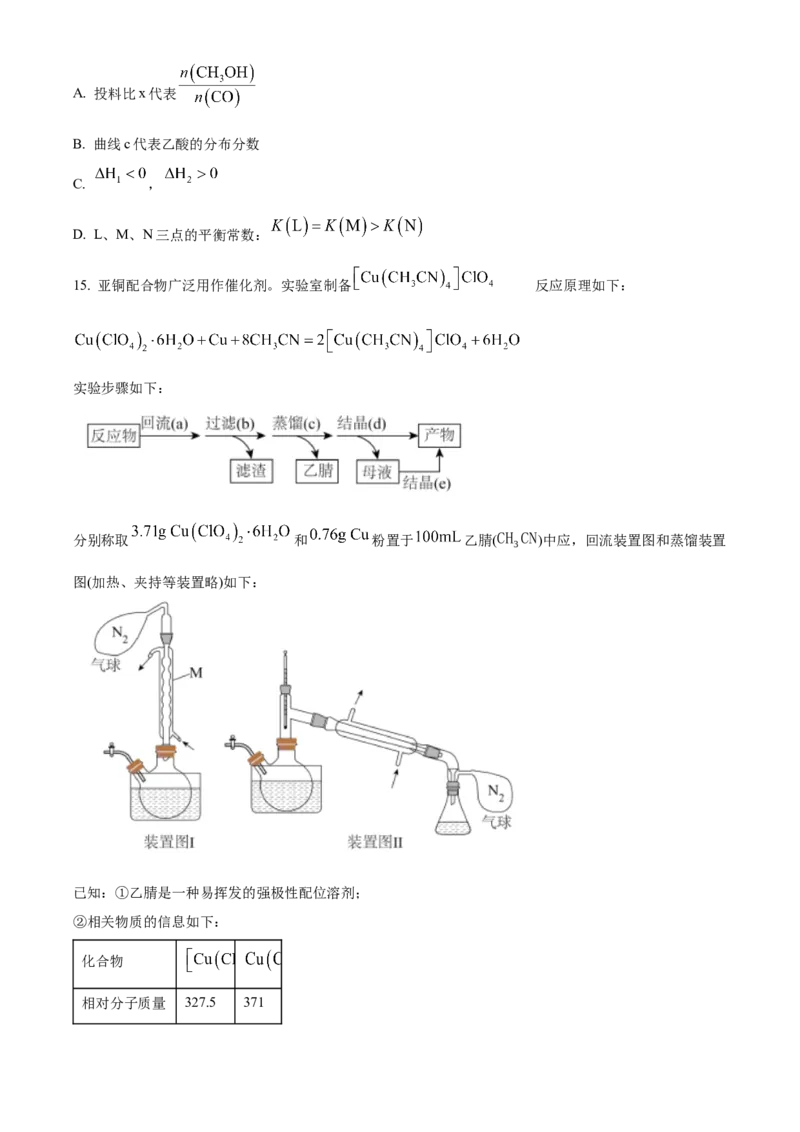
15. 亚铜配合物广泛用作催化剂。实验室制备 的反应原理如下:
实验步骤如下:
分别称取 和 粉置于 乙腈(CH CN)中应,回流装置图和蒸馏装置
3
图(加热、夹持等装置略)如下:
已知:①乙腈是一种易挥发的强极性配位溶剂;
②相关物质的信息如下:
化合物
相对分子质量 327.5 371在乙腈中颜色 无色 蓝色
回答下列问题:
(1)下列与实验有关的图标表示排风的是_______(填标号);
A. B. C. D. E.
(2)装置Ⅰ中仪器M的名称为_______;
(3)装置Ⅰ中反应完全的现象是_______;
(4)装置Ⅰ和Ⅱ中 气球的作用是_______;
(5) 不能由步骤c直接获得,而是先蒸馏至接近饱和,再经步骤d冷却结晶获得。
这样处理的目的是_______
(6)为了使母液中的 结晶,步骤e中向母液中加入的最佳溶剂是_______(填标号);
A.水 B.乙醇 C.乙醚
(7)合并步骤d和e所得的产物,总质量为 ,则总收率为_______(用百分数表示,保留一位小数)。
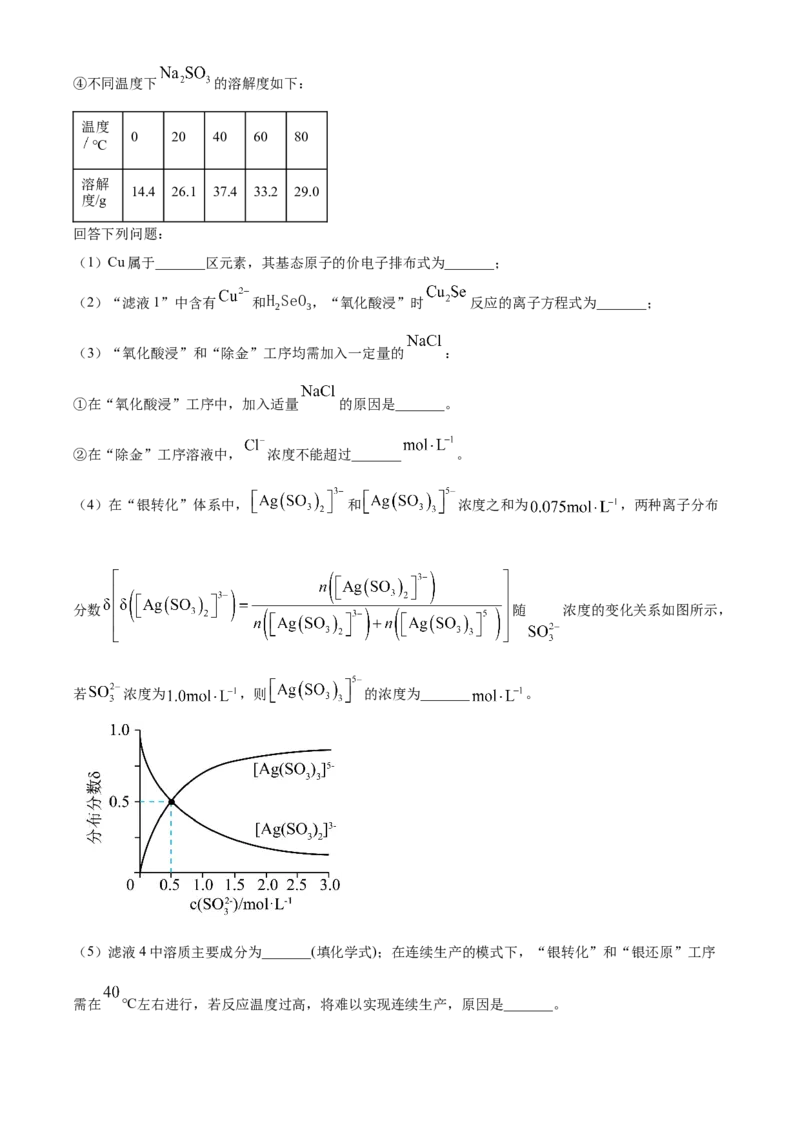
16. 铜阳极泥(含有Au、 、 、 等)是一种含贵金属的可再生资源,回收贵金属的化工
流程如下:
已知:①当某离子的浓度低于 时,可忽略该离子的存在;
② ;
③ 易从溶液中结晶析出;④不同温度下 的溶解度如下:
温度
0 20 40 60 80
℃
溶解
14.4 26.1 37.4 33.2 29.0
度/g
回答下列问题:
(1)Cu属于_______区元素,其基态原子的价电子排布式为_______;
(2)“滤液1”中含有 和H SeO ,“氧化酸浸”时 反应的离子方程式为_______;
2 3
(3)“氧化酸浸”和“除金”工序均需加入一定量的 :
①在“氧化酸浸”工序中,加入适量 的原因是_______。
②在“除金”工序溶液中, 浓度不能超过_______ 。
(4)在“银转化”体系中, 和 浓度之和为 ,两种离子分布
分数 随 浓度的变化关系如图所示,
若 浓度为 ,则 的浓度为_______ 。
(5)滤液4中溶质主要成分为_______(填化学式);在连续生产的模式下,“银转化”和“银还原”工序
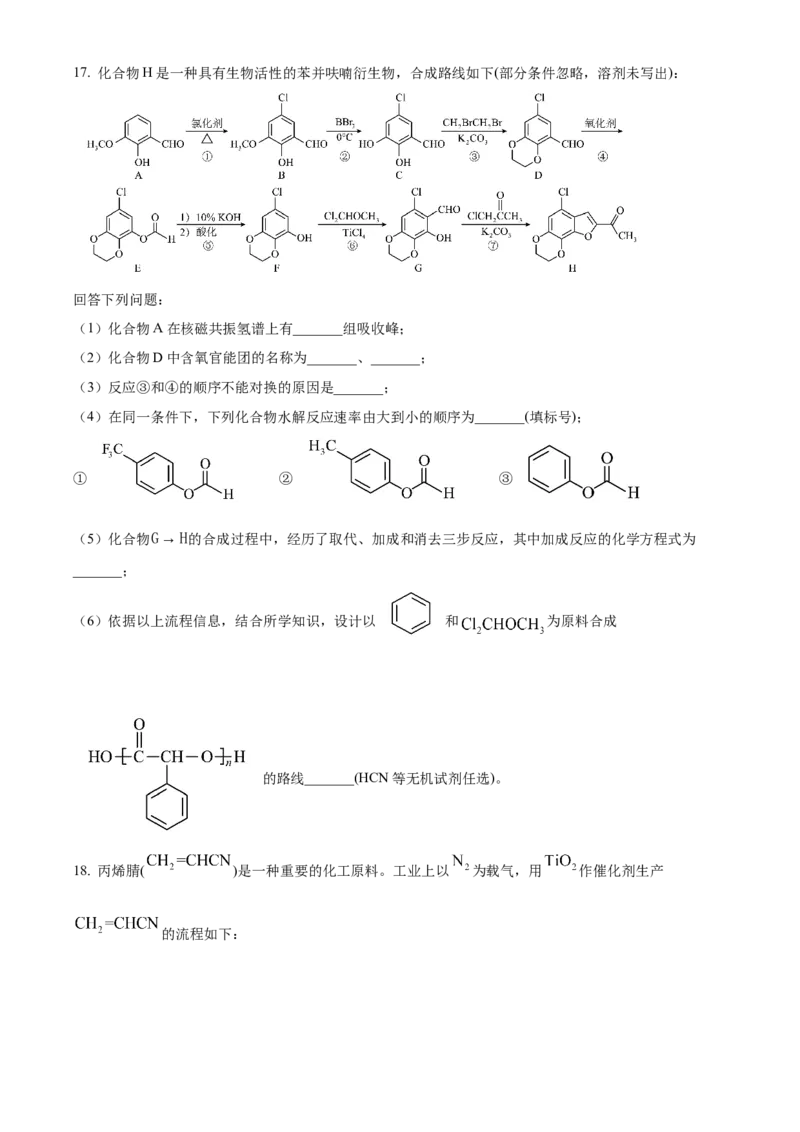
需在 ℃左右进行,若反应温度过高,将难以实现连续生产,原因是_______。17. 化合物H是一种具有生物活性的苯并呋喃衍生物,合成路线如下(部分条件忽略,溶剂未写出):
回答下列问题:
(1)化合物A在核磁共振氢谱上有_______组吸收峰;
(2)化合物D中含氧官能团的名称为_______、_______;
(3)反应③和④的顺序不能对换的原因是_______;
(4)在同一条件下,下列化合物水解反应速率由大到小的顺序为_______(填标号);
① ② ③
(5)化合物G→H的合成过程中,经历了取代、加成和消去三步反应,其中加成反应的化学方程式为
_______;
(6)依据以上流程信息,结合所学知识,设计以 和 为原料合成
的路线_______(HCN等无机试剂任选)。
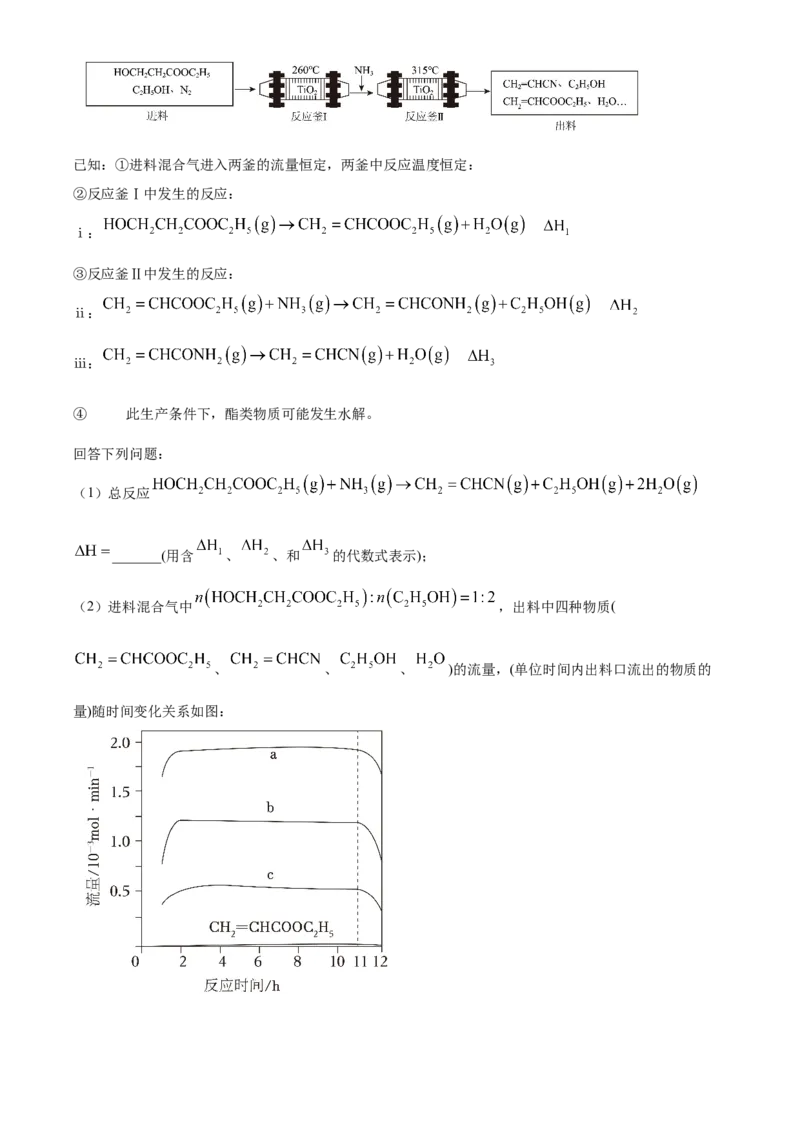
18. 丙烯腈( )是一种重要的化工原料。工业上以 为载气,用 作催化剂生产
的流程如下:已知:①进料混合气进入两釜的流量恒定,两釜中反应温度恒定:
②反应釜Ⅰ中发生的反应:
ⅰ:
③反应釜Ⅱ中发生的反应:
ⅱ:
ⅲ:
在
④ 此生产条件下,酯类物质可能发生水解。
回答下列问题:
(1)总反应
_______(用含 、 、和 的代数式表示);
(2)进料混合气中 ,出料中四种物质(
、 、 、 )的流量,(单位时间内出料口流出的物质的
量)随时间变化关系如图:①表示 的曲线是_______(填“a”“b”或“c”);
②反应釜Ⅰ中加入 的作用是_______。
③出料中没有检测到 的原因是_______。
④反应 后,a、b、c曲线对应物质的流量逐渐降低的原因是_______。
(3)催化剂 再生时会释放 ,可用氨水吸收获得 。现将一定量的 固体(含
水)置于密闭真空容器中,充入 和 ,其中 的分压为 ,在 ℃下进行干燥。为
保证 不分解, 的分压应不低于_______ (已知
分解的平衡常数 );
(4)以 为原料,稀硫酸为电解液,Sn作阴极,用电解的方法可制得 ,
其阴极反应式_______。