文档内容
化学试题
可能用到的相对原子质量:H-1; B-11; C-12; N-14; Na-23; Mg-24; Cl-35.5; Zn-65; As-75; Ag-108;
第 I 卷(选择题,共 45 分)
一、选择题(包括 15 小题,每小题 3 分,共 45 分。每小题只有一个选项符合题意)
1. 化学材料应用广泛,下列有关说法正确的是
A. 隐形战斗机的隐身涂层中含有石墨烯,石墨烯属于一种新型有机材料
B. 四羊方尊的材料青铜属于合金,熔点比铜低 C. 绢的原料蚕丝属于糖
类,是天然高分子材料
D. 故宫的红色宫墙是因为墙涂料中含 Fe O ,Fe O 具有磁性
3 4 3 4
2.化学助力体育事业的发展。下列说法错误的是
选项 用途 物质 原因
A 泳池消毒剂 漂粉精 在空气中易生成强氧化性物质
B 羽毛球拍网线 尼龙 66 强度高且弹性好
C “球场大夫” 氯乙烷 易分解且吸收热量
D 运动场人造草坪 聚乙烯 无毒、耐腐蚀、耐磨性好
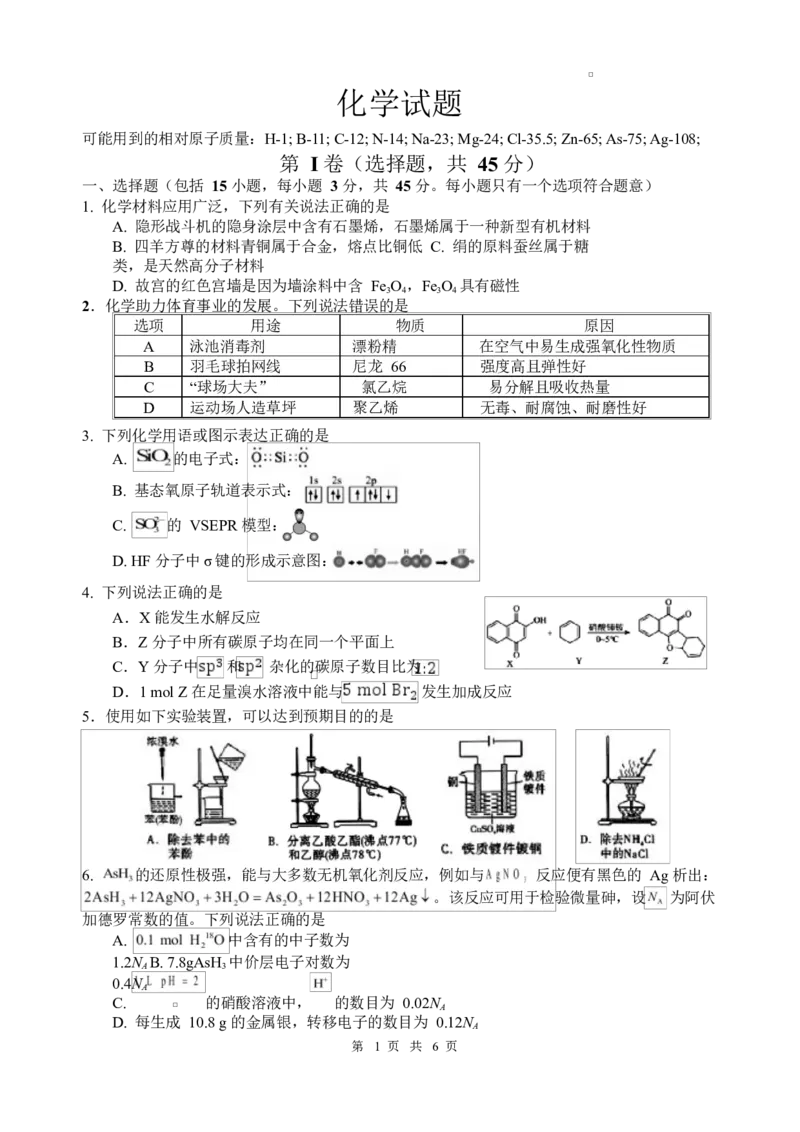
3. 下列化学用语或图示表达正确的是
A. 的电子式:
B. 基态氧原子轨道表示式:
C. 的 VSEPR 模型:
D. HF 分子中σ键的形成示意图:
4. 下列说法正确的是
A.X 能发生水解反应
B.Z 分子中所有碳原子均在同一个平面上
C.Y 分子中 和 杂化的碳原子数目比为
D.1 mol Z 在足量溴水溶液中能与 发生加成反应
5.使用如下实验装置,可以达到预期目的的是
6. 的还原性极强,能与大多数无机氧化剂反应,例如与 反应便有黑色的 Ag 析出:
。该反应可用于检验微量砷,设 为阿伏
加德罗常数的值。下列说法正确的是
A. 中含有的中子数为
1.2N B. 7.8gAsH 中价层电子对数为
A 3
0.4N
A
C. 的硝酸溶液中, 的数目为 0.02N
A
D. 每生成 10.8 g 的金属银,转移电子的数目为 0.12N
A
第 1 页 共 6 页7.下列方程式正确的是
A.硫化钠溶液在空气中氧化变质:2S2- +O
2
+4H+=2S↓+2H
2
O
B.足量酸性高锰酸钾与甲醛反应:5HCHO+2MnO
4
-+6H+=5HCOOH+2Mn2++3H
2
O
C.阿司匹林与足量 NaOH 溶液共热: +2OH-→ +CH COO-+H O
3 2
D.向[Cu(NH 3 ) 4 ]SO 4 溶液中滴加过量的硫酸:[Cu(NH 3 ) 4 ]2++4H+=Cu2++4NH 4+
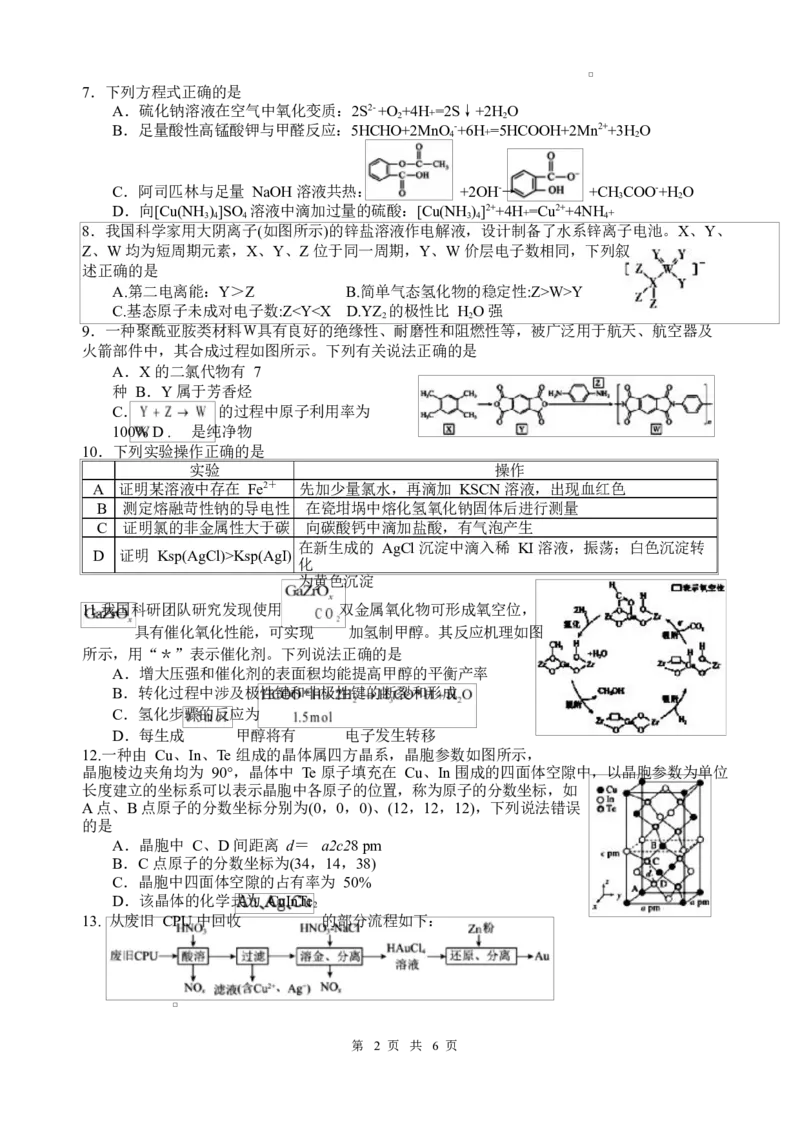
8.我国科学家用大阴离子(如图所示)的锌盐溶液作电解液,设计制备了水系锌离子电池。X、Y、
Z、W 均为短周期元素,X、Y、Z 位于同一周期,Y、W 价层电子数相同,下列叙
述正确的是
A.第二电离能:Y>Z B.简单气态氢化物的稳定性:Z>W>Y
C.基态原子未成对电子数:ZKsp(AgI)
化
为黄色沉淀
11.我国科研团队研究发现使用 双金属氧化物可形成氧空位,
具有催化氧化性能,可实现 加氢制甲醇。其反应机理如图
所示,用“*”表示催化剂。下列说法正确的是
A.增大压强和催化剂的表面积均能提高甲醇的平衡产率
B.转化过程中涉及极性键和非极性键的断裂和形成
C.氢化步骤的反应为
D.每生成 甲醇将有 电子发生转移
12.一种由 Cu、In、Te 组成的晶体属四方晶系,晶胞参数如图所示,
晶胞棱边夹角均为 90°,晶体中 Te 原子填充在 Cu、In 围成的四面体空隙中,以晶胞参数为单位
长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如
A 点、B 点原子的分数坐标分别为(0,0,0)、(12,12,12),下列说法错误
的是
A.晶胞中 C、D 间距离 d= a2c28 pm
B.C 点原子的分数坐标为(34,14,38)
C.晶胞中四面体空隙的占有率为 50%
D.该晶体的化学式为 CuInTe
2
13. 从废旧 CPU 中回收 的部分流程如下:
第 2 页 共 6 页已知 ,下列说法正确的是
A.酸溶时,从消耗硝酸物质的量角度看,用浓硝酸比稀硝酸好
B.向过滤所得滤液中加入过量浓氨水,可以使 和 分离
C.NaCl 促进了 Au 和 的反应,其原因之一是 降低了 ,生成了稳定性更
好的
D.向含 的溶液中加入过量 Zn 使其完全还原为 Au,需消耗
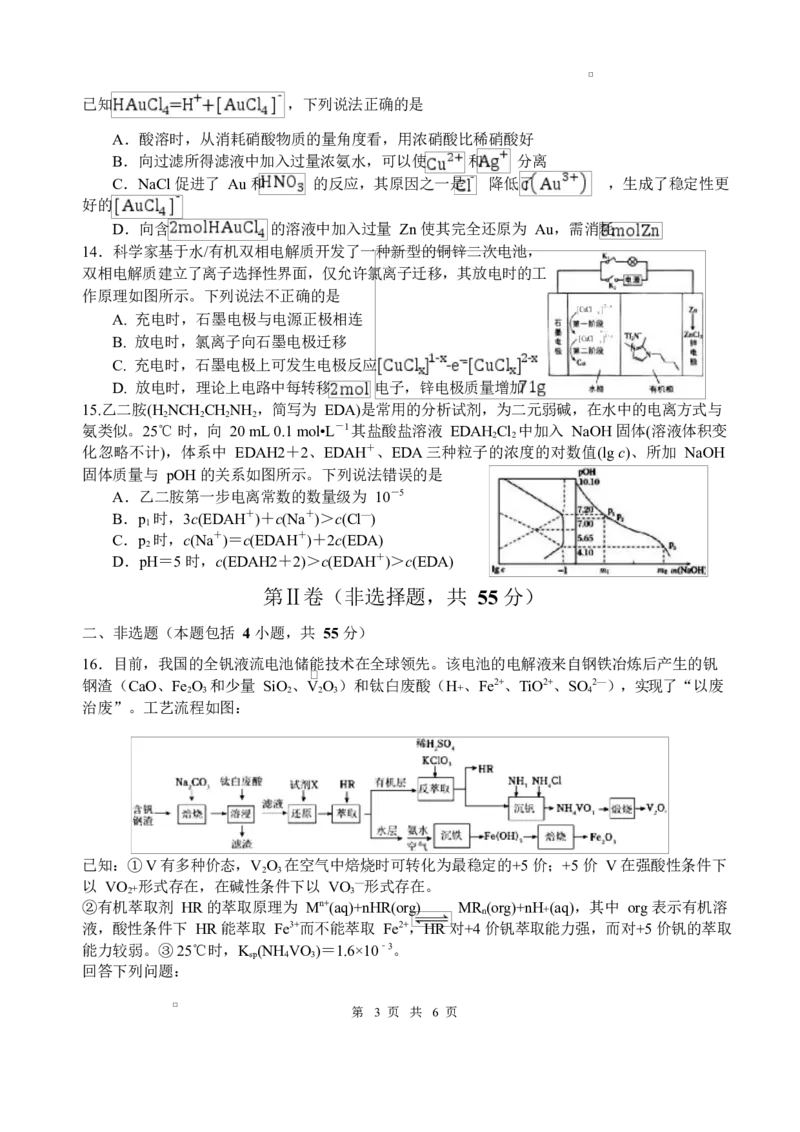
14.科学家基于水/有机双相电解质开发了一种新型的铜锌二次电池,
双相电解质建立了离子选择性界面,仅允许氯离子迁移,其放电时的工
作原理如图所示。下列说法不正确的是
A. 充电时,石墨电极与电源正极相连
B. 放电时,氯离子向石墨电极迁移
C. 充电时,石墨电极上可发生电极反应
D. 放电时,理论上电路中每转移 电子,锌电极质量增加
15.乙二胺(H NCH CH NH ,简写为 EDA)是常用的分析试剂,为二元弱碱,在水中的电离方式与
2 2 2 2
氨类似。25℃ 时,向 20 mL 0.1 mol•L-1 其盐酸盐溶液 EDAH Cl 中加入 NaOH 固体(溶液体积变
2 2
化忽略不计),体系中 EDAH2+2、EDAH+、EDA 三种粒子的浓度的对数值(lg c)、所加 NaOH
固体质量与 pOH 的关系如图所示。下列说法错误的是
A.乙二胺第一步电离常数的数量级为 10-5
B.p 时,3c(EDAH+)+c(Na+)>c(Cl—)
1
C.p 时,c(Na+)=c(EDAH+)+2c(EDA)
2
D.pH=5 时,c(EDAH2+2)>c(EDAH+)>c(EDA)
第Ⅱ卷(非选择题,共 55 分)
二、非选题(本题包括 4 小题,共 55 分)
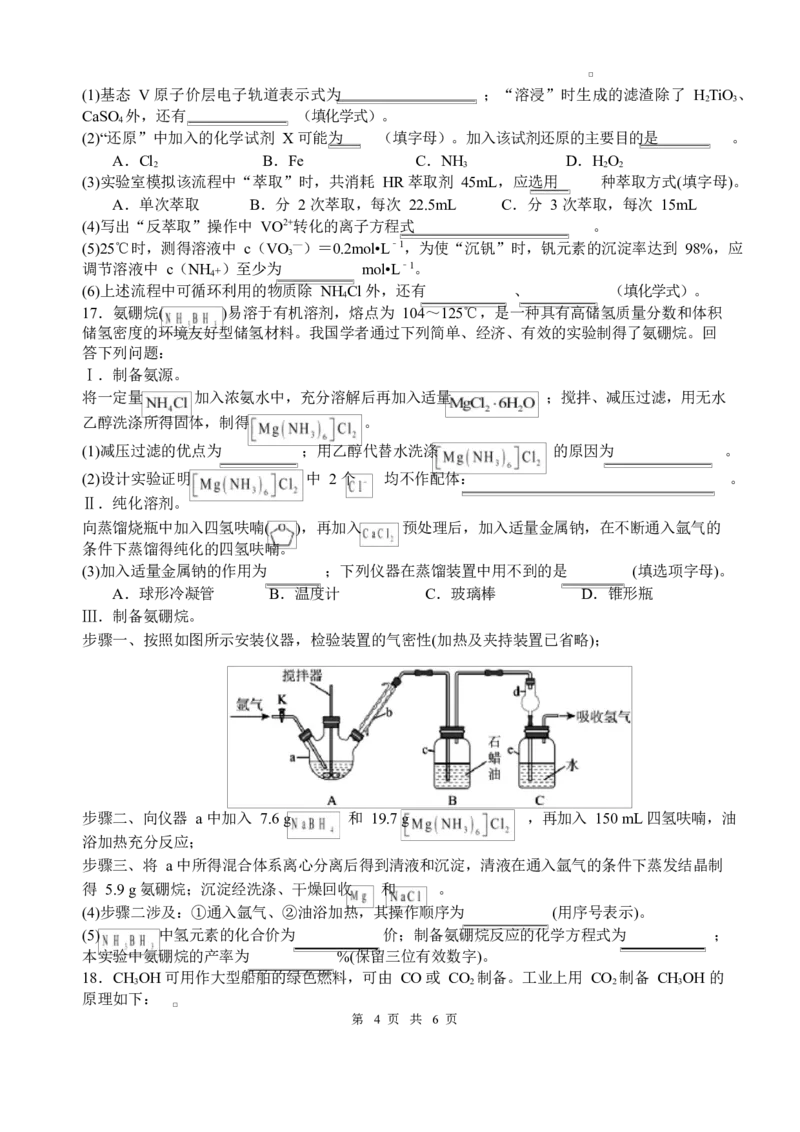
16.目前,我国的全钒液流电池储能技术在全球领先。该电池的电解液来自钢铁冶炼后产生的钒
钢渣(CaO、Fe
2
O
3
和少量 SiO
2
、V
2
O
3
)和钛白废酸(H+ 、Fe2+、TiO2+、SO
4
2—),实现了“以废
治废”。工艺流程如图:
已知:①V 有多种价态,V O 在空气中焙烧时可转化为最稳定的+5 价;+5 价 V 在强酸性条件下
2 3
以 VO 2+ 形式存在,在碱性条件下以 VO 3 —形式存在。
②有机萃取剂 HR 的萃取原理为 Mn+(aq)+nHR(org) MR
n
(org)+nH+(aq),其中 org 表示有机溶
液,酸性条件下 HR 能萃取 Fe3+而不能萃取 Fe2+,HR 对+4 价钒萃取能力强,而对+5 价钒的萃取
能力较弱。③25℃时,K (NH VO )=1.6×10﹣3。
sp 4 3
回答下列问题:
第 3 页 共 6 页(1)基态 V 原子价层电子轨道表示式为 ;“溶浸”时生成的滤渣除了 H TiO 、
2 3
CaSO 外,还有 (填化学式)。
4
(2)“还原”中加入的化学试剂 X 可能为 (填字母)。加入该试剂还原的主要目的是 。
A.Cl B.Fe C.NH D.H O
2 3 2 2
(3)实验室模拟该流程中“萃取”时,共消耗 HR 萃取剂 45mL,应选用 种萃取方式(填字母)。
A.单次萃取 B.分 2 次萃取,每次 22.5mL C.分 3 次萃取,每次 15mL
(4)写出“反萃取”操作中 VO2+转化的离子方程式 。
(5)25℃时,测得溶液中 c(VO —)=0.2mol•L﹣1,为使“沉钒”时,钒元素的沉淀率达到 98%,应
3
调节溶液中 c(NH
4+
)至少为 mol•L﹣1。
(6)上述流程中可循环利用的物质除 NH Cl 外,还有 、 (填化学式)。
4
17.氨硼烷( )易溶于有机溶剂,熔点为 104~125℃,是一种具有高储氢质量分数和体积
储氢密度的环境友好型储氢材料。我国学者通过下列简单、经济、有效的实验制得了氨硼烷。回
答下列问题:
Ⅰ.制备氨源。
将一定量 加入浓氨水中,充分溶解后再加入适量 ;搅拌、减压过滤,用无水
乙醇洗涤所得固体,制得 。
(1)减压过滤的优点为 ;用乙醇代替水洗涤 的原因为 。
(2)设计实验证明 中 2 个 均不作配体: 。
Ⅱ.纯化溶剂。
向蒸馏烧瓶中加入四氢呋喃( ),再加入 预处理后,加入适量金属钠,在不断通入氩气的
条件下蒸馏得纯化的四氢呋喃。
(3)加入适量金属钠的作用为 ;下列仪器在蒸馏装置中用不到的是 (填选项字母)。
A.球形冷凝管 B.温度计 C.玻璃棒 D.锥形瓶
Ⅲ.制备氨硼烷。
步骤一、按照如图所示安装仪器,检验装置的气密性(加热及夹持装置已省略);
步骤二、向仪器 a 中加入 7.6 g 和 19.7 g ,再加入 150 mL 四氢呋喃,油
浴加热充分反应;
步骤三、将 a 中所得混合体系离心分离后得到清液和沉淀,清液在通入氩气的条件下蒸发结晶制
得 5.9 g 氨硼烷;沉淀经洗涤、干燥回收 和 。
(4)步骤二涉及:①通入氩气、②油浴加热,其操作顺序为 (用序号表示)。
(5) 中氢元素的化合价为 价;制备氨硼烷反应的化学方程式为 ;
本实验中氨硼烷的产率为 %(保留三位有效数字)。
18.CH OH 可用作大型船舶的绿色燃料,可由 CO 或 CO 制备。工业上用 CO 制备 CH OH 的
3 2 2 3
原理如下:
第 4 页 共 6 页反应 I: (主反应)
反应Ⅱ: (副反应)
(1)反应 ,该反应在 (填“低温”
“高温”或“任意温度”)下能自发进行。
(2)T ℃时,向恒压密闭容器中充入 1mol CO (g)和 3mol H (g),若在该条件下只发生反应Ⅰ,
1 2 2
达平衡时,放出 20kJ 能量;若在相同条件下向相同容器中充入 1mol CH OH(g)和 1mol H O(g),
3 2
达到平衡时,吸收 kJ 的能量。
(3)某温度下,将 和 按物质的量之比 1:3 通入恒容密闭容器中同时发生反应 I 和反应Ⅱ,
下列情况下能说明反应Ⅱ达到平衡状态的是___________(填标号)。
A. 和 的物质的量之比不再改变 B.混合气体的密度不再变化
C.混合气体的压强不再变化 D.形成 1mol 碳氧键的同时断裂 2mol 氧氢键
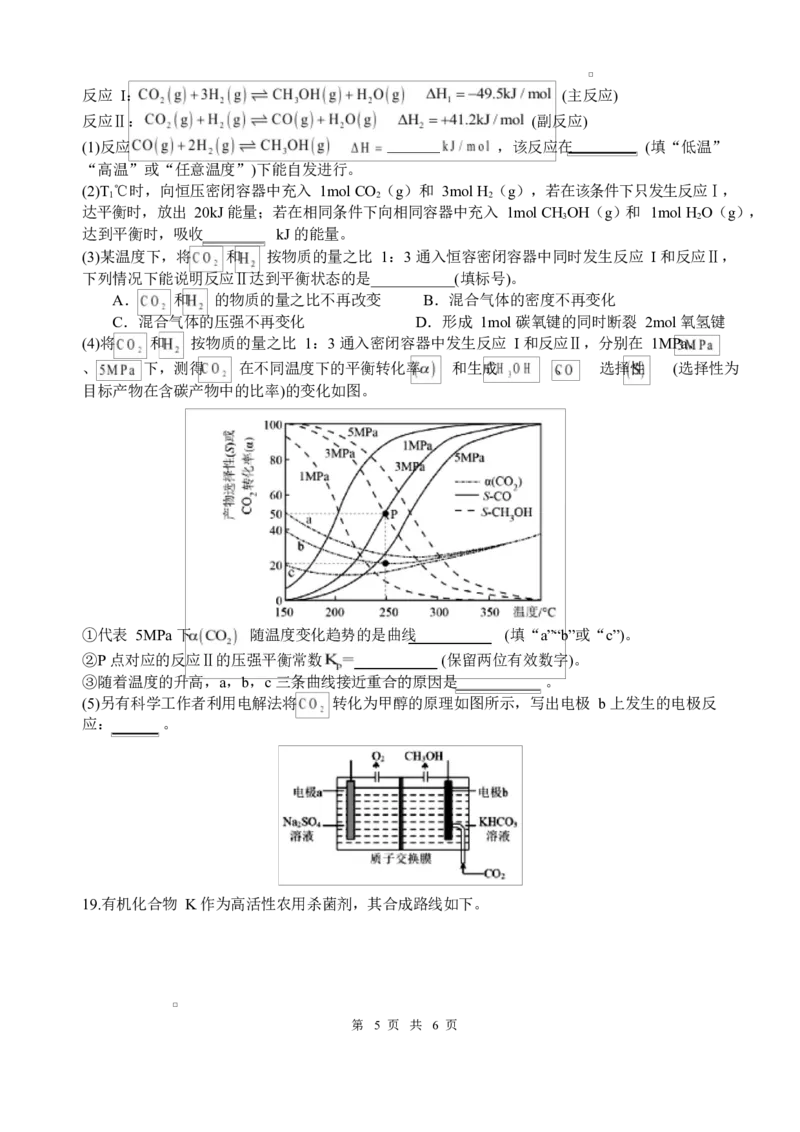
(4)将 和 按物质的量之比 1:3 通入密闭容器中发生反应 I 和反应Ⅱ,分别在 1MPa、
、 下,测得 在不同温度下的平衡转化率 和生成 、 选择性 (选择性为
目标产物在含碳产物中的比率)的变化如图。
①代表 5MPa 下 随温度变化趋势的是曲线 (填“a”“b”或“c”)。
②P 点对应的反应Ⅱ的压强平衡常数 (保留两位有效数字)。
③随着温度的升高,a,b,c 三条曲线接近重合的原因是 。
(5)另有科学工作者利用电解法将 转化为甲醇的原理如图所示,写出电极 b 上发生的电极反
应: 。
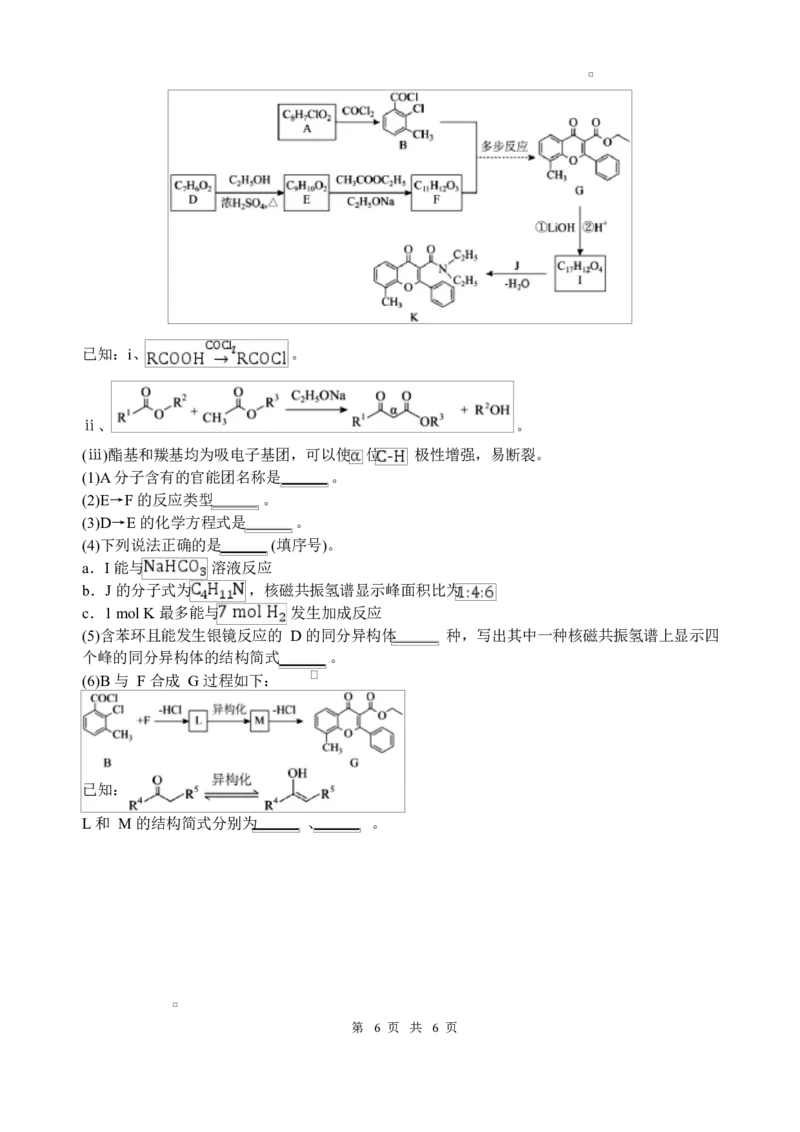
19.有机化合物 K 作为高活性农用杀菌剂,其合成路线如下。
第 5 页 共 6 页已知:i、 。
ⅱ、 。
(ⅲ)酯基和羰基均为吸电子基团,可以使 位 极性增强,易断裂。
(1)A 分子含有的官能团名称是 。
(2)E→F 的反应类型 。
(3)D→E 的化学方程式是 。
(4)下列说法正确的是 (填序号)。
a.I 能与 溶液反应
b.J 的分子式为 ,核磁共振氢谱显示峰面积比为
c.1 mol K 最多能与 发生加成反应
(5)含苯环且能发生银镜反应的 D 的同分异构体 种,写出其中一种核磁共振氢谱上显示四
个峰的同分异构体的结构简式 。
(6)B 与 F 合成 G 过程如下:
已知:
L 和 M 的结构简式分别为 、 。
第 6 页 共 6 页