文档内容
2024 届高三第二次联考
化学参考答案及评分标准
一、选择题:本题共7小题,每小题6分,共42分。在每小题给出的四个选项中,只有一项是符合题目
要求的。
7.C 8.D 9.B 10.C 11.D 12.A 13.B
三、非选择题:共58分。
注意:1.只要答案合理,均可酌情给分;
2.化学方程式书写,反应物、生成物写错或未配平均为0分,无条件或错误或无“↑”“↓”扣1分。
26.(15分,除标注外,每空2分)
(1)除去废钒催化剂中的有机物
(2)原料粉碎(或搅拌,1分) 6V O ·FeO+5NaClO =6V O +3Fe O +5NaCl
2 3 3 2 5 2 3
(3)可制取油漆(或炼铁,2分)
(4)H O+AlO −+HCO −=Al(OH) ↓+CO 2−
2 2 3 3 3
(5)温度升高,氯化铵分解加快,沉钒率下降;或者温度升高NH VO 的溶解度增大沉钒率下降(答
4 3
到一点即可) 1×10−4
(6)50%
27.(14分,除标注外,每空2分)
(1)c
(2)d
(3)2CH CH OH+2Na→2CH CH ONa+H ↑
3 2 3 2 2
乙酸乙酯中乙醇含量过少,生成的乙醇钠浓度过小,催化效率差,反应速率慢;乙酸乙酯中乙醇
含量过多,又会使平衡逆向移动,导致乙酰乙酸乙酯的产率降低
(4)降低乙酰乙酸乙酯的溶解度(1分) 吸收有机物中的水(1分)
(5)球形冷凝管、分液漏斗(2分,1个1分)
减小压强,降低乙酰乙酸乙酯的沸点,从而防止乙酰乙酸乙酯的分解
28.(14分,除标注外,每空2分)
Ⅰ.(1)4NH (g)+6NO(g) 5N (g)+6H O(g) ΔH=(3c-2a-3b)kJ·mol−1
3 2 2
(2分,热方程式倍数变化正确也得分)
Ⅱ.(2)高温(1分)
(3)升高温度、增加CH 或H O(g)的浓度(2分,答对一点即可得分)
4 2
(4)0.15mol·L−1·min−1 BC(2分,1个1分)
Ⅲ.(5)a、b(2分,1个1分,顺序不可交换) 放热(1分)
(6)2.75
1
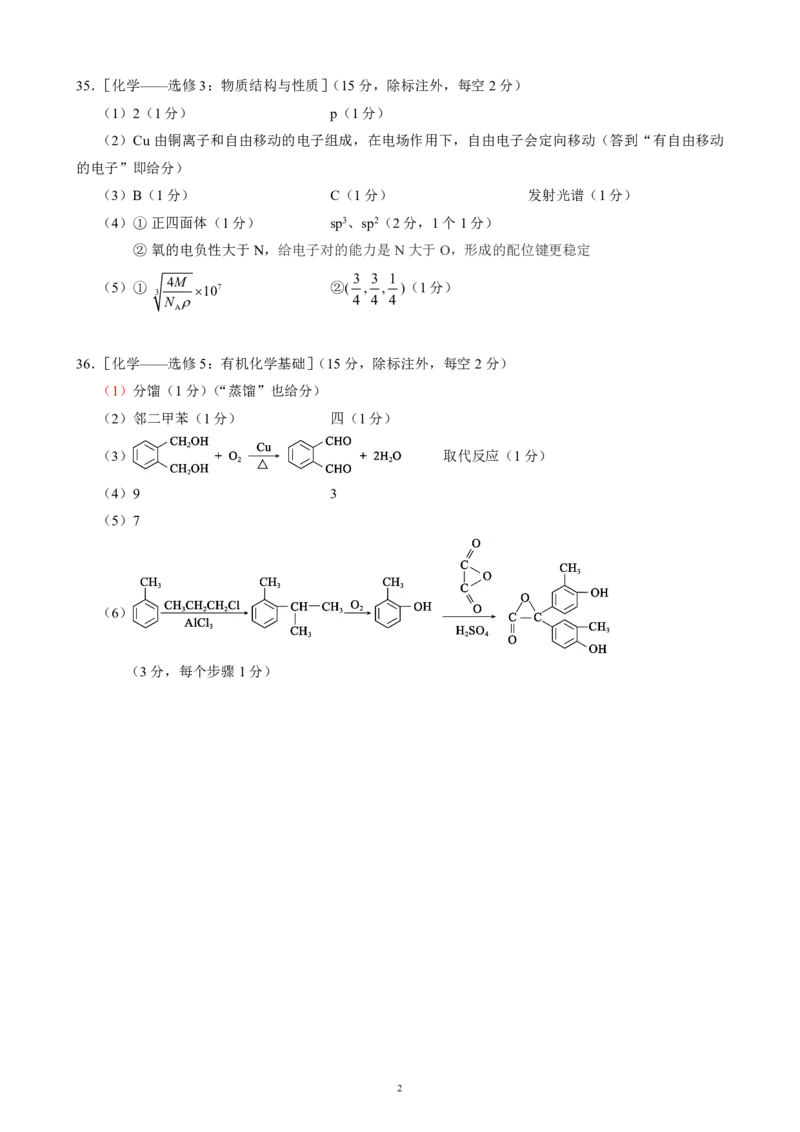
{#{QQABIY4QgggAABIAAQgCAwFICkIQkBEACAoORFAEIAIBCQFABAA=}#}35.[化学——选修3:物质结构与性质](15分,除标注外,每空2分)
(1)2(1分) p(1分)
(2)Cu由铜离子和自由移动的电子组成,在电场作用下,自由电子会定向移动(答到“有自由移动
的电子”即给分)
(3)B(1分) C(1分) 发射光谱(1分)
(4)① 正四面体(1分) sp3、sp2(2分,1个1分)
② 氧的电负性大于N,给电子对的能力是N大于O,形成的配位键更稳定
(5)①
3
4M 107 ②( 3 , 3 , 1 )(1分)
N 4 4 4
A
36.[化学——选修5:有机化学基础](15分,除标注外,每空2分)
(1)分馏(1分)(“蒸馏”也给分)
(2)邻二甲苯(1分) 四(1分)
(3) 取代反应(1分)
(4)9 3
(5)7
(6)
(3分,每个步骤1分)
2
{#{QQABIY4QgggAABIAAQgCAwFICkIQkBEACAoORFAEIAIBCQFABAA=}#}【解析】
7.C
向果蔬中喷洒乙烯有催熟作用,不可达到保鲜的目的,故选C。
8.D
用FeCl 溶液腐蚀印刷电路板的离子方程式为:Cu+2Fe3+=2Fe2++Cu2+,A错误;NH HCO 溶液与
3 4 3
少量Ba(OH) 溶液反应的离子方程式为:Ba2++2OH−+2HCO −=BaCO ↓+2H O,B错误;BaCl 溶液不
2 3 3 2 2
能与SO 气体反应,C错误;将2molCl 通入含3molFeBr 的溶液中发生的反应离子方程式为:4Cl +6Fe2+
2 2 2 2
+2Br−=8Cl−+6Fe3++Br ,D正确;故选D。
2
9.B
该物质有4个不饱和度,可以存在含苯环的同分异构体,故选B。
10.C
根据题目信息可推出M、N、X、Y、Z依次为C、O、F、Na、S,离子半径大小关系为:Na+M,D正确;
2 2 3 2 4
故选C
11.D
由题目信息可知该装置用SO 和O 反应提供电能,电解CO 制取HCOO−,故a、b、c、d电极分别
2 2 2
为负极、正极、阳极、阴极,a电极应通入SO ,b电极应通入O ,A错误;外电路电子的流向为:a→d,
2 2
c→b,B错误;SO 参与的电极反应式为:SO +2H O-2e−=SO 2−+4H+,C错误;电解一段时间后,B
2 2 2 4
装置左池产生H+,消耗溶液中的HCO −,KHCO 溶液浓度降低,D正确;故选D。
3 3
12.A
用Fe作催化剂,发生合成氨反应,通过湿润的红色石蕊试纸变蓝可检验NH ,A正确,MnO 是粉末
3 2
状固体,不可随关随停,B错误;用量气管准确测量气体体积应使两边液面相平再读数,C错误;D选项
的装置中的仪器为长颈漏斗,不能用手捂热试管检查该装置的气密性,D错误;故选A。
13.B
通过图中曲线①的坐标值可算出 10−5.5×10−1 = 10−6.5,通过图中曲线②的坐标值可算出 10−2×101 =
c(HA)
10−1.4,由于二元弱酸H A的K >K ,故曲线②代表pH与lg 的变化关系,A正确;物质的量浓
2 a1 a2
c(H A)
2
1014 1014
度相等的K A和KHA混合溶液中,A2−的水解常数K 107.5,HA−的水解常数K 1012.6,
2 h 106.5 h 101.4
HA−以电离为主,且HA−的电离程度大于A2−的水解程度,故离子浓度大小关系为:c(K+)>c(A2−)>c(HA−)>
K 101.4
c(H+)>c(OH−),B错误;常温下,H A的 a1 105.1,C正确;常温下pH=8的K A溶液中,水
2 K 106.5 2
a2
解促进水的电离,水电离产生的c(H+)为10−6mol·L−1,D正确;故选B。
26.
(1)低温焙烧的目的是除去废钒催化剂表面的有机物。
(2)为提高高温氧化的速率,可采取将原料粉碎或者搅拌,高温氧化可将+3价钒氧化为+5价钒,+2
价铁氧化为+3价铁,则V O ·FeO被氧化的化学方程式为:6V O ·FeO+5NaClO =6V O +3Fe O +5NaCl。
2 3 2 3 3 2 5 2 3
(3)浸取时产生的滤渣Ⅰ是三氧化二铁,可制取油漆或者冶炼铁。
3
{#{QQABIY4QgggAABIAAQgCAwFICkIQkBEACAoORFAEIAIBCQFABAA=}#}(4)沉铝时发生反应的离子方程式为:H O+AlO −+HCO −=Al(OH) +CO 2−。
2 2 3 3 3
(5)温度升高,氯化铵分解加快,沉钒率下降;或者温度升高,NH VO 的溶解度增大沉钒率下降。
4 3
1104 110710
当VO −刚好沉淀完全时,c(NH +)= =10mol·L−1,K = =1×10−4。
3 4 1105 b 1102
(6)根据SO 2−失电子等于VO +离子与MnO −得电子相等,设36.4gV O 中含xmolV O ,则2x×1+
3 2 4 2 5 2 5
1.6×25×10−3×5=2×100×10−3×2,x=0.1mol,V O 产品的纯度为50%
2 5
27.
(1)制钠珠时,溶剂不能与钠反应且沸点应高于钠的熔点,乙醇和水与钠能发生反应,苯的沸点比钠
的熔点低,故选用二甲苯。
(2)分离回收溶剂A采用倾倒法。
(3)乙醇钠是乙醇和钠反应生成的,故2CH CH OH+2Na→2CH CH ONa+H ↑,乙酸乙酯中乙醇含
3 2 3 2 2
量过少,生成的乙醇钠浓度过小,催化效率差,反应速率慢,乙酸乙酯中乙醇含量过多,又会使平衡逆向
移动,导致乙酰乙酸乙酯的产率降低。
(4)步骤④中加入饱和氯化钠溶液的目的是减小乙酰乙酸乙酯的溶解度,加入无水MgSO 的目的是
4
充分吸收有机物中的水。
(5)步骤⑤为蒸馏,不需要使用球形冷凝管和分液漏斗,乙酰乙酸乙酯的分解温度低于沸点,减小压
强,可将乙酰乙酸乙酯的沸点降低在分解温度以下,从而防止乙酰乙酸乙酯的分解。
28.
Ⅰ.(1)由盖斯定律可知,300℃时,氨气还原NO气体的热化学方程式可由3×③-2×①-3×②得到,
故答案为:4NH (g)+6NO(g) 5N (g)+6H O(g) ΔH=(3c-2a-3b)kJ·mol−1。
3 2 2
Ⅱ.(2)由于反应CH (g)+H O(g) CO(g)+3H (g) ΔH>0,ΔS>0,根据ΔG=ΔH-TΔS<0可知有利
4 2 2
于该反应自发进行的条件是高温。
(3)既能提高该反应的反应速率,也使能平衡正向移动的措施是升高温度、增加CH 或H O(g)的浓度。
4 2
(4)恒温条件下,在2L密闭容器中投入1molCH (g)和1molH O(g),反应5min时,若CH 的转化
4 2 4
率是50%,则生成的H 为1.5mol,则用H 表示的反应速率为0.15mol·L−1·min−1,因混合气体的总质量不
2 2
变,体积不变,混合气体的密度不是变量,故不能根据混合气体的密度不变判断平衡,若未平衡则混合气
体的总物质的量是变量,故混合气体的平均摩尔质量不变和容器内的总压不变可判断平衡;3ʋ (CH )=ʋ
正 4 逆
(H )才可判断平衡,故能判断该反应达到平衡的是BC。
2
Ⅲ.(5)4CO(g)+2NO (g) 4CO (g)+N (g),恒压条件下,按n(CO):n(NO )=2:1投料,反应达平衡时,
2 2 2 2
四种组分的物质的量分数随温度的变化如图所示。因按n(CO):n(NO )=2:1投料符合方程式的系数比,图
2
中纵坐标符合2:1的曲线,即a和c分别代表CO和NO ,纵坐标符合4:1的曲线,即b和d分别代表CO
2 2
和N ,故图中表示CO和CO 的曲线分别是a、b,由图可知,温度越高,CO和NO 物质的量分数越大,
2 2 2
可知平衡逆向移动,故正反应是放热反应。
4 4 2
(6)图中M点的纵坐标为 ,CO和CO 的物质的量分数均为 ,NO 的物质的量分数 ,N 的
2 2 2
11 11 11
4 1
( )4
物质的量分数 1 ,则用物质的量分数计算该反应的平衡常数K = 11 11 2.75。
x
11 4 2
( )4( )2
11 11
4
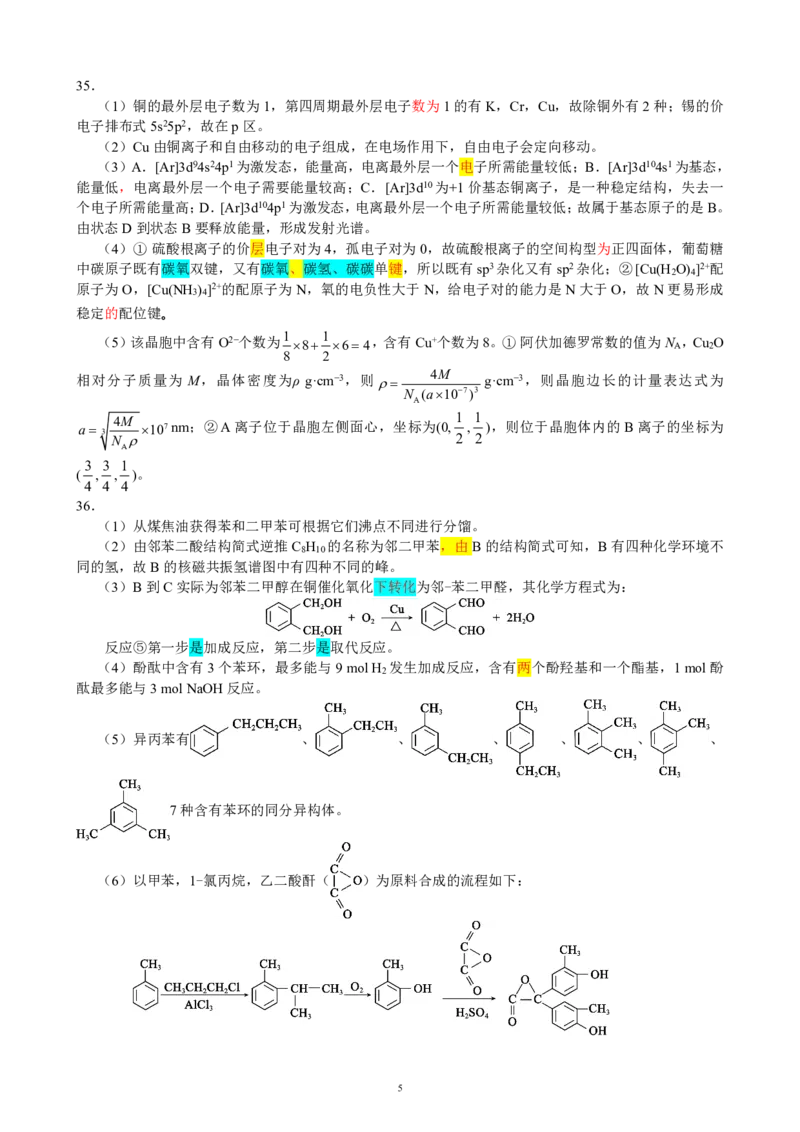
{#{QQABIY4QgggAABIAAQgCAwFICkIQkBEACAoORFAEIAIBCQFABAA=}#}35.
(1)铜的最外层电子数为1,第四周期最外层电子数为1的有K,Cr,Cu,故除铜外有2种;锡的价
电子排布式5s25p2,故在p区。
(2)Cu由铜离子和自由移动的电子组成,在电场作用下,自由电子会定向移动。
(3)A.[Ar]3d94s24p1为激发态,能量高,电离最外层一个电子所需能量较低;B.[Ar]3d104s1为基态,
能量低,电离最外层一个电子需要能量较高;C.[Ar]3d10为+1价基态铜离子,是一种稳定结构,失去一
个电子所需能量高;D.[Ar]3d104p1为激发态,电离最外层一个电子所需能量较低;故属于基态原子的是B。
由状态D到状态B要释放能量,形成发射光谱。
(4)① 硫酸根离子的价层电子对为4,孤电子对为0,故硫酸根离子的空间构型为正四面体,葡萄糖
中碳原子既有碳氧双键,又有碳氧、碳氢、碳碳单键,所以既有sp3杂化又有sp2杂化;②[Cu(H O) ]2+配
2 4
原子为O,[Cu(NH ) ]2+的配原子为N,氧的电负性大于N,给电子对的能力是N大于O,故N更易形成
3 4
稳定的配位键。
1 1
(5)该晶胞中含有O2−个数为 8 64 ,含有Cu+个数为8。① 阿伏加德罗常数的值为N A ,Cu 2 O
8 2
相对分子质量为 M,晶体密度为ρ g·cm−3,则 4M g·cm−3,则晶胞边长的计量表达式为
N (a107)3
A
a
3
4M 107nm;②A离子位于晶胞左侧面心,坐标为(0, 1 , 1 ),则位于晶胞体内的B离子的坐标为
N 2 2
A
3 3 1
( , , )。
4 4 4
36.
(1)从煤焦油获得苯和二甲苯可根据它们沸点不同进行分馏。
(2)由邻苯二酸结构简式逆推C H 的名称为邻二甲苯,由B的结构简式可知,B有四种化学环境不
8 10
同的氢,故B的核磁共振氢谱图中有四种不同的峰。
(3)B到C实际为邻苯二甲醇在铜催化氧化下转化为邻-苯二甲醛,其化学方程式为:
反应⑤第一步是加成反应,第二步是取代反应。
(4)酚酞中含有3个苯环,最多能与9molH 发生加成反应,含有两个酚羟基和一个酯基,1mol酚
2
酞最多能与3molNaOH反应。
(5)异丙苯有 、 、 、 、 、 、
7种含有苯环的同分异构体。
(6)以甲苯,1-氯丙烷,乙二酸酐( )为原料合成的流程如下:
5
{#{QQABIY4QgggAABIAAQgCAwFICkIQkBEACAoORFAEIAIBCQFABAA=}#}