文档内容
上师大附中闵行分校 2023 学年第二学期
高一化学期末试卷
可能用到的相对原子质量:
除不定向选择题含1至2个正确答案外,其余的选择题均含1个正确答案
一、元素周期律和元素周期表
1869年,俄国化学家门捷列夫编制了一份元素周期表,是化学发展史上的一个里程碑。元素周期表的意思
远远超出了化学领域本身,他体现了科学规律的本质。如图是元素周期表的一部分,回答下列问题:
B C
1. 元素周期表中位于金属和非金属的交界处,容易找到的元素是
A. 制备农药的元素 B. 用于制作半导体材料的元素
C. 耐高温的合金元素 D. 制备催化剂的元素
2. 已知核内有48个中子的硒的同位素,下列表示该核素的符号正确的是
.
A B. C. D.
3. 硒 被誉为“生命的奇效元素”,下列关于硒的描述不正确的是
A. 富硒大米中的“硒”指硒元素 B. 最高价氧化物是
C. 单质常温下呈固态 D. 硒原子最外层核外电子数为6
4. 人体内产生的活性氧能加速人体衰老,被称为“生命杀手”,化学家尝试用 及其他富硒物质清除
人体内的活性氧,此时 表现出___________性。
的
5. 原子半径是描述原子大小 参数之一,对元素的化学性质有较大影响,对于元素半径的研究在化学发展
中有着重要的意义和价值,几种短周期元素的原子半径及主要化合价如下表,请回答下列问题:
第1页/共13页
学科网(北京)股份有限公司① ② ③ ④ ⑤ ⑥ ⑦
原子半径 0.030 0.077 0.070 0.066 0.186 0.11 0.106
最外层电子数 1 4 1 5
常见化合价 -3、+5 -2 -2、+6
(1)元素 的气态氢化物与氯化氢反应生成的化合物,内部含有的化学键有___________,用其浓的水溶
液处理过的③舞台幕布不易着火,原因是:___________。
(2)元素 的某一种氧化物具有漂白性,将其通入少量紫色石蕊试液中会看到的实验现象是___________。
(3)元素⑦在周期表中的位置是___________。
(4)依据④所学,任意写出1种能体现元素非金属性 的事实___________。
⑥ ⑦
(5)依据上表,可预测 原子半径大小范围是___________。
二、铁及其化合物
铁是自然界中储量比较丰富的元素,是人类冶炼和使用最多的金属。四氧化三铁 磁性纳米颗粒
稳定、容易生产且用途广泛,是临床诊断、生物技术和环境化学领域多种潜在应用的有力工具。
的
6. 下列金属 冶炼原理错误的是
A. 2Al O 4Al +3O ↑ B. 2Na+CuSO=Cu+Na SO
2 3 2 4 2 4
C. Fe O +3CO 2Fe +3CO D. 2HgO 2Hg +O ↑
2 3 2 2
7. 铁粉在氧气中燃烧是制取 最为快捷的方法, 能和稀硫酸反应:
(1)生成的盐有___________。
(2)能检验上面反应后的溶液中是否含有 的试剂是___________。
A. 溶液 B. 溶液 C. 酸性 溶液 D. 溶液
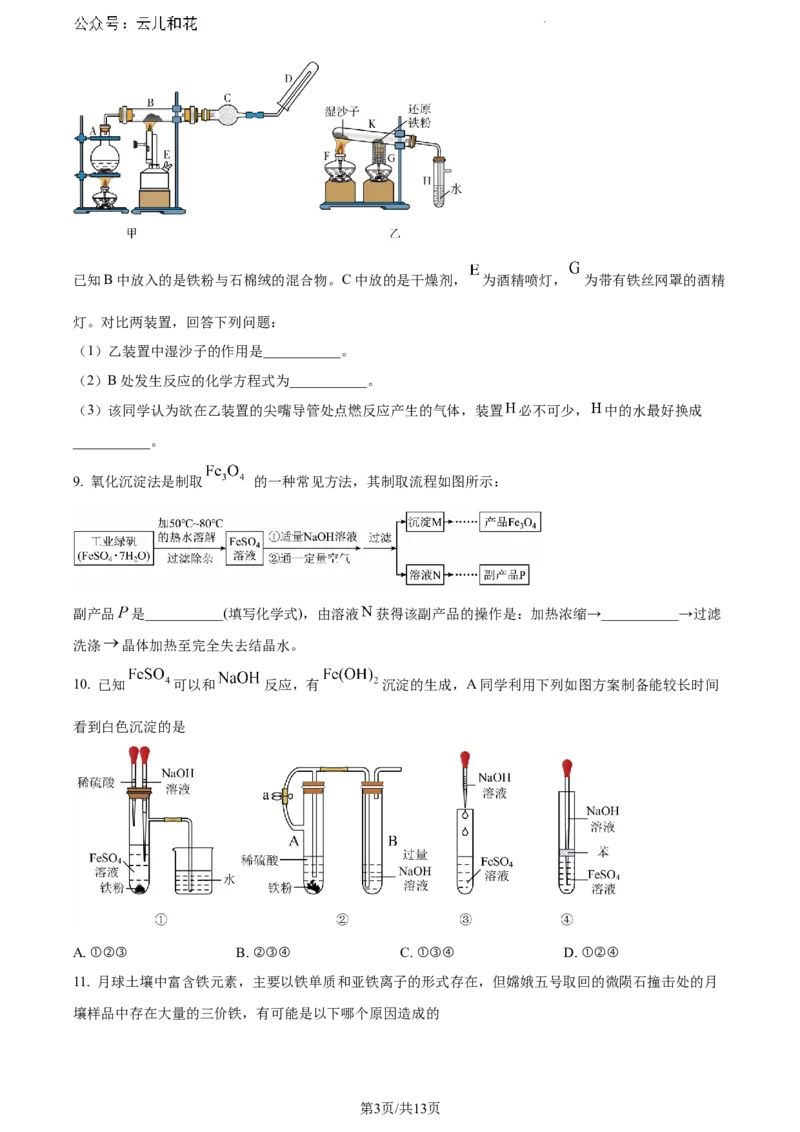
8. 某同学欲在实验室中完成 与水蒸气反应的实验,装置如图甲、乙所示
第2页/共13页
学科网(北京)股份有限公司已知B中放入的是铁粉与石棉绒的混合物。C中放的是干燥剂, 为酒精喷灯, 为带有铁丝网罩的酒精
灯。对比两装置,回答下列问题:
(1)乙装置中湿沙子的作用是___________。
(2)B处发生反应的化学方程式为___________。
(3)该同学认为欲在乙装置的尖嘴导管处点燃反应产生的气体,装置 必不可少, 中的水最好换成
___________。
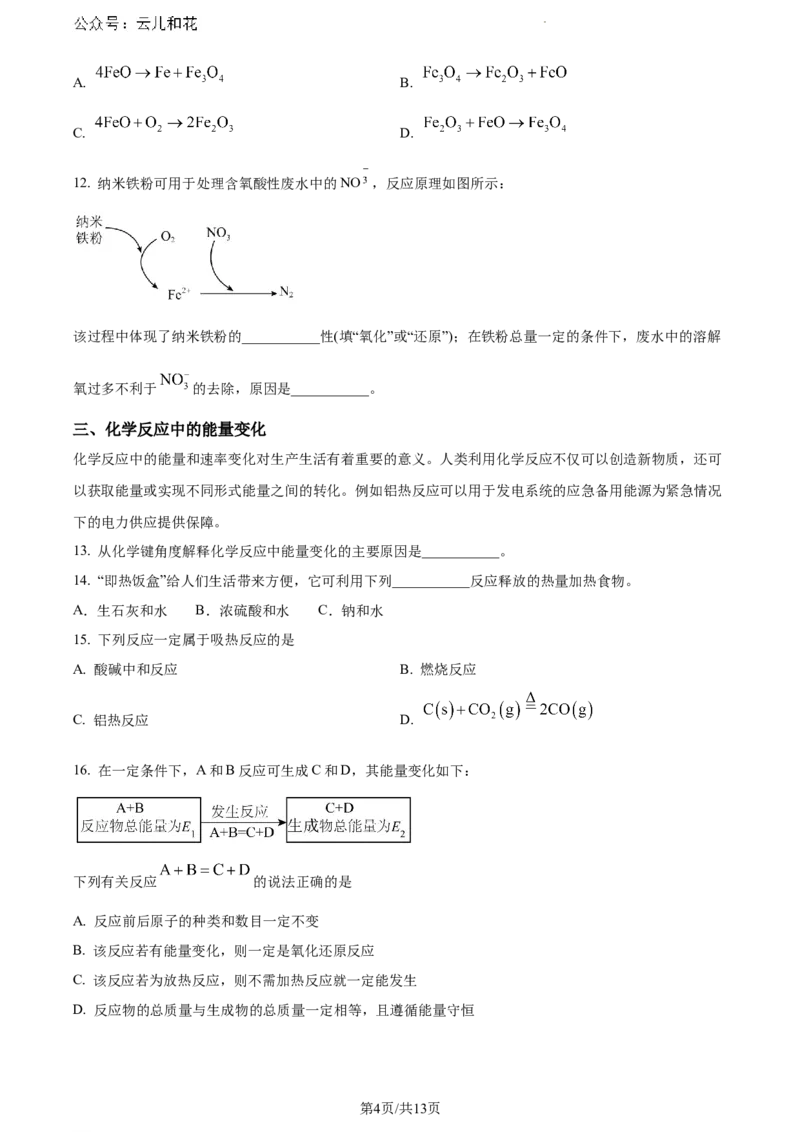
9. 氧化沉淀法是制取 的一种常见方法,其制取流程如图所示:
副产品 是___________(填写化学式),由溶液 获得该副产品的操作是:加热浓缩→___________→过滤
洗涤 晶体加热至完全失去结晶水。
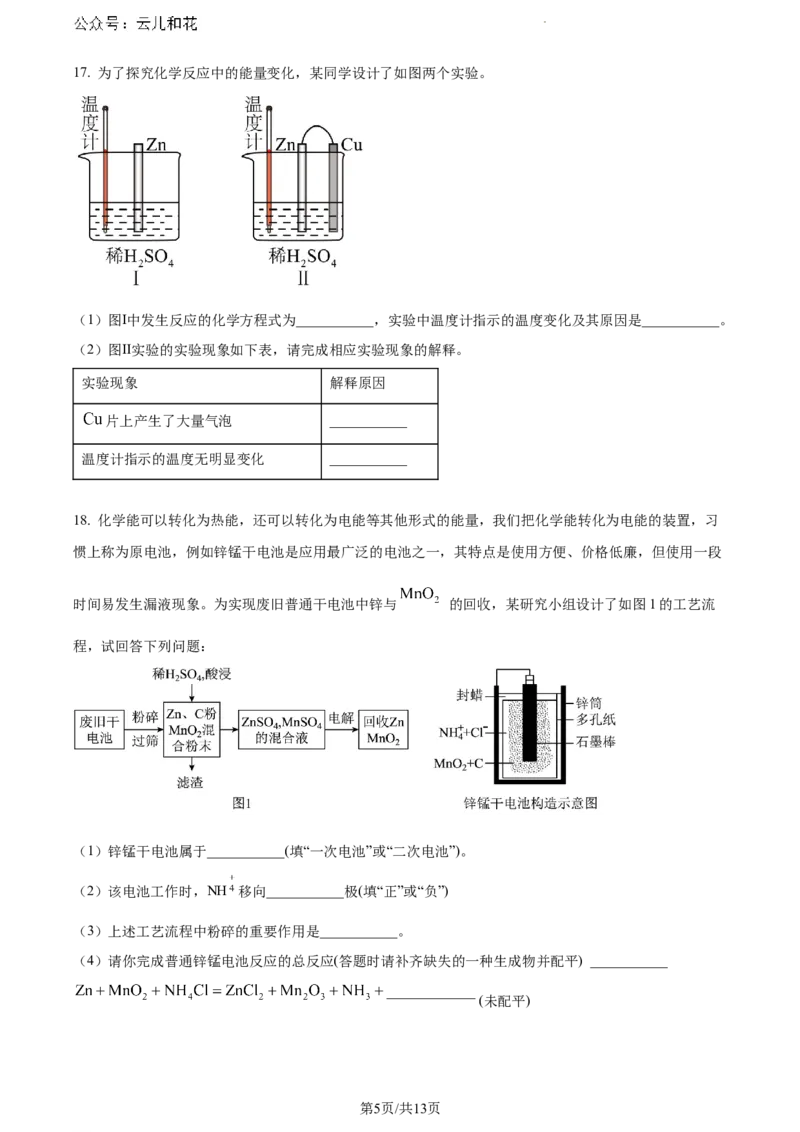
10. 已知 可以和 反应,有 沉淀的生成,A同学利用下列如图方案制备能较长时间
看到白色沉淀的是
A. ①②③ B. ②③④ C. ①③④ D. ①②④
11. 月球土壤中富含铁元素,主要以铁单质和亚铁离子的形式存在,但嫦娥五号取回的微陨石撞击处的月
壤样品中存在大量的三价铁,有可能是以下哪个原因造成的
第3页/共13页
学科网(北京)股份有限公司A. B.
C. D.
12. 纳米铁粉可用于处理含氧酸性废水中的NO ,反应原理如图所示:
该过程中体现了纳米铁粉的___________性(填“氧化”或“还原”);在铁粉总量一定的条件下,废水中的溶解
氧过多不利于 的去除,原因是___________。
三、化学反应中的能量变化
化学反应中的能量和速率变化对生产生活有着重要的意义。人类利用化学反应不仅可以创造新物质,还可
以获取能量或实现不同形式能量之间的转化。例如铝热反应可以用于发电系统的应急备用能源为紧急情况
下的电力供应提供保障。
13. 从化学键角度解释化学反应中能量变化的主要原因是___________。
14. “即热饭盒”给人们生活带来方便,它可利用下列___________反应释放的热量加热食物。
A.生石灰和水 B.浓硫酸和水 C.钠和水
15. 下列反应一定属于吸热反应的是
A. 酸碱中和反应 B. 燃烧反应
C. 铝热反应 D.
16. 在一定条件下,A和B反应可生成C和D,其能量变化如下:
下列有关反应 的说法正确的是
A. 反应前后原子的种类和数目一定不变
B. 该反应若有能量变化,则一定是氧化还原反应
C. 该反应若为放热反应,则不需加热反应就一定能发生
D. 反应物的总质量与生成物的总质量一定相等,且遵循能量守恒
第4页/共13页
学科网(北京)股份有限公司17. 为了探究化学反应中的能量变化,某同学设计了如图两个实验。
(1)图Ⅰ中发生反应的化学方程式为___________,实验中温度计指示的温度变化及其原因是___________。
(2)图Ⅱ实验的实验现象如下表,请完成相应实验现象的解释。
实验现象 解释原因
片上产生了大量气泡 ___________
温度计指示的温度无明显变化 ___________
18. 化学能可以转化为热能,还可以转化为电能等其他形式的能量,我们把化学能转化为电能的装置,习
惯上称为原电池,例如锌锰干电池是应用最广泛的电池之一,其特点是使用方便、价格低廉,但使用一段
时间易发生漏液现象。为实现废旧普通干电池中锌与 的回收,某研究小组设计了如图1的工艺流
程,试回答下列问题:
(1)锌锰干电池属于___________(填“一次电池”或“二次电池”)。
(2)该电池工作时,NH 移向___________极(填“正”或“负”)
(3)上述工艺流程中粉碎的重要作用是___________。
(4)请你完成普通锌锰电池反应的总反应(答题时请补齐缺失的一种生成物并配平) ___________
(未配平)
第5页/共13页
学科网(北京)股份有限公司四、化学反应速率
研究化学反应的速率,可以在实际生产中掌握各个环节的反应时间,最大限度地节约成本,提高收益,煤
化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
19. 某兴趣小组将除去氧化膜的镁条投入到少量稀盐酸中进行实验,实验测得氢气的产生速率变化情况如
图曲线所示,对该曲线 的原因是___________。
20. 工业上用 生产燃料甲醇,一定条件下发生反应 。
(1)图1是表示一定温度下,在体积为 的密闭容器中加入 和一定量的 后, 和
的浓度随时间变化情况。从反应开始到平衡,用 浓度变化表示平均反应速率
___________。
(2)图2表示该反应进行过程中能量的变化。曲线 表示不使用催化剂时反应的能量变化,曲线 表示使
用催化剂后的能量变化。请结合图像解释催化剂加快化学反应速率的原因___________,该反应消耗
第6页/共13页
学科网(北京)股份有限公司时,放出___________ 热量。
21. 固定和利用 能有效地利用资源,并减少空气中的温室气体。工业上有一种用 来生产甲醇燃
料的方法 。
(1)下列条件的改变能加快上述反应的反应速率的是___________。
A. 保持压强不变,充入 B. 保持容积不变,充入
C. 将容器的体积压缩 D. 保持容积不变,充入
(2)对于 的反应来说,以下化学反应速率的表示中,反应速率最快的是___________。
A. B.
C. D.
的
(3)下列关于有效碰撞理论与影响速率因素之间关系正确 是___________。
A. 增大反应物浓度,可以提高活化分子百分数,从而提高反应速率
B. 升高温度,可以提高活化分子的能量,会减慢反应速率
C. 加入催化剂可以降低活化能,活化分子百分比虽然没变,但可以加快反应速率
D. 通过压缩体积增大压强,可提高单位体积内活化分子数,从而提高反应速率
22. 控制变量法是化学实验的一种常用方法,下表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的
实验数据,分析以下数据,回答下列问题:
序号 锌的质量/g 锌的形式 c(H SO )/mol/L V(H SO )/mL 反应前溶液的温度/℃ 其他试剂
2 4 2 4
1 0.65 粒状 0.5 50 20 无
2 0.65 粉末 0.5 50 20 无
3 0.65 粒状 0.5 50 20 2滴CuSO 溶液
4
4 0.65 粉末 0.8 50 20 无
5 0.65 粉末 0.8 50 35 2滴CuSO 溶液
4
(1)判断锌和稀硫酸反应速率大小,最简单的方法可通过测定___________进行判断,在此5组实验中,
其速率最快的是___________(填实验序号)。
第7页/共13页
学科网(北京)股份有限公司(2)实验1和2表明___________对反应速率有影响,实验1和3对比发现实验3反应速率明显较快,主
要原因是___________。
五、钠及其化合物
钠的化合物是化工生产与科学研究的重要组成部分
23. 下列关于物质用途的说法中,不正确的是
A. 可在呼吸面具中作为氧气的来源 B. 在食品工业用作膨松剂
C. 可用于工业上制备 D. 在食品工业用作酸度调节剂
24. 将 、 、 、 长时间露置在空气中,最终都会变为___________(填化学式)。
的
由我国自主研发 “奋斗者号”潜水艇在太平洋马里亚纳海沟成功坐底,创造了中国载人深潜的新纪录。
25. 过氧化钠可用作潜水艇的供氧剂, 中阳离子与阴离子的个数之比为___________;写出
和 反应中每生成 时,转移的___________个电子。
26. 将一定量的 固体投入到含有下列离子的溶液中: ,反应完毕后,溶
液中上述离子数目几乎不变的有___________(填离子符号)。
27. 向酸性 溶液中加入 粉末,观察到溶液褪色,发生如下反应:补全方程式并配平。
___________
___________ ___________ ___________ ___________ ___________
___________ ___________
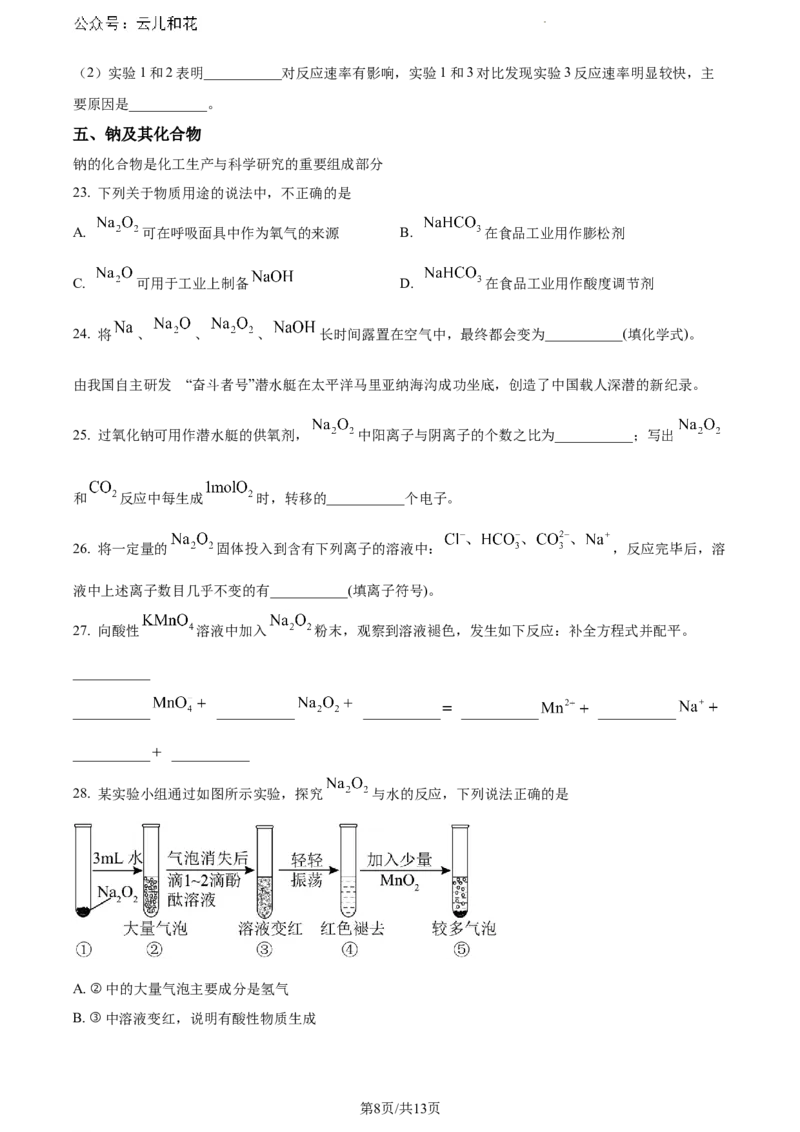
28. 某实验小组通过如图所示实验,探究 与水的反应,下列说法正确的是
A. ②中的大量气泡主要成分是氢气
B. ③中溶液变红,说明有酸性物质生成
第8页/共13页
学科网(北京)股份有限公司C. ④中现象可能是由于溶液中含有强氧化性物质造成的
D. ⑤中 的主要作用是验证溶液中存在过氧化氢
29. 科学家设计出烧碱溶液捕捉 法,原理如图所示:
(1)下列溶液中,也能用作“捕捉”二氧化碳试剂的是___________。
A. 溶液 B. 溶液 C. 溶液 D. 稀硫酸
(2)上述流程中,被循环利用的物质有和 和___________,请说明 循环利用的途径:
___________。
(3)现有 溶液,若喷酒完上述 溶液后,测得吸收液中
,则被吸收的 在标准状况下的体积为___________ 。(请书写计算
过程)
第9页/共13页
学科网(北京)股份有限公司上师大附中闵行分校 2023 学年第二学期
高一化学期末试卷
可能用到的相对原子质量:
除不定向选择题含1至2个正确答案外,其余的选择题均含1个正确答案
一、元素周期律和元素周期表
1869年,俄国化学家门捷列夫编制了一份元素周期表,是化学发展史上的一个里程碑。元素周期表的意思
远远超出了化学领域本身,他体现了科学规律的本质。如图是元素周期表的一部分,回答下列问题:
B C
【1题答案】
【答案】B
【2题答案】
【答案】D
【3题答案】
【答案】B
【4题答案】
【答案】还原
【5题答案】
【答案】(1) ①. 离子键、共价键 ②. 氯化铵分解吸收热量,使温度降低至着火点以下,同时生
成氯化氢和氨气可以隔绝空气
(2)溶液变红色,不褪色
(3)第二周期第VIA族
(4)氧化性:S>P ;稳定性:HS>PH ;酸性:HSO >HPO 中的任一个
2 3 2 4 3 4
(5)0.110 nm~ 0.186 nm二、铁及其化合物
第10页/共13页
学科网(北京)股份有限公司铁是自然界中储量比较丰富的元素,是人类冶炼和使用最多的金属。四氧化三铁 磁性纳米颗粒
稳定、容易生产且用途广泛,是临床诊断、生物技术和环境化学领域多种潜在应用的有力工具。
【6题答案】
【答案】B
【7题答案】
【答案】(1)FeSO 和Fe (SO ) (2)C
4 2 4 3
【8题答案】
【答案】(1)提供水蒸气
(2)3Fe+4H O(g) Fe O+4H
2 3 4 2
(3)浓硫酸
【9题答案】
【答案】 ①. NaSO ②. 冷却结晶
2 4
【10题答案】
【答案】D
【11题答案】
【答案】A
【12题答案】
【答案】 ①. 还原 ②. Fe2+会被O 氧化为Fe3+,导致Fe2+含量减少,不利于还原
2
三、化学反应中的能量变化
化学反应中的能量和速率变化对生产生活有着重要的意义。人类利用化学反应不仅可以创造新物质,还可
以获取能量或实现不同形式能量之间的转化。例如铝热反应可以用于发电系统的应急备用能源为紧急情况
下的电力供应提供保障。
【13题答案】
【答案】断开化学键要吸收能量,形成化学键要释放能量
【14题答案】
【答案】A
【15题答案】
【答案】D
【16题答案】
【答案】AD
第11页/共13页
学科网(北京)股份有限公司【17题答案】
【答案】(1) ①. Zn+HSO =ZnSO +H↑ ②. 升高 锌与稀硫酸反应是放热反应
2 4 4 2
(2) ①. Zn、Cu构成原电池,H+在Cu片上得电子产生氢气 ②. 反应中的化学能主要转化成了电
能
【18题答案】
【答案】(1)一次电池
(2)正 (3)加快反应的速率
(4)
四、化学反应速率
研究化学反应的速率,可以在实际生产中掌握各个环节的反应时间,最大限度地节约成本,提高收益,煤
化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
【19题答案】
【答案】盐酸的浓度减小,使化学反应速率减小
【20题答案】
【答案】(1)0.15mol·L-1·min-1
(2) ①. 加入催化剂,使得反应的活化能有了较为明显的下降 ②. 91000
【21题答案】
【答案】(1)CD (2)B (3)D
【22题答案】
【答案】(1) ①. 锌完全消失所需时间 ②. 5
(2) ①. 固体表面积 ②. 锌会置换出少量的金属铜,在该条件下构成了原电池,加快了反应速率
五、钠及其化合物
钠的化合物是化工生产与科学研究的重要组成部分
【23题答案】
【答案】C
【24题答案】
【答案】NaCO
2 3
由我国自主研发的“奋斗者号”潜水艇在太平洋马里亚纳海沟成功坐底,创造了中国载人深潜的新纪录。
【25题答案】
【答案】 ①. 2:1 ②. 2N
A
【26题答案】
【答案】Cl-
第12页/共13页
学科网(北京)股份有限公司【27题答案】
【答案】2 +5Na O+16H+=2Mn2++10Na++5O ↑+8H O
2 2 2 2
【28题答案】
【答案】CD
【29题答案】
【答案】(1)B (2) ①. CaO ②. NaOH溶液与CO 反应生成碳酸钠、碳酸氢钠溶液,碳酸
2
钠和碳酸氢钠溶液中加入CaO,CaO先与水反应生成Ca(OH) ,Ca(OH) 与碳酸钠、碳酸氢钠反应生成氢氧
2 2
化钠和碳酸钙,生成的氢氧化钠溶液再循环利用
(3)10.08
第13页/共13页
学科网(北京)股份有限公司