文档内容
2023—2024 学年度下学期教学质量监测
高一年级化学试题卷
(考试时间:90分钟;满分:100分)
注意事项:
1.本卷为试题卷,考生必须在答题卡上解题作答,答案书写在答题卡相应位置,在试题卷、
草稿纸上作答无效。选择题作答必须用2B铅笔填涂。
2.考试结束后,请将答题卡交给监考教师。
可能用到的相对原子质量:Al-27
第Ⅰ卷选择题
一、选择题(共18小题,每小题3分,共计54分。注意每小题只有一个选项符合题意)
1. 《厉害了,我的国》展示了中国探索太空,开发深海,建设世界第一流的高铁、桥梁、码头,5G技术
联通世界等取得的举世瞩目的成就,它们与化学有着密切联系。下列说法不正确的是
A. 耐高温、耐腐蚀的合金材料,科学家们是从元素周期表中过渡元素去寻找的
B. 我国提出网络强国战略,光纤线路总长超过三千万公里,光纤的主要成分是二氧化硅
C. 我国“硅—石墨烯—锗高速晶体管”技术获重大突破,C、Si、Ge都是主族元素
D. 物质发生化学反应时都伴随着能量变化,伴随能量变化的变化一定是化学变化
2. 下列化学用语表达正确的是
A. CO 的结构式:O-C-O B. HClO的电子式:H:O:Cl
2
C. NH Cl 的电子式为: D. 中子数为8的氮原子:
4
3. 在给定条件下,下列选项所示的物质间转化均能实现的是
A.
B.
C.
D.
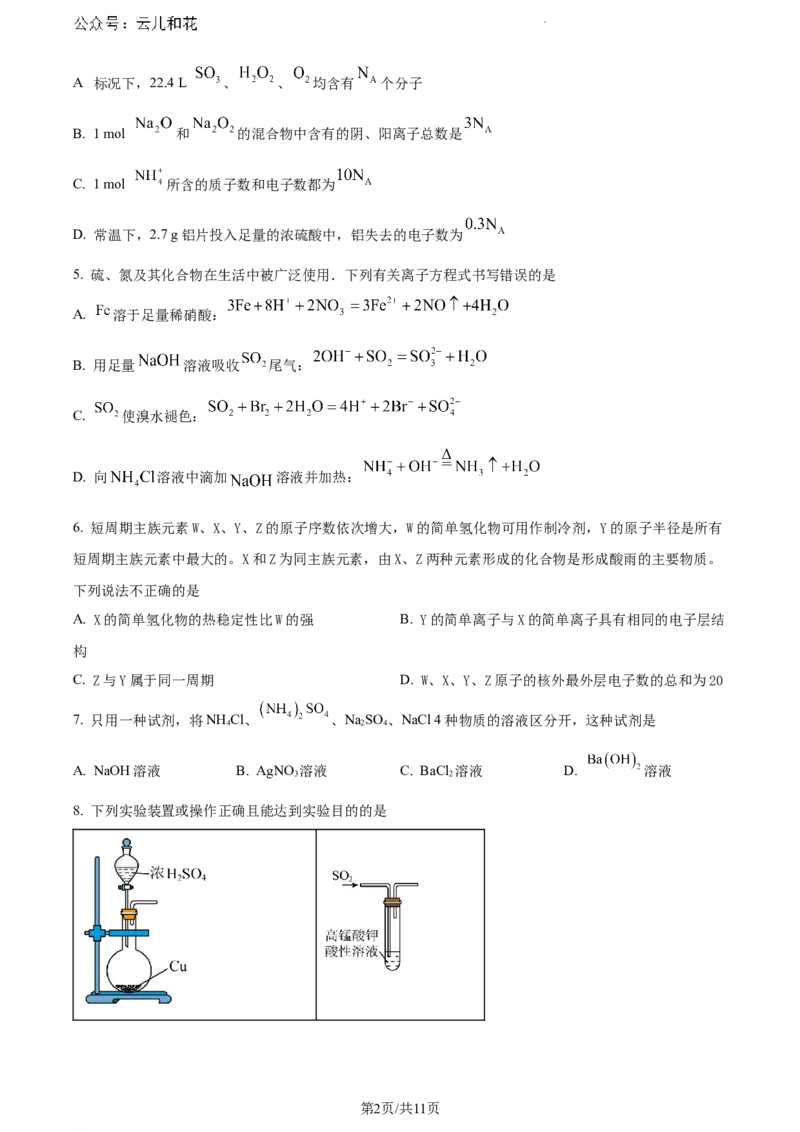
4. 设 为阿伏加德罗常数的值,下列叙述中正确的是
第1页/共11页
学科网(北京)股份有限公司.
A 标况下,22.4 L 、 、 均含有 个分子
B. 1 mol 和 的混合物中含有的阴、阳离子总数是
C. 1 mol 所含的质子数和电子数都为
D. 常温下,2.7 g铝片投入足量的浓硫酸中,铝失去的电子数为
5. 硫、氮及其化合物在生活中被广泛使用.下列有关离子方程式书写错误的是
A. 溶于足量稀硝酸:
B. 用足量 溶液吸收 尾气:
C. 使溴水褪色:
D. 向 溶液中滴加 溶液并加热:
6. 短周期主族元素W、X、Y、Z的原子序数依次增大,W的简单氢化物可用作制冷剂,Y的原子半径是所有
短周期主族元素中最大的。X和Z为同主族元素,由X、Z两种元素形成的化合物是形成酸雨的主要物质。
下列说法不正确的是
A. X的简单氢化物的热稳定性比W的强 B. Y的简单离子与X的简单离子具有相同的电子层结
构
C. Z与Y属于同一周期 D. W、X、Y、Z原子的核外最外层电子数的总和为20
7. 只用一种试剂,将NH Cl、 、NaSO 、NaCl 4种物质的溶液区分开,这种试剂是
4 2 4
A. NaOH溶液 B. AgNO 溶液 C. BaCl 溶液 D. 溶液
3 2
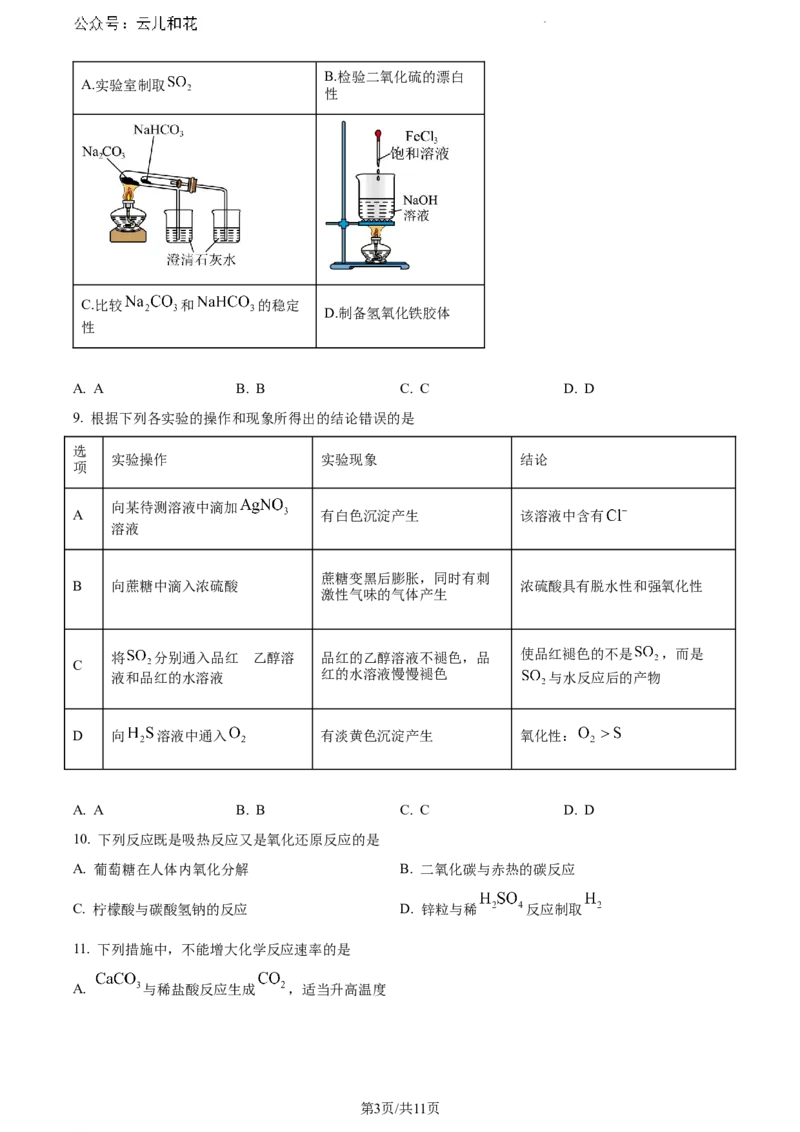
8. 下列实验装置或操作正确且能达到实验目的的是
第2页/共11页
学科网(北京)股份有限公司B.检验二氧化硫的漂白
A.实验室制取
性
C.比较 和 的稳定
D.制备氢氧化铁胶体
性
A. A B. B C. C D. D
9. 根据下列各实验的操作和现象所得出的结论错误的是
选
实验操作 实验现象 结论
项
向某待测溶液中滴加
A 有白色沉淀产生 该溶液中含有
溶液
蔗糖变黑后膨胀,同时有刺
B 向蔗糖中滴入浓硫酸 浓硫酸具有脱水性和强氧化性
激性气味的气体产生
将 分别通入品红 乙的醇溶 品红的乙醇溶液不褪色,品 使品红褪色的不是 ,而是
C
液和品红的水溶液 红的水溶液慢慢褪色 与水反应后的产物
D 向 溶液中通入 有淡黄色沉淀产生 氧化性:
A. A B. B C. C D. D
10. 下列反应既是吸热反应又是氧化还原反应的是
A. 葡萄糖在人体内氧化分解 B. 二氧化碳与赤热的碳反应
C. 柠檬酸与碳酸氢钠的反应 D. 锌粒与稀 反应制取
11. 下列措施中,不能增大化学反应速率的是
A. 与稀盐酸反应生成 ,适当升高温度
第3页/共11页
学科网(北京)股份有限公司B. Al在 中燃烧生成 ,用铝粉代替铝片
C. Zn与稀硫酸反应制取 时,加入蒸馏水
D. 分解制取 时,添加少量
12. 一定条件下的密闭容器中,发生可逆反应2A(g)+B(g) 3C(g)。下列情况不能说明该反应一定达到化
学平衡的是
A. A(g)、B(g)和C(g)的物质的量之比为2:1:3
B. B(g)的物质的量保持不变
C. 正反应和逆反应的速率相等
D. A(g)的质量保持不变
13. 反应 己经达到平衡状态时,下列关系成立的是
A. B.
C. D.
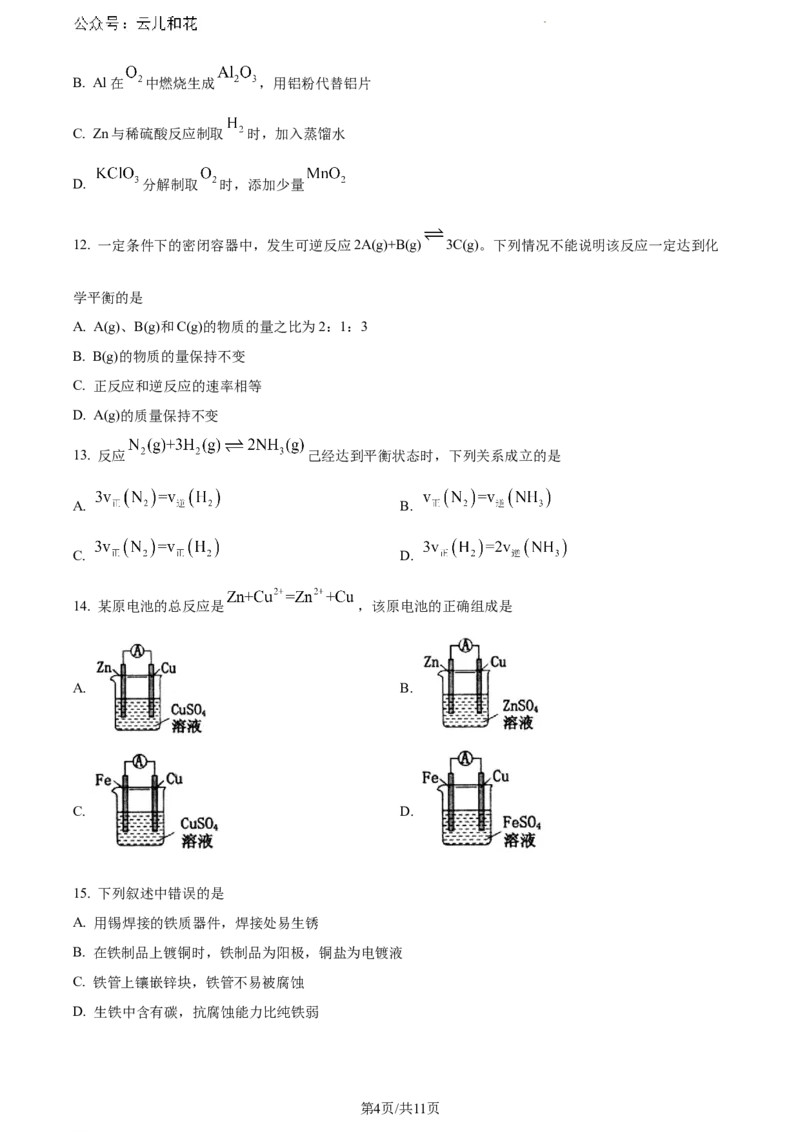
14. 某原电池的总反应是 ,该原电池的正确组成是
A. B.
C. D.
15. 下列叙述中错误的是
A. 用锡焊接的铁质器件,焊接处易生锈
B. 在铁制品上镀铜时,铁制品为阳极,铜盐为电镀液
C. 铁管上镶嵌锌块,铁管不易被腐蚀
D. 生铁中含有碳,抗腐蚀能力比纯铁弱
第4页/共11页
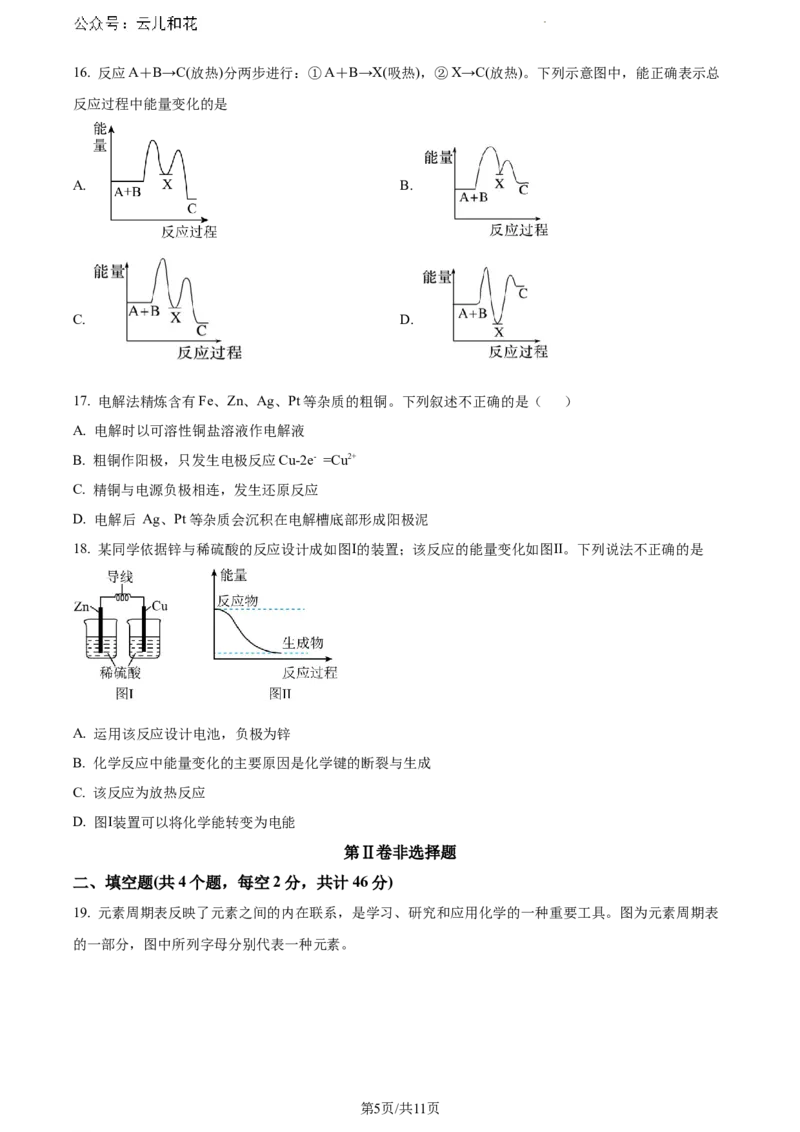
学科网(北京)股份有限公司16. 反应A+B→C(放热)分两步进行:①A+B→X(吸热),②X→C(放热)。下列示意图中,能正确表示总
反应过程中能量变化的是
A. B.
C. D.
17. 电解法精炼含有Fe、Zn、Ag、Pt等杂质的粗铜。下列叙述不正确的是( )
A. 电解时以可溶性铜盐溶液作电解液
B. 粗铜作阳极,只发生电极反应Cu-2e- =Cu2+
C. 精铜与电源负极相连,发生还原反应
D. 电解后 Ag、Pt等杂质会沉积在电解槽底部形成阳极泥
18. 某同学依据锌与稀硫酸的反应设计成如图Ⅰ的装置;该反应的能量变化如图Ⅱ。下列说法不正确的是
A. 运用该反应设计电池,负极为锌
B. 化学反应中能量变化的主要原因是化学键的断裂与生成
C. 该反应为放热反应
D. 图Ⅰ装置可以将化学能转变为电能
第Ⅱ卷非选择题
二、填空题(共4个题,每空2分,共计46分)
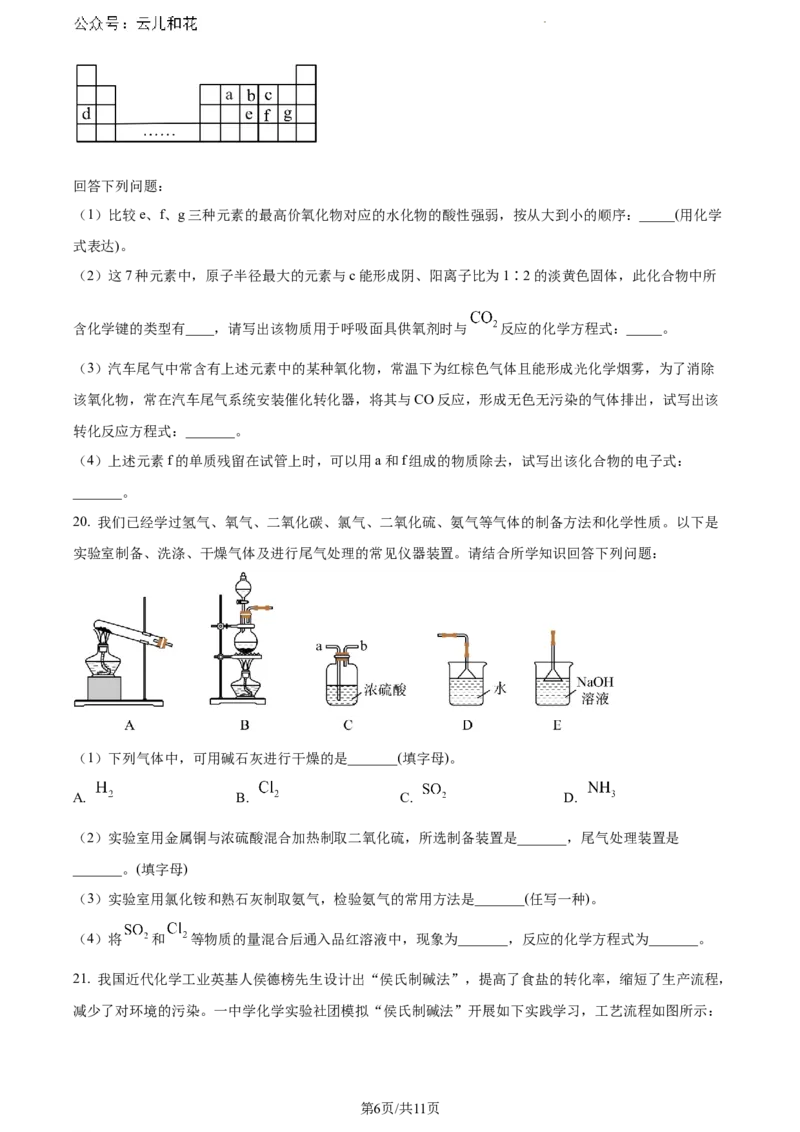
19. 元素周期表反映了元素之间的内在联系,是学习、研究和应用化学的一种重要工具。图为元素周期表
的一部分,图中所列字母分别代表一种元素。
第5页/共11页
学科网(北京)股份有限公司回答下列问题:
(1)比较e、f、g三种元素的最高价氧化物对应的水化物的酸性强弱,按从大到小的顺序:_____(用化学
式表达)。
(2)这7种元素中,原子半径最大的元素与c能形成阴、阳离子比为1∶2的淡黄色固体,此化合物中所
含化学键的类型有____,请写出该物质用于呼吸面具供氧剂时与 反应的化学方程式:_____。
(3)汽车尾气中常含有上述元素中的某种氧化物,常温下为红棕色气体且能形成光化学烟雾,为了消除
该氧化物,常在汽车尾气系统安装催化转化器,将其与CO反应,形成无色无污染的气体排出,试写出该
转化反应方程式:_______。
(4)上述元素f的单质残留在试管上时,可以用a和f组成的物质除去,试写出该化合物的电子式:
_______。
20. 我们已经学过氢气、氧气、二氧化碳、氯气、二氧化硫、氨气等气体的制备方法和化学性质。以下是
实验室制备、洗涤、干燥气体及进行尾气处理的常见仪器装置。请结合所学知识回答下列问题:
(1)下列气体中,可用碱石灰进行干燥的是_______(填字母)。
A. B. C. D.
(2)实验室用金属铜与浓硫酸混合加热制取二氧化硫,所选制备装置是_______,尾气处理装置是
_______。(填字母)
(3)实验室用氯化铵和熟石灰制取氨气,检验氨气的常用方法是_______(任写一种)。
(4)将 和 等物质的量混合后通入品红溶液中,现象为_______,反应的化学方程式为_______。
21. 我国近代化学工业英基人侯德榜先生设计出“侯氏制碱法”,提高了食盐的转化率,缩短了生产流程,
减少了对环境的污染。一中学化学实验社团模拟“侯氏制碱法”开展如下实践学习,工艺流程如图所示:
第6页/共11页
学科网(北京)股份有限公司(1)上述制备纯碱( )的实验过程中,可以循环使用的物质是_______(填化学式)。
的
(2)氨化和碳酸化过程在如图所示装置中进行,a导管应通入 气体是_______(填“ ”或“ ”),
仪器c的作用是_______。
(3)写出煅烧固体 时发生的化学方程式:_______。
(4)工业上可以用氨生产尿素,其方程式为 ,一定温
度下,将1 mol 和2 mol 充入体积为1 L 的密闭容器中,5 min后测得 的物质的量为0.6
mol,则:
①对上述反应,若适当升高温度,化学反应速率会_______(填“增大”或“减小”)。
②用 的浓度变化表示该反应的平均速率为_______mol/(L·min)。
22. 研究化学能与热能、电能的转化具有重要价值。请回答:
(1) 的反应过程如图所示:
该反应为_______(填“放热”或“吸热”)反应。
(2)甲醇( )可作为燃料电池的原料。以 和 为原料,通过下列反应来制备甲醇:
Ⅰ: kJ⋅mol-1。
Ⅱ: kJ⋅mol-1。
第7页/共11页
学科网(北京)股份有限公司与 反应生成 和 的热化学方程式为_______。
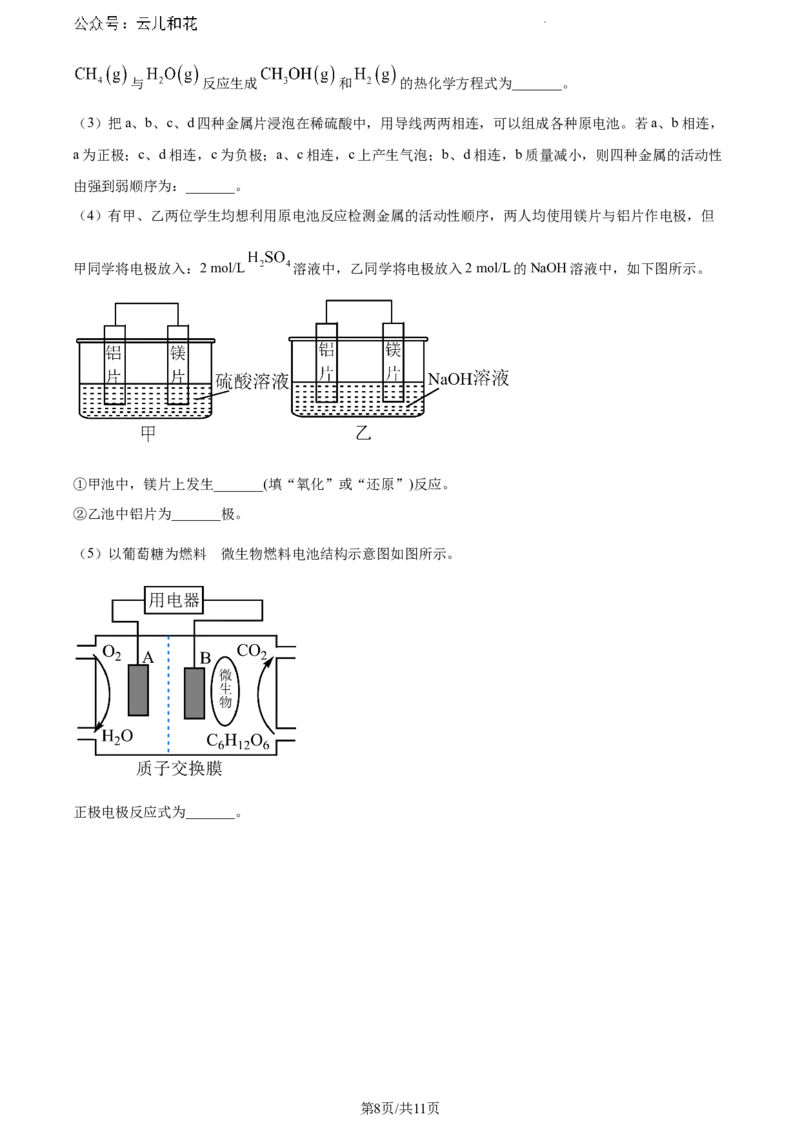
(3)把a、b、c、d四种金属片浸泡在稀硫酸中,用导线两两相连,可以组成各种原电池。若a、b相连,
a为正极;c、d相连,c为负极;a、c相连,c上产生气泡;b、d相连,b质量减小,则四种金属的活动性
由强到弱顺序为:_______。
(4)有甲、乙两位学生均想利用原电池反应检测金属的活动性顺序,两人均使用镁片与铝片作电极,但
甲同学将电极放入:2 mol/L 溶液中,乙同学将电极放入2 mol/L的NaOH溶液中,如下图所示。
①甲池中,镁片上发生_______(填“氧化”或“还原”)反应。
②乙池中铝片为_______极。
的
(5)以葡萄糖为燃料 微生物燃料电池结构示意图如图所示。
正极电极反应式为_______。
第8页/共11页
学科网(北京)股份有限公司2023—2024 学年度下学期教学质量监测
高一年级化学试题卷
(考试时间:90分钟;满分:100分)
注意事项:
1.本卷为试题卷,考生必须在答题卡上解题作答,答案书写在答题卡相应位置,在试题卷、
草稿纸上作答无效。选择题作答必须用2B铅笔填涂。
2.考试结束后,请将答题卡交给监考教师。
可能用到的相对原子质量:Al-27
第Ⅰ卷选择题
一、选择题(共18小题,每小题3分,共计54分。注意每小题只有一个选项符合题意)
【1题答案】
【答案】D
【2题答案】
【答案】D
【3题答案】
【答案】C
【4题答案】
【答案】B
【5题答案】
【答案】A
【6题答案】
【答案】D
【7题答案】
【答案】D
【8题答案】
【答案】C
【9题答案】
【答案】A
【10题答案】
【答案】B
【11题答案】
第9页/共11页
学科网(北京)股份有限公司【答案】C
【12题答案】
【答案】A
【13题答案】
【答案】A
【14题答案】
【答案】A
【15题答案】
【答案】B
【16题答案】
【答案】A
【17题答案】
【答案】B
【18题答案】
【答案】D
第Ⅱ卷非选择题
二、填空题(共4个题,每空2分,共计46分)
【19题答案】
【答案】(1)
(2) ①. 离子键、非极性共价键 ②.
(3)
(4)
【20题答案】
【答案】(1)AD (2) ①. B ②. E
(3)用湿润的红色石蕊试纸,若变蓝,证明是氨气
(4) ①. 品红不会褪色 ②.
【21题答案】
【答案】(1)CO (2) ①. ②. 吸收尾气,防止污染空气
2
第10页/共11页
学科网(北京)股份有限公司(3)
(4) ①. 增大 ②. 0.12
【22题答案】
【答案】(1)放热 (2)
(3)b>a>c>d (4) ①. 氧化 ②. 负
(5)
第11页/共11页
学科网(北京)股份有限公司