文档内容
江西省名校联盟 2023-2024 学年高一上学期 10 月质量检测
化学试题
考生注意:
1.本试卷分选择题和非选择题两部分。满分 100分,考试时间 75分钟。
2.答题前,考生务必用直径 0.5毫米黑色墨水签字笔将密封线内项目填写清楚。
3.考生作答时,请将答案答在答题卡上。选择题每小题选出答案后,用 2B铅笔把答题卡上对
应题目的答案标号涂黑;非选择题请用直径 0.5毫米黑色墨水签
字笔在答题卡上各题的答题区域内作答,超出答题区域书写的答案无效,在试题卷、草稿纸
............. .... ...
上
.
作
.
答
.
无
.
效
.
。
4.本卷命题范围:人教版必修第一册第一章。
5.可能用到的相对原子质量:H 1 C 12 O 16 Cl 35.5 Fe 56 Cu 64
一、选择题(本题共 15小题,每小题 3分,共计 45分。在每小题列出的四个选项中,只有一
项是符合题目要求的)
1. 我国海洋资源丰富。下列有关说法错误的是
A. 海底开采的石油属于纯净物 B. 海洋生物的呼吸作用属于化学变化
C. 高温煅烧贝壳可以制生石灰 D. 海水是一种比较复杂的分散系
2. 下列分散系中分散质粒子直径最小的是
A. 氢氧化铁悬浊液 B. 氢氧化铁胶体 C. 雾 D. 硫酸铜溶液
3. 下.列反应中属于氧化还原反应的是
Δ
A. NH +HCl=NH Cl B. 2Fe(OH) Fe O +3H O
3 4 3 2 3 2
高温
C. 3Fe+4H O(g) Fe O +4H D. CaCO +2HCl=CaCl +H O+CO ↑
2 3 4 2 3 2 2 2
4. 下列物质的分类错误的是
A. 纯碱——钠盐 B. 氢氧化铁胶体——纯净物
C H SO ——电解质 D. H O——氧化物
2 4 2
5. 在太空舱里,常用NiFe O 作催化剂将宇航员呼出的CO 转化为O ,NiFe O 中Ni的化合价为+2价。
2 4 2 2 2 4
下列说法中正确的是
A. NiFe O 中Fe为+6价 B. 将CO 转化为O ,一定发生了氧化还原反应
2 4 2 2
第1页/共8页
学科网(北京)股份有限公司C. NiFe O 属于氧化物 D. CO 与CO是同素异形体
2 4 2
6. 判断下列有关化学基本概念的本质依据正确的是
.
A. 纯净物与混合物:是否仅含有一种元素
B. 溶液与胶体:能否发生丁达尔效应
C. 氧化还原反应:元素化合价是否变化
D. 电解质与非电解质:水溶液中或熔融状态下能否导电的化合物
7. 下列物质溶于水,其电离方程式正确的是
A. NaHCO =Na+ +H+ +CO2− B. (NH ) SO =NH+ +SO2−
3 3 4 2 4 4 4
C NH Cl=NH+ +Cl− D. Ca(OH) =Ca2+ +OH−
4 4 2 2
8. 工业上制取ClO 的化学反应:2NaClO +SO +H SO =2ClO +2NaHSO 。下列说法正确的是
2 3 2 2 4 2 4
A. SO 在反应中被氧化
2
B. NaClO 在反应中失去电子
3
C. H SO 在反应中作氧化剂
2 4
D. 每生成1个ClO ,转移2个电子
2
9. 下列转化过程中(线上为所加物质)加入还原剂的是
Ca(OH) HCl
A. Cl ⎯⎯⎯⎯⎯2→CaCl B. Na SO ⎯⎯⎯→SO
2 2 2 3 2
O Fe
C. Na⎯⎯2⎯→Na O D. FeCl ⎯⎯→FeCl
2 3 2
10. 室温下,下列各组离子在指定溶液中能大量共存的是
A. 含FeSO 的溶液中:K+、Na+、Cl−
4
B. NaOH溶液中:Mg2+、SO2−、Cl−
4
C. 含NaHCO 溶液中:H+、SO2−、NO−
3 4 3
D. 稀盐酸中:Ba2的+、Ag+、NO−
3
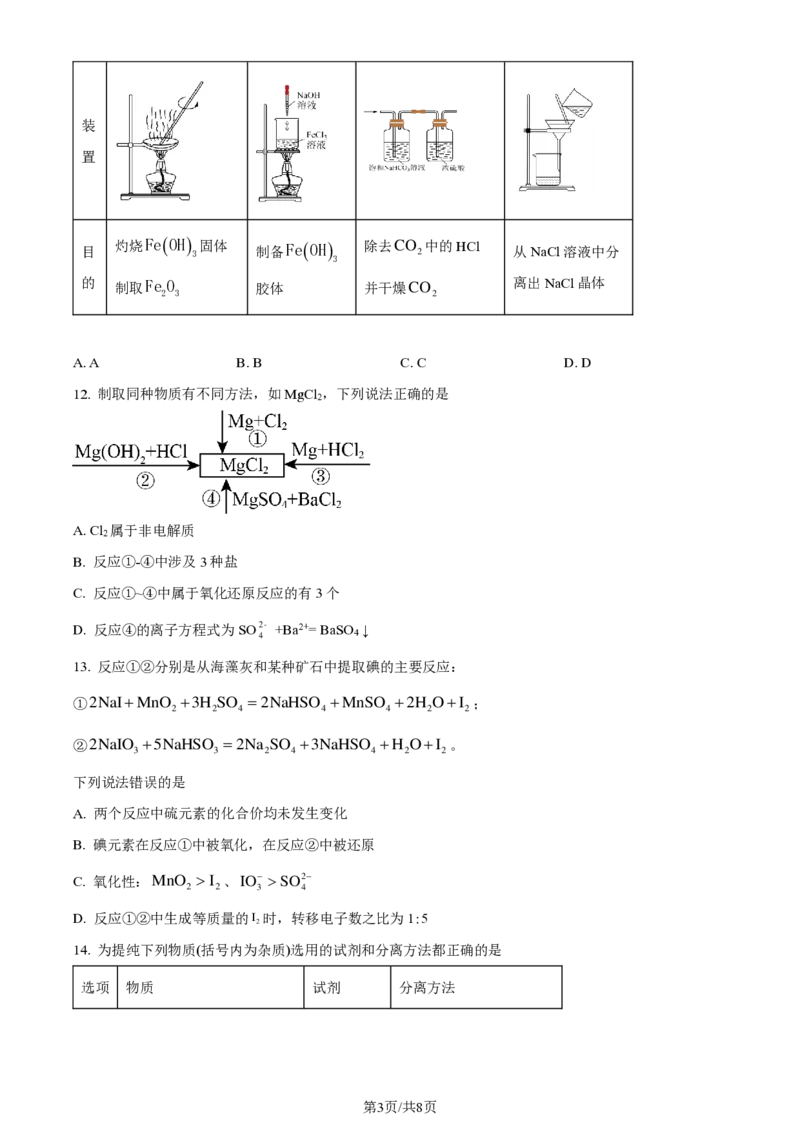
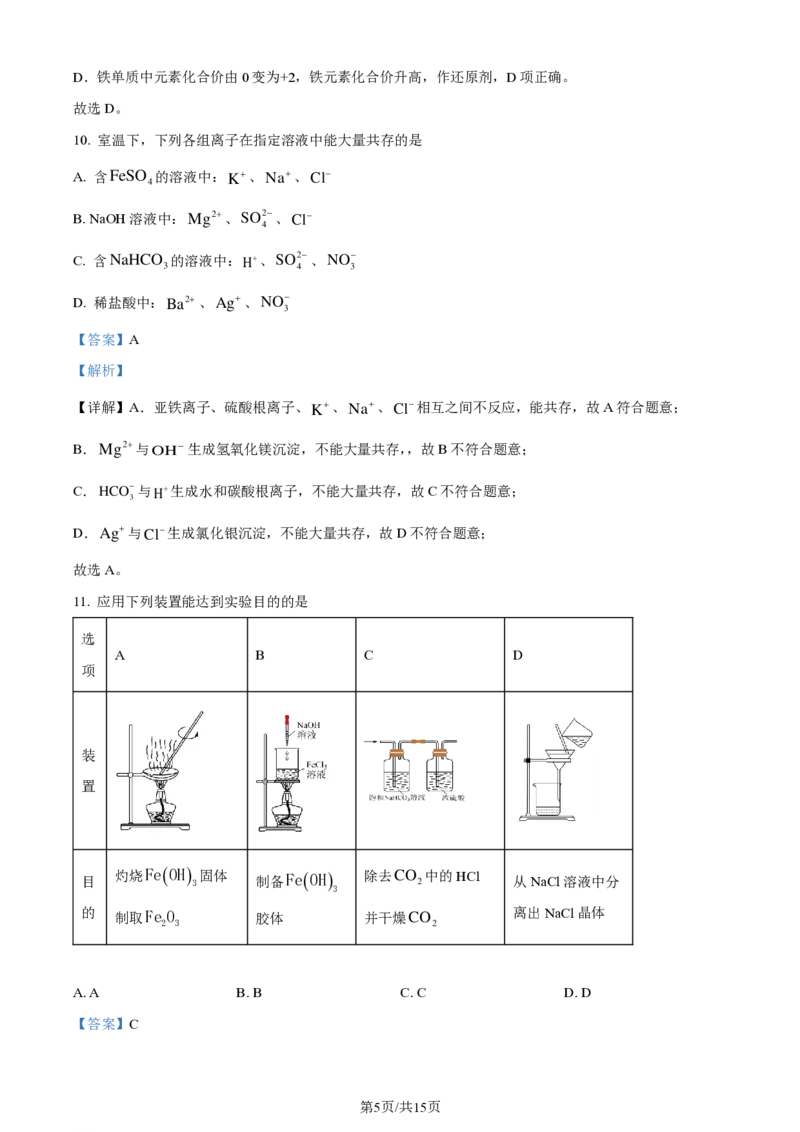
11. 应用下列装置能达到实验目的的是
选
A B C D
项
第2页/共8页
学科网(北京)股份有限公司装
置
目
灼烧Fe(OH)
3
固体 制备Fe(OH) 除去CO
2
中的HCl
从NaCl溶液中分
3
的 制取Fe O 胶体 并干燥CO 离出NaCl晶体
2 3 2
A. A B. B C. C D. D
12. 制取同种物质有不同方法,如MgCl ,下列说法正确的是
2
A. Cl 属于非电解质
2
B. 反应①-④中涉及3种盐
C. 反应①~④中属于氧化还原反应的有3个
D. 反应④的离子方程式为SO2- +Ba2+= BaSO ↓
4 4
13. 反应①②分别是从海藻灰和某种矿石中提取碘的主要反应:
①2NaI+MnO +3H SO =2NaHSO +MnSO +2H O+I ;
2 2 4 4 4 2 2
②2NaIO +5NaHSO =2Na SO +3NaHSO +H O+I 。
3 3 2 4 4 2 2
下列说法错误的是
A. 两个反应中硫元素的化合价均未发生变化
B. 碘元素在反应①中被氧化,在反应②中被还原
C. 氧化性:MnO I 、IO− SO2−
2 2 3 4
D. 反应①②中生成等质量的I 时,转移电子数之比为1:5
2
14. 为提纯下列物质(括号内为杂质)选用的试剂和分离方法都正确的是
选项 物质 试剂 分离方法
第3页/共8页
学科网(北京)股份有限公司A AgNO 溶液Cu(NO ) 锌粉 过滤
. 3 3 2
B CO (CO) O 点燃
2 2
C MnO (KCl) 水 溶解、过滤、洗涤、干燥
2
D
NaCl(NaOH)
足量稀硫酸 蒸发结晶
A A B. B C. C D. D
15. 天然气中含有少量H S等气体,开采应用受限。T.F菌在酸性Fe (SO ) 溶液中可实现天然气的催化
2 2 4 3
T.F菌
脱硫,其原理如图所示。总反应方程式为2H S+O 2S+2H O。下列说法错误的是
2 2 Fe (SO ) 2
2 4 3
A. 大量开采可燃冰和天然气会加剧温室效应
B. 脱硫过程的总反应属于置换反应
C. 脱硫过程中Fe (SO ) 的质量和化学性质不变
2 4 3
D. 该反应原理可以应用于高温条件下脱硫
二、非选择题(本题共 4小题,共 55分)
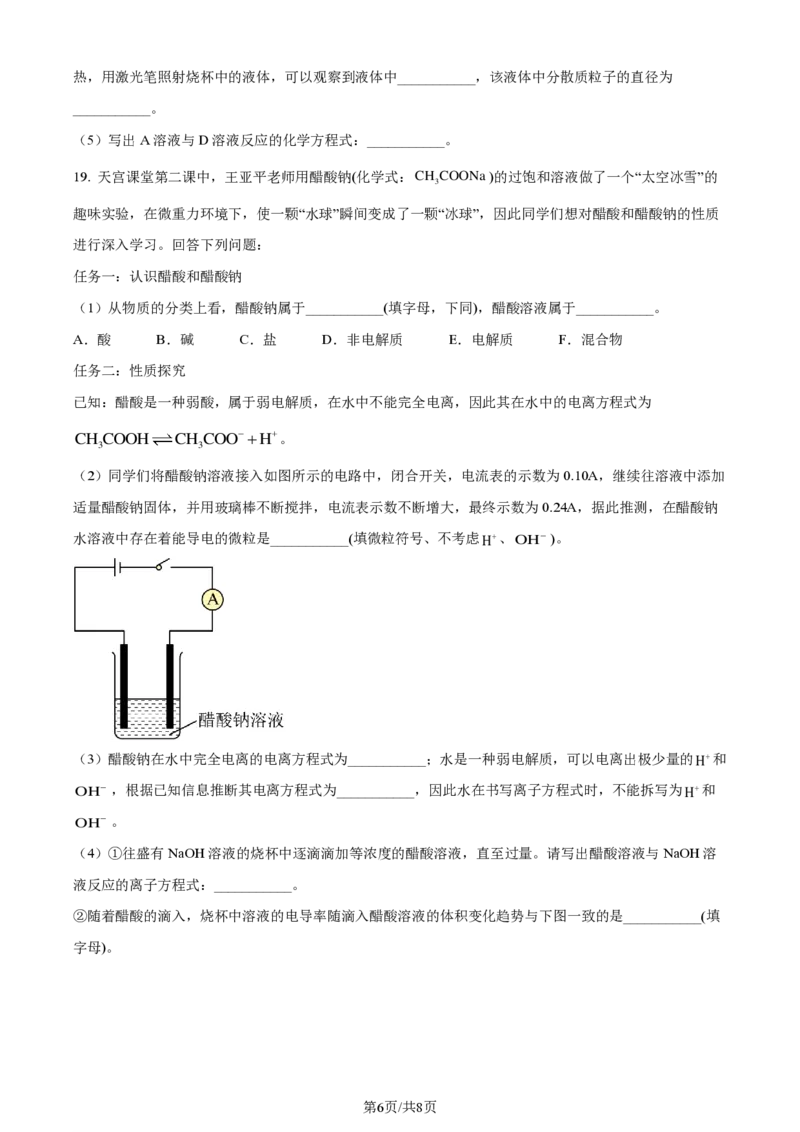
16. A~I为中学化学常见的物质。A可帮助消化,故又称为胃酸;C、H为常见金属单质,C是目前世界上
产量最高的金属,H可用作导线;E的组成元素与F相同;I是由地壳中含量最高的元素所形成的气体单
质。根据如图所示(图中部分反应条件已略去)的转化关系,回答下列问题:
(1)物质B的化学式为___________,物质I的用途有___________(任写一种)。
第4页/共8页
学科网(北京)股份有限公司(2)A~D中属于电解质的是___________(填化学式);反应①~③中属于离子反应的是___________(填序
号)。
(3)在溶液中发生反应②时的实验现象为___________;反应④的化学方程式为___________。
(4)发生反应①时,若消耗物质B的质量为120g,则生成物质E的质量为___________。
17. 氧化还原反应在高中化学中是一类重要的反应类型。KMnO 、FeCl 、KClO 、K Cr O 是中学
4 3 3 2 2 7
化学中常用的氧化剂。回答下列问题:
(1)下列基本反应类型中一定属于氧化还原反应的是___________(填字母)。
A. 化合反应 B. 分解反应 C. 置换反应 D. 复分解反应
(2)实验室迅速制备少量氯气可利用如下反应:2KMnO +16HCl(浓)=2KCl+2MnCl +5Cl +
4 2 2
8H O。上述反应中被氧化的元素为___________(填元素符号);还原产物为___________(填化学式)。
2
(3)FeCl 溶液能与Cu反应制作印刷电路板,其制作原理可用2FeCl +Cu=CuCl +2X表示。
3 3 2
①上式中X的化学式为___________。
②若有32g铜被氧化,则参与反应的FeCl 的质量为___________g。
3
③该反应的离子方程式为___________。
(4)已知方程式:KClO +6HCl(浓)=KCl+3Cl +3H O。用双线桥法标出电子转移 方向和数目
3 2 2
___________。
的
(5)某反应的反应物与生成物有K CrO 、KCl、CrCl 、Cl 、HCl(浓)、H O,已知氧化性:
2 2 7 3 2 2
K Cr O Cl ,写出并配平该化学方程式:___________。
2 2 7 2
18. 由Ca2+、Ag+、K+、Fe3+、NO−、SO2−、Cl−、CO2−这8种离子构成A、B、C、D四种可溶性
3 4 3
盐(离子在物质中不能重复出现)。现做如下实验:
①把四种盐分别溶于盛有蒸馏水的四支试管中,只有C的溶液呈黄色;
②向①的四支试管中分别加入盐酸,A的溶液中有沉淀生成,B的溶液中有无色无味的气体逸出。
回答下列问题:
(1)写出A、C的化学式:A___________,C___________。
(2)写出足量的盐酸与B溶液反应的离子方程式:___________。
(3)向C中滴入NaOH溶液的现象为___________。
(4)与C含有同一种阳离子的氯化物M,配制M的饱和溶液并进行以下实验:在烧杯中加入40 mL蒸馏
水,加热至沸腾后,向沸水中加入制取的饱和M溶液5~6滴,继续煮沸至液体呈___________色,停止加
第5页/共8页
学科网(北京)股份有限公司热,用激光笔照射烧杯中的液体,可以观察到液体中___________,该液体中分散质粒子的直径为
___________。
(5)写出A溶液与D溶液反应的化学方程式:___________。
19. 天宫课堂第二课中,王亚平老师用醋酸钠(化学式:CH COONa)的过饱和溶液做了一个“太空冰雪”的
3
趣味实验,在微重力环境下,使一颗“水球”瞬间变成了一颗“冰球”,因此同学们想对醋酸和醋酸钠的性质
进行深入学习。回答下列问题:
任务一:认识醋酸和醋酸钠
(1)从物质的分类上看,醋酸钠属于___________(填字母,下同),醋酸溶液属于___________。
A.酸 B.碱 C.盐 D.非电解质 E.电解质 F.混合物
任务二:性质探究
已知:醋酸是一种弱酸,属于弱电解质,在水中不能完全电离,因此其在水中的电离方程式为
CH COOH CH COO− +H+。
3 3
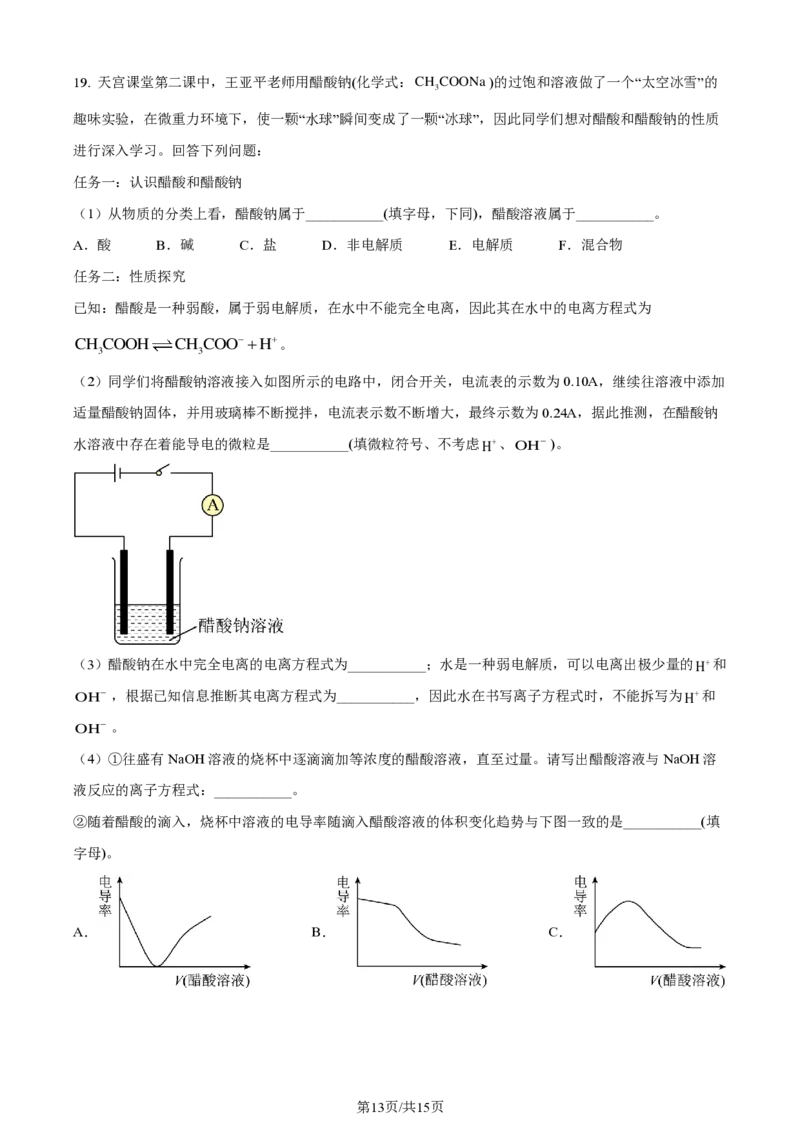
(2)同学们将醋酸钠溶液接入如图所示的电路中,闭合开关,电流表的示数为0.10A,继续往溶液中添加
适量醋酸钠固体,并用玻璃棒不断搅拌,电流表示数不断增大,最终示数为0.24A,据此推测,在醋酸钠
水溶液中存在着能导电的微粒是___________(填微粒符号、不考虑H+、OH− )。
(3)醋酸钠在水中完全电离的电离方程式为___________;水是一种弱电解质,可以电离出极少量的H+和
OH− ,根据已知信息推断其电离方程式为___________,因此水在书写离子方程式时,不能拆写为H+和
OH− 。
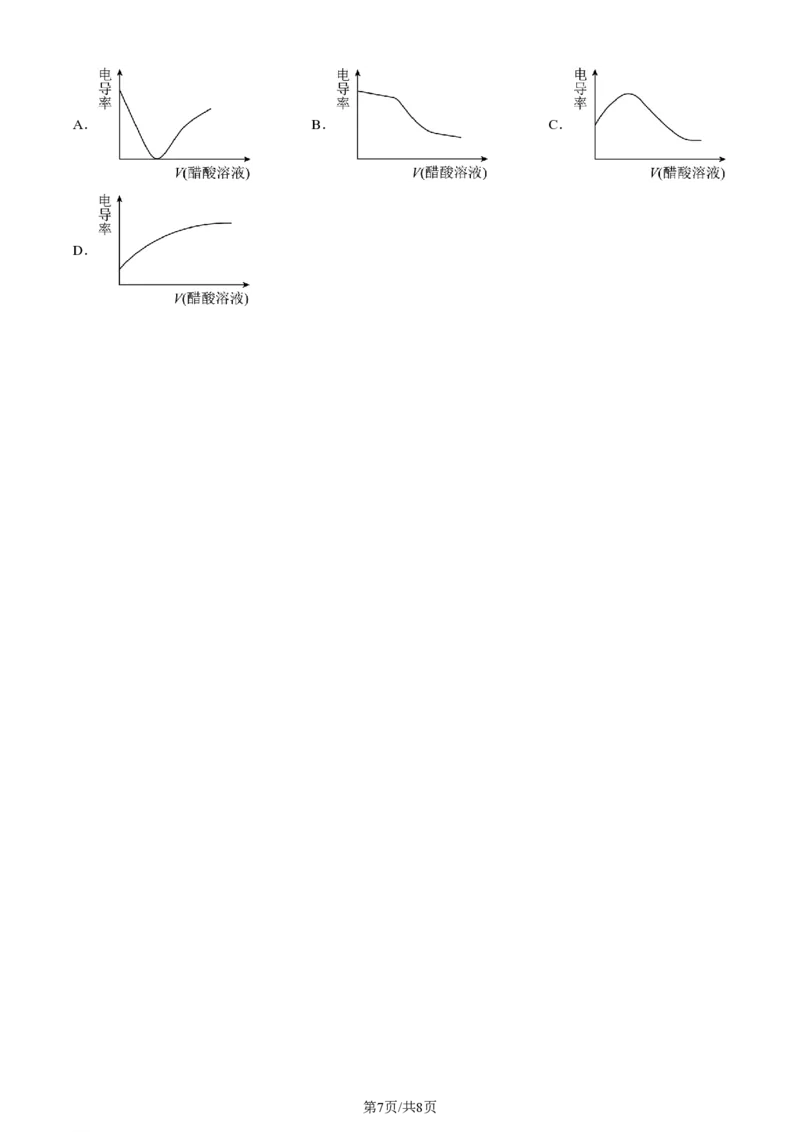
(4)①往盛有NaOH溶液的烧杯中逐滴滴加等浓度的醋酸溶液,直至过量。请写出醋酸溶液与NaOH溶
液反应的离子方程式:___________。
②随着醋酸的滴入,烧杯中溶液的电导率随滴入醋酸溶液的体积变化趋势与下图一致的是___________(填
字母)。
第6页/共8页
学科网(北京)股份有限公司A. B. C.
D.
第7页/共8页
学科网(北京)股份有限公司江西省名校联盟 2023-2024 学年高一上学期 10 月质量检测
化学试题
考生注意:
1.本试卷分选择题和非选择题两部分。满分 100分,考试时间 75分钟。
2.答题前,考生务必用直径 0.5毫米黑色墨水签字笔将密封线内项目填写清楚。
3.考生作答时,请将答案答在答题卡上。选择题每小题选出答案后,用 2B铅笔把答题卡上对
应题目的答案标号涂黑;非选择题请用直径 0.5毫米黑色墨水签
字笔在答题卡上各题的答题区域内作答,超出答题区域书写的答案无效,在试题卷、草稿纸
............. .... ...
上
.
作
.
答
.
无
.
效
.
。
4.本卷命题范围:人教版必修第一册第一章。
5.可能用到的相对原子质量:H 1 C 12 O 16 Cl 35.5 Fe 56 Cu 64
一、选择题(本题共 15小题,每小题 3分,共计 45分。在每小题列出的四个选项中,只有一
项是符合题目要求的)
1. 我国海洋资源丰富。下列有关说法错误的是
A. 海底开采的石油属于纯净物 B. 海洋生物的呼吸作用属于化学变化
C. 高温煅烧贝壳可以制生石灰 D. 海水是一种比较复杂的分散系
【答案】A
【解析】
【详解】A.石油含有多种物质,属于混合物,A项错误;
B.呼吸作用过程中生成生成新物质,是化学变化,B项正确;
C.贝壳的主要成分是碳酸钙,碳酸钙煅烧时分解生成CCOO 和CaO,C项正确;
22
D.海水含有多种物质,是一种比较复杂的分散系,D项正确。
故选A。
2. 下列分散系中分散质粒子直径最小的是
A. 氢氧化铁悬浊液 B. 氢氧化铁胶体 C. 雾 D. 硫酸铜溶液
【答案】D
【解析】
【详解】氢氧化铁悬浊液,浊液的分散质粒子直径大于100 nm,氢氧化铁胶体、雾属于胶体,胶体的分散
质粒子直径在1~100 nm,硫酸铜溶液,溶液的分散质粒子的直径小于1 nm,D项符合题意。
答案选D。
第1页/共15页
学科网(北京)股份有限公司3. 下列反应中属于氧化还原反应的是
Δ
A. NH +HCl=NH Cl B. 2Fe(OH) Fe O +3H O
3 4 3 2 3 2
高温
C. 3Fe+4H O(g) Fe O +4H D. CaCO +2HCl=CaCl +H O+CO ↑
2 3 4 2 3 2 2 2
【答案】C
【解析】
【详解】A.NH +HCl=NH Cl反应前后各种元素化合价不变,因此反应不属于氧化还原反应,A不符合题
3 4
意;
Δ
B.2Fe(OH) Fe O +3H O反应前后各种元素化合价不变,因此反应不属于氧化还原反应,B不符合题
3 2 3 2
意;
高温
C.3Fe+4H O(g) Fe O +4H 反应前后Fe、H元素化合价发生了变化,因此该反应属于氧化还原反
2 3 4 2
应,C符合题意;
D.CaCO +2HCl=CaCl +H O+CO ↑的反应前后各种元素化合价不变,因此反应不属于氧化还原反应,D不
3 2 2 2
符合题意;
故合理选项是C。
4. 下列物质的分类错误的是
A. 纯碱——钠盐 B. 氢氧化铁胶体——纯净物
C. H SO ——电解质 D. HH OO——氧化物
2 4 22
【答案】B
【解析】
【详解】A.纯碱是碳酸钠,属于钠盐,A项正确;
B.氢氧化铁胶体是混合物,B项错误;
C.H SO 是化合物,在水溶液里电离能够导电,是电解质,C项正确;
2 4
D.HH OO为只含氢、氧两种元素的化合物,其中一种是氧元素,属于氧化物,D项正确。
22
答案选B。
5. 在太空舱里,常用NNiiFFee OO 作催化剂将宇航员呼出的CCOO 转化为OO ,NNiiFFee OO 中Ni的化合价为+2价。
22 44 22 22 22 44
第2页/共15页
学科网(北京)股份有限公司下列说法中正确的是
A. NiFe O 中Fe为+6价 B. 将CO 转化为O ,一定发生了氧化还原反应
2 4 2 2
C. NiFe O 属于氧化物 D. CO 与CO是同素异形体
2 4 2
【答案】B
【解析】
【详解】A.NiFe O 中Ni为+2价,O为-2价,所以Fe为+3价,故A错误;
2 4
B.将CO 转化为O ,O元素化合价升高,被氧化,一定发生了氧化还原反应,故B正确;
2 2
C.NiFe O 属于盐,故C错误;
2 4
D.CO 与CO是碳的氧化物,同素异形体指单质,故D错误;
2
故选B。
6. 判断下列有关化学基本概念的本质依据正确的是
A. 纯净物与混合物:是否仅含有一种元素
B. 溶液与胶体:能否发生丁达尔效应
C. 氧化还原反应:元素化合价是否变化
D. 电解质与非电解质:水溶液中或熔融状态下能否导电的化合物
【答案】D
【解析】
【详解】A.纯净物与混合物的分类标准为是否只含有一种物质,而不是仅含有一种元素,A项错误;
B.胶体是分散质粒子大小在 1nm~100nm 的分散系;溶液是分散质粒子大小于1nm的分散系;丁达尔效
应是区分溶液与胶体,不是本质依据,本质区别是分散质颗粒大小,B项错误;
C.判断氧化还原的本质是电子得失或共用电子对偏移,C项错误;
D.电解质与非电解质的标准是在水溶液中或熔融状态下能否导电的化合物,D项正确。
故选D。
7. 下列物质溶于水,其电离方程式正确的是
A. NaHCO =Na+ +H+ +CO2− B. (NH ) SO =NH+ +SO2−
3 3 4 2 4 4 4
C. NH Cl=NH+ +Cl− D. Ca(OH) =Ca2+ +OH−
4 4 2 2
【答案】C
【解析】
第3页/共15页
学科网(北京)股份有限公司【详解】A.HCO- 是多元弱酸的酸式根,不能拆,A错误;
3
B.电荷不守恒,应有2个NH+,B错误;
4
C.NH Cl是可溶性盐,强电解质,完全电离,C正确;
4
D.OH-书写错误,应为2个OH-,D错误;
故选C。
8. 工业上制取ClO 的化学反应:2NaClO +SO +H SO =2ClO +2NaHSO 。下列说法正确的是
2 3 2 2 4 2 4
A. SO 在反应中被氧化
2
B. NaClO 在反应中失去电子
3
C. H SO 在反应中作氧化剂
2 4
D. 每生成1个ClO ,转移2个电子
2
【答案】A
【解析】
【详解】A.反应时,SO 中S元素的化合价升高,失电子发生氧化反应,故A正确;
2
B.NaClO 中Cl元素的化合价降低,得电子发生还原反应,故B错误;
3
C.H SO 在反应中各元素化合价均未发生改变,既不是氧化剂,也不是还原剂,故C错误;
2 4
D.2NaClO +SO +H SO =2ClO +2NaHSO 反应中Cl从+5价降低为+4价,生成1个ClO ,转移1个电
3 2 2 4 2 4 2
子,故D错误;
选A。
9. 下列转化过程中(线上为所加物质)加入还原剂的是
Ca(OH) HCl
A. Cl ⎯⎯⎯⎯⎯2→CaCl B. Na SO ⎯⎯⎯→SO
2 2 2 3 2
O Fe
C. Na⎯⎯2⎯→Na O D. FeCl ⎯⎯→FeCl
2 3 2
【答案】D
【解析】
【分析】加入还原剂,即加入的物质中存在元素化合价升高。
【详解】A.氯气和氢氧化钙生成氯化钙、次氯酸钙和水,反应为氯元素的歧化反应,Ca(OH)
中无元
2
素化合价改变,不是还原剂,A项错误;
B.亚硫酸钠和盐酸生成氯化钠和水、二氧化硫,无元素化合价改变,B项错误;
C.钠和氧气生成氧化钠,反应中O 中氧元素化合价降低,作氧化剂,C项错误;
2
第4页/共15页
学科网(北京)股份有限公司D.铁单质中元素化合价由0变为+2,铁元素化合价升高,作还原剂,D项正确。
故选D。
10. 室温下,下列各组离子在指定溶液中能大量共存的是
A. 含FeSO 的溶液中:K+、Na+、Cl−
4
B. NaOH溶液中:Mg2+、SO2−、Cl−
4
C. 含NaHCO 的溶液中:H+、SO2−、NO−
3 4 3
D. 稀盐酸中:Ba2+、Ag+、NO−
3
【答案】A
【解析】
【详解】A.亚铁离子、硫酸根离子、K+、Na+、Cl−相互之间不反应,能共存,故A符合题意;
B.Mg2+与OH− 生成氢氧化镁沉淀,不能大量共存,,故B不符合题意;
C.HCO−与H+生成水和碳酸根离子,不能大量共存,故C不符合题意;
3
D.Ag+与Cl−生成氯化银沉淀,不能大量共存,故D不符合题意;
故选A。
11. 应用下列装置能达到实验目的的是
选
A B C D
项
装
置
目
灼烧Fe(OH)
3
固体 制备Fe(OH) 除去CO
2
中的HCl
从NaCl溶液中分
3
的 制取Fe O 胶体 并干燥CO 离出NaCl晶体
2 3 2
A. A B. B C. C D. D
【答案】C
第5页/共15页
学科网(北京)股份有限公司【解析】
【详解】A.灼烧固体不能使用蒸发皿应使用坩埚,A项错误;
B.制取Fe(OH)
红褐色胶体应该向煮沸的蒸馏水中滴加饱和氯化铁溶液至溶液变红褐色,加NaOH溶液
3
会生成氢氧化铁沉淀,B项错误;
C.NaHCO 除去HCl并生成二氧化碳气体,浓硫酸可以干燥CO ,C项正确;
3 2
D.从NaCl溶液中制得NaCl晶体应蒸发结晶,D项错误。
故选C。
12. 制取同种物质有不同方法,如MgCl ,下列说法正确的是
2
A. Cl 属于非电解质
2
B. 反应①-④中涉及3种盐
C. 反应①~④中属于氧化还原反应的有3个
D. 反应④的离子方程式为SO2- +Ba2+= BaSO ↓
4 4
【答案】D
【解析】
【详解】A. Cl 为单质,既不属于电解质,也不属于非电解质,故A错误;
2
B.反应①~④中涉及的盐为MgSO 、MgCl 、BaSO 、BaCl ,共4种盐,故B错误;
4 2 4 2
C.反应①~④中属于氧化还原反应的为①和③,有2个,故C错误;
D.反应④中硫酸根离子和钡离子反应生成硫酸钡沉淀,离子方程式为SO2- +Ba2+= BaSO ↓,故D正确;
4 4
故选:D。
13. 反应①②分别是从海藻灰和某种矿石中提取碘的主要反应:
①2NaI+MnO +3H SO =2NaHSO +MnSO +2H O+I ;
2 2 4 4 4 2 2
②2NaIO +5NaHSO =2Na SO +3NaHSO +H O+I 。
3 3 2 4 4 2 2
下列说法错误的是
A. 两个反应中硫元素的化合价均未发生变化
B. 碘元素在反应①中被氧化,在反应②中被还原
第6页/共15页
学科网(北京)股份有限公司C. 氧化性:MnO I 、IO− SO2−
2 2 3 4
D. 反应①②中生成等质量的I 时,转移电子数之比为1:5
2
【答案】A
【解析】
【详解】A.反应②中硫元素的化合价升高,被氧化,A错误;
B.反应①中碘元素的化合价升高,被氧化,反应②中碘元素的化合价降低,被还原,B正确;
C.由反应①可知氧化性:MnO I ,由反应②可知氧化性:IO− SO2−,C正确;
2 2 3 4
D.由反应①得,生成1个I 转移2个e−,由反应②得,生成1个I 转移10个e−,所以当生成等量的I 时,
2 2 2
转移电子数之比为1:5,D正确;
故选A。
14. 为提纯下列物质(括号内为杂质)选用的试剂和分离方法都正确的是
选项 物质 试剂 分离方法
A AgNO 3 溶液 Cu(NO 3 ) 2 锌粉 过滤
B CO (CO) O 点燃
2 2
C MnO (KCl) 水 溶解、过滤、洗涤、干燥
2
D
NaCl(NaOH)
足量稀硫酸 蒸发结晶
A. A B. B C. C D. D
【答案】C
【解析】
【详解】A.Zn与AgNO 、Cu(NO ) 均能反应,且引入新杂质离子Zn2+,A错误;
3 3 2
B.向CO 、CO混合气中通入O 不易点燃,且通入O 的量无法确定,B错误;
2 2 2
C.MnO 难溶于水,KCl能溶于水,加水溶解后过滤、洗涤、干燥可除去KCl,C正确;
2
D.除去NaCl中的NaOH,加入足量稀盐酸,再蒸发结晶,D错误;
故选C。
第7页/共15页
学科网(北京)股份有限公司15. 天然气中含有少量H S等气体,开采应用受限。T.F菌在酸性Fe (SO ) 溶液中可实现天然气的催化
2 2 4 3
T.F菌
脱硫,其原理如图所示。总反应方程式为2H S+O 2S+2H O。下列说法错误的是
2 2 Fe (SO ) 2
2 4 3
A. 大量开采可燃冰和天然气会加剧温室效应
B. 脱硫过程的总反应属于置换反应
C. 脱硫过程中Fe (SO ) 的质量和化学性质不变
2 4 3
D. 该反应原理可以应用于高温条件下脱硫
【答案】D
【解析】
【详解】A.CH 属于温室气体,且其燃烧会产生温室气体二氧化碳气体,A正确;
4
B.总反应为一种单质和化合物生成另外一种单质和化合物的反应属于置换反应,B正确;
C.Fe (SO ) 作为反应的催化剂,反应前后质量和化学性质不变,C正确;
2 4 3
D.T.F菌在高温下会失去活性,故该脱硫过程不能在高温下进行,D错误;
故选D。
二、非选择题(本题共 4小题,共 55分)
16. A~I为中学化学常见的物质。A可帮助消化,故又称为胃酸;C、H为常见金属单质,C是目前世界上
产量最高的金属,H可用作导线;E的组成元素与F相同;I是由地壳中含量最高的元素所形成的气体单
质。根据如图所示(图中部分反应条件已略去)的转化关系,回答下列问题:
(1)物质B的化学式为___________,物质I的用途有___________(任写一种)。
(2)A~D中属于电解质的是___________(填化学式);反应①~③中属于离子反应的是___________(填序
号)。
第8页/共15页
学科网(北京)股份有限公司(3)在溶液中发生反应②时的实验现象为___________;反应④的化学方程式为___________。
(4)发生反应①时,若消耗物质B的质量为120g,则生成物质E的质量为___________。
【答案】(1) ①. CuO ②. 医疗急救(或其他合理答案)
(2) ①. CuO、CuCl ②. ①②
2
(3) ①. 铁逐渐溶解,铁表面附着紫红色固体,溶液逐渐由蓝色变为浅绿色 ②.
催化剂
2H O 2H O+O
2 2 2 2
(4)27g
【解析】
【分析】A可帮助消化,故又称为胃酸,A为HCl;C是产量高的金属Fe;Cu作导线,H为Cu;I是由
地壳中含量最高的元素O;E的组成元素与F相同,则E为H O,F为H O ;O 及Cu生成B,则B为
2 2 2 2
CuO;HCl与CuO生成CuCl 和H O,则D为CuCl ;Fe与CuCl 生成Cu与FeCl ,则G为FeCl ,综
2 2 2 2 2 2
上:A为盐酸、B为CuO、C为Fe、D为CuCl 、E为H O、F为H O 、G为FeCl 溶液、H为Cu、I为
2 2 2 2 2
O ;
2
【小问1详解】
根据分析,B为CuO;I为O 可以供给呼吸;
2
故答案为:CuO;医疗急救;
【小问2详解】
根据分析,电解质为CuO、CuCl ;①为2HCl+CuO=CuCl +H O,属于离子反应;②为
2 2 2
Fe+CuCl = FeCl +Cu,属于离子反应;③为2Cu+O =2CuO,不属于离子反应;
2 2 2
故答案为:CuO、 CuCl ;①②;
2
【小问3详解】
根据分析,②的现象为 溶液由蓝色变为浅绿色,有红色单质生成;④为2H O = 2H O+O ;
2 2 2 2
催化剂
故答案为:铁逐渐溶解,铁表面附着紫红色固体,溶液逐渐由蓝色变为浅绿色;
2H O = 2H O+O ;
2 2 2 2
催化剂
【小问4详解】
根据分析,CuO~H O,则H2O的质量为27g;
2
故答案为:27。
第9页/共15页
学科网(北京)股份有限公司17. 氧化还原反应在高中化学中是一类重要的反应类型。KMnO 、FeCl 、KClO 、K Cr O 是中学
4 3 3 2 2 7
化学中常用的氧化剂。回答下列问题:
(1)下列基本反应类型中一定属于氧化还原反应的是___________(填字母)。
A. 化合反应 B. 分解反应 C. 置换反应 D. 复分解反应
。
(2)实验室迅速制备少量氯气可利用如下反应:2KMnO +16HCl(浓)=2KCl+2MnCl +5Cl +
4 2 2
8H O。上述反应中被氧化的元素为___________(填元素符号);还原产物为___________(填化学式)。
2
(3)FeCl 溶液能与Cu反应制作印刷电路板,其制作原理可用2FeCl +Cu=CuCl +2X表示
3 3 2
①上式中X的化学式为___________。
②若有32g铜被氧化,则参与反应的FeCl 的质量为___________g。
3
③该反应的离子方程式为___________。
(4)已知方程式:KClO +6HCl(浓)=KCl+3Cl +3H O。用双线桥法标出电子转移的方向和数目
3 2 2
___________。
(5)某反应的反应物与生成物有K CrO 、KCl、CrCl 、Cl 、HCl(浓)、H O,已知氧化性:
2 2 7 3 2 2
K Cr O Cl ,写出并配平该化学方程式:___________。
2 2 7 2
【答案】17. C 18. ①. Cl ②. MnCl
2
19. ①. FeCl ②. 162.5 ③. 2Fe3+ +Cu =Cu2+ +2Fe2+
2
20. 21.
K CrO +14HCl(浓)=3Cl +2KCl+2CrCl +7H O
2 2 7 2 2 2
【解析】
【小问1详解】
A.有单质参加的化合反应为氧化还原,A错误;
B.有单质生成的分解反应为氧化还原,B错误;
C.置换反应为单质与化合物的反应,属于氧化还原反应,C正确;
D.复分解反应化合价不变,一定不属于氧化还原反应,D错误;
第10页/共15页
学科网(北京)股份有限公司故答案为:C;
【小问2详解】
该反应中,Mn元素化合价降低,故KMnO 是氧化剂被还原,MnCl 是还原产物;Cl元素化合价升高,
4 2
HCl作还原剂被氧化,Cl 是氧化产物;
2
故答案为:Cl;MnCl ;
2
【小问3详解】
①根据原子守恒,X为FeCl ;
2
②该反应中,Cu ~ 2e− ~ 2FeCl ,则32g铜被氧化,消耗162.5gFeCl ;
3 3
故答案为:FeCl ;162.5;
2
【小问4详解】
KClO 中Cl为+5价发生还原反应生成0价Cl ,1个KClO 得到5个电子;HCl中Cl为-1价发生氧化反
3 2 3
应生成Cl ,5个HCl体现还原性,1个HCl体现酸性;
2
故答案为: ;
【小问5详解】
K Cr O 中Cr为+6价发生还原反应生成CrCl ,1个K Cr O 得到6个电子,HCl中的Cl为-1价发生氧化
2 2 7 3 2 2 7
反应生成Cl ,1个Cl 得到2个电子,根据得失电子守恒,则生成3个Cl ;
2 2 2
故答案为:K CrO +14HCl(浓)=3Cl +2KCl+2CrCl +7H O。
2 2 7 2 2 2
18. 由Ca2+、Ag+、K+、Fe3+、NO−、SO2−、Cl−、CO2−这8种离子构成A、B、C、D四种可溶性
3 4 3
盐(离子在物质中不能重复出现)。现做如下实验:
①把四种盐分别溶于盛有蒸馏水的四支试管中,只有C的溶液呈黄色;
②向①的四支试管中分别加入盐酸,A的溶液中有沉淀生成,B的溶液中有无色无味的气体逸出。
回答下列问题:
(1)写出A、C的化学式:A___________,C___________。
(2)写出足量的盐酸与B溶液反应的离子方程式:___________。
(3)向C中滴入NaOH溶液的现象为___________。
(4)与C含有同一种阳离子的氯化物M,配制M的饱和溶液并进行以下实验:在烧杯中加入40 mL蒸馏
水,加热至沸腾后,向沸水中加入制取的饱和M溶液5~6滴,继续煮沸至液体呈___________色,停止加
第11页/共15页
学科网(北京)股份有限公司热,用激光笔照射烧杯中的液体,可以观察到液体中___________,该液体中分散质粒子的直径为
___________。
(5)写出A溶液与D溶液反应的化学方程式:___________。
【答案】(1) ①. AgNO ②. Fe (SO )
3 2 4 3
(2)CO2− +2H+=H O+CO
3 2 2
(3)产生红褐色沉淀 (4) ①. 红褐 ②. 出现一条光亮的“通路” ③. 1-100 nm
(5)2AgNO +CaCl =Ca(NO ) +2AgCl
3 2 3 2
【解析】
【分析】A、B、C、D 四种可溶性盐,根据离子共存可知,Ag+只能与NO−共存,Ca2+与SO2−、CO2−
3 4 3
不共存、但能与Cl-共存,Fe3+不能与CO2−不共存、能与SO2−共存,则四种盐为AgNO 、CaCl 、
3 4 3 2
为
Fe (SO ) 、K CO ;
2 4 3 2 3
①把四种盐分别溶于盛有蒸馏水的四支试管中,只有C的溶液呈黄色,则C为Fe (SO ) ;
2 4 3
②向①的四支试管中分别加入盐酸,A的溶液中有沉淀生成,B的溶液中有无色无味的气体逸出,则A为
AgNO ,B为K CO ,D为CaCl ,据此分析解答。
3 2 3 2
【小问1详解】
由上述分析可知,A为AgNO ,B为K CO ,C为Fe (SO ) ,D为CaCl ;
3 2 3 2 4 3 2
【小问2详解】
B为K CO ,足量盐酸与B反应的离子方程式为CO2− +2H+=H O+CO ;
2 3 3 2 2
【小问3详解】
C Fe (SO ) ,向C中滴入NaOH溶液时生成红褐色Fe(OH) 沉淀和Na SO ,实验现象为有红褐色沉淀生
2 4 3 3 2 4
成;
【小问4详解】
为
氯化物M为FeCl ,向沸水中加入制取的饱和FeCl 溶液5~6滴,继续煮沸可得到氢氧化铁胶体,氢氧化
3 3
铁胶体为红褐色液体,有丁达尔效应,即用激光笔照射烧杯中的氢氧化铁胶体时可观察到液体中有一条光
亮的“通路”,胶体的分散质粒子的直径为1~100nm;
【小问5详解】
A为AgNO ,D为CaCl
;两者反应生成AgCl沉淀和Ca(NO )
,化学方程式为
3 2 3 2
2AgNO +CaCl =Ca(NO ) +2AgCl。
3 2 3 2
第12页/共15页
学科网(北京)股份有限公司19. 天宫课堂第二课中,王亚平老师用醋酸钠(化学式:CH COONa)的过饱和溶液做了一个“太空冰雪”的
3
趣味实验,在微重力环境下,使一颗“水球”瞬间变成了一颗“冰球”,因此同学们想对醋酸和醋酸钠的性质
进行深入学习。回答下列问题:
任务一:认识醋酸和醋酸钠
(1)从物质的分类上看,醋酸钠属于___________(填字母,下同),醋酸溶液属于___________。
A.酸 B.碱 C.盐 D.非电解质 E.电解质 F.混合物
任务二:性质探究
已知:醋酸是一种弱酸,属于弱电解质,在水中不能完全电离,因此其在水中的电离方程式为
CH COOH CH COO− +H+。
3 3
(2)同学们将醋酸钠溶液接入如图所示的电路中,闭合开关,电流表的示数为0.10A,继续往溶液中添加
适量醋酸钠固体,并用玻璃棒不断搅拌,电流表示数不断增大,最终示数为0.24A,据此推测,在醋酸钠
水溶液中存在着能导电的微粒是___________(填微粒符号、不考虑H+、OH− )。
(3)醋酸钠在水中完全电离的电离方程式为___________;水是一种弱电解质,可以电离出极少量的H+和
OH− ,根据已知信息推断其电离方程式为___________,因此水在书写离子方程式时,不能拆写为H+和
OH− 。
(4)①往盛有NaOH溶液的烧杯中逐滴滴加等浓度的醋酸溶液,直至过量。请写出醋酸溶液与NaOH溶
液反应的离子方程式:___________。
②随着醋酸的滴入,烧杯中溶液的电导率随滴入醋酸溶液的体积变化趋势与下图一致的是___________(填
字母)。
A. B. C.
第13页/共15页
学科网(北京)股份有限公司D.
【答案】(1) ①. CE ②. F
(2)CH COO−和Na+
3
(3) ①. CH COONa=CH COO− +Na+ ②. H O H+ +OH−
3 3 2
(4) ①. CH COOH+OH− =CH COO− +H O ②. B
3 3 2
【解析】
【小问1详解】
电解质是溶于水或在熔融状态下能够导电的化合物;盐是由金属阳离子或铵根离子和酸根离子构成的化合
物;醋酸钠是由钠离子和醋酸根离子构成的,属于盐也属于电解质;醋酸溶液为混合物;
【小问2详解】
溶液或熔融电解质导电 原因是存在自由移动的离子,醋酸钠水溶液中存在着能导电的微粒是醋酸钠电离
出的醋酸根离子和钠离子,故填CH COO−和Na+;
的3
小问3详解】
醋酸钠在水中完全电离出钠离子和醋酸根离子,电离方程式为CH COONa=CH COO− +Na+;水是一
【 3 3
种弱电解质,可以电离出极少量的H+和OH− ,则其部分电离,为H O H+ +OH−;
2
【小问4详解】
①醋酸为弱酸,醋酸溶液与NaOH溶液反应生成醋酸钠和水,反应为
CH COOH+OH− =CH COO− +H O;
3 3 2
②溶液或熔融电解质导电的原因是存在自由移动的离子;往盛有NaOH溶液的烧杯中逐滴滴加等浓度的醋
酸溶液,两者反应生成与加入醋酸等物质的量的醋酸钠,但是溶液体积增大,溶液中自由移动离子浓度减
小,导致其电导率减弱,故选B。
第14页/共15页
学科网(北京)股份有限公司