文档内容
福建省漳州市乙丙级联盟校2024-2025学年高一下学期期中联考
化学试题
一、单选题
1.第24届冬奥会在北京和张家口联合举行,本届冬奥会见证了中国冰雪运动的“热辣滚烫”。下列说法
错误的是
A.场馆的照明由风力发电提供,有利于实现碳达峰
B.运动员比赛服内层使用的石墨烯与石墨互为同素异形体
C.速滑馆采用二氧化碳跨临界直接制冰,实现二氧化碳的循环利用和零排放,干冰属于分子晶体
D.冬奥会火炬改良了气源比例,使火焰在日光下也清晰可见,火炬燃烧过程化学能完全转化为热能
2.下列化学用语正确的是
A.次氯酸的结构式:H-Cl-O B.氯离子结构示意图为
C.二氧化碳的电子式: D. 分子的空间填充模型:
3.下列变化过程属于氮的固定的是
A.由 制碳酸氢铵
B.生物从土壤中吸收含氨养料
C.将含氮化合物转变为植物蛋白质
D.豆科植物将空气中的氮气转化为含氮化合物
4.设N 为阿伏加德罗常数的值。下列说法正确的是
A
A.标准状况下,22.4LCCl 含有的分子数目为N
4 A
B. 溶液含有的 数目为0.1N
A
C.常温常压下,92g NO 和NO 的混合气体含有的原子数目为6N
2 2 4 A
D.5.6 g铁与足量氯气反应转移电子的数目为0.2N
A
5.X、Y、Z、W为四种短周期主族元素,它们在周期表中的位置如下图所示,X原子最外层电子数是内
层电子数的2倍,下列说法错误的是A.X的气态氢化物的热稳定性比HO弱
2
B.Y的气态氢化物能使湿润的红色石蕊试纸变蓝
C.Z的最高价氧化物的水化物属于强碱
D.可用电解熔融化合物的方法制备W单质
6.下列离子方程式正确的是
A.氯化铁溶液与铁反应:Fe3++Fe=2Fe2+
B.石灰石溶于醋酸:CaCO +2CH COOH=2CH COO-+Ca2++CO ↑+H O
3 3 3 2 2
C.铜与浓硝酸反应:3Cu+8H++2NO =3Cu2++2NO↑+4HO
2
D.碳酸氢铵与足量的NaOH溶液反应:HCO +OH-=CO ↑+HO
2 2
7.反应 在四种不同条件下的反应速率分别为:① ;②
③ ;④ 。其中表示该反应速率最快的是
A.① B.② C.③ D.④
8.如图所示原电池装置的总反应为 ,电池工作时灵敏电流计的指针向右偏转。下列说法
正确的是
A.电极 可为 片
B.电极 的作用是提供得电子场所
C.负极反应为
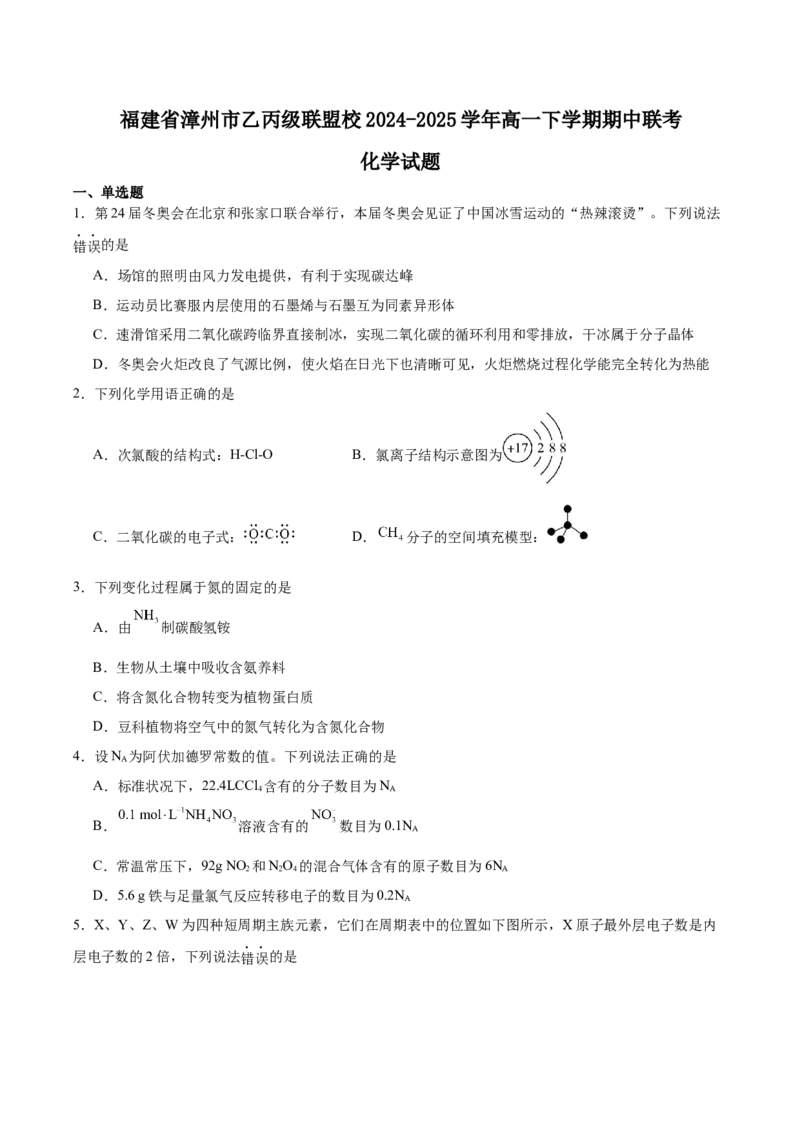
D. 可为 溶液,电池工作时 向 电极运动9.铝片与稀硫酸反应产生氢气的速率较慢,为了加快该反应速率,下列措施不合理的是
A.将溶液适当加热 B.将铝片更换为铝粉
C.将稀硫酸改为98%浓硫酸 D.向溶液中滴入少量硫酸铜溶液
10.下列各组物质发生所述变化时,克服的微粒间作用力属于同种类型的是
A.碘单质和苯受热变为气体 B.NaBr和HI在水中电离
C. 和CaO的熔化 D.HCl和乙醇溶于水中
11.反应4A(s)+3B(g)=2C(g)+D(g),经 ,B的浓度减少 。对该反应速率的表示,下列说
法正确的是
A.用A表示的反应速率是
B.用B、C 、D表示的反应速率之比为3∶2∶1
C.在 末,用B表示的反应速率是
D.在 内用B表示的反应速率逐渐减小,用C表示的反应速率逐渐增大
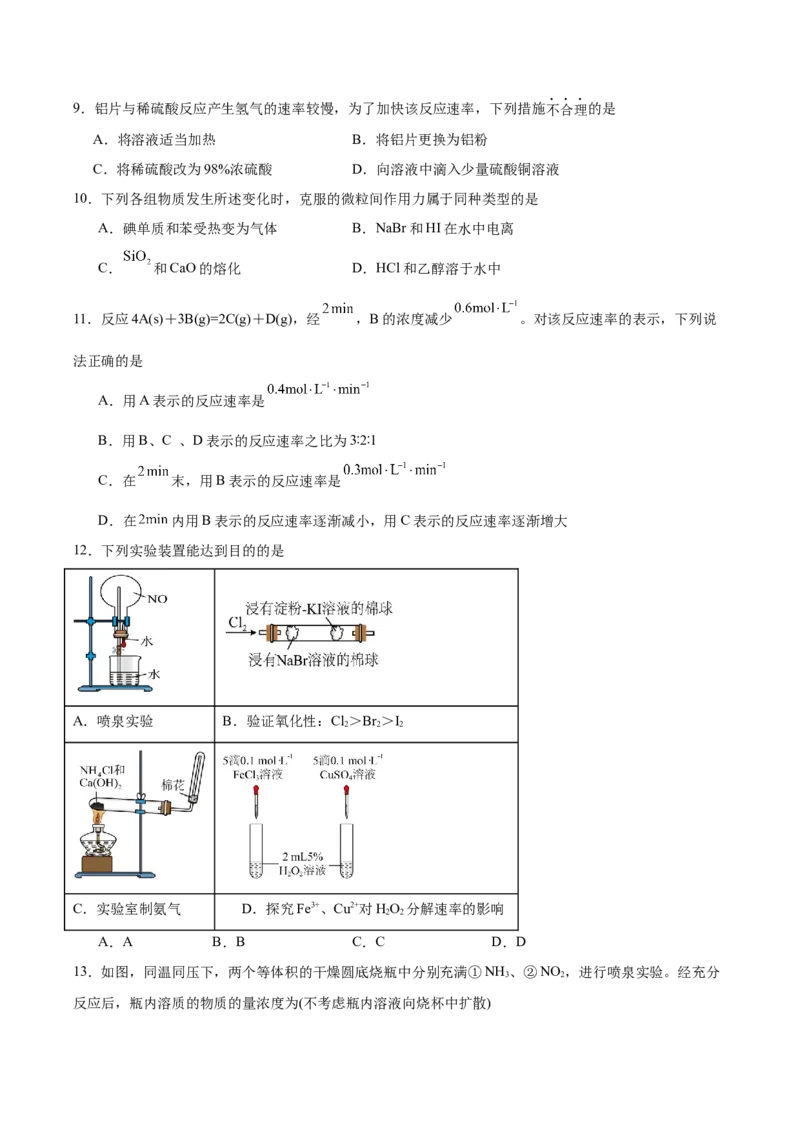
12.下列实验装置能达到目的的是
A.喷泉实验 B.验证氧化性:Cl>Br >I
2 2 2
C.实验室制氨气 D.探究Fe3+、Cu2+对HO 分解速率的影响
2 2
A.A B.B C.C D.D
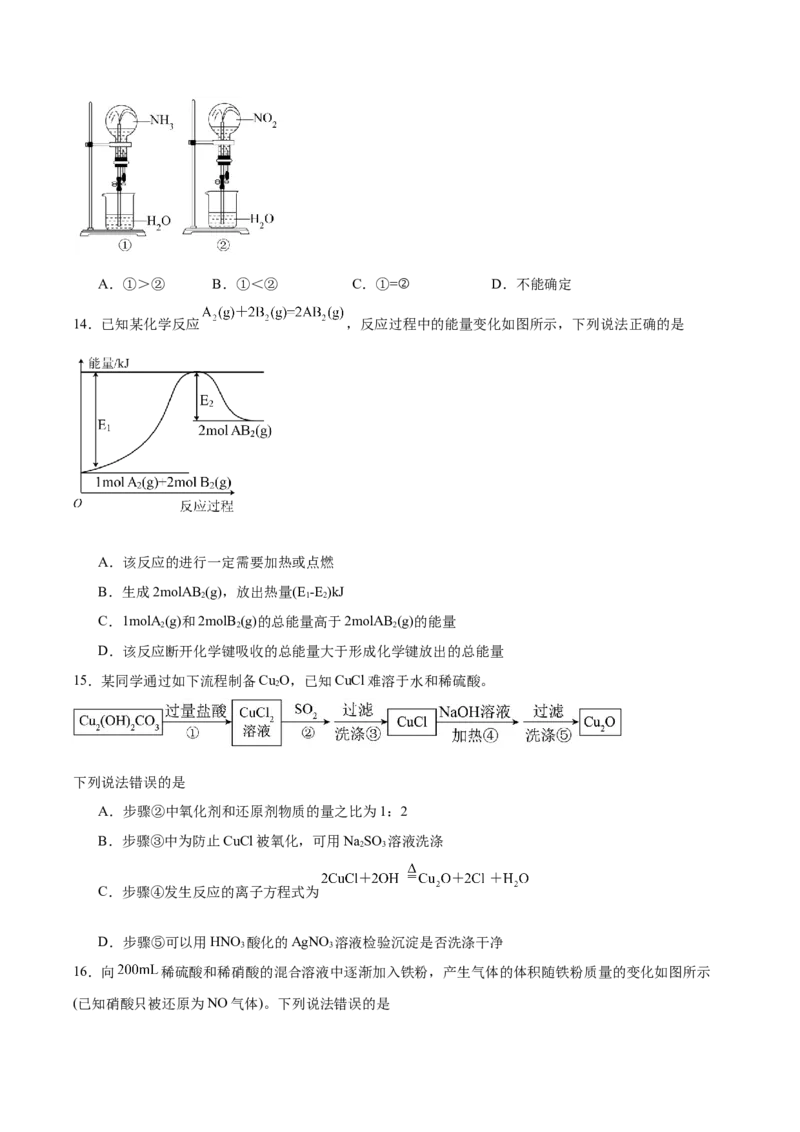
13.如图,同温同压下,两个等体积的干燥圆底烧瓶中分别充满①NH 、②NO ,进行喷泉实验。经充分
3 2
反应后,瓶内溶质的物质的量浓度为(不考虑瓶内溶液向烧杯中扩散)A.①>② B.①<② C.①=② D.不能确定
14.已知某化学反应 ,反应过程中的能量变化如图所示,下列说法正确的是
A.该反应的进行一定需要加热或点燃
B.生成2molAB (g),放出热量(E -E )kJ
2 1 2
C.1molA (g)和2molB (g)的总能量高于2molAB (g)的能量
2 2 2
D.该反应断开化学键吸收的总能量大于形成化学键放出的总能量
15.某同学通过如下流程制备Cu O,已知CuCl难溶于水和稀硫酸。
2
下列说法错误的是
A.步骤②中氧化剂和还原剂物质的量之比为1:2
B.步骤③中为防止CuCl被氧化,可用NaSO 溶液洗涤
2 3
C.步骤④发生反应的离子方程式为
D.步骤⑤可以用HNO 酸化的AgNO 溶液检验沉淀是否洗涤干净
3 3
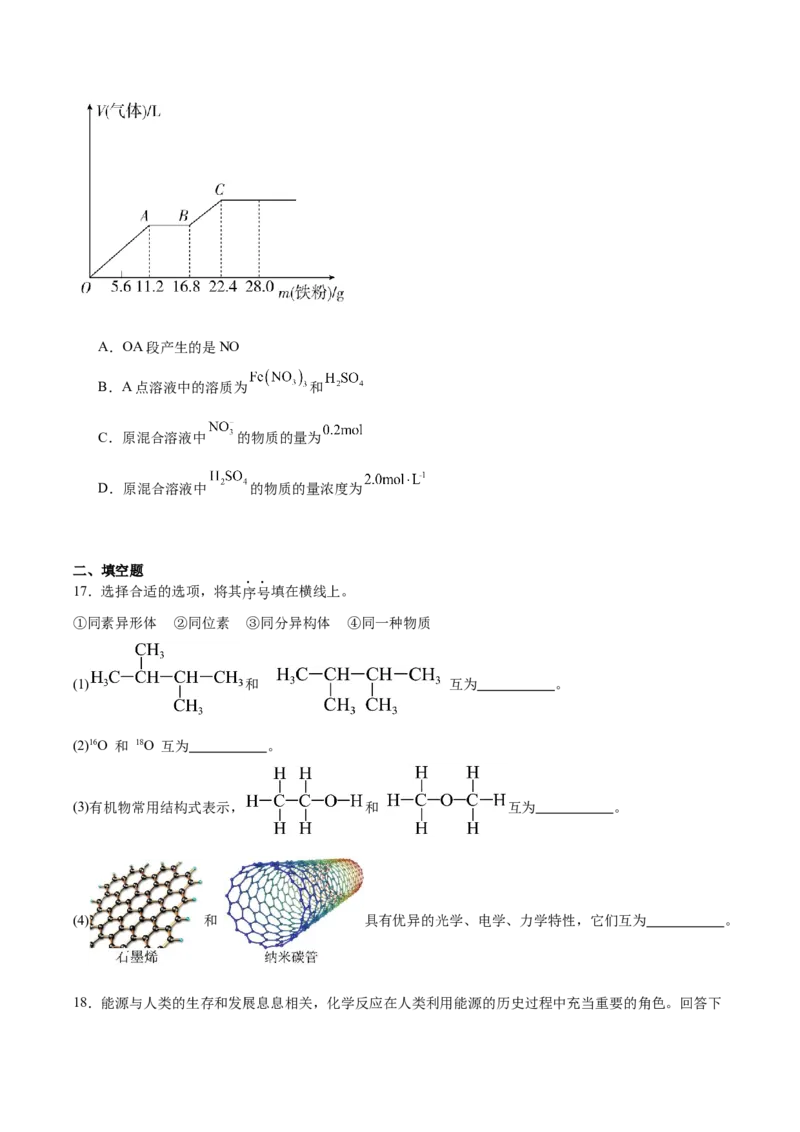
16.向 稀硫酸和稀硝酸的混合溶液中逐渐加入铁粉,产生气体的体积随铁粉质量的变化如图所示
(已知硝酸只被还原为NO气体)。下列说法错误的是A.OA段产生的是NO
B.A点溶液中的溶质为 和
C.原混合溶液中 的物质的量为
D.原混合溶液中 的物质的量浓度为
二、填空题
17.选择合适的选项,将其序号填在横线上。
①同素异形体 ②同位素 ③同分异构体 ④同一种物质
(1) 和 互为 。
(2)16O 和 18O 互为 。
(3)有机物常用结构式表示, 和 互为 。
(4) 和 具有优异的光学、电学、力学特性,它们互为 。
18.能源与人类的生存和发展息息相关,化学反应在人类利用能源的历史过程中充当重要的角色。回答下列问题:
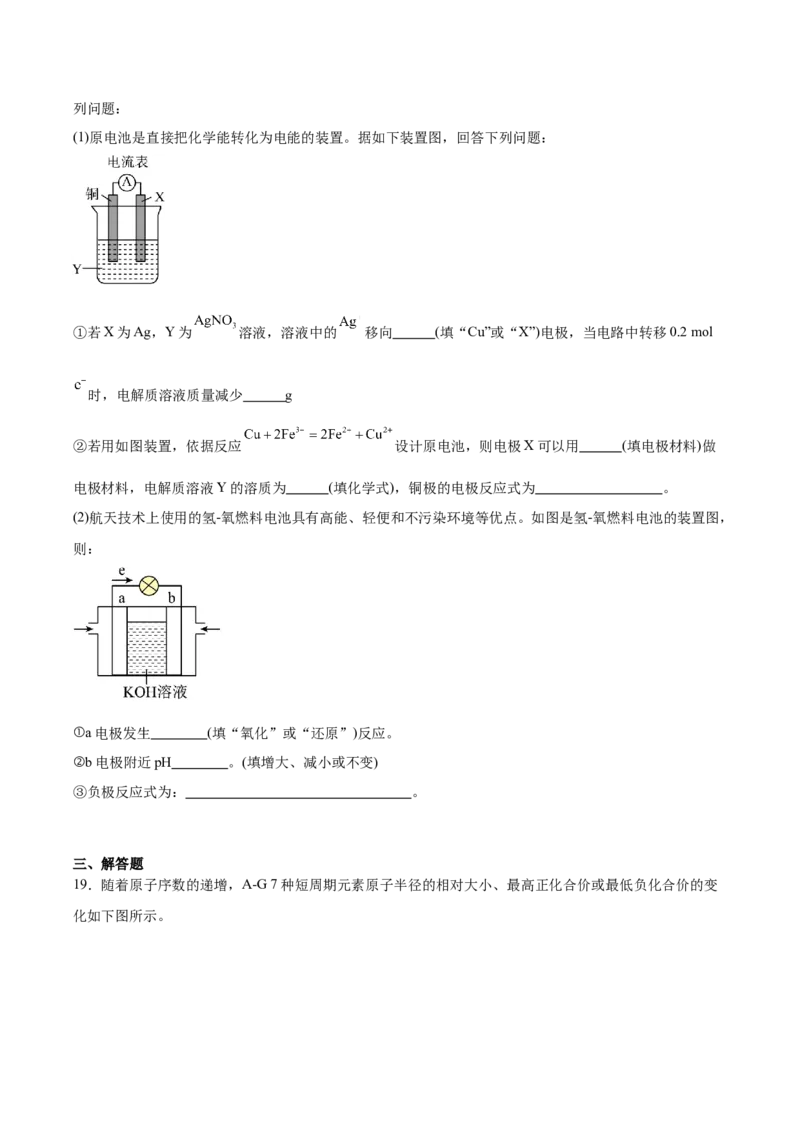
(1)原电池是直接把化学能转化为电能的装置。据如下装置图,回答下列问题:
①若X为Ag,Y为 溶液,溶液中的 移向 (填“Cu”或“X”)电极,当电路中转移0.2 mol
时,电解质溶液质量减少 g
②若用如图装置,依据反应 设计原电池,则电极X可以用 (填电极材料)做
电极材料,电解质溶液Y的溶质为 (填化学式),铜极的电极反应式为 。
(2)航天技术上使用的氢-氧燃料电池具有高能、轻便和不污染环境等优点。如图是氢-氧燃料电池的装置图,
则:
①a电极发生 (填“氧化”或“还原”)反应。
②b电极附近pH 。(填增大、减小或不变)
③负极反应式为: 。
三、解答题
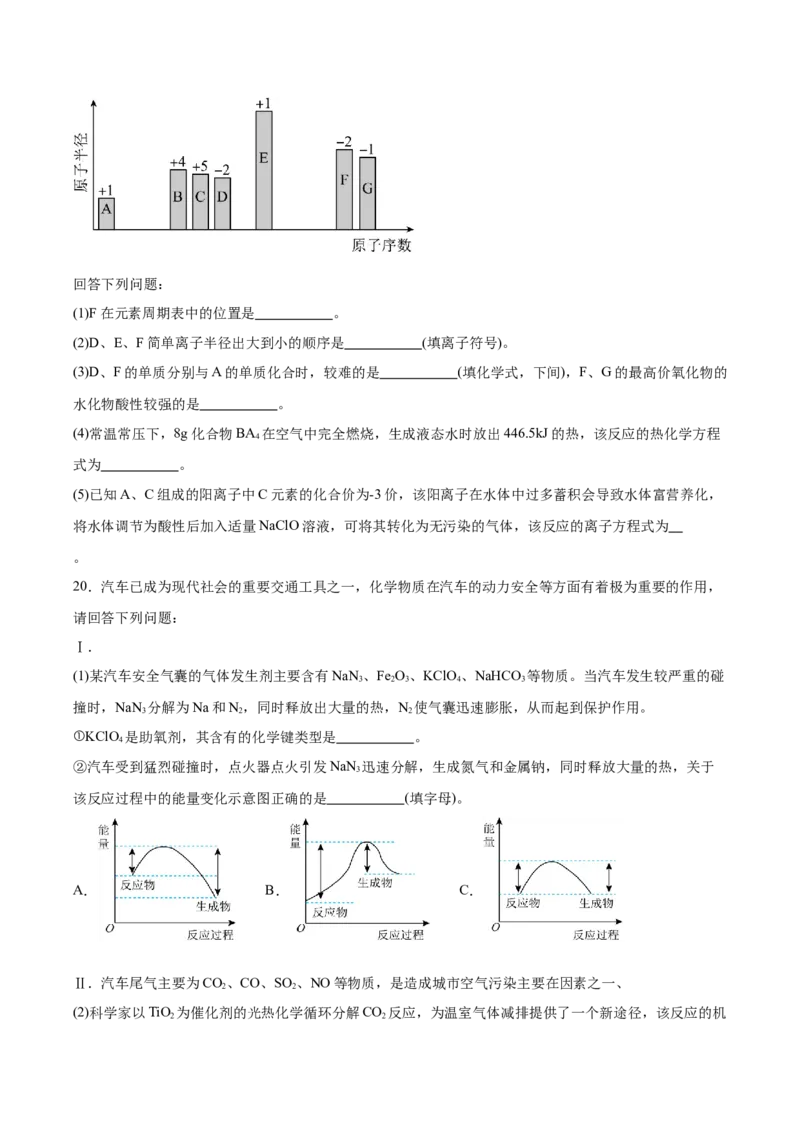
19.随着原子序数的递增,A-G 7种短周期元素原子半径的相对大小、最高正化合价或最低负化合价的变
化如下图所示。回答下列问题:
(1)F在元素周期表中的位置是 。
(2)D、E、F简单离子半径出大到小的顺序是 (填离子符号)。
(3)D、F的单质分别与A的单质化合时,较难的是 (填化学式,下间),F、G的最高价氧化物的
水化物酸性较强的是 。
(4)常温常压下,8g化合物BA 在空气中完全燃烧,生成液态水时放出446.5kJ的热,该反应的热化学方程
4
式为 。
(5)已知A、C组成的阳离子中C元素的化合价为-3价,该阳离子在水体中过多蓄积会导致水体富营养化,
将水体调节为酸性后加入适量NaClO溶液,可将其转化为无污染的气体,该反应的离子方程式为
。
20.汽车已成为现代社会的重要交通工具之一,化学物质在汽车的动力安全等方面有着极为重要的作用,
请回答下列问题:
Ⅰ.
(1)某汽车安全气囊的气体发生剂主要含有NaN 、Fe O、KClO、NaHCO 等物质。当汽车发生较严重的碰
3 2 3 4 3
撞时,NaN 分解为Na和N,同时释放出大量的热,N 使气囊迅速膨胀,从而起到保护作用。
3 2 2
①KClO 是助氧剂,其含有的化学键类型是 。
4
②汽车受到猛烈碰撞时,点火器点火引发NaN 迅速分解,生成氮气和金属钠,同时释放大量的热,关于
3
该反应过程中的能量变化示意图正确的是 (填字母)。
A. B. C.
Ⅱ.汽车尾气主要为CO、CO、SO 、NO等物质,是造成城市空气污染主要在因素之一、
2 2
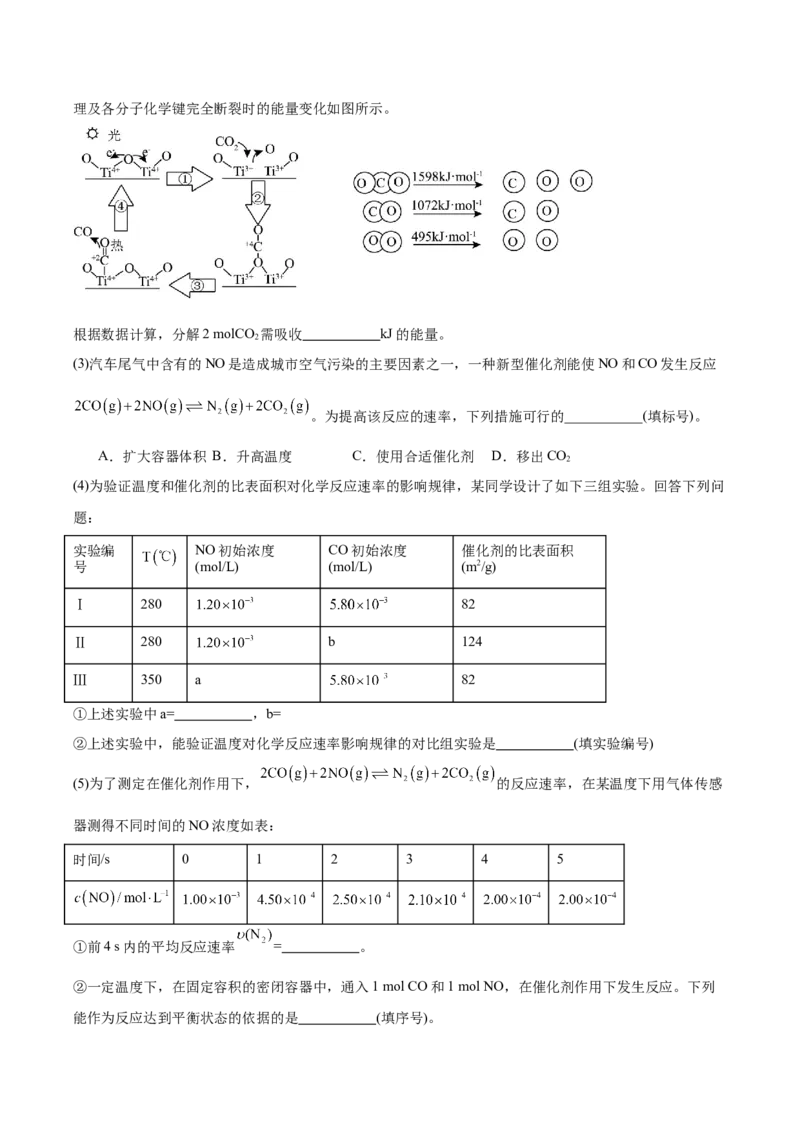
(2)科学家以TiO 为催化剂的光热化学循环分解CO 反应,为温室气体减排提供了一个新途径,该反应的机
2 2理及各分子化学键完全断裂时的能量变化如图所示。
根据数据计算,分解2 molCO 需吸收 kJ的能量。
2
(3)汽车尾气中含有的NO是造成城市空气污染的主要因素之一,一种新型催化剂能使NO和CO发生反应
。为提高该反应的速率,下列措施可行的___________(填标号)。
A.扩大容器体积 B.升高温度 C.使用合适催化剂 D.移出CO
2
(4)为验证温度和催化剂的比表面积对化学反应速率的影响规律,某同学设计了如下三组实验。回答下列问
题:
实验编 NO初始浓度 CO初始浓度 催化剂的比表面积
号 (mol/L) (mol/L) (m2/g)
Ⅰ 280 82
Ⅱ 280 b 124
Ⅲ 350 a 82
①上述实验中a= ,b=
②上述实验中,能验证温度对化学反应速率影响规律的对比组实验是 (填实验编号)
(5)为了测定在催化剂作用下, 的反应速率,在某温度下用气体传感
器测得不同时间的NO浓度如表:
时间/s 0 1 2 3 4 5
①前4 s内的平均反应速率 = 。
②一定温度下,在固定容积的密闭容器中,通入1 mol CO和1 mol NO,在催化剂作用下发生反应。下列
能作为反应达到平衡状态的依据的是 (填序号)。a.
b.单位时间内生成2 mol CO,同时生成1 mol N
2
c.NO的浓度与CO浓度相等
d.容器内总压强不再改变
e.反应后混合气体的密度不再发生变化
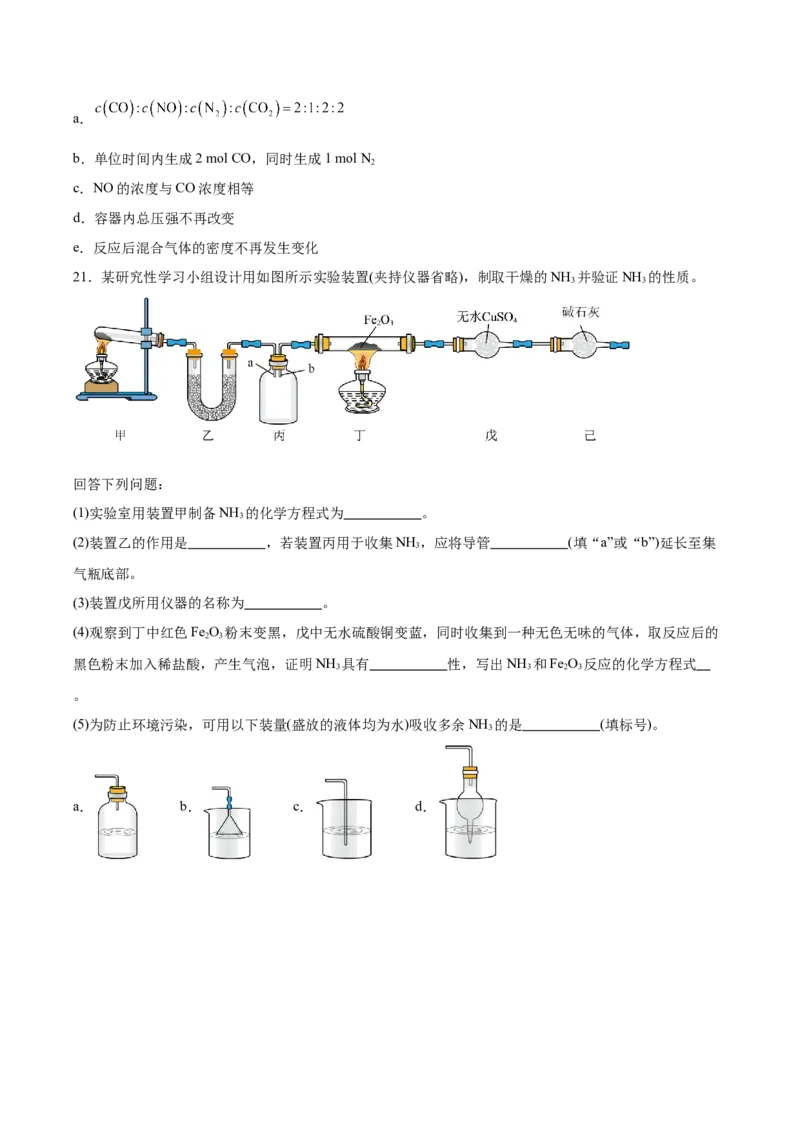
21.某研究性学习小组设计用如图所示实验装置(夹持仪器省略),制取干燥的NH 并验证NH 的性质。
3 3
回答下列问题:
(1)实验室用装置甲制备NH 的化学方程式为 。
3
(2)装置乙的作用是 ,若装置丙用于收集NH ,应将导管 (填“a”或“b”)延长至集
3
气瓶底部。
(3)装置戊所用仪器的名称为 。
(4)观察到丁中红色Fe O 粉末变黑,戊中无水硫酸铜变蓝,同时收集到一种无色无味的气体,取反应后的
2 3
黑色粉末加入稀盐酸,产生气泡,证明NH 具有 性,写出NH 和Fe O 反应的化学方程式
3 3 2 3
。
(5)为防止环境污染,可用以下装量(盛放的液体均为水)吸收多余NH 的是 (填标号)。
3
a. b. c. d.题号 1 2 3 4 5 6 7 8 9 10
答案 D B D C C B A B C A
题号 11 12 13 14 15 16
答案 B C C D A B
17.(1)④
(2)②
(3)③
(4)①
【详解】(1)
和 均为同一种物质:2,3-二甲基丁烷,故选④;
(2)16O 和 18O 互为②同位素;
(3)
和 为具有相同分子式而结构不同的化合物互为同分异构体,故选
③;
(4)同种元素形成的不同单质互为同素异形体;石墨烯和纳米碳管互为同素异形体,故选①。
18.(1) X 15.2 银或金或石墨棒等 或 等
(2) 氧化 增大
【详解】(1)①若X为银、Y为硝酸银溶液,该装置为原电池,金属性强于银的铜电极做原电池的负极,
银电极做正极,银离子向正极银移动;电池的总反应方程式为Cu+2Ag+=Cu2++2Ag,则当电路中转移0.2
mol电子时,电解质溶液减少的质量0.2 mol×108g/mol—0.1mol×64g/mol=15.2g,故答案为:X;15,2;
②由总反应方程式可知,还原剂铜为负极,X电极为正极,应是金属活泼性弱于铜的银或金,或者是能导
电的石墨电极,电解质溶液为可溶性铁盐,负极的电极反应式为 ,故答案为:银或金或石
墨棒等; 或 等; ;
(2)由电子的移动方向可知,通入氢气的a电极为燃料电池的负极,碱性条件下氢气在负极失去电子发生
氧化反应生成水,电极反应式为H—2e—+2OH—=2H O,通入氧气的电极b为正极,水分子作用下氧气在
2 2
正极得到电子发生还原反应生成氢氧根离子,电极反应式为O+4e—+2H O=4OH—;
2 2①由分析可知,通入氢气的a电极为燃料电池的负极,碱性条件下氢气在负极失去电子发生氧化反应生成
水,故答案为:氧化;
②由分析可知,通入氧气的电极b为正极,水分子作用下氧气在正极得到电子发生还原反应生成氢氧根离
子,电极反应式为O+4e—+2H O=4OH—,则b电极附近溶液pH增大,故答案为:增大;
2 2
③由分析可知,通入氢气的a电极为燃料电池的负极,碱性条件下氢气在负极失去电子发生氧化反应生成
水,电极反应式为H—2e—+2OH—=2H O,故答案为:H—2e—+2OH—=2H O;
2 2 2 2
19.(1)第3周期ⅥA族
(2)S2->O2->Na+
(3) S HClO
4
(4) ΔH=-893.0kJ·mol-1
(5)
【详解】(1)S在周期表中的位置是第3周期ⅥA族。
(2)一般电子层数越多半径越大,核外电子数相同时,核电荷数越大半径越小,故半径由大到小为S2-
>O2->Na+。
(3)O非金属性强于S,故S更易与氢气化合,Cl的非金属性强于S,故Cl的最高价氧化物的水化物
HClO 的酸性更强。
4
(4)8g甲烷的物质的量为0.5mol,0.5mol甲烷完全燃烧放出446.5 kJ的热,该反应的热化学方程式为
ΔH=-893.0kJ·mol-1。
(5)A、C组成的阳离子为NH ,根据题意在酸性条件下,次氯酸钠可以将其氧化为氮气,相应的离子方
程式为: 。
20.(1) 离子键、共价键 A
(2)557
(3)BC
(4) I和Ⅲ
(5) bd【详解】(1)①KClO 属于盐,钾离子、高氯酸根离子之间形成离子键,高氯酸根离子中原子之间形成
4
共价键,故答案为:离子键、共价键;
②汽车受到猛烈碰撞时,点火器点火引发NaN 迅速分解,生成氮气和金属钠,同时释放大量的热,即反
3
应物总能量高于生成物总能量,则只有A项图像符合,故答案为:A;
(2)根据数据计算,分解2mol CO 需吸收能量为(1598×2-1072×2-495)kJ=557kJ,故答案为:557;
2
(3)A.扩大容器体积将导致反应物CO、NO和生成物N、CO 的浓度减小,反应速率减慢,A不合题意;
2 2
B.升高温度能够增大活化分子百分数,增大单位体积单位时间内的有效碰撞次数,从而加快反应速率,B
符合题意;
C.使用合适催化剂能够降低反应所需要的活化能,增大活化分子百分数,增大单位体积单位时间内的有
效碰撞次数,从而加快反应速率,C符合题意;
D.移出CO 将导致CO 浓度减小,逆反应速率突然减小,平衡正向移动,CO、NO浓度减小,正反应速
2 2
率也减小,D不合题意;
故答案为:BC;
(4)①保证反应物起始浓度一致,则a=1.20×10-3,b=5.80×10-3,故答案为:1.20×10-3;5.80×10-3;
②实验Ⅰ和Ⅲ催化剂的比表面积相同,能验证温度对化学反应速率影响规律,故答案为:Ⅰ和Ⅲ;
(5)①由题干表中数据可知,前4 s内的平均反应速率 =2.00×10-
4mol/(L·s),根据化学反应速率之比等于化学计量系数之比可知, = = ×2.00×10-4mol/
(L·s)=1.00×10-4mol/(L·s),故答案为:1.00×10-4mol/(L·s);
②
a.已知化学平衡的宏观特征为各组分的浓度保持不变,而不是相等或成比例,故
时不能说明反应达到化学平衡,a不合题意;
b.单位时间内生成2 mol CO表示逆反应,同时生成1 mol N 表示正反应,二者系数比为2:1,则正逆反应
2
速率相等,反应达到化学平衡,b符合题意;
c.已知化学平衡的宏观特征为各组分的浓度保持不变,而不是相等或成比例,且反应过程中NO的浓度与
CO浓度始终相等,不能说明反应达到化学平衡,c不合题意;
d.已知该反应前后气体的系数和发生改变,即恒温恒容密闭容器中气体的总压强一直改变,则当容器内
总压强不再改变时说明反应达到化学平衡,d符合题意;e.恒温恒容密闭容器中混合气体的密度始终保持不变,故反应后混合气体的密度不再发生变化时不能说
明反应达到化学平衡,e不合题意;
故答案为:bd。
21.(1)
(2) 干燥NH b
3
(3)球形干燥管
(4) 还原
(5)bd
【详解】(1)实验室制备氨气的化学方程式为 。
(2)装置乙的作用是干燥NH 。NH 的密度小于空气,则导管b延长至集气瓶底部,将空气从b口挤出。
3 3
(3)装置戊为球形干燥管。
(4)实验中观察到丁中红色Fe O 粉末变黑生铁单质,戊中无水硫酸铜变蓝说明生成水,并收集到一种单
2 3
质气体氮气,则该反应的化学方程式为 ,氮元素化合价升高,证明氨气具
有还原性。
(5)NH 极易溶于水,应采用防倒吸装置来吸收多余氨气,可选择bd。
3