文档内容
2024级高一学年上学期期中考试 5. 下列反应的离子方程式书写正确的是( )
化 学 试 题 A. 石灰乳与稀硝酸反应: Ca²⁺+2OH⁻+2H⁺=Ca²⁺+2H₂O
B. 氢氧化钡溶液中加入少量硫酸氢钠溶液: Ba2++2OH-+2H++SO 2-=Ba SO ↓+2H O
4 4 2
考试时间:75分钟 分值:100分 C.向氯化钙溶液中通入少量CO₂气体: Ca²⁺+CO₂+H₂O=CaCO₃↓+2H⁺
命题人:姜萍萍 审题人:许晶 D. 氢氧化钠溶液与过量的碳酸氢钙溶液反应: OH-+Ca2++HCO -=CaCO ↓+ H O
3 3 2
6. 常温下,下列各组离子在水溶液中能大量共存的是( )
相对原子质量: H:1 O:16 Na:23 S:32 Cl:35.5 Ca:40 Fe:56 A. 澄清透明的溶液中: K+、MnO - 、SO 2- 、CO 2-
4 4 3
一、选择题(1-19每题2分, 20-23每题3分, 共50分) B. 酸性溶液中: Na+ 、K+ 、SO 2- 、CH COO-
4 3
1.化学与生活、社会密切相关,下列说法正确的是( ) C. 含有大量Cl⁻的溶液中: Na+、Ag+、NH + 、NO -
4 3
A.绚丽缤纷的烟花中,发光物质是在烟花药中添加了含钾、钠、铁、铜等金属元素的化合物 D. 在饱和氯水中: Mg2+ 、K+、NO - 、SO 2-
3 3
B. NaClO 是“84消毒液”的有效成分,其水溶液能使有色布条褪色,原因是生成的氯气具有漂白 7.(NH₄)₂Cr₂O₇是一种受热易发生氧化还原反应而分解的盐。下列各组对( (NH₄)₂Cr₂O₇受热分解产物的判
性 断,符合实际的是( )
C.氯气能与铁反应,所以液氯不能存放在钢瓶中 A.CrO₃+NH₃+H₂O B.Cr₂O₃+NH₃+H₂O C.CrO₃+N₂+H₂O D.Cr₂O₃+N₂+H₂O
D. Fe₂O₃是一种红棕色粉末,俗称铁红,常用作红色油漆和涂料 8. 已知在酸性溶液中, Co₂O₃的还原产物是 Co²⁺,Co₂O₃、Cl₂、FeCl₃、I₂的氧化性依次减弱。下列叙述
2.物质的分类有利于我们更好地认识和利用物质。下列叙述中正确的个数为( ) 中,正确的是( )
①有单质参加的反应或有单质产生的反应是氧化还原反应 A.Co₂O₃在酸性溶液中易被氧化成 Co²⁺
②稀豆浆、雾、淀粉溶液、血液、有色玻璃均属于胶体 B.Cl₂通入 FeI₂溶液中,可存在反应 3Cl₂+6FeI₂=2FeCl₃+4FeI₃
③CO₂、NO₂、 P₂O₅均为酸性氧化物, Na₂O、Na₂O₂均为碱性氧化物 C.FeCl₃溶液能将 KI溶液中的I⁻氧化
④非电解质:干冰、麦芽糖、乙醇 D.I₂具有较强的氧化性,可以将 Co²⁺氧化成 Co₂O₃
⑤金属氧化物都是碱性氧化物 9.下列有关钠元素的单质及其化合物的说法错误的是( )
⑥氢氧化铁胶体稳定存在的主要原因是胶粒直径介于1nm到100nm之间 A. 金属钠与 Ca(HCO₃)₂溶液反应时,既有沉淀生成又有气体逸出
⑦同素异形体: C₆₀、C₈₀、金刚石、石墨 B. 等物质的量的 Na₂O₂和 Na₂O分别溶于等质量的水中,所得溶液的溶质质量分数相同
A.2 B.3 C.4 D.5 C. 向饱和碳酸钠溶液中通入足量的( CO₂,有沉淀生成
3. 我国科学家在世界上第一次为一种名为“钴酞箐”的分子(直径约为 1.3×10⁻⁸m)恢复了磁性。“钴酞 D. 可用澄清石灰水鉴别 NaHCO₃溶液和 Na₂CO₃溶液
箐”分子的结构和性质与人体内的血红素和植物的叶绿素非常相似。下列关于“钴酞箐”分子的说法 10. 实验室模拟并改进侯氏制碱法制备 Na₂CO₃的实验流程如下图
中正确的是 ( )
A. 它在水中所形成的分散系属于浊液
B. 它的分子既能透过滤纸,也能透过半透膜
C. 它在水中形成的分散系与淀粉溶液的分散系种类相同
D. 向40mL沸水中逐滴加入5-6滴 FeCl₃饱和溶液,搅拌至液体呈红褐色,得到氢氧化铁胶体
4.离子的摩尔电导率可用来衡量电解质溶液中离子导电能力的强弱,摩尔电导率越大,离子在溶液中 下列说法错误的是 ( )
的导电能力越强。已知 Ca²⁺,OH⁻、HCO₃的摩尔电导率分别为0.60、1.98、0.45 据此可判断,向饱和的澄 A. 实验室制备的CO₂可用饱和 NaHCO₃溶液洗气
清石灰水中通入过量的二氧化碳,溶液导电能力随二氧化碳通入量的变化趋势正确的是( ) B. 生成 NaHCO₃的总反应的离子方程式为 CO +NH +Na++H O=NaHCO ↓+NH +
2 3 2 3 4
C. 流程中可循环使用的试剂仅为 CO₂
D. 母液中含有较多 HCO -,NH Cl可作肥料
3 4
11.在“价-类”二维图中融入“杠杆模型”,可直观辨析部分物质间的转化及其定量关系。图中的字
母分别代表常见的含氯元素的物质,下列相关推断合理的是( )A. 加热条件下,足量二氧化锰和含4mol a的浓溶液充分反应可制得 1m old气体
B.若d 在加热条件下与强碱溶液反应生成的含氯化合物只有e和f,则n(e): n(f)=5: 1
C. d能使湿润的有色布条褪色,说明d具有漂白性
D. 等浓度的 b、c溶液,b溶液酸性更强
12. 氯化碘 (ICl₃)在药物合成中用途非常广泛,其熔点为33°C,沸点为 73°C,,遇水易反应。实验室可用
如 图 装 置 ( 部 分 夹 持 装 置 已 略 去 ) 制 取 ICl₃ , 制 备 的 反 应 原 理 : I₂+3Cl₂=2ICl₃, 已 知 :
KClO₃+6HCl(浓)=KCl+3Cl₂↑+3H₂O, 下列说法不正确的是( ) D.标准状况下,22.4L HCl溶于1L 水,盐酸的物质的量浓度为 1mol⋅L⁻¹
16.高铜酸钾 (KCuO₂)是一种难溶于水的黑色粉末状固体(其中氧元素的化合价为-2价),与高铁酸钾
(K₂FeO₄)性质相似,可以由四羟基合铜酸钾和次溴酸在冰水浴中合成:① K₂[Cu(OH)₄]
+HBrO→ KCuO₂+KBr+KBrO+H₂O( 未 配 平 ) 。 高 铜 酸 钾 在 酸 性 条 件 下 不 稳 定 :
②KCuO₂+H₂SO₄→O₂↑+CuSO₄+H₂O+K₂SO 未配平)。下列说法错误的是( )
4
A.①中还原剂和氧化剂的数量之比为2:1 B.②若有 32gO₂生成,则生成 72gH₂O
A.装置丙可用盛有浓硫酸的洗气瓶来代替 C.②中 KCuO₂既表现氧化性,又表现还原性 D.由①、②可知氧化性强弱顺序为 HBrO>KCuO₂>O₂
B.装置乙中长颈漏斗内液面上升说明丙装置可能发生堵塞
C.装置戊中碱石灰的作用是干燥Cl₂ 17.将铁屑溶于过量的稀盐酸后加入过量的NaOH 溶液,有白色沉淀生成,过滤,在空气中加热至沉淀
D.装置丁中生成ICl₃的过程温度不宜过高 质量不再发生变化为止,得到红棕色残渣。上述沉淀和残渣分别是 ( )
13.设NA表示阿伏加德罗常数的值,下列说法正确的是( ) A. Fe(OH)₃; Fe₂O₃ B. Fe(OH)₂; Fe₂O₃ C. Fe(OH)₂; Fe(OH)₃、 Fe₃O₄ D. Fe₂O₃; Fe(OH)₃
A.常温常压下,23gNO₂和N₂O₄的混合气体中含有的原子数目为1.5NA 18. 某研究小组欲分析某矿石的主要成分,粉碎后将其溶于过量稀盐酸中充分反应,过滤后用所得溶
B.常温常压下, 1L1mol/L 的 KNO₃溶液中含有的氧原子数目为3NA 液进行如下实验,下列说法正确的是( )
C.标准状况下,22.4L 乙醇含有的分子数目为 NA A.取少量滤液向其中滴加少量 Na₂CO₃溶液,无白色沉淀,说明矿石中一定不含 Ca²⁺
D.常温常压下, 18g H₂O 的体积大于22.4L B.取少量滤液向其中滴加过量 BaCl₂溶液,产生白色沉淀,说明矿石中含有 SO 2-
4
14.如图是利用“手持”技术测定阳光照射不同气体温度变化曲线,其中四个容器均密闭、体积相等且 C.取少量滤液,向其中滴加适量NaOH 溶液,产生白色沉淀,说明矿石中一定含有 Mg²⁺
初始压强均为101KPa.下列说法错误的是 ( ) D.取少量滤液向其中加入硝酸酸化的硝酸银,产生白色沉淀,说明矿石中一定有Cl⁻
19. 下列除去物质中混有少量杂质的方法不正确的是( )
选项 物质 杂质 除去杂质的方法
A Cl₂ HCl 将气体依次通过盛有饱和食盐水和浓硫酸的洗气瓶
B NaCl溶液 CaCl₂ 加入足量 Na₂CO₃溶液,过滤
A.实验开始时,四种气体密度最大的是( CO₂ C MnO₂粉末 KCl 用足量蒸馏水溶解、过滤、洗涤、干燥
B.若容器的容积为22.4L, 13:00时N₂原子个数等于2NA
C.12:30-13:30时间范围内,CO₂压强最大 D Na₂CO₃固体 NaHCO₃固体 将固体混合物加热至恒重
D. CO₂是四种气体中温室效应最显著的 20.下图所示装置可用来制取 Fe(OH)₂和观察 Fe(OH)₂在空气中被氧化时的颜色变化。实验提供的试剂:
15.下列溶液的物质的量浓度的相关计算正确的是( ) 铁屑、6mol/L 硫酸溶液、NaOH溶液.下列说法错误的是( )
A.同浓度的三种物质的溶液:Na₂SO₄、MgSO₄、Al₂(SO₄)₃溶液体积之比为3:2:1,则:SO 2-浓度之比 A. B中盛有一定量的 NaOH 溶液,A中应预先加入的试剂是铁屑
4
为3:2:3 B.实验开始时应先将活塞 E 关闭
B.将100mL5mol⋅L⁻¹的盐酸加水稀释至1L,再取出5mL,这5mL溶液的物质的量浓度为 0.5mol⋅L⁻¹ C.生成 Fe(OH)₂的操作为:关闭E,使A中溶液压入 B瓶中
C.将 1mol⋅L⁻¹的NaCl溶液和0.5mol⋅L⁻¹的BaCl₂溶液等体积混合后,忽略溶液体积变化, D.取下装置B中的橡皮塞,使空气进入,有关反应的化学方程式为: 4Fe(OH)₂+O₂+2H₂O=4Fe(OH)₃
c(Cl⁻)=0.75mol⋅L⁻¹ 21. 一瓶不纯的 K₂CO₃粉末,所含杂质可能是 KNO₃、Ca(NO₃)₂、KCl、CuCl₂、Na₂SO₄中的一种或几种,为确定其成分,进行如下流程:
下列推断正确的是( )
A.白色沉淀1为 BaSO₄ B.无色溶液 1 中的溶质为 KCl、KNO₃、NaCl、 回答下列问题:
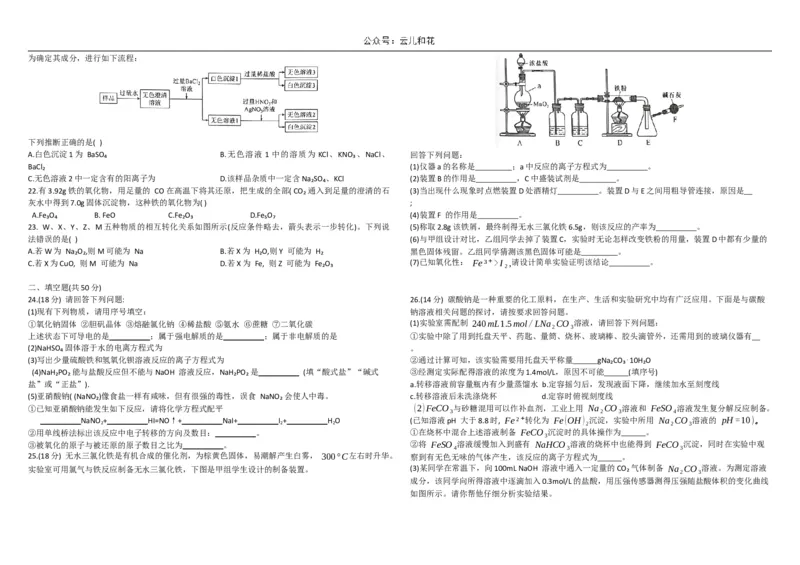
BaCl₂ (1)仪器a的名称是 ;a中反应的离子方程式为 。
C.无色溶液2中一定含有的阳离子为 D.该样品杂质中一定含Na₂SO₄、KCl (2)装置B的作用是 ,C中盛装试剂是 。
22.有3.92g铁的氧化物,用足量的 CO在高温下将其还原,把生成的全部( CO₂通入到足量的澄清的石 (3)当出现什么现象时点燃装置D处酒精灯 。装置D与E之间用粗导管连接,原因是
灰水中得到7.0g固体沉淀物,这种铁的氧化物为( ) ;
A.Fe₃O₄ B. FeO C.Fe₂O₃ D.Fe₅O₇ (4)装置F 的作用是 。
23. W、X、Y、Z、M五种物质的相互转化关系如图所示(反应条件略去,箭头表示一步转化)。下列说 (5)称取2.8g该铁屑,最终制得无水三氯化铁6.5g,则该反应的产率为 。
法错误的是( ) (6)与甲组设计对比,乙组同学去掉了装置C,实验时无论怎样改变铁粉的用量,装置D中都有少量的
A.若W为 Na₂O₂,则M可能为 Na B.若X为 H₂O,则Y 可能为 H₂ 黑色固体残留。乙组同学猜测该黑色固体可能是 。
C.若X为CuO, 则M 可能为 Na D.若X为 Fe, 则Z 可能为 Fe₂O₃ (7)已知氧化性: Fe³⁺>I₂,请设计简单实验证明该结论 。
二、填空题(共50分)
24.(18分) 请回答下列问题: 26.(14分) 碳酸钠是一种重要的化工原料,在生产、生活和实验研究中均有广泛应用。下面是与碳酸
(1)现有下列物质,请用序号填空: 钠溶液相关问题的探讨,请按要求回答问题。
①氧化钠固体 ②胆矾晶体 ③熔融氯化钠 ④稀盐酸 ⑤氨水 ⑥蔗糖 ⑦二氧化碳 (1)实验室需配制 240mL1.5mol/LNa₂CO₃溶液,请回答下列问题:
上述状态下可导电的是 ;属于强电解质的是 ;属于非电解质的是 ①实验中除了用到托盘天平、药匙、量筒、烧杯、玻璃棒、胶头滴管外,还需用到的玻璃仪器有
(2)NaHSO₄固体溶于水的电离方程式为 。
(3)写出少量硫酸铁和氢氧化钡溶液反应的离子方程式为 ②通过计算可知,该实验需要用托盘天平称量 gNa₂CO₃⋅10H₂O
(4)NaH₂PO₂能与盐酸反应但不能与NaOH 溶液反应,NaH₂PO₂是 (填“酸式盐”“碱式 ③经测定实际配得溶液的浓度为1.4mol/L,原因不可能 (填序号)
盐”或“正盐”). a.转移溶液前容量瓶内有少量蒸馏水 b.定容摇匀后,发现液面下降,继续加水至刻度线
(5)亚硝酸钠( (NaNO₂)像食盐一样有咸味,但有很强的毒性,误食 NaNO₂会使人中毒。 c.转移溶液后未洗涤烧杯 d.定容时俯视刻度线
①已知亚硝酸钠能发生如下反应,请将化学方程式配平 (2)FeCO₃与砂糖混用可以作补血剂,工业上用 Na₂CO₃溶液和 FeSO₄溶液发生复分解反应制备。
NaNO + HI=NO↑+ NaI+ I + H O (已知溶液pH 大于8.8时, Fe²⁺转化为 Fe(OH)₂沉淀,实验中所用 Na₂CO₃溶液的 pH=10)。
2 2 2
②用单线桥法标出该反应中电子转移的方向及数目: 。 ①在烧杯中混合上述溶液制备 FeCO₃沉淀时的具体操作为 。
③被氧化的原子与被还原的原子数目之比为 。 ②将 FeSO₄溶液缓慢加入到盛有 NaHCO₃溶液的烧杯中也能得到 FeCO₃沉淀,同时在实验中观
25.(18分) 无水三氯化铁是有机合成的催化剂,为棕黄色固体,易潮解产生白雾, 300°C左右时升华。 察到有无色无味的气体产生,该反应的离子方程式为 。
实验室可用氯气与铁反应制备无水三氯化铁,下图是甲组学生设计的制备装置。 (3)某同学在常温下,向100mL NaOH 溶液中通入一定量的CO₂气体制备 Na₂CO₃溶液。为测定溶液
成分,该同学向所得溶液中逐滴加入0.3mol/L的盐酸,用压强传感器测得压强随盐酸体积的变化曲线
如图所示。请你帮他仔细分析实验结果。①该同学所得溶液的溶质成分为 。
②该同学使用的 NaOH 溶液的物质的量浓度不低于 mol/L化学答案
1 2 3 4 5 6 7 8 9 10
D B C D D A D C D C
11 12 13 14 15 16 17 18 19 20
B C A B B B B B B B
21 22 23
C D D