文档内容
2026届高二年级第五次月考化学试卷 反应的能量变化如图1所示。体系中还存在其他副反应。相同时间内,乙烷的转化率、乙烯的
选择性与温度的关系如图2所示。已知:乙烯的选择性为转化的乙烷中生成乙烯的百分比
可能用到的相对原子质量:Zn-65 S-32 As-75 Ga-70
一、单选题
1.味精的主要成分是谷氨酸钠( ),其分子中含有的手性碳原子数是
A.0 B.1 C.2 D.3
2.已知在有机化合物中,吸电子基团(吸引电子云密度靠近)能力:
,推电子基团(排斥电子云密度偏离)能力:
,一般来说,体系越缺电子,酸性越强;体系越
富电子,碱性越强。下列说法错误的是
A.与Na反应的容易程度: B.羟基的活性:C HOH>H O
6 5 2 下列说法不正确的是
A.
C.酸性: D.碱性: >
B.反应②比反应①的速率小,是总反应的决速步
C.在图2所画曲线的温度范围内,温度越高,乙烯的产率越低
3.运用元素周期律分析下面的推断,其中错误的是( )
D.其他条件不变,适当增大投料比 ,能提高 的转化率
A.氢氧化铍[Be(OH) ]的碱性比氢氧化镁弱
2
B.砹(At)为有色固体,HAt不稳定 7.有科学研究提出:锂电池负极材料(Li)由于生成 而不利于电池容量的保持。一定温度
C.硫酸锶(SrSO )是难溶于水的白色固体
4
D.硒化氢(H Se)是无色、有毒,比HS稳定的气体 下,利用足量重水( )与含 的 负极材料反应,通过测定 可以获知 。
2 2
4.结构决定性质,性质决定用途。下列事实解释错误的是
事实 解释 已知:① ② , 下列说法不正确的
A 甘油是黏稠液体 甘油分子间的氢键较强
是
、MgO、 离子键成分的百分数依
B Na、Mg、Al的电负性依次增大 A.可用质谱区分 和 B. 与 的反应:
次减小
C 冰的密度小于干冰 冰晶体中水分子的空间利用率相对较低
C.若 越大,则 越小 D. 反应所得 比 反应所得 大
熔化时要断开化学键, 只需克服范
D 熔点:
德华力 8.下列说法错误的是
A.A B.B C.C D.D
5.下列有关化学用语表示正确的是
A.BF 的空间结构: (三角锥形)
3
B.CaO 的电子式:
2
A.图1晶体中既存在共价键又存在范德华力,属于混合型晶体
C.H 2 S分子的比例模型: B.图2为某气态团簇分子的结构,该气态团簇分子的化学式为TiC
D.NH 分子中N原子的杂化轨道表示式: C.图3为ZnS的晶胞结构, 的配位数为4
3
D.图3为ZnS的晶胞结构,已知该晶体的密度为 , 为阿伏加德罗常数的值,则晶
6. 转化可减少 排放并实现资源利用。 催化氧化乙烷制乙烯的主要反应有:
①: ②:
2026届高二年级第五次月考化学试卷--1B.产生白色沉淀时,溶液中存在
胞中 和 的最近距离为
C.若起始时向卤水中滴加2滴(0.1 ) ,能产生沉淀
9.相变离子液体体系因节能潜力大被认为是新一代 吸收剂,某新型相变离子液体X吸 D.白色沉淀开始析出时,
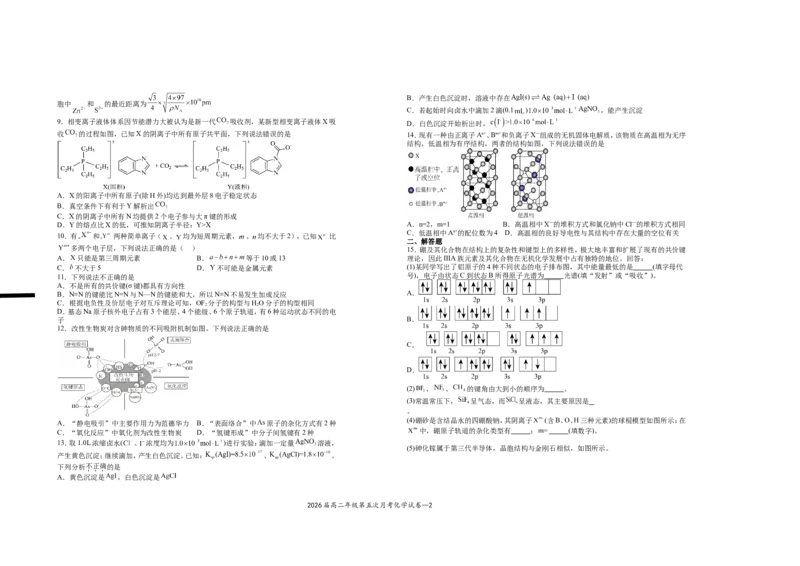
收 的过程如图,已知X的阴离子中所有原子共平面,下列说法错误的是 14.现有一种由正离子An+、Bm+和负离子X—组成的无机固体电解质,该物质在高温相为无序
结构,低温相为有序结构,两者的结构如图,下列说法错误的是
A.X的阳离子中所有原子(除H外)均达到最外层8电子稳定状态
B.真空条件下有利于Y解析出
C.X的阴离子中所有N均提供2个电子参与大π键的形成
D.Y的熔点比X的低,可推知阴离子半径:Y>X A.n=2,m=1 B.高温相中X—的堆积方式和氯化钠中Cl—的堆积方式相同
C.低温相中An+的配位数为4 D.高温相的良好导电性与其结构中存在大量的空位有关
10.有 和 两种简单离子( 、 均为短周期元素, 、 均不大于2),已知 比
二、解答题
多两个电子层,下列说法正确的是( ) 15.硼及其化合物在结构上的复杂性和键型上的多样性,极大地丰富和扩展了现有的共价键
A. 只能是第三周期元素 B. 等于10或13 理论,因此IIIA族元素及其化合物在无机化学发展中占有独特的地位。回答:
C. 不大于5 D. 不可能是金属元素 (1)某同学写出了铝原子的4种不同状态的电子排布图,其中能量最低的是 (填字母代
11.下列说法不正确的是 号),电子由状态C到状态B所得原子光谱为 光谱(填“发射”或“吸收”)。
A.不是所有的共价键(σ键)都具有方向性
B.N≡N的键能比N=N与N—N的键能和大,所以N≡N不易发生加成反应 A.
C.根据电负性及价层电子对互斥理论可知,OF 分子的构型与HO分子的构型相同
2 2
D.基态Na原子核外电子占有3个能层、4个能级、6个原子轨道,有6种运动状态不同的电
子 B.
12.改性生物炭对含砷物质的不同吸附机制如图。下列说法正确的是
C.
D.
(2) 、 、 的键角由大到小的顺序为 。
(3)常温常压下, 呈气态,而 呈液态,其主要原因是
。
(4)硼砂是含结晶水的四硼酸钠,其阴离子 (含B、O、H三种元素)的球棍模型如图所示:在
A.“静电吸引”中主要作用力为范德华力 B.“表面络合”中 原子的杂化方式有2种
C.“氧化反应”中氧化剂为改性生物炭 D.“氢键形成”中分子间氢键有2种 中,硼原子轨道的杂化类型有 ; (填数字)。
13.取1.0L浓缩卤水( 、 浓度均为 )进行实验:滴加一定量 溶液,
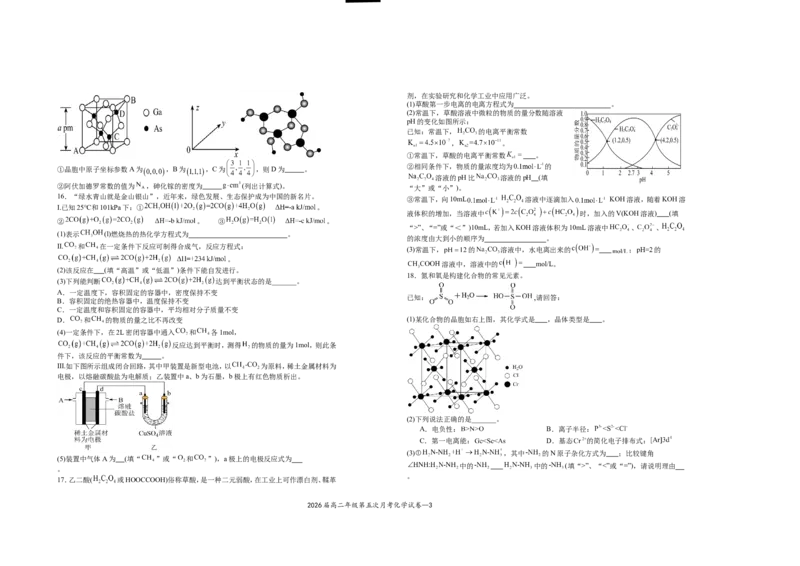
(5)砷化镓属于第三代半导体,晶胞结构与金刚石相似,如图所示。
产生黄色沉淀;继续滴加,产生白色沉淀。已知: 、 。
下列分析不正确的是
A.黄色沉淀是 ,白色沉淀是
2026届高二年级第五次月考化学试卷--2剂,在实验研究和化学工业中应用广泛。
(1)草酸第一步电离的电离方程式为 。
(2)常温下,草酸溶液中微粒的物质的量分数随溶液
pH的变化如图所示:
已知:常温下, 的电离平衡常数
, 。
①常温下,草酸的电离平衡常数 。
②相同条件下,物质的量浓度均为 的
①晶胞中原子坐标参数A为 ,B为 ,C为 ,则D为 。
溶液的pH比 溶液的pH (填
②阿伏加德罗常数的值为 ,砷化镓的密度为 (列出计算式)。
“大”或“小”)。
16.“绿水青山就是金山银山”,近年来,绿色发展、生态保护成为中国的新名片。
③常温下,向10mL 溶液中逐滴加入 KOH溶液,随着KOH溶
Ⅰ.已知25℃和101kPa下:① 。
液体积的增加,当溶液中 时,加入的V(KOH溶液) (填
② 。 ③ 。
“>”、“=”或“<”)10mL,若加入KOH溶液体积为10mL溶液中 、 、
(1)表示 (l)燃烧热的热化学方程式为 。
的浓度由大到小的顺序为 。
Ⅱ. 和 在一定条件下反应可制得合成气,反应方程式:
(3)常温下, 的 溶液中,水电离出来的 = ; 的
。
溶液中,溶液中的 mol/L。
(2)该反应在 (填“高温”或“低温”)条件下能自发进行。
18.氮和氧是构建化合物的常见元素。
(3)下列能判断 达到平衡状态的是_______。
A.一定温度下,容积固定的容器中,密度保持不 变
已知: ,请回答:
B.容积固定的绝热容器中,温度保持不变
C.一定温度和容积固定的容器中,平均相对分子质量不变
D. 和 的物质的量之比不再改变 (1)某化合物的晶胞如右上图,其化学式是 ,晶体类型是 。
(4)一定条件下,在2L密闭容器中通入 和 各1mol,
反应达到平衡时,测得 的物质的量为1mol,则此条
件下,该反应的平衡常数为 。
Ⅲ.如下图所示组成闭合回路,其中甲装置是新型电池,以 为原料,稀土金属材料为
电极,以熔融碳酸盐为电解质;乙装置中a、b为石墨,b极上有红色物质析出。
(2)下列说法正确的是_______。
A.电负性: B.离子半径:
C.第一电离能: D.基态 2+的简化电子排布式:
(3)① ,其中 的N原子杂化方式为 ;比较键角
(5)装置中气体A为 (填“ ”或“ 和 ”),a极上的电极反应式为
中的 中的 (填“>”、“<”或“=”),请说明理由
。
。
17.乙二酸( 或HOOCCOOH)俗称草酸,是一种二元弱酸,在工业上可作漂白剂、鞣革
2026届高二年级第五次月考化学试卷--3②将 与 按物质的量之比1:2发生化合反应生成A,测得A由2种微粒构成,其中之
一是 。比较氧化性强弱: (填“>”、“<”或“=”);写出A中阴离子的结构
式
2026届高二年级第五次月考化学试卷参考答案
题号 1 2 3 4 5 6 7 8 9 10
答案 B D D D B C C B C C
题号 11 12 13 14
答案 D C D A
15.(1) A 发射
(2)
(3) 、 是结构与组成相似的分子晶体, 的相对分子质量较大,分子间作用力更
强
(4) 、 2
(5)
16.(1)
(2)高温
(3)BC
(4)1
(5)
17.(1)
(2) 小 >
(3)
18.(1) 分子晶体
(2)CD
(3) sp3 < 有孤电子对,孤电子对对成键电子排斥力大,键角变小 >
2026届高二年级第五次月考化学试卷--4