文档内容
高三年级素养检测一 B.X、Z位于同一主族
C.X、W的氯化物中各原子均为8电子稳定结构
化学试题
D.Y、Z的第一电离能均小于同周期相邻两种元素
可能用到的相对原子量:H-1 C-12 O-16 Al-27 Si-28 S-32 Cl-35.5
4.短周期元素 X、Y、M 原子半径依次减小,M 与 X、Y 位于不同周期,它们组成的
Fe-56 Co-59 Cu-64 As-75 Ta-181
某离子液体阳离子结构如图所示。下列有关说法错误的是
一、单项选择题。本题共14小题,每小题3分,共42分,在每小题给出的四个选
项中,只有一项是符合题目要求的。
1.河北省有着深厚的文化底蕴和独特的自然条件,民间艺术代表着民族的思想和
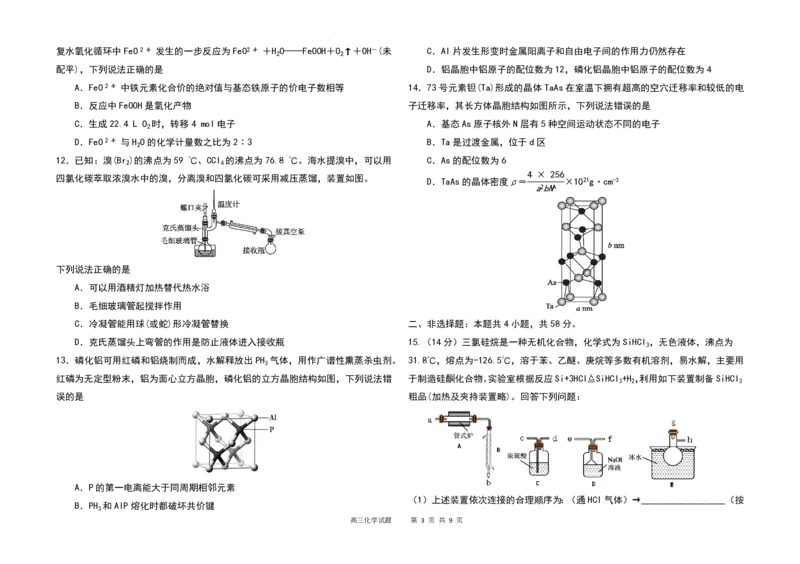
智慧,下列民间艺术作品的制作材料主要成分是蛋白质的是
A.X元素的单质,既可能是共价晶体,也可能是分子晶体
B.Y的简单氢化物既可溶于水,又可溶于甲醇
民间艺术作品
C.X的简单氢化物的空间结构为正四面体
D.X、Y均可与O形成原子个数比1∶2的酸性氧化物
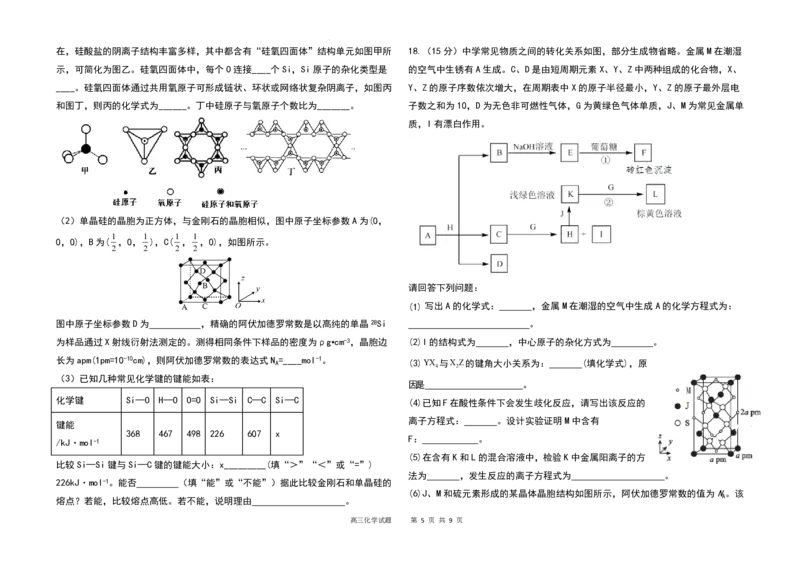
5.某化合物的分子结构如图所示,其中 G、X、Y、Z、W 为原子序数依次递增的短
D.唐山驴皮皮
周期主族元素,G、Y、W位于不同周期。下列说法错误的是
选项 A.井陉木雕 B.雄安芦苇画 C.蔚县剪纸
影
2.N是阿伏加德罗常数的值,下列说法错误的是
A
A.1 mol乙二醇中采取sp3杂化的原子总数为2N
A
B.标准状况下,11.2 L乙炔中π键的数目为N
A
A.原子半径:Z>W>Y>G
C.31 g P 分子中孤电子对数为N
4 A
B.沸点:XY >XZ
2 2
D.1 mol [Cr(NH ) (H O) Cl]2+中配位键的数目为6N
3 3 2 2 A
C.G XY分子和G Y分子之间可以形成氢键
2 2
3.一种名贵宝石的主要成分是由原子序数依次增大的短周期主族元素X、Y、Z、W
D.该化合物中X、Y、Z、W原子均满足8电子结构
组成,其中 X、Z 为金属元素,X 的质子数等于 W 的最外层电子数,Y、W 的最外层
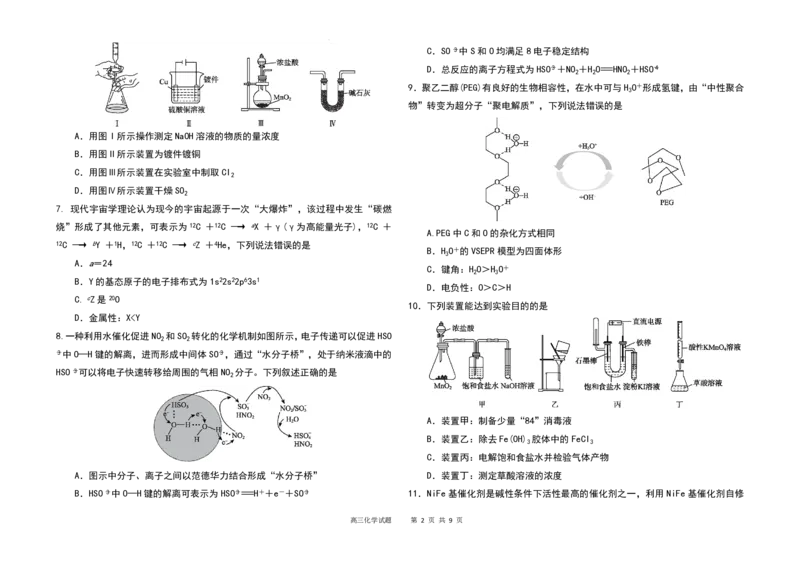
6. 下列仪器或装置能实现相应实验目的的是
电子数之和是X、Z最外层电子数之和的2倍,Y单质是空气的主要成分之一。下列
有关说法正确的是
A.X的氢氧化物易溶于水
高三化学试题 第 1 页 共 9 页
学科网(北京)股份有限公司C.SO-3中S和O均满足8电子稳定结构
D.总反应的离子方程式为HSO-3+NO +H O===HNO +HSO-4
2 2 2
9.聚乙二醇(PEG)有良好的生物相容性,在水中可与H O+形成氢键,由“中性聚合
3
物”转变为超分子“聚电解质”,下列说法错误的是
A.用图Ⅰ所示操作测定NaOH溶液的物质的量浓度
B.用图Ⅱ所示装置为镀件镀铜
C.用图Ⅲ所示装置在实验室中制取Cl
2
D.用图Ⅳ所示装置干燥SO
2
7. 现代宇宙学理论认为现今的宇宙起源于一次“大爆炸”,该过程中发生“碳燃
烧”形成了其他元素,可表示为 12C +12C ―→ aX +γ(γ为高能量光子),12C +
A.PEG中C和O的杂化方式相同
12C ―→ bY +1H,12C +12C ―→ cZ +4He,下列说法错误的是
B.H O+的VSEPR模型为四面体形
3
A.a=24
C.键角:H O>H O+
2 3
B.Y的基态原子的电子排布式为1s22s22p63s1
D.电负性:O>C>H
C. cZ是20O
10.下列装置能达到实验目的的是
D.金属性:X H O CH 和H O均为 sp3杂化,CH 无孤电子对,H O有两对孤电子对,孤电子对对
4 2 4 2 4 2
= 。
成键电子的排斥力大,键角变小,所以键角CH > H O
4 2
16.答案:(1)适当升温、搅拌、适当增大硫酸的浓度等(2分) (2)N(1分) (4)Cu O + 2H+ = Cu2+ + Cu + H O 取固体粉末于试管中,加入过量硫酸,振荡,充分反应后,仍
A 2 2
Mn2++HSO -+H O=MnO+SO2-+3H+ (2分) (3)9.0% (1分) 继续增大SO 体积分数时,由于 有固体剩余,溶液变为蓝色,说明含有Cu O。(2分)
5 2 2 4 2 2
SO 有还原性,过多将会降低H SO 的浓度,降低Mn (Ⅱ)氧化速率;(2分)
2 2 5 (5)取少量溶液于试管中,滴加K Fe(CN) 溶液,有蓝色沉淀生成 K+ + Fe2+ + Fe(CN) 3-
(4)9.2 < pH < 9.6(2分) 4Co(OH) +O =4CoO(OH)+2H 0(2分) (5)14.75%(2分) 3 6 6
2 2 2
解析:(1)“加压酸浸”过程中,为增大褐铁矿层红土矿在硫酸中的浸出速率,可采取的措 =KFeFe(CN) ↓(2分)
6
施为适当升温、搅拌、适当增大硫酸的浓度等。
(2)根据化合价判断H SO 分子含有2个-1价氧原子,所以1 mol H SO 中含有O-O单键的数目
2 5 2 5
(6) g·cm-3(2分)
为N;用石灰乳调节pH=4,Mn2+被H SO 氧化为MnO,该反应的离子方程式为:
A 2 5 2
Mn2++HSO -+H O=MnO+SO2-+3H+。 解析:由题意可知:X是H元素,D是CO ,Y是C元素,Z是O元素,C是H O,G是Cl ,H是
5 2 2 4 2 2 2
(3)根据图示可知SO 体积分数为9.0%时,Mn (Ⅱ)氧化速率最大;继续增大SO 体积分数时, HCl,I是HClO,J是Fe,K是FeCl ,L是FeCl ,B是CuCl ,A是Cu (OH) CO 。
2 2 2 3 2 2 2 3
由于SO 有还原性,过多将会降低H SO 的浓度,降低Mn (Ⅱ)氧化速率。 (1)A的化学式为:Cu (OH) CO ,铜在空气中生成铜锈的反应方程式为:
2 2 5 2 2 3
(4)Co2+、Ni2+完全沉淀的pH为9.2,Mg2+开始沉淀的pH为9.6,故加入氢氧化钠调节至9.2 < 2Cu+O +CO +H O=Cu (OH) CO
2 2 2 2 2 3
pH <9.6;Co(Ⅱ)在空气中被氧化成Co(Ⅲ)的化学方程式为:4Co(OH) +O =4CoO(OH)+2H O (2)I是HClO,结构式为H-O-Cl,中心原子O为sp3杂化。
2 2 2
(5)根据元素守恒和得失电子守恒可得关系式:2CoOOH~2Co³+~I₂~2S O 2-;n[Co (3)E是氢氧化铜,氢氧化铜和葡萄糖在加热条件下反应得到红色的氧化亚铜沉淀,方程式为:
2 3
(Ⅲ)]=n(S O 2-)=c(S O 2-)×V(S O 2-)=0.01000mol·L-1×25.00mL×10⁻3L·mL⁻¹=2.5000×10⁻
2 5 2 5 2 5 CH OH(CHOH) CHO+2Cu(OH) +NaOHΔCu O+CH OH(CHOH) COONa+3H O,反应中
4mol;m(Co样品)=2.5000×10-4mol×59g·mol-¹=1.475×10-²g;w=m[Co/m(样品)]=1.475×10- 2 4 2 2 2 4 2
²g/0.1000g×100%=14.75% 体现葡萄糖的还原性。
17.(15分,除标注外,每空1分) (4)键角CH > H O,原因为 CH 和H O均为 sp3杂化,CH 无孤电子对,H O有两对孤电子对,
4 2 4 2 4 2
(1)3s23p2 2 sp3 Si O 12- (2分)6:17(2分) 孤电子对对成键电子的排斥力大,键角变小,所以键角CH > H O
6 18 4 2
1 3 3 288 (5)F为Cu 2 O沉淀,Cu 2 O在酸性条件下会发生歧化反应的离子方程式:Cu 2 O + 2H+ = Cu2+ + Cu
(2) ( ,,)(2分) ×1030(2分)
4 4 4 ρa3 + H O;验证Cu中含有Cu O的操作为:取固体粉末于试管中,加入过量硫酸,振荡,充分反应
2 2
(3)> 能 金刚石的熔点高于单晶硅 (2分) 后,仍有固体剩余,溶液变为蓝色,说明含有Cu O。
2
解析:(1)Si为14号元素,基态Si原子的核外电子排布式是1s22s22p23s23p2,因此基态Si
(6)在含有Fe2+和Fe3+的混合溶液中,可以用K Fe(CN) 溶液检验Fe2+,方法为:取少量溶液
原子的价层电子排布式是3s23p2;根据结构图可知,SiO 晶体中,每个O连接2个Si;SiO 晶 3 6
2 2
高三化学试题 第 8 页 共 9 页
学科网(北京)股份有限公司于试管中,滴加K Fe(CN) 溶液,有蓝色沉淀生成;发生反应的离子方程式为:K+ + Fe2+ +
3 6
Fe(CN) 3- =KFeFe(CN) ↓
6 6
(7)ρ= cm3
高三化学试题 第 9 页 共 9 页
学科网(北京)股份有限公司