文档内容
2024 学年第一学期金华市卓越联盟 12 月阶段性联考
高二年级化学试题
命题人:磐安中学; 审题人:东阳二中、兰溪五中
考生须知:
1.本卷共 8页满分 100 分,考试时间 90 分钟。
2.答题前,在答题卷指定区域填写班级、姓名、考场号、座位号及准考证号并填涂相应数字。
3.所有答案必须写在答题纸上,写在试卷上无效。
4.考试结束后,只需上交答题纸。
5.相对原子质量:H-1;Li-7;C-12;N-14;O-16;Mg-24;Al-27;P-31;S-32;Cl-35.5;Zn-65。
选择题部分
一、选择题(本大题共 16 小题,每小题 3分,共 48 分。每小题列出的四个备选项中只有一个
是符合题目要求的,不选、多选、错选均不得分)
1.下列属于挥发性强酸的是
A.H CO B.NaOH C.HCl D.NH ·H O
2 3 3 2
2.下列化学用语不
.
正
.
确
.
的是
A.中子数为 10 的氧原子: B.H O 的空间结构模型
2
18
8O
C.Na 原子的结构示意图: Na 2 8 1 D.NaOH 的电子式:
3.下列说法正确的是
A.点燃的镁条可在 N 中持续燃烧 B.随意混服多种处方药可同时治疗多种疾病
2
C.工业上用水直接吸收 SO 制得硫酸 D.太阳能电池能将化学能转化为电能
3
4.下列说法正确的是
A.铸铁管道用导线连接锌块或直流电源的负极,可减缓管道生锈
B.灼烧 NaCl 时火焰出现黄色,属于钠元素产生的原子吸收光谱
C.基态时,原子的最外能层排布式为 ns1的元素均位于元素周期表的 s 区
D.碱 AOH 溶液加水稀释 10 倍,pH 变化量小于 1,AOH 可确定为弱碱
5.硝化细菌可将 NH 4 +转化为 NO 3 -:NH 4 ++2O 2 =NO 3 -+2H++H 2 O,下列说法不 . 正 . 确 . 的是
A.NO -既是氧化产物也是还原产物 B.反应中氧化剂与还原剂之比为 1∶2
3
C.H O 是还原产物 D.1molNH +完全反应,转移 8mol 电子
2 4
6.下列离子方程式不
.
正
.
确
.
的是
A.CuCl 浓溶液加水稀释:[CuCl ]2-+ 4H O [Cu(H O) ]2++ 4Cl-
2 4 2 2 4
B.用 Na SO 溶液做导电性实验,灯泡发光:Na SO 通电 2Na+ +SO 2-
2 4 2 4 4
C.K Cr O 溶液中加入 KOH:Cr O 2-+ 2OH- 2CrO 2-+ H O
2 2 7 2 7 4 2
D.K [Fe(CN) ]溶液滴入 FeCl 溶液中:K++ Fe2++ [Fe(CN) ]3-= KFe[Fe(CN) ]↓
3 6 2 6 6
高二化学第 1 页 共 8 页7.已知反应 CO(g) + H O(g) 催化剂 CO (g)+ H (g) ΔH<0。在恒温体积可变密闭容器中达到
2 2 2
平衡,下列叙述不正确的是
...
A.升高温度,到达平衡的时间变短 B.减小压强,c(CO )不变
2
C.加入炭固体,H O 的平衡转化率可能增大 D.充入氮气,n(H )不变
2 2
8.N 为阿伏加德罗常数的值。下列说法正确的是
A
A.锌锰干电池放电时,负极减少 0.65g,则转移电子的数目为 0.02N
A
B.含 0.1mol NaOH 的溶液中通 HF 至中性,反应后溶液中 F-小于 0.1N
A
C.1L0.1 mol·L-1NaCl溶液含有的电子数为2.8N
A
D.12.4 g 白磷(P )中含有的非极性键数目为0.4N
4 A
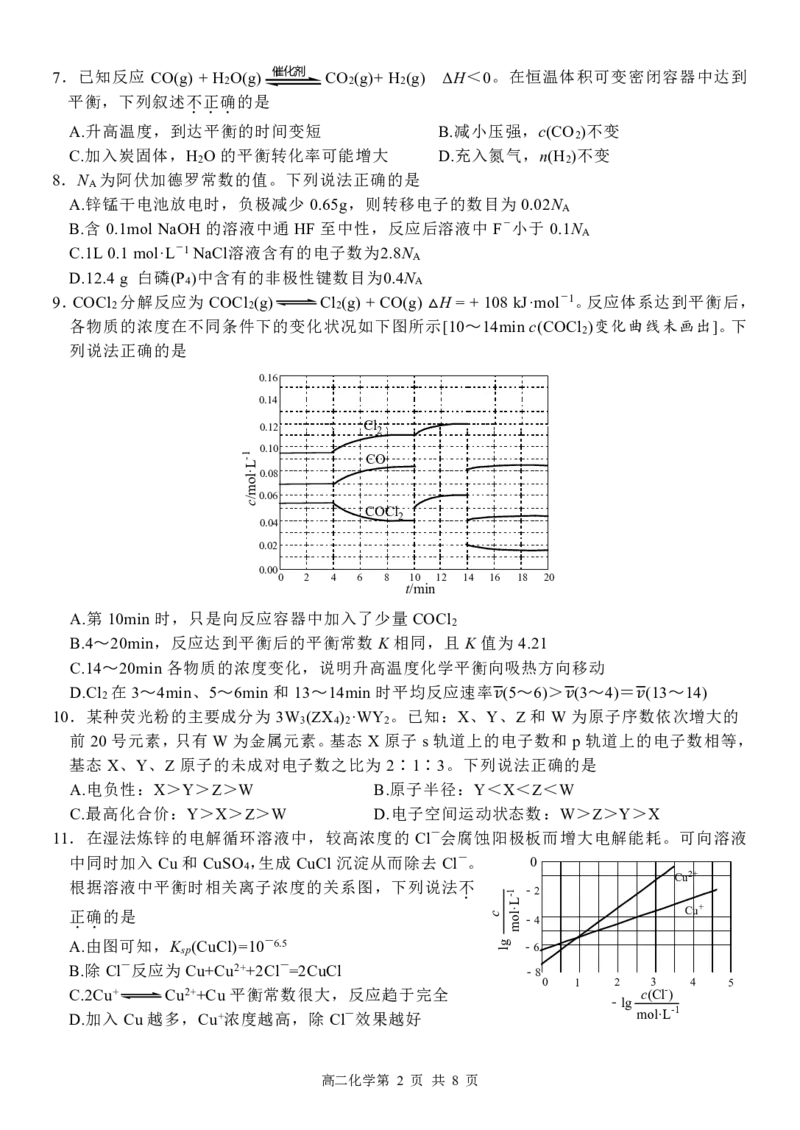
9.COCl 分解反应为 COCl (g) Cl (g) + CO(g) H = + 108 kJ·mol-1。反应体系达到平衡后,
2 2 2
各物质的浓度在不同条件下的变化状况如下图所示[10~14min c(COCl )变化曲线未画出]。下
2
△
列说法正确的是
0.16
0.14
0.12 Cl 2
0.10
CO
0.08
0.06
COCl
2
0.04
0.02
0.00
0 2 4 6 8 10 12 14 16 18 20
t/min
高二化学第 2 页 共 8 页
1-L·lom/c
A.第 10min 时,只是向反应容器中加入了少量 COCl
2
B.4~20min,反应达到平衡后的平衡常数 K 相同,且 K 值为 4.21
C.14~20min 各物质的浓度变化,说明升高温度化学平衡向吸热方向移动
D.Cl 在 3~4min、5~6min 和 13~14min 时平均反应速率 (5~6)> (3~4)= (13~14)
2
10.某种荧光粉的主要成分为 3W (ZX ) ·WY 。已知:X、Y、Z和 W为原子序数依次增大的
3 4 2 2
� � �
前 20 号元素,只有 W 为金属元素。基态 X 原子 s轨道上的电子数和 p 轨道上的电子数相等,
基态 X、Y、Z原子的未成对电子数之比为 2∶1∶3。下列说法正确的是
A.电负性:X>Y>Z>W B.原子半径:Y<X<Z<W
C.最高化合价:Y>X>Z>W D.电子空间运动状态数:W>Z>Y>X
11.在湿法炼锌的电解循环溶液中,较高浓度的 Cl—会腐蚀阳极板而增大电解能耗。可向溶液
中同时加入 Cu 和 CuSO ,生成 CuCl 沉淀从而除去 Cl—。
4
根据溶液中平衡时相关离子浓度的关系图,下列说法不
.
正确的是 ..
A.由图可知,K (CuCl)=10—6.5 sp
B.除 Cl—反应为 Cu+Cu2++2Cl—=2CuCl
C.2Cu+ Cu2++Cu 平衡常数很大,反应趋于完全 c(Cl-)
-lg
D.加入 Cu 越多,Cu+浓度越高,除 Cl—效果越好 mol·L-1
c
gl
1-L·lom
0
Cu2+
-2
Cu+
-4
-6
-8
0 1 2 3 4 512.用电解氧化法可以在铝制品表面形成致密、耐腐蚀的氧化膜,电解质溶液为稀 H SO —
2 4
H 2 C 2 O 4 混合溶液。下列叙述不 . 正 . 确 . 的是
A.电解时需加水以维持电解液浓度稳定
B.阳极反应式为:2Al-6e-+6OH-=Al O +3H O
2 3 2
C.可选用金属铝作为阴极
D.电解过程中,阳极区 c(SO 2-)增大
4
13.室温下,取一定量冰醋酸,进行如下实验:
① 将冰醋酸配制成100mL 0.1 mol·L-1醋酸溶液;
② 取20 mL①所配溶液,加入a mL 0.1 mol·L-1NaOH溶液,充分反应后,测得溶液pH=7;
③ 向②所得溶液中继续滴加x mol·L-1稀盐酸,直至溶液中n(Na+)=n(Cl-)。
下列说法正确的是
A.①中,如果定容时俯视会导致醋酸浓度偏小
B.②中a=20
C.③中,稀盐酸 c(H+)的精确值为[x + ] mol·L-1
��
D.③最后的溶液与 20mL①溶液相比,n� (CH COOH)前者小
平衡 3
14.335℃,在恒容密闭容器中,1mol C H (l)催化脱氢的反应过程如下:
10 18
反应 I:C H (l) C H (l) + 3H (g) H
10 18 10 12 2 1
反应 II:C H (l) C H (l) + 2H (g) H
10 12 10 8 2 △ 2
反应过程的能量变化(反应方向可能是 A→B 或 B→A)、产物产率(x)随时间的变化如下图所
△
示。下列说法正确的是
0.5
量 量 0.4
能 能
E1
1
E
m
2
ol C10H12(l)
E3
E4
B 0.3
(8,0.374)
+ 0.2
3mol H2(g)
A 0.1
或 (8,0.027)
0
反应过程 2 4 6 8 10 12 14 16
时间/h
图 1
高二化学第 3 页 共 8 页
x率产
C H
10 8
C H 10 12
图 2
A.ΔH =E -E +E -E
2 1 2 3 4
B.8h 时,容器中 H 的物质的量为 0.802mol
2
C.使用更高效催化剂能提高 C H 的平衡产率
10 8
D.图 1中的 A 代表的是 1mol C H (l)的能量
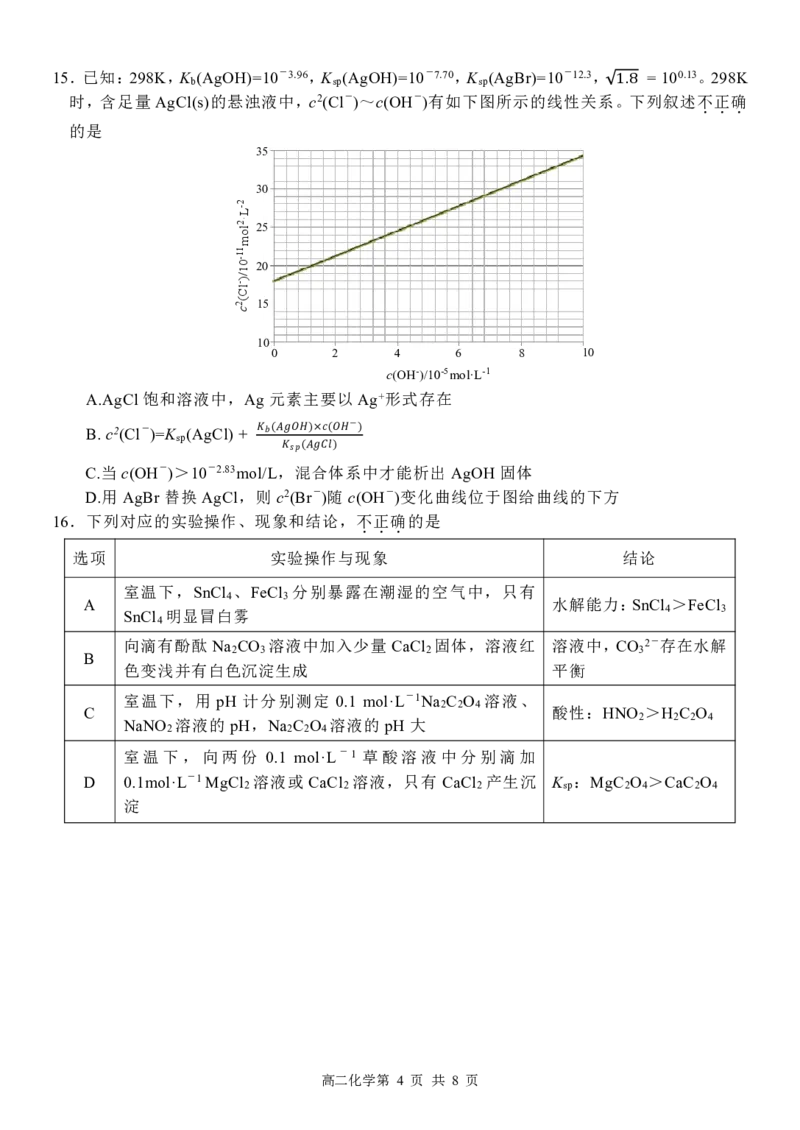
10 1815.已知:298K,K (AgOH)=10-3.96,K (AgOH)=10-7.70,K (AgBr)=10-12.3, = 100.13。298K
b sp sp
时,含足量 AgCl(s)的悬浊液中,c2(Cl-)~c(OH-)有如下图所示的线性关系。下列叙述不
.
正
.
确
.
1.8
的是
35
30
2
-L
2 ol · 25
m
1
1
- 1 0 20
- Cl
)/
2( 15
c
10
0 2 4 6 8 10
c(OH-)/10-5mol·L-1
A.AgCl 饱和溶液中,Ag 元素主要以 Ag+形式存在
B. c2(Cl-)=K (AgCl) +
sp
−
��(����)�(�� )
C.当 c(OH-)>10-2.83mol/L,��混�(�合���体) 系中才能析出 AgOH 固体
D.用 AgBr 替换 AgCl,则 c2(Br-)随 c(OH-)变化曲线位于图给曲线的下方
16.下列对应的实验操作、现象和结论,不
.
正
.
确
.
的是
选项 实验操作与现象 结论
室温下,SnCl 、FeCl 分别暴露在潮湿的空气中,只有
4 3
A 水解能力:SnCl >FeCl
SnCl 明显冒白雾 4 3
4
向滴有酚酞 Na CO 溶液中加入少量 CaCl 固体,溶液红 溶液中,CO 2-存在水解
2 3 2 3
B
色变浅并有白色沉淀生成 平衡
室温下,用 pH 计分别测定 0.1 mol·L-1Na C O 溶液、
C 2 2 4 酸性:HNO >H C O
NaNO 溶液的 pH,Na C O 溶液的 pH 大 2 2 2 4
2 2 2 4
室温下,向两份 0.1 mol·L-1 草酸溶液中分别滴加
D 0.1mol·L-1MgCl 溶液或 CaCl 溶液,只有 CaCl 产生沉 K :MgC O >CaC O
2 2 2 sp 2 4 2 4
淀
高二化学第 4 页 共 8 页非选择题部分
二、非选择题(本大题共 4 小题,共 52 分)
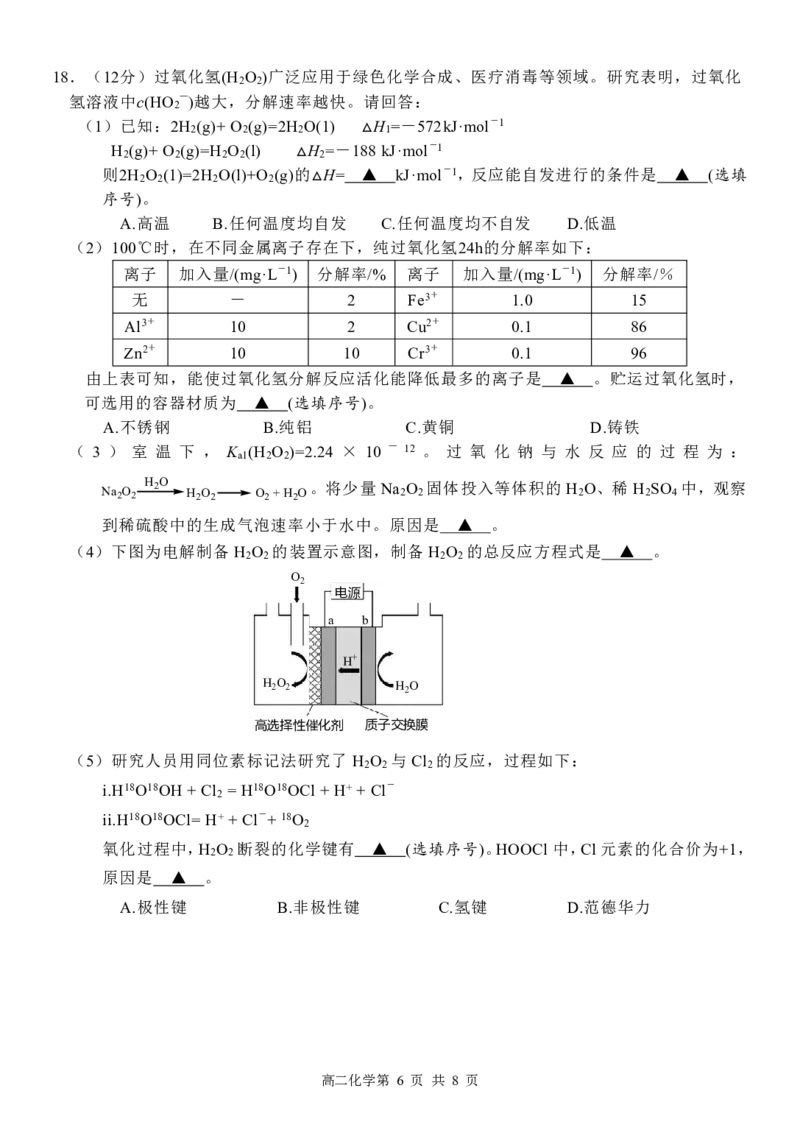
17.(13 分)Li 及其化合物在电池行业得到广泛应用。请回答:
(1)下列 Li 原子电子排布图表示的状态中,能量最高的是 ▲ (选填序号)。
A. B.
1s 2s 2s 2p
C. D.
2s 2p 2s 2p
(2)LiAlH 是有机合成中常用的还原剂,制备方法是:LiH +AlH = LiAlH 。
4 3 4
①Al 的价层电子排布式为 ▲ 。
②与 Al 同一周期的元素中,第一电离能小于 Al 的元素有 ▲ (填元素符号)。
③LiAlH 中,各元素的电负性由小到大的顺序是 ▲ 。
4
④利用下图中的装置制备 LiH,装置连接顺序是 ▲ (选填序号,必要时可重复使用)。
稀硫酸
锂
粗锌(含少 NaOH溶液
浓硫酸
量Cu和ZnS)
A B C D E
(3)Li O生成过程的能量变化( H)如下图所示。
2
2Li+(g) + △ O2-(g) -2908kJ·mol-1 Li O(晶体)
2
1040kJ·mol-1 703kJ·mol-1
2Li(g) O(g)
318kJ·mol-1 249kJ·mol-1
-598kJ·mol-1
2Li(晶体) + O (g)
2
Li 的第一电离能为 ▲ kJ·mol-1。计算 1mol Li(g)与足量 O (g)反应生成 Li O 晶体的 H=
2 2
▲ kJ·mol-1。
△
(4)有机合成中,还原剂的还原能力通常用“有效氢”表示,其含义是 1 克还原剂相当于多
少克氢气的还原能力。LiAlH 的“有效氢”为 ▲ (结果保留 2 位小数)。
4
高二化学第 5 页 共 8 页18.(12分)过氧化氢(H O )广泛应用于绿色化学合成、医疗消毒等领域。研究表明,过氧化
2 2
氢溶液中c(HO —)越大,分解速率越快。请回答:
2
(1)已知:2H (g)+ O (g)=2H O(1) H =-572kJ·mol-1
2 2 2 1
H (g)+ O (g)=H O (l) H =-188 kJ·mol-1
2 2 2 2 2
△
则2H O (1)=2H O(l)+O (g)的 H= ▲ kJ·mol-1,反应能自发进行的条件是 ▲ (选填
2 2 2 2
△
序号)。
△
A.高温 B.任何温度均自发 C.任何温度均不自发 D.低温
(2)100℃时,在不同金属离子存在下,纯过氧化氢24h的分解率如下:
离子 加入量/(mg·L-1) 分解率/% 离子 加入量/(mg·L-1) 分解率/%
无 - 2 Fe3+ 1.0 15
Al3+ 10 2 Cu2+ 0.1 86
Zn2+ 10 10 Cr3+ 0.1 96
由上表可知,能使过氧化氢分解反应活化能降低最多的离子是 ▲ 。贮运过氧化氢时,
可选用的容器材质为 ▲ (选填序号)。
A.不锈钢 B.纯铝 C.黄铜 D.铸铁
( 3 ) 室 温 下 , K (H O )=2.24 × 10 — 12 。 过 氧 化 钠 与 水 反 应 的 过 程 为 :
a1 2 2
Na 2 O 2 H 2 O H 2 O 2 O 2 + H 2 O 。将少量 Na 2 O 2 固体投入等体积的 H 2 O、稀 H 2 SO 4 中,观察
到稀硫酸中的生成气泡速率小于水中。原因是 ▲ 。
(4)下图为电解制备 H O 的装置示意图,制备 H O 的总反应方程式是 ▲ 。
2 2 2 2
O
2
电源
a b
H+
H 2 O 2 H 2 O
高选择性催化剂 质子交换膜
(5)研究人员用同位素标记法研究了 H O 与 Cl 的反应,过程如下:
2 2 2
i.H18O18OH + Cl = H18O18OCl + H+ + Cl-
2
ii.H18O18OCl= H+ + Cl-+ 18O
2
氧化过程中,H O 断裂的化学键有 ▲ (选填序号)。HOOCl 中,Cl 元素的化合价为+1,
2 2
原因是 ▲ 。
A.极性键 B.非极性键 C.氢键 D.范德华力
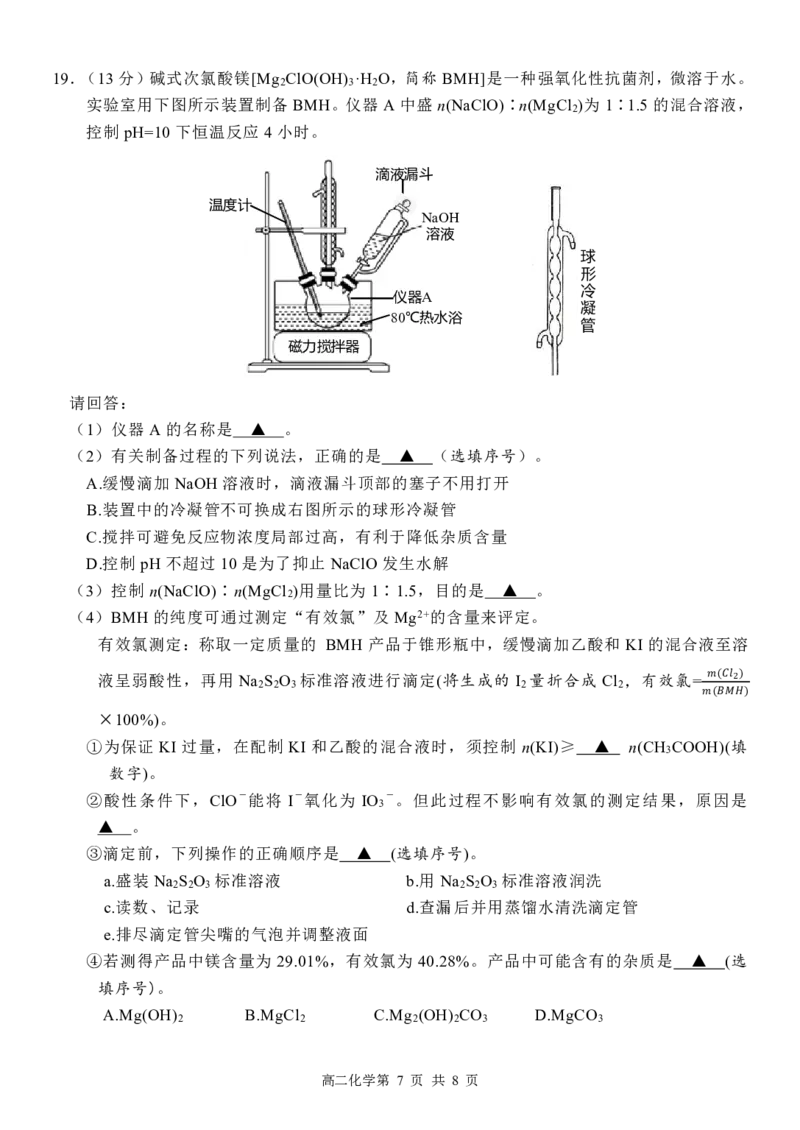
高二化学第 6 页 共 8 页19.(13 分)碱式次氯酸镁[Mg ClO(OH) ·H O,简称 BMH]是一种强氧化性抗菌剂,微溶于水。
2 3 2
实验室用下图所示装置制备 BMH。仪器 A 中盛 n(NaClO)∶n(MgCl )为 1∶1.5 的混合溶液,
2
控制 pH=10 下恒温反应 4小时。
滴液漏斗
温度计
NaOH
溶液
球
形
冷
仪器A
凝
80℃热水浴
管
磁力搅拌器
请回答:
(1)仪器 A 的名称是 ▲ 。
(2)有关制备过程的下列说法,正确的是 ▲ (选填序号)。
A.缓慢滴加 NaOH 溶液时,滴液漏斗顶部的塞子不用打开
B.装置中的冷凝管不可换成右图所示的球形冷凝管
C.搅拌可避免反应物浓度局部过高,有利于降低杂质含量
D.控制 pH 不超过 10 是为了抑止 NaClO 发生水解
(3)控制 n(NaClO)∶n(MgCl )用量比为 1∶1.5,目的是 ▲ 。
2
(4)BMH 的纯度可通过测定“有效氯”及 Mg2+的含量来评定。
有效氯测定:称取一定质量的 BMH 产品于锥形瓶中,缓慢滴加乙酸和 KI 的混合液至溶
液呈弱酸性,再用 Na S O 标准溶液进行滴定(将生成的 I 量折合成 Cl ,有效氯=
2 2 3 2 2
�(��2)
×100%)。 �(���)
①为保证 KI 过量,在配制 KI 和乙酸的混合液时,须控制 n(KI)≥ ▲ n(CH COOH)(填
3
数字)。
②酸性条件下,ClO-能将 I-氧化为 IO -。但此过程不影响有效氯的测定结果,原因是
3
▲ 。
③滴定前,下列操作的正确顺序是 ▲ (选填序号)。
a.盛装 Na S O 标准溶液 b.用 Na S O 标准溶液润洗
2 2 3 2 2 3
c.读数、记录 d.查漏后并用蒸馏水清洗滴定管
e.排尽滴定管尖嘴的气泡并调整液面
④若测得产品中镁含量为 29.01%,有效氯为 40.28%。产品中可能含有的杂质是 ▲ (选
填序号)。
A.Mg(OH) B.MgCl C.Mg (OH) CO D.MgCO
2 2 2 2 3 3
高二化学第 7 页 共 8 页20.(14 分)FeS 是橡胶中使用最为广泛的硫化剂之一。
已知:25℃,K [Fe(OH) ]=10-16.31,K [FeS] = 10-17.20,K [H S]=10-6.96,K [H S]=10-12.89,
sp 2 sp a1 2 a2 2
K [NH ·H O]=10-4.74。
b 3 2
请回答:
(1)实验室可用 Fe 粉与硫粉混合制取 FeS:玻璃棒加热后插入混合物中,反应即可持续发
生。说明 Fe(s)和 S(s)反应生成 FeS(s)属于 ▲ (选填“吸热”或“放热”)反应。
(2)工业上曾用 FeCl 溶液和过量的 Na S 溶液反应制备 FeS。
2 2
①粗产品中可能会混入少量Fe(OH) ,原因是发生副反应:Fe2+(aq) + S2-(aq) + 2H O(l)
2 2
Fe(OH) (s) + H S(aq),则副反应的平衡常数 K= ▲ 。
2 2
②Fe(OH) 会被氧化为 Fe(OH) ,反应方程式为 ▲ 。已知 Fe3+的氧化性强于 S,请设计
2 3
实验方案检验 FeS 中是否混有 Fe(OH) : ▲ (不考虑其它杂质忽略)。
3
(3)用(NH ) S 溶液替代 Na S 溶液可制备更高纯度的 FeS。
4 2 2
①实验室可用带 ▲ (选填“橡胶塞”或“玻璃塞”)的试剂瓶保存(NH ) S溶液。
4 2
②过滤得到的 FeS 沉淀可直接加热烘干,无需洗涤。原因是 ▲ 。
③下列关于(NH ) S的说法正确的是 ▲ (选填序号)。
4 2
A.(NH ) S 溶液中加 FeCl 固体,c(NH +)逐渐增大(体积变化忽略不计)
4 2 2 4
B.与 Na S比,(NH ) S 溶液中 S2-水解程度小,可避免生成 Fe(OH)
2 4 2 2
C.(NH ) S溶液中,c(OH-)+c(NH ·H O)=c(H+) + c(HS-) + 2c(H S)
4 2 3 2 2
D.(NH ) S 中,各粒子的最外层均满足 8电子稳定结构
4 2
(4)FeS 还可用于电池行业。某新型电池的截面结构如图所示,LLZTO 导体管只允许 Li+通
过。先用 1.8 V 电压充电后,电池正极材料中 S、Fe 的原子个数比为 1.02(不计 Li S,下
2
同);再升至 2.3 V 电压充电后,S、Fe 的原子个数比为 2.01。下列说法正确的是 ▲ (选
填序号)。 负极集流器
A.Al 2 O 3 隔离正负极,使化学能有效地转化为电能 Al 2 O 3 绝缘体
B.2.3 V 充电时,阳极反应为:Fe + 2Li S-4e-= FeS +4Li+
2 2 LLZTO导体管
C.比较不同电压可知,FeS 的热稳定性强于 FeS
2 Li
D.电池总反应可表示为 2xLi + FeS 放电 xLi S + FeS
2 充电 2 2-x
FeS2
正极集流器
高二化学第 8 页 共 8 页