文档内容
绝密★考试结束前
2024 学年第一学期丽水五校高中发展共同体期中联考
高二年级化学学科 试题
考生须知:
1.本卷共8页满分100分,考试时间90分钟。
2.答题前,在答题卷指定区域填写班级、姓名、考场号、座位号及准考证号并填涂相应数字。
3.所有答案必须写在答题纸上,写在试卷上无效。
4.考试结束后,只需上交答题纸。
5.可能用到的相对原子质量:H-1 O-16 Na-23 Al-27 S-32 Ca-40 Fe-56 Cu-64 Ba-137
选择题部分
一、选择题(本大题共20小题,1-10题每小题2分,11-20题每小题3分,共50分。每小题列出的
四个备选项中只有一个是符合题目要求的,不选、多选、错选均不得分)
1.水溶液呈碱性的盐是
A.Na CO B.FeCl C.NaNO D.Ba(OH)
2 3 3 3 2
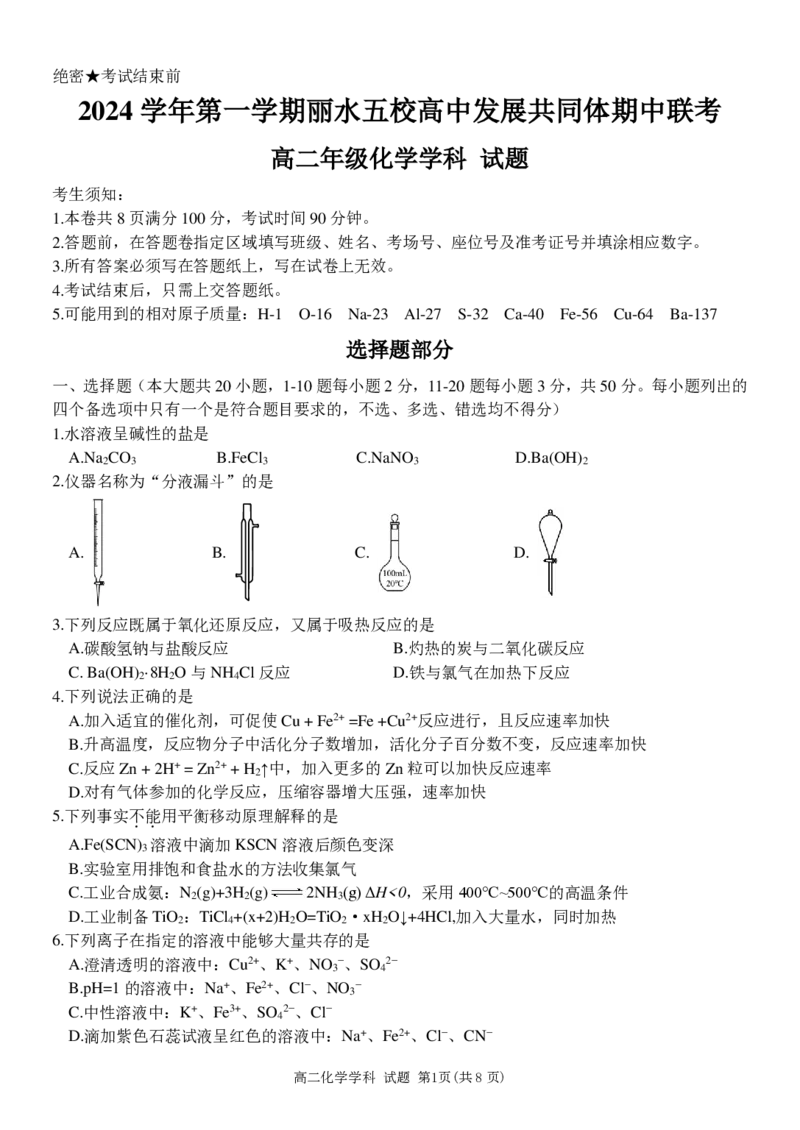
2.仪器名称为“分液漏斗”的是
A. B. C. D.
3.下列反应既属于氧化还原反应,又属于吸热反应的是
A.碳酸氢钠与盐酸反应 B.灼热的炭与二氧化碳反应
C. Ba(OH) ·8H O与NH Cl反应 D.铁与氯气在加热下反应
2 2 4
4.下列说法正确的是
A.加入适宜的催化剂,可促使Cu + Fe2+ =Fe +Cu2+反应进行,且反应速率加快
B.升高温度,反应物分子中活化分子数增加,活化分子百分数不变,反应速率加快
C.反应Zn + 2H+ = Zn2+ + H ↑中,加入更多的Zn粒可以加快反应速率
2
D.对有气体参加的化学反应,压缩容器增大压强,速率加快
5.下列事实不能用平衡移动原理解释的是
..
A.Fe(SCN) 溶液中滴加KSCN溶液后颜色变深
3
B.实验室用排饱和食盐水的方法收集氯气
C.工业合成氨:N (g)+3H (g) 2NH (g) ΔH<0,采用400℃~500℃的高温条件
2 2 3
D.工业制备TiO :TiCl +(x+2)H O=TiO ·xH O↓+4HCl,加入大量水,同时加热
2 4 2 2 2
6.下列离子在指定的溶液中能够大量共存的是
A.澄清透明的溶液中:Cu2+、K+、NO −、SO 2−
3 4
B.pH=1的溶液中:Na+、Fe2+、Cl−、NO −
3
C.中性溶液中:K+、Fe3+、SO 2−、Cl−
4
D.滴加紫色石蕊试液呈红色的溶液中:Na+、Fe2+、Cl−、CN−
高二化学学科 试题 第1页(共8页)7.下列事实对应的离子方程式正确的是
A.用饱和Na CO 溶液处理锅炉水垢中的CaSO :
2 3 4
CaSO (s)+CO 2− (aq) CaCO (s)+SO 2− (aq)
4 3 3 4
B.用醋酸除去水壶中水垢:CaCO +2H+=Ca2++CO ↑+H O
3 2 2
C.用Na CO 溶液清洗油污:CO 2−+2H O H CO +2OH−
2 3 3 2 2 3
D.用石墨电极电解CuCl 溶液:CuCl Cu2++2Cl−
2 2
8.某温度下,密闭恒容绝热的容器中,发生如下反应:3A(g) + B(s) C(g) + 2D(g),不能说明该
...... ..
反应已经达到平衡状态的是
A.容器内混合气体的密度不再发生变化
B.容器内的总压强不随时间变化而变化
C.每消耗n mol B的同时生成2n mol的D
D.混合气体的平均相对分子质量不再变化
9.电化学腐蚀是海水对海上船体外壳腐蚀的主要类型,为了防止造成更大损失,通常船体钢铁外壳
镶嵌锌块来延缓腐蚀。下列不正确的是
...
A.该法称为牺牲阳极法
B.钢铁外壳成为原电池的正极
C.镶嵌的锌块需定期更换
D.原电池的负极发生还原反应,发生反应Zn-2e-=Zn2+
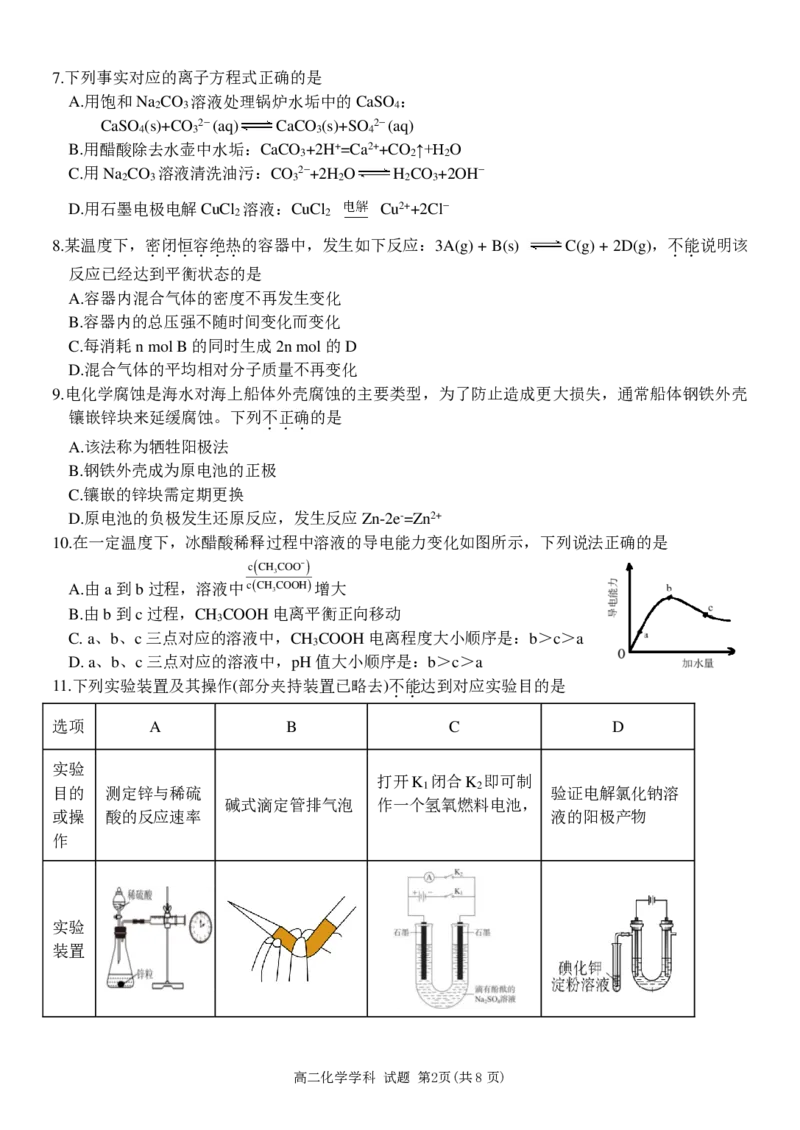
10.在一定温度下,冰醋酸稀释过程中溶液的导电能力变化如图所示,下列说法正确的是
A.由a到b过程,溶液中
高二化学学科 试题 第2页(共8页)
( c C
( c C
H
H
C3
C3
O
O
O
O
−
H
))
增大
B.由b到c过程,CH COOH电离平衡正向移动
3
C. a、b、c三点对应的溶液中,CH COOH电离程度大小顺序是:b>c>a
3
D. a、b、c三点对应的溶液中,pH值大小顺序是:b>c>a
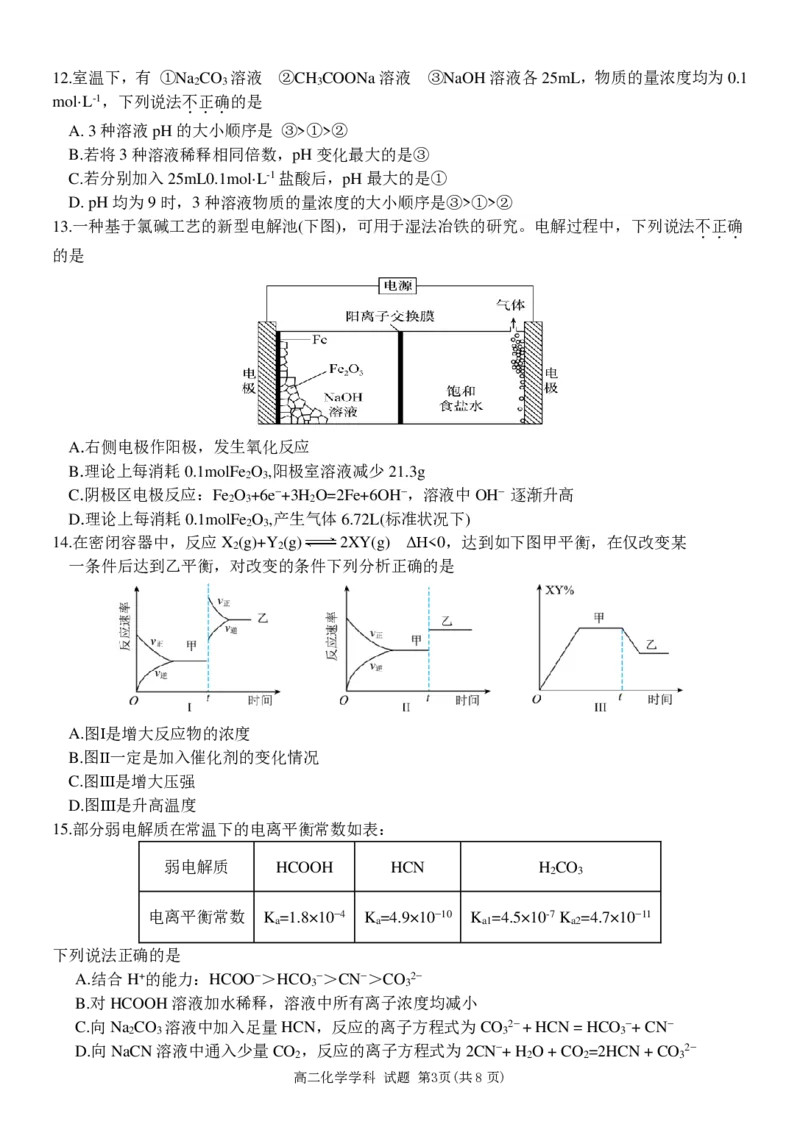
11.下列实验装置及其操作(部分夹持装置已略去)不能达到对应实验目的是
..
选项 A B C D
实验
打开K 闭合K 即可制
1 2
目的 测定锌与稀硫 验证电解氯化钠溶
碱式滴定管排气泡 作一个氢氧燃料电池,
或操 酸的反应速率 液的阳极产物
作
实验
装置12.室温下,有 ①Na CO 溶液 ②CH COONa溶液 ③NaOH溶液各25mL,物质的量浓度均为0.1
2 3 3
mol·L-1,下列说法不正确的是
...
A. 3种溶液pH的大小顺序是 ③>①>②
B.若将3种溶液稀释相同倍数,pH变化最大的是③
C.若分别加入25mL0.1mol·L-1盐酸后,pH最大的是①
D. pH均为9时,3种溶液物质的量浓度的大小顺序是③>①>②
13.一种基于氯碱工艺的新型电解池(下图),可用于湿法冶铁的研究。电解过程中,下列说法不正确
...
的是
A.右侧电极作阳极,发生氧化反应
B.理论上每消耗0.1molFe O ,阳极室溶液减少21.3g
2 3
C.阴极区电极反应:Fe O +6e−+3H O=2Fe+6OH−,溶液中OH− 逐渐升高
2 3 2
D.理论上每消耗0.1molFe O ,产生气体6.72L(标准状况下)
2 3
14.在密闭容器中,反应X (g)+Y (g) 2XY(g) ΔH<0,达到如下图甲平衡,在仅改变某
2 2
一条件后达到乙平衡,对改变的条件下列分析正确的是
A.图Ⅰ是增大反应物的浓度
B.图Ⅱ一定是加入催化剂的变化情况
C.图Ⅲ是增大压强
D.图Ⅲ是升高温度
15.部分弱电解质在常温下的电离平衡常数如表:
弱电解质 HCOOH HCN H CO
2 3
电离平衡常数 K =1.8×10−4 K =4.9×10−10 K =4.5×10-7 K =4.7×10−11
a a a1 a2
下列说法正确的是
A.结合H+的能力:HCOO−>HCO −>CN−>CO 2−
3 3
B.对HCOOH溶液加水稀释,溶液中所有离子浓度均减小
C.向Na CO 溶液中加入足量HCN,反应的离子方程式为CO 2− + HCN = HCO −+ CN−
2 3 3 3
D.向NaCN溶液中通入少量CO ,反应的离子方程式为2CN−+ H O + CO =2HCN + CO 2−
2 2 2 3
高二化学学科 试题 第3页(共8页)16.N 是阿伏加德罗常数的值,下列说法正确的是
A
A.电解精炼铜时阳极减少32g,转移电子的个数为N
A
B.25℃时,1L pH=13的Ba(OH) 溶液中含有的OH−数目为0.1N
2 A
C.氢氧燃料电池工作时,标准状况下正极消耗11.2L气体,电路中转移电子数为N
A
D.0.1 mol·L-1的Na CO 溶液中H CO 、HCO −、CO 2−的粒子总数为0.1N
2 3 2 3 3 3 A
17.在常温下,向10mL浓度均为0.1 mol·L-1的NaOH和Na CO 混合溶液中滴0.1 mol·L-1的盐酸,
2 3
溶液pH随盐酸加入体积的变化如图所示。下列说法正确的是
A.在a点的溶液中,c(Na+)>c(CO 2−)>c(Cl−)>c(OH−)>c(H+)
3
B.若将0.1mol·L-1的盐酸换成同浓度的醋酸,当滴至溶液的pH=7时:c(Na+)=c(CH COO−)
3
C.在c点的溶液pH<7,是因为此时HCO −的电离能力大于其水解能力
3
D.在b点的溶液中,2n(CO 2−)+n(HCO −)<0.001mol
3 3
18.标准状态下,气态反应物和气态生成物的相对能量与反应历程如图所示[已知 O (g)和 Cl (g)的相
2 2
对能量为0],下列说法正确的是
A.Cl (g)=Cl(g)+Cl(g)的 ΔH=+2(E -E )kJ·mol-1
2 2 3
B.ClO 在历程Ⅱ中作催化剂
C.相同条件下,O 的平衡转化率:历程Ⅱ>历程Ⅰ
3
D.历程Ⅱ中速率最慢的一步反应的热化学方程式为 ClO(g)+O(g)=O (g)+Cl(g)
2
ΔH=(E -E )kJ·mol-1
5 4
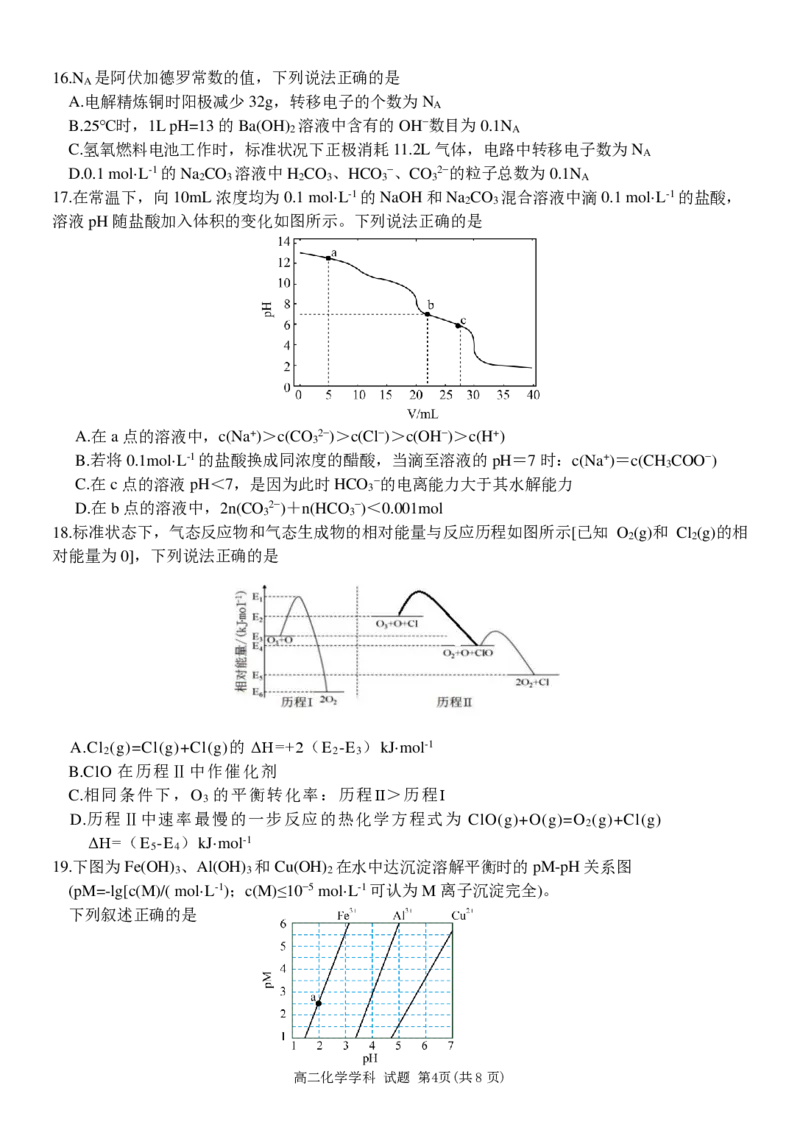
19.下图为Fe(OH) 、Al(OH) 和Cu(OH) 在水中达沉淀溶解平衡时的pM-pH关系图
3 3 2
(pM=-lg[c(M)/( mol·L-1);c(M)≤10−5 mol·L-1可认为M离子沉淀完全)。
下列叙述正确的是
高二化学学科 试题 第4页(共8页)A.由a点可求得Ksp(Fe(OH) )=10−8.5
3
B.pH=4时Al(OH) 的溶解度为 ×10-10 mol·L-1
3
C.浓度均为0.01 mol·L-1的Al3+和Fe3+可通过分步沉淀进行分离
D.Al3+、Cu2+混合溶液中c(Cu2+)=0.2 mol·L-1时二者不会同时沉淀
20.下列实验目的对应的实验方案设计、现象和结论都正确的是
选
实验方案设计 现象和结论
项
用pH计测量CH COONa、NaClO的pH, NaClO的pH比CH COONa大,说明ClO−水解
3 3
A
比较溶液pH大小 程度大于CH COO−
3
溶液由黄绿色变为蓝色,说明降低温度
将2ml0.5 mol·L-1的CuCl 溶液加热后置于
B 2 [Cu(H O) ]2++4Cl− [CuCl ]2−+4H O向逆方
冷水中 2 4 4 2
向移动
将中间裹有锌皮的铁钉放入滴有酚酞溶液 中间锌皮表面无明显变化,铁钉两端溶液变红,
C
和K [Fe(CN) ]溶液的饱和食盐水琼脂液中 说明铁钉发生了吸氧腐蚀
3 6
向2mL0.1 mol·L-1 AgNO 溶液中先滴加4 先产生白色沉淀,再产生黄色沉淀,说明
3
D 滴0.1 mol·L-1KCl溶液,再滴加4滴0.1 Ksp(AgCl)>Ksp(AgI)
mol·L-1 KI溶液
非选择题部分
二、非选择题(本大题共 5 小题,共 50 分)
21.(10分)回答下列问题:
(1)写出CH COOH在水溶液中的电离方程式_________________
3
(2)泡沫灭火器中盛放的灭火剂包括 Al (SO ) 溶液(约1 mol·L-1)、NaHCO 溶液(约1 mol·L-1)及起泡
2 4 3 3
剂。使用时发生反应的离子方程式是__________________
(3) 0.2 mol·L-1与0.1 mol·L-1醋酸中c(H+)之比为______________2:1 (填“>”“<”或“=”)
(4)已知乙醇的燃烧热△H=-1366.8 kJ·mol-1,且H O(g)= H O(l) △H=-44.0 kJ·mol-1,请写出乙醇燃烧生
2 2
成气态水的热化学方程式____________________________________
(5) 联氨(N H )为二元弱碱,在水中的电离方式与氨相似。联氨第一步电离反应的平衡常数值为
2 4
__________________ (已知:N H +H+ N H+的K=8.7×107;K =1.0×10−14)。
2 4 2 5 w
22. (6分)常温下,有关下列四种溶液
编号 ① ② ③ ④
溶液 氨水 氢氧化钠溶液 醋酸 盐酸
pH 11 11 3 3
按要求回答问题:
(1)将溶液①、④等体积混合,所得溶液的各离子浓度由大到小顺序是__________________
高二化学学科 试题 第5页(共8页)(2)分别取1mL稀释至10mL,四种溶液的pH由大到小顺序是__________________(填编号)
(3)将aL溶液④与bL溶液②混合后,若所得溶液的pH=4,则a:b=_________________
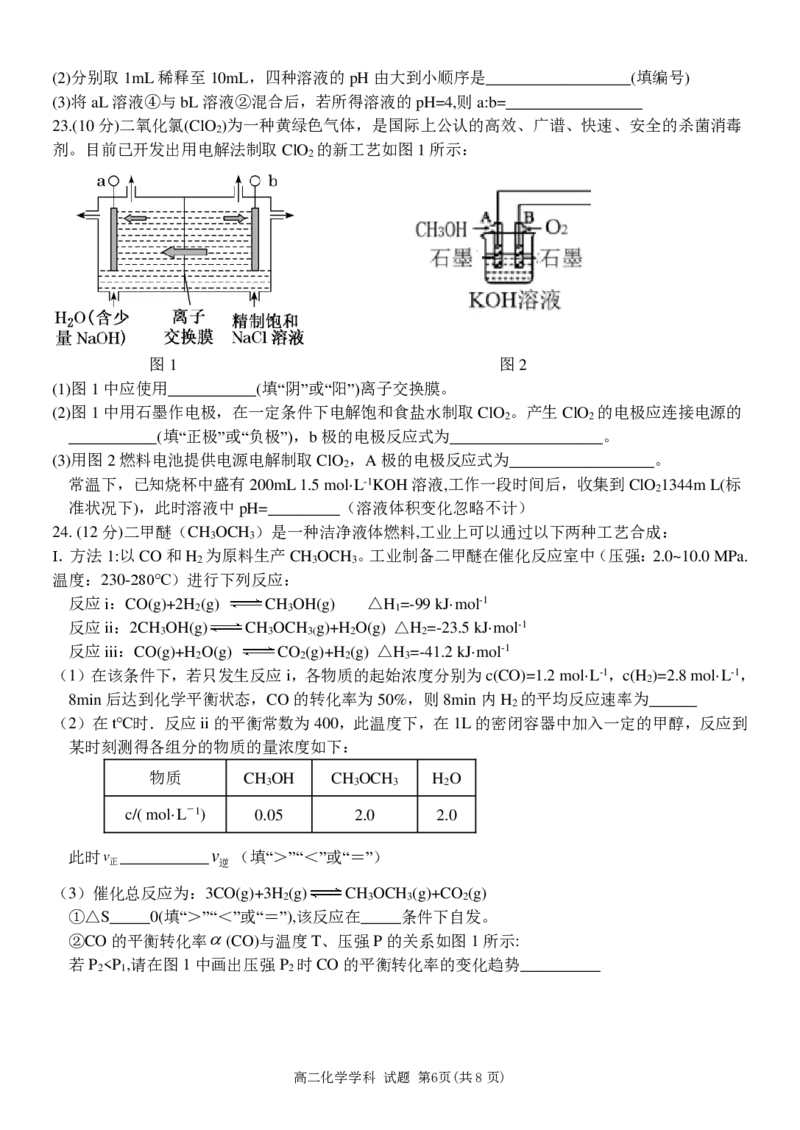
23.(10分)二氧化氯(ClO )为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒
2
剂。目前已开发出用电解法制取ClO 的新工艺如图1所示:
2
图1 图2
(1)图1中应使用___________(填“阴”或“阳”)离子交换膜。
(2)图1中用石墨作电极,在一定条件下电解饱和食盐水制取ClO 。产生ClO 的电极应连接电源的
2 2
___________(填“正极”或“负极”),b极的电极反应式为___________________。
(3)用图2燃料电池提供电源电解制取ClO ,A极的电极反应式为__________________。
2
常温下,已知烧杯中盛有200mL1.5 mol·L-1KOH溶液,工作一段时间后,收集到ClO 1344m L(标
2
准状况下),此时溶液中pH=_________(溶液体积变化忽略不计)
24. (12分)二甲醚(CH OCH )是一种洁净液体燃料,工业上可以通过以下两种工艺合成:
3 3
Ⅰ.方法1:以CO和H 为原料生产CH OCH 。工业制备二甲醚在催化反应室中(压强:2.0~10.0 MPa.
2 3 3
温度:230-280℃)进行下列反应:
反应i:CO(g)+2H (g) CH OH(g) △H =-99 kJ·mol-1
2 3 1
反应ii:2CH OH(g) CH OCH g)+H O(g) △H =-23.5 kJ·mol-1
3 3 3( 2 2
反应iii:CO(g)+H O(g) CO (g)+H (g) △H =-41.2 kJ·mol-1
2 2 2 3
(1)在该条件下,若只发生反应i,各物质的起始浓度分别为c(CO)=1.2 mol·L-1,c(H )=2.8 mol·L-1,
2
8min后达到化学平衡状态,CO的转化率为50%,则8min内H 的平均反应速率为______
2
(2)在t℃时.反应ii的平衡常数为400,此温度下,在1L的密闭容器中加入一定的甲醇,反应到
某时刻测得各组分的物质的量浓度如下:
物质 CH OH CH OCH H O
3 3 3 2
c/( mol·L-1) 0.05 2.0 2.0
此时v ___________v (填“>”“<”或“=”)
正 逆
(3)催化总反应为:3CO(g)+3H (g) CH OCH (g)+CO (g)
2 3 3 2
①△S_____0(填“>”“<”或“=”),该反应在_____条件下自发。
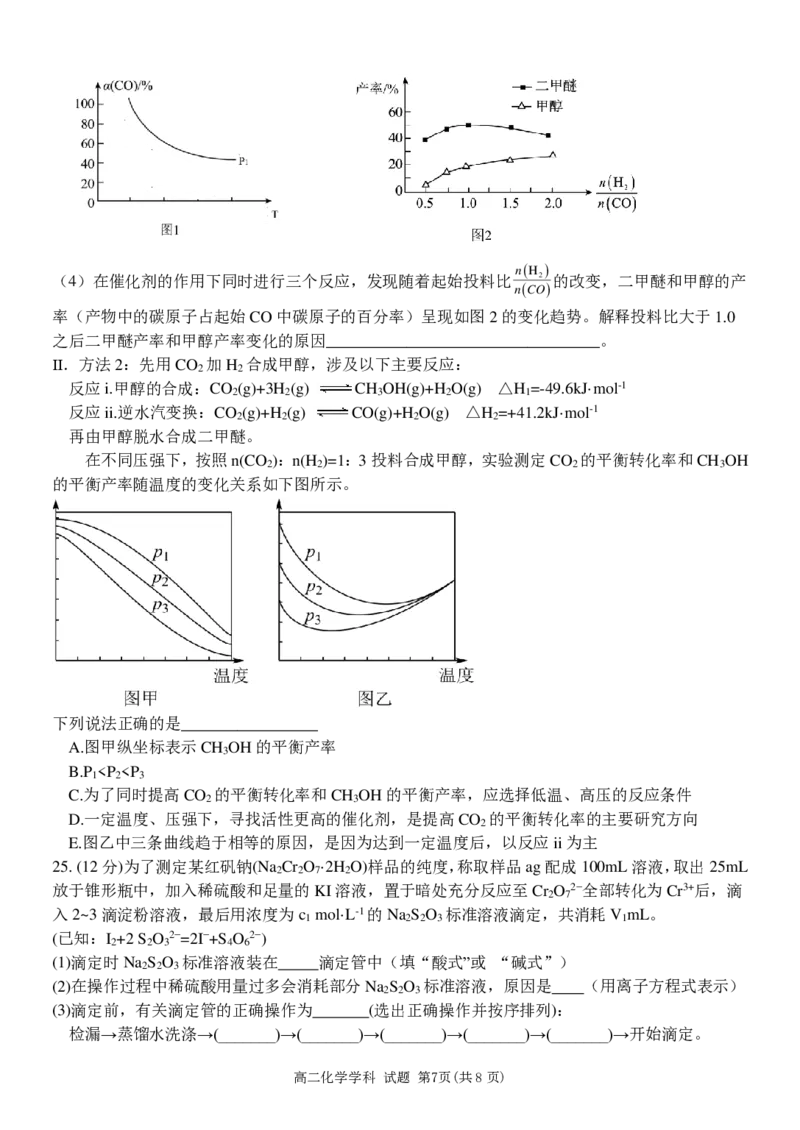
②CO的平衡转化率(CO)与温度T、压强P的关系如图1所示:
若P