文档内容
万州二中高 2023 级高二上期中考试 化学试题
可能用到的相对原子质量:H-1 O-16 S-32 Fe-56
一、选择题(本大题共14小题,每小题3分,共42分,每小题给出的四个选
项中,只有一项是符合题目要求)
1. 下列各组物质中,前者属于强电解质,后者属于弱电解质的一组是( )
A.CHCOONa、葡萄糖 B.CaCO 、HF
3 3
C.NaSO 、NH D.HS、(NH )CO
2 4 3 2 4 2 3
2. 下列物质的用途或事实与盐类的水解无关的是( )
A. 粗盐因含CaCl 在空气中易潮解
2
B. 用明矾净水
C. 配制AgNO 溶液时,将AgNO 溶于较浓的HNO 中,再加水稀释
3 3 3
D. 用MgCl ﹒6HO制取无水MgCl ,需在HCl气流中加热
2 2 2
3. 下列实验现象不能证明醋酸是弱电解质的是( )
A. 醋酸钠溶液的pH大于7
B. 0.1mol/L的醋酸溶液pH=3.3
C. 1mol/L的醋酸电导率弱于1mol/L的盐酸
D. 醋酸溶液能与碳酸钠固体混合产生气泡
4. 下列事实能用勒夏特列原理解释的是( )
A.工业合成氨选择500 ℃
B.SO 氧化成SO ,需要使用催化剂
2 3
C.光照新制氯水时,溶液的颜色逐渐变浅
D.由H(g)、I(g)和HI(g)组成的平衡体系,加压后颜色加深
2 2
5. SO 2 催化氧化反应为:2SO 2 (g) + O 2 (g) ⇌ 2SO 3 (g) △H<0,下列措施既能加快反应速
率又能提高SO 转化率的是( )
2
A.升高温度 B.增大压强 C.分离出SO D.使用催化剂
3
6. 在X(g) + 3Y(g) ⇌ 2Z(g) + R(g)反应中,表示该反应速率最快的是( )
A.v(X)= 0.07 mol·L-1·s-1 B.v(Y)= 0.09 mol·L-1·s-1
C.v(Z)= 0.06 mol·L-1·s-1 D.v(R)= 3.6 mol·L-1·min-1
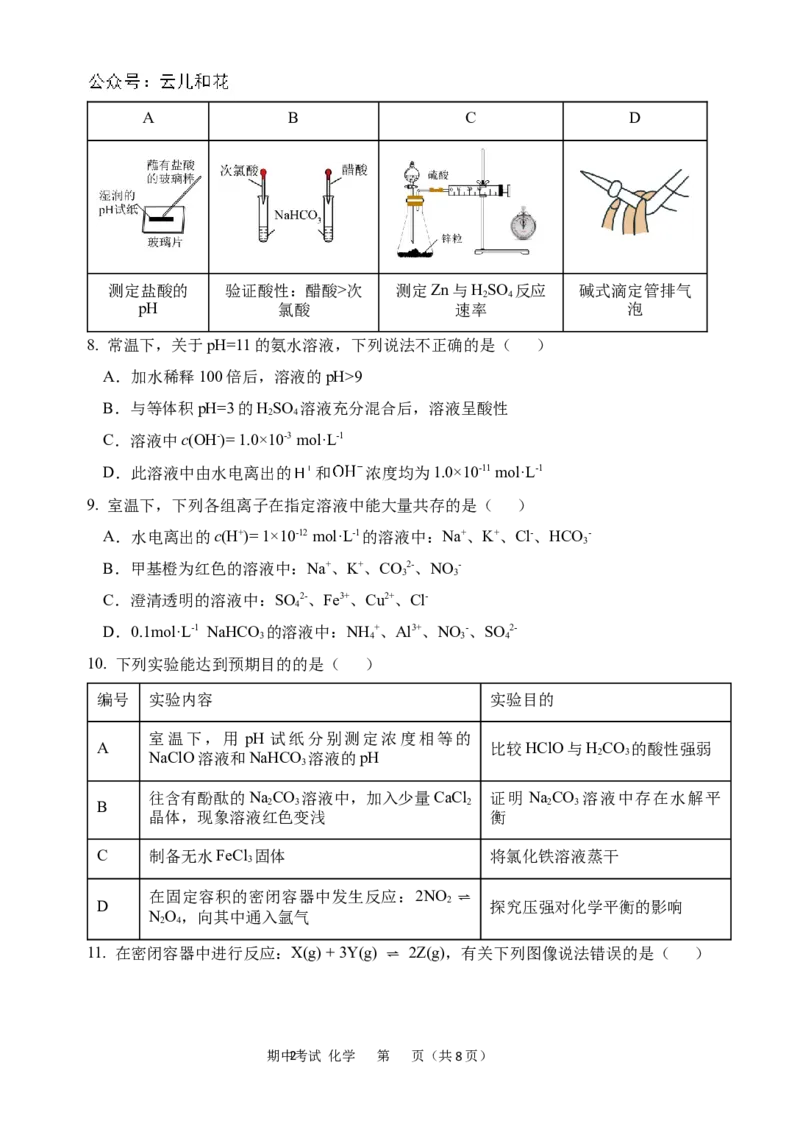
7. 用下列实验装置进行相应实验,操作不正确或不能达到预期目的的是( )
期中1考试 化学 第 页(共8页)A B C D
测定盐酸的 验证酸性:醋酸>次 测定Zn与HSO 反应 碱式滴定管排气
2 4
pH 氯酸 速率 泡
8. 常温下,关于pH=11的氨水溶液,下列说法不正确的是( )
A.加水稀释100倍后,溶液的pH>9
B.与等体积pH=3的HSO 溶液充分混合后,溶液呈酸性
2 4
C.溶液中c(OH-)= 1.0×10-3 mol·L-1
D.此溶液中由水电离出的 和 浓度均为1.0×10-11 mol·L-1
9. 室温下,下列各组离子在指定溶液中能大量共存的是( )
A.水电离出的c(H+)= 1×10-12 mol·L-1的溶液中:Na+、K+、Cl-、HCO -
3
B.甲基橙为红色的溶液中:Na+、K+、CO2-、NO -
3 3
C.澄清透明的溶液中:SO 2-、Fe3+、Cu2+、Cl-
4
D.0.1mol·L-1 NaHCO 的溶液中:NH +、Al3+、NO -、SO 2-
3 4 3 4
10. 下列实验能达到预期目的的是( )
编号 实验内容 实验目的
室温下,用 pH 试纸分别测定浓度相等的
A 比较HClO与HCO 的酸性强弱
NaClO溶液和NaHCO 溶液的pH 2 3
3
往含有酚酞的NaCO 溶液中,加入少量CaCl 证明 NaCO 溶液中存在水解平
B 2 3 2 2 3
晶体,现象溶液红色变浅 衡
C 制备无水FeCl 固体 将氯化铁溶液蒸干
3
D 在固定容积的密闭容器中发生反应:2NO 2 ⇌ 探究压强对化学平衡的影响
NO,向其中通入氩气
2 4
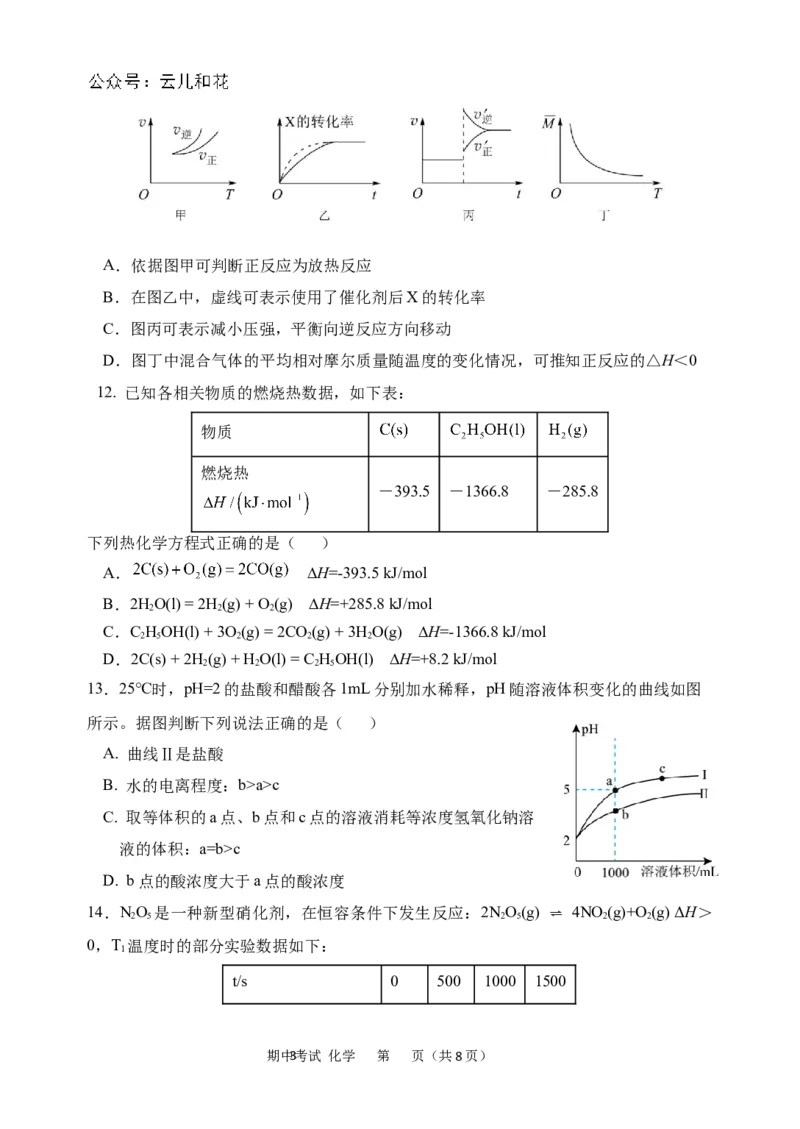
11. 在密闭容器中进行反应:X(g) + 3Y(g) ⇌ 2Z(g),有关下列图像说法错误的是( )
期中2考试 化学 第 页(共8页)A.依据图甲可判断正反应为放热反应
B.在图乙中,虚线可表示使用了催化剂后X的转化率
C.图丙可表示减小压强,平衡向逆反应方向移动
D.图丁中混合气体的平均相对摩尔质量随温度的变化情况,可推知正反应的△H<0
12. 已知各相关物质的燃烧热数据,如下表:
物质
燃烧热
-393.5 -1366.8 -285.8
下列热化学方程式正确的是( )
A. ∆H=-393.5 kJ/mol
B.2HO(l) = 2H (g) + O(g) ∆H=+285.8 kJ/mol
2 2 2
C.C HOH(l) + 3O (g) = 2CO (g) + 3HO(g) ∆H=-1366.8 kJ/mol
2 5 2 2 2
D.2C(s) + 2H (g) + HO(l) = C HOH(l) ∆H=+8.2 kJ/mol
2 2 2 5
13.25℃时,pH=2的盐酸和醋酸各1mL分别加水稀释,pH随溶液体积变化的曲线如图
所示。据图判断下列说法正确的是( )
A. 曲线Ⅱ是盐酸
B. 水的电离程度:b>a>c
C. 取等体积的a点、b点和c点的溶液消耗等浓度氢氧化钠溶
液的体积:a=b>c
D. b点的酸浓度大于a点的酸浓度
14.N 2 O 5 是一种新型硝化剂,在恒容条件下发生反应:2N 2 O 5 (g) ⇌ 4NO 2 (g)+O 2 (g) ΔH>
0,T 温度时的部分实验数据如下:
1
t/s 0 500 1000 1500
期中3考试 化学 第 页(共8页)5.00 3.52 2.50 2.50
下列说法不正确的是( )
A. 内NO 分解速率为
2 5
B.T 温度下的平衡常数为K =125,1000s时NO 的转化率为50%
1 1 2 5
C.其他条件不变,T 温度下反应到1000s时测得NO 的浓度为2.98 mol/L,则T<T
2 2 5 1 2
D.1500s时,再充入3mol/L N O,重新达到平衡后NO 的转化率减小
2 5 2 5
二、填空题(本大题共4小题,共58分)
15.(16分)溶液中的反应以及平衡与日常生活、工农业生产和环境保护等息息相关,
请根据所学知识回答下列问题。
(1)泡沫灭火器中的主要成分是Al (SO ) 和NaHCO 溶液,灭火的原理是 (用离
2 4 3 3
子方程式表示)。
(2)CuSO₄的水溶液呈 (填“酸”、“中”、“碱”)性,实验室在配制CuSO₄溶
液时,常将CuSO₄固体先溶于硫酸中,然后再用蒸馏水稀释到所需的浓度,目的是
。
(3)向氨水中滴加稀硫酸,使其恰好完全中和,则所得溶液中离子浓度由大到小的关系
是: 。
(4)某温度下,纯水中的c(H+)=2.0×10-7 mol/L,则该温度时的水的离子积K = 。
w
(5)25℃时,将pH=2的盐酸溶液与pH=13的NaOH溶液以一定体积比混合后,溶液
pH=11,则盐酸溶液与NaOH溶液的体积比为 。(近似认为酸碱总体积就是混合液体
积)
(6)已知25℃时,HCO 的电离平衡常数K = 4.3×10-7,K = 5.6×10-11,HCN的电离平衡
2 3 a1 a2
常数K= 6.2×10-10,则向NaCN溶液中通入少量CO ,反应的离子方程式为 。下列
a 2
措施能使HCN溶液中c(CN-)增大的同时c(H+)减小的是 (填字母)。
A.NaCN B.加入固体KHSO C.加入NaCO 固体 D.升高温度
4 2 3
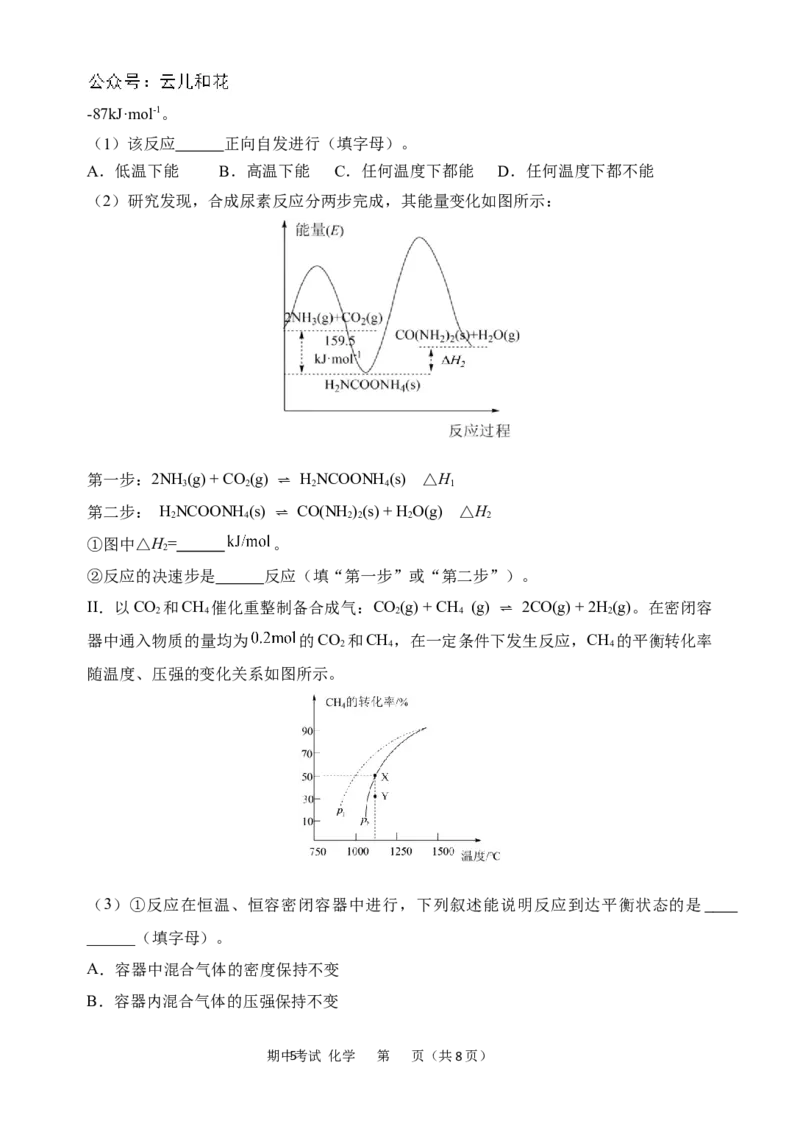
16.(14分)中国政府承诺:到2030年,二氧化碳排放比2005年下降65%以上。因而
研究CO 可转化成有机物实现碳循环很重要。
2
I. 以 CO
2
和 NH
3
为 原 料 合 成 尿 素 : 2NH
3
(g)+CO
2
(g)⇌ CO(NH
2
)
2
(s)+H
2
O(g) ΔH=
期中4考试 化学 第 页(共8页)-87kJ·mol-1。
(1)该反应 正向自发进行(填字母)。
A.低温下能 B.高温下能 C.任何温度下都能 D.任何温度下都不能
(2)研究发现,合成尿素反应分两步完成,其能量变化如图所示:
第一步:2NH 3 (g) + CO 2 (g) ⇌ H 2 NCOONH 4 (s) △H 1
第二步: H 2 NCOONH 4 (s) ⇌ CO(NH 2 ) 2 (s) + H 2 O(g) △H 2
①图中△H= 。
2
②反应的决速步是 反应(填“第一步”或“第二步”)。
II.以CO 2 和CH 4 催化重整制备合成气:CO 2 (g) + CH 4 (g) ⇌ 2CO(g) + 2H 2 (g)。在密闭容
器中通入物质的量均为 的CO 和CH ,在一定条件下发生反应,CH 的平衡转化率
2 4 4
随温度、压强的变化关系如图所示。
(3)①反应在恒温、恒容密闭容器中进行,下列叙述能说明反应到达平衡状态的是
______(填字母)。
A.容器中混合气体的密度保持不变
B.容器内混合气体的压强保持不变
期中5考试 化学 第 页(共8页)C.容器中气体的平均相对分子质量不变
D.同时断裂1mol C-H键和2mol H-H键
E.CO和H 的浓度相等时
2
②由图可知,压强p p(填“>”、“<”或“=”,下同);Y点速率v v 。
1 2 逆 正
③已知气体分压=气体总压×气体的物质的量分数,用平衡分压代替平衡浓度可以得到平
衡常数K ,则X点对应温度下的K = (用含p 的代数式表示)。
p p 2
17.(14分)滴定是一种常见的化学定量分析方法,根据已有知识,回答下列问题:
(1)用NaOH溶液测定某食用白醋中醋酸的物质的量浓度,某同学列出的实验步骤如下:
A.分别向碱式滴定管、酸式滴定管注入NaOH标准溶液和待测醋酸至0刻度以上2~3cm
B.调节滴定管液面至0或0刻度以下,记下读数
C.用NaOH标准溶液滴定至终点,记下滴定管液面的刻度
D.用标准溶液清洗碱式滴定管2~3次;待测醋酸清洗酸式滴定管2~3次
E.排气泡使滴定管尖嘴充满溶液,把滴定管固定好
F.滴定管检漏,用水清洗所有仪器,备用
G.通过酸式滴定管向锥形瓶注入20.00mL待测醋酸,并加入2滴指示剂
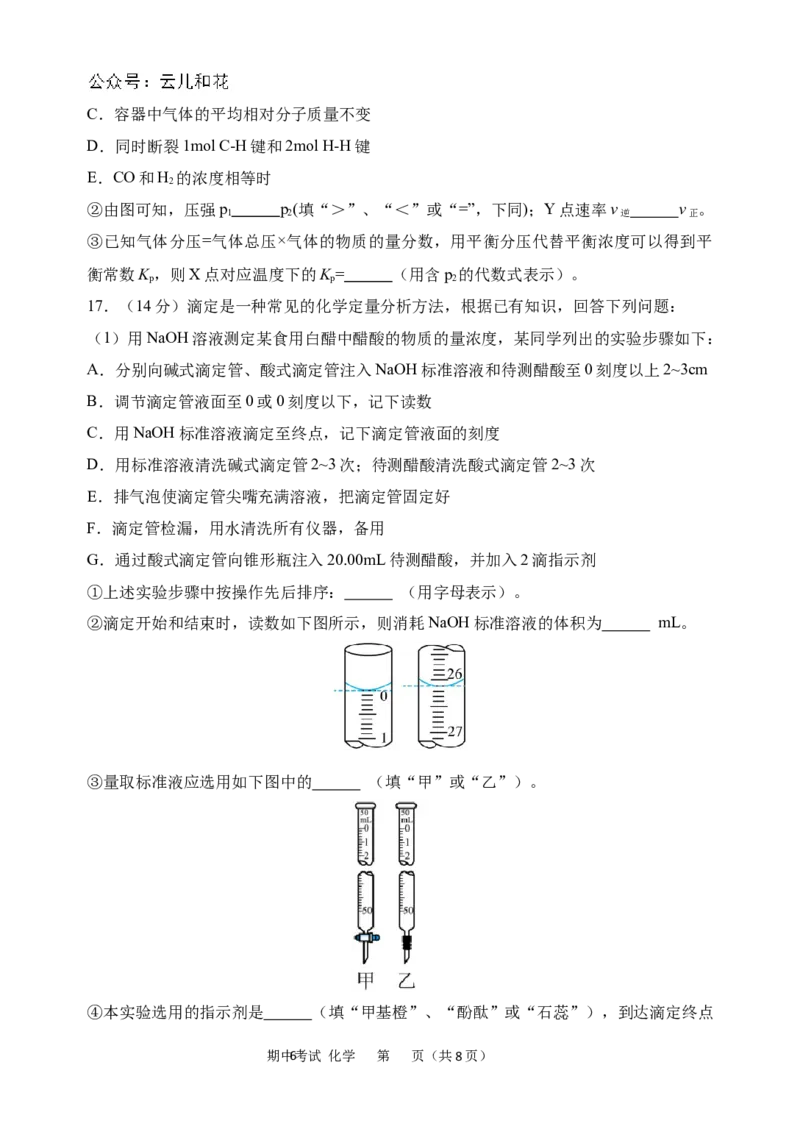
①上述实验步骤中按操作先后排序: (用字母表示)。
②滴定开始和结束时,读数如下图所示,则消耗NaOH标准溶液的体积为 mL。
③量取标准液应选用如下图中的 (填“甲”或“乙”)。
④本实验选用的指示剂是 (填“甲基橙”、“酚酞”或“石蕊”),到达滴定终点
期中6考试 化学 第 页(共8页)时的标志为 。
(2)绿矾晶体(FeSO ·7H O)在空气中易被氧化,利用滴定法可以测定其纯度。取2.950g
4 2
样品,加水完全溶解,用酸化的0.1000 mol·L-1 KMnO 溶液滴定(滴定时发生反应的离子
4
方程式为:5Fe2+ + MnO - + 8H+ ═ 5Fe3+ + Mn2+ + 4H O),平均消耗KMnO 溶液20.00 mL。
4 2 4
则样品中绿矾晶体的质量分数为 (保留4位有效数字),下列情况会导致产品纯度
偏大的是 (填字母)。
A.滴定达终点时,仰视刻度线读数
B.滴定终点时,滴定管尖嘴内有气泡生成
C.酸式滴定管未用KMnO 溶液润洗
4
D.滴定前,在锥形瓶中加水稀释待测液
18.(14分)醋酸钠(CHCOONa)是一种常用的防腐剂和缓冲剂。
3
(1)为探究外界因素对CHCOONa水解程度的影响,甲同学设计实验方案如下(表中溶
3
液浓度均为0.10 mol·L-1):
序
温度 V(CHCOONa)/mL V(CHCOONH)/mL V(HO)/mL pH
号 3 3 4 2
1 25℃ 40.0 0 0 A
1
2 25℃ 4.0 0 36.0 A
2
3 25℃ 20.0 20.0 0 A
3
4 40℃ 40.0 0 0 A
4
①i.实验 (填序号),探究加水稀释对CHCOONa水解程度的影响。
3
ii.实验1和3,探究加入NH +对CHCOONa水解程度的影响。
4 3
②iii.实验1和4,探究 对CHCOONa水解程度的影响。
3
③写出CHCOONa水解的离子方程式 。
3
④加水稀释CHCOONa溶液的过程中,下列表达式的数值变小的是 。
3
A.c(OH-) B.c(H+)·c(OH-) C.c(H+) D.
⑤实验测得 A>A ,该结果 (填“能”或“不能”)证明加入 NH +促进了
1 3 4
CHCOONa的水解,原因是 。
3
期中7考试 化学 第 页(共8页)(2)乙同学通过测定不同温度下CHCOONa的水解常数K 确定温度对CHCOONa水解
3 h 3
程度的影响。
试剂:CHCOONa溶液、0.1000mol/L盐酸、 计。
3
实验:测定40℃下CHCOONa水解常数K ,完成下表中序号7的实验。
3 h
序号 实验 记录的数据
取 溶液,用 盐
5 消耗盐酸体积为
酸滴定至终点
6 测40℃纯水的
7
在50℃和60℃下重复上述实验。
实验结论:K (60℃)>K (50℃)>K (40℃),温度升高,促进CHCOONa水解。
h h h 3
期中8考试 化学 第 页(共8页)