文档内容
秘密★启用前
嘉陵一中高 2023 级高二下期第一次月考
化学试卷
注意事项:
1. 答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2. 回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,
用橡皮擦干净后,再选涂其它答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
3. 考试结束后,将答题卡交回。
考试时间:75分钟 满分:100分
可能用到的相对原子质量:C-12 O-16 Co-59
一、选择题:(本题共 14 小题,每小题 3 分,共 42分。每小题给出的四个选项中,只有一
项是符合题目要求的。)
1.科技创新是引领发展的第一动力。下列说法错误的是
A.“问天”实验舱采用了砷化镓太阳能电池,砷化镓具有高熔点、高硬度的特点,属于
共价晶体
B.绚烂焰火的产生是电子由基态跃迁到激发态时,能量以光的形式释放引起的
C.我国发现了月球新矿物——“嫦娥石”,可以采用 X射线衍射法分析其晶体结构
D.C919 飞机采用了碳纤维和玻璃纤维,二者均属于无机非金属材料
2.“类推”是一种重要的学习方法,但有时会产生错误,下列类推得到的结论正确的是
A.第二周期元素简单氢化物的稳定性顺序是 HF>H O>NH ;
2 3
则第三周期元素简单氢化物的稳定性顺序也是 HCl>H S>PH
2 3
B.CO 是分子晶体;则 SiO 也是分子晶体
2 2
C.IVA 族元素氢化物沸点顺序:GeH >SiH >CH ;
4 4 4
则VA族元素氢化物沸点顺序:AsH >PH >NH
3 3 3
D.SO2−和P 都为正四面体形结构,SO2−中键角为 109°28′,P 中键角也为 109°28′
4 4 4 4
3.下列说法正确的是
A.邻羟基苯甲醛的分子内氢键:
第 1 页 共 8 页B.SO 的价层电子对互斥模型:
2
C.KI的电子式:
D.碳的基态原子轨道表示式:
4.设N 为阿伏加德罗常数的值。下列说法正确的是
A
A.0.1molCo(NH ) ClCl 与足量硝酸银溶液反应,生成AgCl的数目为0.3N
3 5 2 A
B.标准状况下,22.4 L SO 含质子数为40N
3 A
C.0.1mol·L−1的H S溶液中H S、HS−和S2−的总数为 0.1N
2 2 A
D. 12g金刚石中,碳碳共价键数为 2N
A
5.下列有关晶体的说法不正确的是
...
A.干冰晶体中,每个CO 周围紧邻12个CO
2 2
B.氯化钠晶体中,每个Na+周围紧邻且距离相等的Na+共有6个
C.金刚石为三维骨架结构,由共价键形成的碳原子环中,最小的环上有 6个碳原子
D.金属晶体的电导率随温度升高而降低与自由电子在热的作用下与金属原子频繁碰撞
有关
6.下列各组物质发生变化时,克服的粒子间作用力种类相同的是
A.水和乙醇沸腾 B.味精(谷氨酸钠)和蔗糖溶解在水中
C.石英和岩盐(NaCl)熔化下 D.碘和钨升华
7.当某实验小组设计的Cu(NH ) SO H O晶体制备实验方案如下:
3 4 4 2
胆矾晶体⎯H⎯2O⎯→蓝色溶液⎯足⎯量1⎯mol⎯/L氨⎯水→深蓝色溶液⎯乙⎯醇⎯→ ⎯过⎯滤⎯、洗⎯涤、⎯干燥⎯→
Cu(NH
3
)
4
SO
4
H
2
O
下列说法不正确的是
...
A.形成深蓝色溶液说明与Cu2+的配位能力:NH H O
3 2
B.加入乙醇的目的是减小Cu(NH ) SO H O的溶解度
3 4 4 2
C.为促进晶体析出可以用玻璃棒摩擦试管内壁
D.1molCu(NH ) 2+含有σ键的数量为12N
3 4 A
8.BF 与一定量的水形成(H O) •BF ,一定条件下(H O) •BF 可发生如图转化,下列说法
3 2 2 3 2 2 3
正确的是
第 2 页 共 8 页A.BF 和 中B 原子均采用sp2杂化轨道成键
3
B. (H O) •BF 中的所有元素都位于元素周期表中的 p区
2 2 3
C. (H O) •BF 分子中存在氢键和配位键
2 2 3
D.BF 、NF 分子中的原子个数比相同,两者都是极性分子
3 3
9.储氢材料MgH 的晶胞结构如图所示,MgH 的摩尔质量为M g/mol,阿伏加德罗常数的
2 2
值为N 。下列说法正确的是
A
A.H-的配位数为2 B.晶胞中含有 2个Mg2+
C.晶体密度的计算式为
2M
g/cm3 D.Mg2+(i)和Mg2+(ii)之间的距离为
a2+2c2
nm
N a2c
2
A
10.“宏观辨识与微观探析”是化学学科核心素养之一。下列有关宏观辨识与微观探析说法
错误的是
宏观辨识 微观探析
A O 在水中的溶解度大于O O 是极性分子,O 是非极性分子
3 2 3 2
石墨晶体中相邻碳原子平面之间相隔较
B 石墨的导电性只能沿石墨平面的方向
远
C 椅式环己烷(C H )比船式环己烷稳定 分子空间结构不同,椅式的空间位阻小
6 12
冠醚是一类皇冠状分子,18-冠-6(空穴适配
D 18-冠-6可通过离子键与K+形成超分子
K+)可增加KI在苯中的溶解度
第 3 页 共 8 页11.前四周期元素X、Y、Z、W的原子数依次增大,X原子中有6个运动状态不同的电
子,Y是地壳中含量最多的元素,基态 Z原子K,L层上的电子总数是3p 原子轨道上电子
数的两倍,基态W原子中有 6个未成对电子。下列说法错误的是
A.键角:ZO− ZO− ZO−
2 3 4
B.电负性:YZ;原子半径:XY
C.在一定条件下,WO2−和WO2−可以相互转化
2 7 4
D.Y与Z形成的一种化合物可用于自来水消毒
12.能正确表示下列变化的方程式的是
A.向银氨溶液中加入足量盐酸:2H+ +Ag(NH ) + =Ag++2NH+
3 2 4
B.废水中的Pb2+用FeS 除去:S2- + Pb2+ = PbS↓
C.将铁氰化钾溶液滴到氯化亚铁溶液中:K+ +Fe2+ +Fe(CN)3− =KFeFe(CN)
6 6
D.FeI 溶液中通入过量Cl :2Fe2+ + 2I- +2Cl = 2Fe3+ + I + 4Cl-
2 2 2 2
13.某离子液体的阴离子结构如图。短周期主族元素 V、W、X、Y、Z的原子序数依次增大,
但V、W、X、Y的原子半径依次减小,X、Z同主族。下列说法错误的是( )。
..
A.该离子液体中V、W、X、Y、Z均达到8 电子稳定结构
B.V分别与X、Z组成的三原子分子,空间结构均为直线形
C.W、Z的最高价氧化物对应水化物的酸性均比 V的最高价氧化物对应水化物的酸性强
D.简单气态氢化物的熔、沸点大小顺序一定为 V”或“<”)。
(5)与Si 同周期的部分元素的电离能如图所示,其中 a、b和c分别代表_________(填字
母)。
第 5 页 共 8 页A.a为I ,b为I ,c为I B.a为 I ,b为I ,c为I
1 3 2 2 3 1
C.a为I ,b为I ,c为I D.a为 I ,b为I ,c为I
3 2 1 2 1 3
16.(15分)铜元素在生命体系和超导领域研究中发挥着至关重要的作用。回答下列问
题。
(1)基态Cu原子电子排布式为 。在结构化学中,每个轨道填充两个电子,顺时针
1 1
旋转的电子,其自旋量子数m = + ,逆时针旋转的电子自旋量子数m = − ,则基态铜
s 2 s 2
原子核外电子的m 总和等于 。
s
(2)Cu(H O) 2+为平面正方形结构,其中的两个H O被Cl−取代后有两种不同的结构,画
2 4 2
出Cu(H O) (Cl) 是非极性分子的结构为 。NH 也能与Cu2+形成配合物,
2 2 2 3
[Cu(NH ) ]SO 溶液中存在的化学键有 (填字母)。
3 4 4
A.离子键 B.极性键 C.非极性键 D.金属键 E.配位键 F.氢键
(3)双核铜物种存在于色素细胞中,某大环双核铜配合物的配离子结构如图。
①该配离子中涉及元素电负性由大到小的顺序为 。
②该配合物中Cu的配位数为 ,铜元素的价态为_________________。
③键角α β(填“>”“<”或“=”),解释原因 。
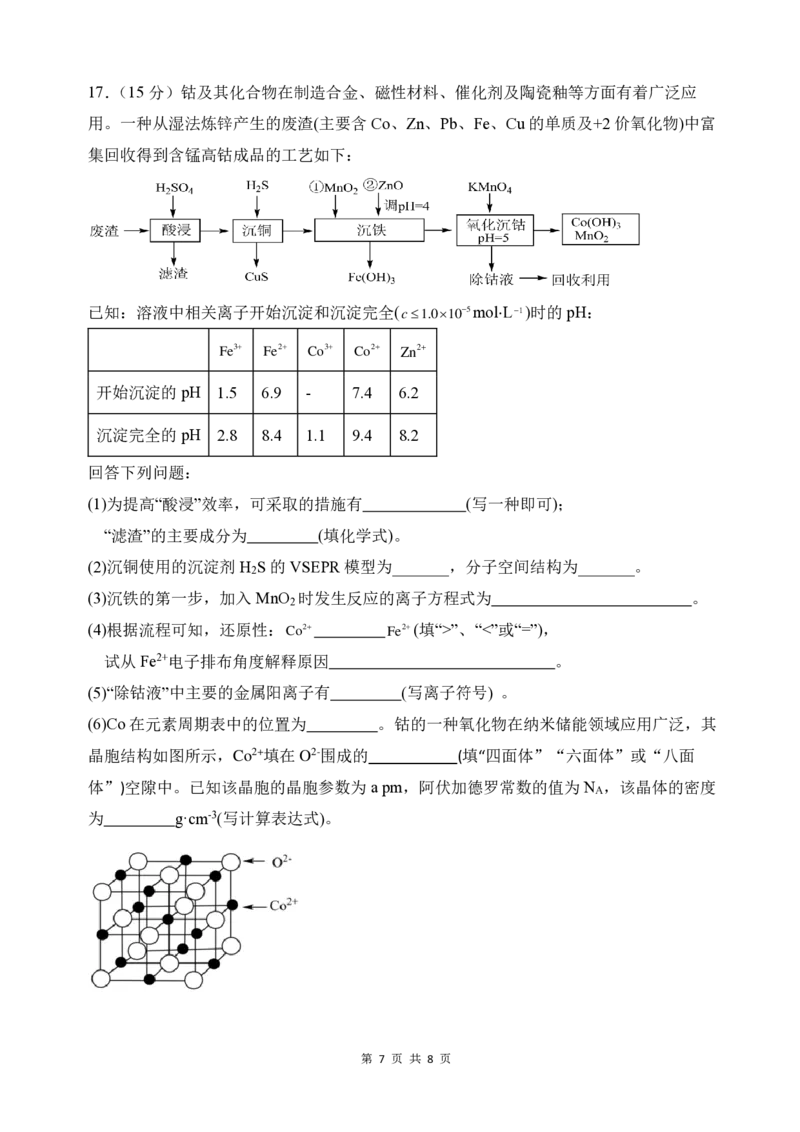
第 6 页 共 8 页17.(15分)钴及其化合物在制造合金、磁性材料、催化剂及陶瓷釉等方面有着广泛应
用。一种从湿法炼锌产生的废渣(主要含 Co、Zn、Pb、Fe、Cu的单质及+2价氧化物)中富
集回收得到含锰高钴成品的工艺如下:
已知:溶液中相关离子开始沉淀和沉淀完全(c1.010−5mol⋅L−1)时的pH:
Fe3+ Fe2+ Co3+ Co2+ Zn2+
开始沉淀的pH 1.5 6.9 - 7.4 6.2
沉淀完全的pH 2.8 8.4 1.1 9.4 8.2
回答下列问题:
(1)为提高“酸浸”效率,可采取的措施有 (写一种即可);
“滤渣”的主要成分为 (填化学式)。
(2)沉铜使用的沉淀剂H S 的VSEPR 模型为_______,分子空间结构为_______。
2
(3)沉铁的第一步,加入 MnO 时发生反应的离子方程式为 。
2
(4)根据流程可知,还原性:Co2+ Fe2+(填“>”、“<”或“=”),
试从Fe2+电子排布角度解释原因 。
(5)“除钴液”中主要的金属阳离子有 (写离子符号) 。
(6)Co在元素周期表中的位置为 。钴的一种氧化物在纳米储能领域应用广泛,其
晶胞结构如图所示,Co2+填在O2-围成的 (填“四面体”“六面体”或“八面
体”)空隙中。已知该晶胞的晶胞参数为 a pm,阿伏加德罗常数的值为 N ,该晶体的密度
A
为 g·cm-3(写计算表达式)。
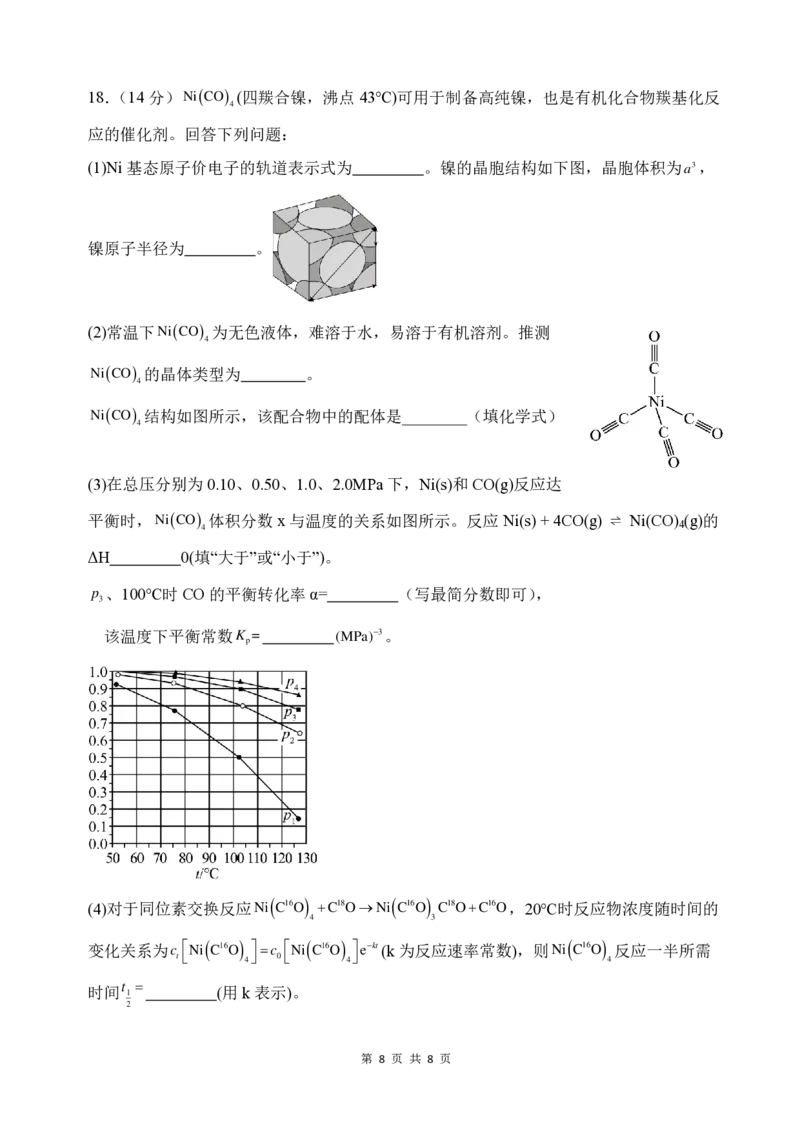
第 7 页 共 8 页18.(14分)Ni(CO) (四羰合镍,沸点 43℃)可用于制备高纯镍,也是有机化合物羰基化反
4
应的催化剂。回答下列问题:
(1)Ni基态原子价电子的轨道表示式为 。镍的晶胞结构如下图,晶胞体积为a3,
镍原子半径为 。
(2)常温下Ni(CO) 为无色液体,难溶于水,易溶于有机溶剂。推测
4
Ni(CO) 的晶体类型为 。
4
Ni(CO) 结构如图所示,该配合物中的配体是________(填化学式)
4
(3)在总压分别为0.10、0.50、1.0、2.0MPa下,Ni(s)和CO(g)反应达
平衡时,Ni(CO) 体积分数 x与温度的关系如图所示。反应 Ni(s) + 4CO(g) ⇌ Ni(CO) (g)的
4
4
ΔH 0(填“大于”或“小于”)。
p 、100℃时CO的平衡转化率 α= (写最简分数即可),
3
该温度下平衡常数K = (MPa)−3。
p
(4)对于同位素交换反应Ni ( C16O ) +C18O→Ni ( C16O ) C18O+C16O,20℃时反应物浓度随时间的
4 3
变化关系为c Ni ( C16O ) =c Ni ( C16O ) e−kt(k为反应速率常数),则Ni ( C16O ) 反应一半所需
t 4 0 4 4
t =
时间 1 (用k 表示)。
2
第 8 页 共 8 页