文档内容
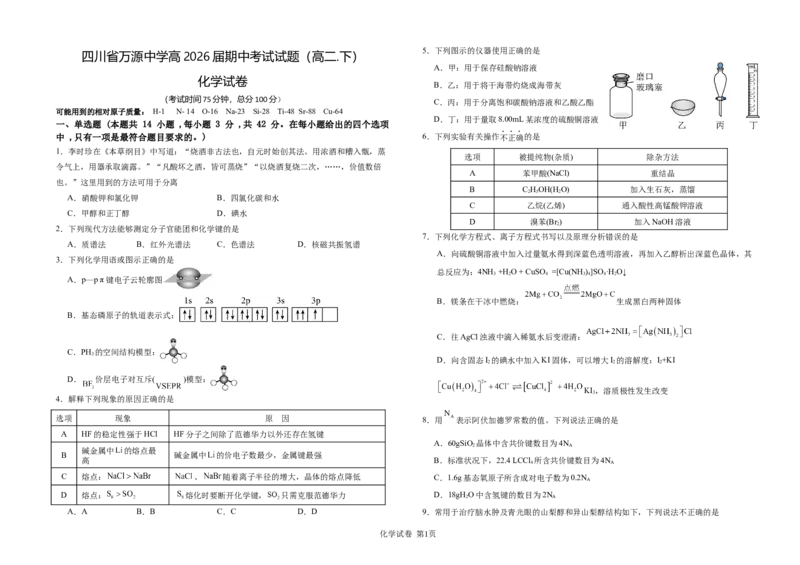
5.下列图示的仪器使用正确的是
四川省万源中学高 2026 届期中考试试题(高二.下)
A.甲:用于保存硅酸钠溶液
化学试卷
B.乙:用于将干海带灼烧成海带灰
(考试时间75分钟,总分100分)
C.丙:用于分离饱和碳酸钠溶液和乙酸乙酯
可能用到的相对原子质量: H-1 N- 14 O-16 Na-23 Si-28 Ti-48 Sr-88 Cu-64
D.丁:用于量取8.00mL某浓度的硫酸铜溶液
一、单选题 (本题共 14 小题 ,每小题 3 分 ,共 42 分。在每小题给出的四个选项
中 ,只有一项是最符合题目要求的。) 6.下列实验有关操作不正确的是
1.李时珍在《本草纲目》中写道:“烧酒非古法也,自元时始创其法。用浓酒和糟入甑,蒸
选项 被提纯物(杂质) 除杂方法
令气上,用器承取滴露。”“凡酸坏之酒,皆可蒸烧”“以烧酒复烧二次,……,价值数倍
A 苯甲酸(NaCl) 重结晶
也。”这里用到的方法可用于分离
B C HOH(HO) 加入生石灰,蒸馏
2 5 2
A.硝酸钾和氯化钾 B.四氯化碳和水
C 乙烷(乙烯) 通入酸性高锰酸钾溶液
C.甲醇和正丁醇 D.碘水
D 溴苯(Br) 加入NaOH溶液
2
2.下列现代方法能够测定分子官能团和化学键的是
7.下列化学方程式、离子方程式书写以及原理分析错误的是
A.质谱法 B.红外光谱法 C.色谱法 D.核磁共振氢谱
A.向硫酸铜溶液中加入过量氨水得到深蓝色透明溶液,再加入乙醇析出深蓝色晶体,其
3.下列化学用语或图示正确的是
总反应为:4NH +H O + CuSO =[Cu(NH )]SO ·H O↓
3 2 4 3 4 4 2
A.p—p π键电子云轮廓图
B.镁条在干冰中燃烧: 生成黑白两种固体
B.基态磷原子的轨道表示式:
C.往AgCl浊液中滴入稀氨水后变澄清:
C.PH 的空间结构模型:
3
D.向含固态I 的碘水中加入KI固体,可以增大I 的溶解度:I+KI
2 2 2
D. 价层电子对互斥( )模型:
KI ,溶质极性发生改变
3
4.解释下列现象的原因正确的是
选项 现象 原 因 8.用 表示阿伏加德罗常数的值。下列说法正确的是
A HF的稳定性强于HCl HF分子之间除了范德华力以外还存在氢键
A.60gSiO 晶体中含共价键数目为4N
2 A
碱金属中 的熔点最
B 碱金属中 的价电子数最少,金属键最强
高 B.标准状况下,22.4 LCCl 所含共价键数目为4N
4 A
C 熔点: 、 随着离子半径的增大,晶体的熔点降低 C.1.6g基态氧原子所含成对电子数为0.2N
A
D 熔点: 熔化时要断开化学键, 只需克服范德华力 D.18gHO中含氢键的数目为2N
2 A
A.A B.B C.C D.D 9.常用于治疗脑水肿及青光眼的山梨醇和异山梨醇结构如下,下列说法不正确的是
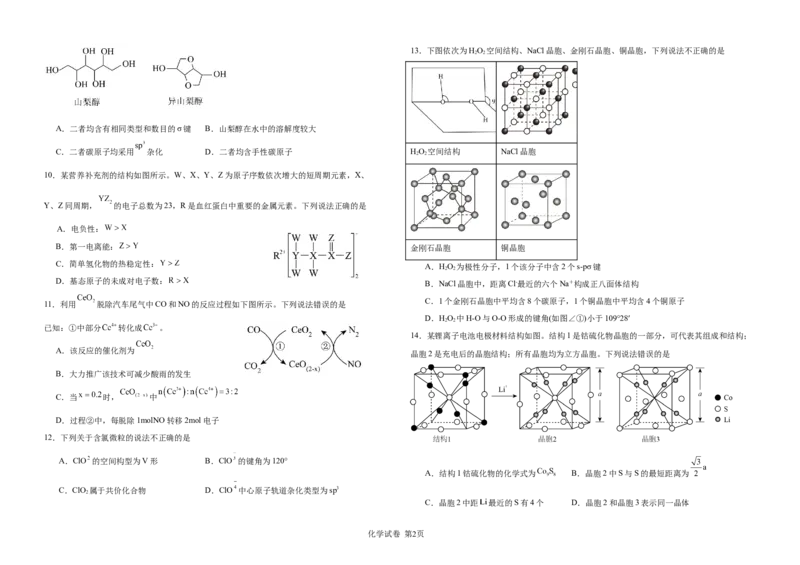
化学试卷 第1页13.下图依次为HO 空间结构、NaCl晶胞、金刚石晶胞、铜晶胞,下列说法不正确的是
2 2
A.二者均含有相同类型和数目的σ键 B.山梨醇在水中的溶解度较大
C.二者碳原子均采用 杂化 D.二者均含手性碳原子 HO 空间结构 NaCl晶胞
2 2
10.某营养补充剂的结构如图所示。W、X、Y、Z为原子序数依次增大的短周期元素,X、
Y、Z同周期, 的电子总数为23,R是血红蛋白中重要的金属元素。下列说法正确的是
A.电负性:
B.第一电离能: 金刚石晶胞 铜晶胞
C.简单氢化物的热稳定性:
A.HO 为极性分子,1个该分子中含2个s-pσ键
2 2
D.基态原子的未成对电子数: B.NaCl晶胞中,距离Cl-最近的六个Na+构成正八面体结构
C.1个金刚石晶胞中平均含8个碳原子,1个铜晶胞中平均含4个铜原子
11.利用 脱除汽车尾气中CO和NO的反应过程如下图所示。下列说法错误的是
D.HO 中H-O与O-O形成的键角(如图∠①)小于109°28′
2 2
已知:①中部分 转化成 。
14.某锂离子电池电极材料结构如图。结构1是钴硫化物晶胞的一部分,可代表其组成和结构;
A.该反应的催化剂为
晶胞2是充电后的晶胞结构;所有晶胞均为立方晶胞。下列说法错误的是
B.大力推广该技术可减少酸雨的发生
C.当 时, 中
D.过程②中,每脱除1molNO转移2mol电子
12.下列关于含氯微粒的说法不正确的是
A.ClO 的空间构型为V形 B.ClO 的键角为120°
A.结构1钴硫化物的化学式为 B.晶胞2中S与S的最短距离为
C.ClO 属于共价化合物 D.ClO 中心原子轨道杂化类型为sp3
2
C.晶胞2中距 最近的S有4个 D.晶胞2和晶胞3表示同一晶体
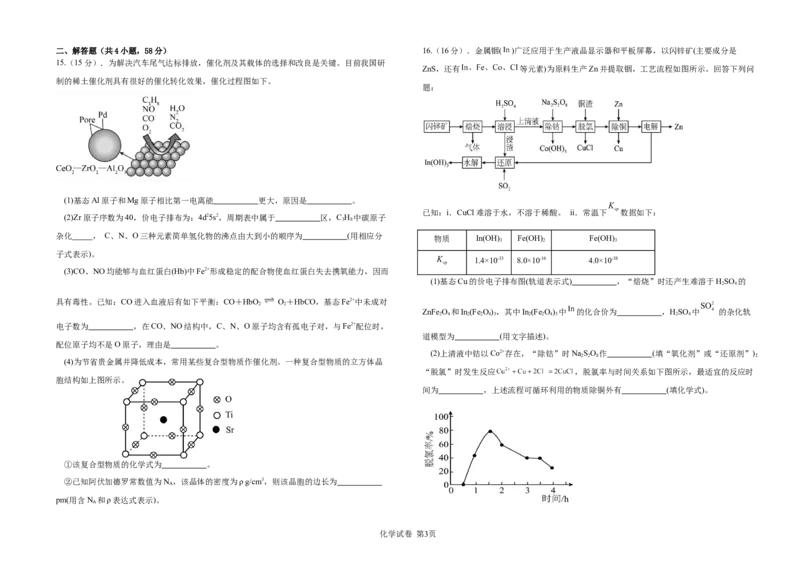
化学试卷 第2页二、解答题(共4小题,58分) 16.(16分).金属铟( )广泛应用于生产液晶显示器和平板屏幕,以闪锌矿(主要成分是
15.(15分).为解决汽车尾气达标排放,催化剂及其载体的选择和改良是关键。目前我国研
ZnS,还有 等元素)为原料生产Zn并提取铟,工艺流程如图所示。回答下列问
制的稀土催化剂具有很好的催化转化效果,催化过程图如下。
题:
(1)基态Al原子和Mg原子相比第一电离能 更大,原因是 。
已知:i.CuCl难溶于水,不溶于稀酸。 ii.常温下 数据如下:
(2)Zr原子序数为40,价电子排布为:4d25s2,周期表中属于 区,C H 中碳原子
3 8
杂化 , C、N、O三种元素简单氢化物的沸点由大到小的顺序为 (用相应分
物质 In(OH) Fe(OH) Fe(OH)
3 2 3
子式表示)。
1.4×10-33 8.0×10-16 4.0×10-38
(3)CO、NO均能够与血红蛋白(Hb)中Fe2+形成稳定的配合物使血红蛋白失去携氧能力,因而
(1)基态Cu的价电子排布图(轨道表示式) ,“焙烧”时还产生难溶于HSO 的
2 4
具有毒性。已知:CO进入血液后有如下平衡:CO+HbO O+HbCO,基态Fe2+中未成对
2 2
ZnFe O 和In(Fe O),其中In(Fe O) 中 的化合价为 ,HSO 中 的杂化轨
2 4 2 2 4 3 2 2 4 3 2 4
电子数为 ,在CO、NO结构中,C、N、O原子均含有孤电子对,与Fe2+配位时,
道模型为 (用文字描述)。
配位原子均不是O原子,理由是 。
(2)上清液中钴以Co2+存在,“除钴”时NaSO 作 (填“氧化剂”或“还原剂”);
2 2 8
(4)为节省贵金属并降低成本,常用某些复合型物质作催化剂。一种复合型物质的立方体晶
“脱氯”时发生反应 ,脱氯率与时间关系如下图所示,最适宜的反应时
胞结构如上图所示。
间为 ,上述流程可循环利用的物质除铜外有 (填化学式)。
①该复合型物质的化学式为 。
②已知阿伏加德罗常数值为N ,该晶体的密度为ρ g/cm3,则该晶胞的边长为
A
pm(用含N 和ρ表达式表示)。
A
化学试卷 第3页(3) 写出酸性条件下SO 还原In(Fe O) 得到In3+和Fe2+的离子方程式 ;要水解得
2 2 2 4 3
到In(OH) ,需先将ZnFe O 和In(Fe O) 中的Fe“还原”为+2价,原因是 。 18.(15分).学习小组探究了铜的氧化过程及铜的氧化物的组成。回答下列问题:
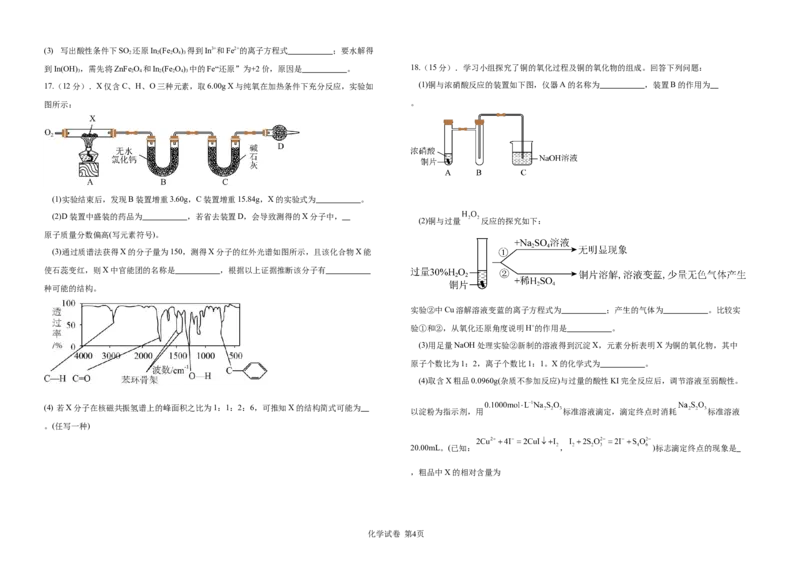
3 2 4 2 2 4 3
17.(12分).X仅含C、H、O三种元素,取6.00g X与纯氧在加热条件下充分反应,实验如 (1)铜与浓硝酸反应的装置如下图,仪器A的名称为 ,装置B的作用为
图所示: 。
(1)实验结束后,发现B装置增重3.60g,C装置增重15.84g,X的实验式为 。
(2)D装置中盛装的药品为 ,若省去装置D,会导致测得的X分子中,
(2)铜与过量 反应的探究如下:
原子质量分数偏高(写元素符号)。
(3)通过质谱法获得X的分子量为150,测得X分子的红外光谱如图所示,且该化合物X能
使石蕊变红,则X中官能团的名称是 ,根据以上证据推断该分子有
种可能的结构。
实验②中Cu溶解溶液变蓝的离子方程式为 ;产生的气体为 。比较实
验①和②,从氧化还原角度说明H+的作用是 。
(3)用足量NaOH处理实验②新制的溶液得到沉淀X,元素分析表明X为铜的氧化物,其中
原子个数比为1:2,离子个数比1:1。X的化学式为 。
(4)取含X粗品0.0960g(杂质不参加反应)与过量的酸性KI完全反应后,调节溶液至弱酸性。
(4) 若X分子在核磁共振氢谱上的峰面积之比为1:1:2:6,可推知X的结构简式可能为
以淀粉为指示剂,用 标准溶液滴定,滴定终点时消耗 标准溶液
。(任写一种)
20.00mL。(已知: , )标志滴定终点的现象是
,粗品中X的相对含量为
化学试卷 第4页